ІМУНОЗАЛЕЖНИЙ МЕХАНІЗМ РЕГЕНЕРАТИВНОЇ ДІЇ МСК ПРИ СТРЕСОВОМУ ВИРАЗКОУТВОРЕННІ
Нікольський І.С., Нікольська В.В., Тарануха Л.І., Семенова Я.-М.О., Нікольська К.І.
Резюме. У теперішній час актуальним є вивчення можливості використання мультипотентних стромальних клітин (МСК) для стимуляції процесів регенерації при імунодефіцитах, серед яких особливе місце посідають стресові реакції. У роботі розглянуто механізм впливу МСК кісткового мозку на шлункове виразкоутворення і стан імунної системи в умовах гострого та повторювального стресу. У щурів лінії Вістар відтворено іммобілізаційний водно-імерсійний стрес у двох варіантах: гострий та повторювальний. Досліджено кількість і площу стресових виразок, показники тимуса і селезінки, а також гематологічні показники, проліферативну і цитотоксичну активність мононуклеарів периферичної крові, спленоцитів і клітин лімфатичних вузлів, визначено поглинальну активність нейтрофілів. Внаслідок реалізації обох видів стресу у щурів індукується процес виразкоутворення у шлунку з одночасною вираженою перебудовою імунної системи при повторювальному стресі та незначним її залученням при гострому стресі. Введення МСК перед індукцією гострого стресу або перед останньою індукцією, якою завершується формування повторювального стресу, призводить до вираженого пригнічення виразкоутворення тільки при повторювальному стресі з розвитком при цьому характерних змін в системі імунітету. Регенеративна активність МСК формується в певних умовах композиції імунної системи, що є необхідним і для прояву власної імунотропної дії МСК, певні механізми якої можуть сприяти підсиленню регенеративної активності клітин. Імунозалежний механізм регенеративної дії МСК бажано брати до уваги при розробці методів лікування за допомогою трансплантації МСК. Трансплантація МСК кісткового мозку щурам перед відтворенням у них гострого іммобілізаційного водно-імерсійного стресу не впливає на інтенсивність виразкоутворення у шлунку, а введення клітин перед останньою індукцією повторювального стресу призводить до значного пригнічення шлункового виразкоутворення зі зменшенням кількості та площі виразок. Ефективна регенеративна дія МСК відзначається тільки при повторювальному стресі, коли відбувається значно більша перебудова імунної системи, що свідчить про імунозалежну дію МСК. Також трансплантовані МСК демонструють власну імунотропну активність, ефективно впливаючи на проліферативну активність тимоцитів і поглинальну активність нейтрофілів при гострому стресі, а також поглинальну активність нейтрофілів при повторювальному стресі.
DOI: 10.32471/rheumatology.2707-6970.89.17306
УДК: 617.-089.843
Вступ
У сучасній медицині активно розробляються лікувальні заходи з використанням стовбурових клітин, серед яких особливе місце належить стовбуровим клітинам, які за Міжнародною класифікацією від 2005 року отримали назву «мультипотентні стромальні клітини» (МСК) [1]. Раніше вони визначалися як мезенхімальні стовбурові клітини. Перейменування здійснене з двох основних причин: по-перше, МСК дійсно з’являються у мезенхімі, але у позаембріональний період такої тканини в організмі немає. По-друге, МСК містяться в сполучній тканині скрізь, де вона є, і, поряд з основними властивостями, успадкованими від мезенхімальних клітин, мають риси, притаманні МСК певної органної та тканинної компартменної локалізації [2, 3, 4]. Особливе місце МСК посідають і в імунній системі, де виконують багато функцій: від підтримки паренхіми до участі в імунних реакціях [5–16].
Але багато в чому активність МСК вивчена недостатньо. Причому часто це стосується участі МСК у важливих процесах загально-біологічного і медичного значення, серед яких виділяють і стрес, у розвитку якого велика роль належить імунній системі, оскільки для її функціонування необхідні МСК.
Таким чином, відомо про значну роль імунної системи у розвитку стресу, також визначена необхідність МСК для нормального формування імунітету, проте вплив МСК на імунні механізми при стресі залишається невизначеним. Між тим, зрозуміло, що питання потребує уваги, оскільки дослідження у цьому напрямку можуть бути перспективними для розробки методів регенерації імунної системи при стресі.
Стрес є стандартною адаптаційною реакцією на надзвичайну ситуацію, що створюється сильними чинниками, які потенційно загрожують організму [17]. Видів стресу багато, і найчастіше вони визначаються за факторами, що їх викликають. У даній роботі вивчається іммобілізаційний водно-імерсійний гострий та повторювальний стрес. Одними з ключових чинників розвитку стресу вважаються глюкокортикоїди, катехоламіни, деякі інші гормони та фактори, що продукуються у підвищеній кількості, дія яких спрямована в основному на лімфоцити і спричиняє виражені порушення в імунній системі.
Класичними проявами стресу є гормонозалежні зміни, які були виділені Г. Сельє: гіпертрофія надниркових залоз, гіпотрофія тимуса і виразкоутворення у шлунку [18]. З боку імунної системи важливими і вираженими компонентами стресу є лейкоцитарна реакція і тимчасовий імунодефіцит.
Розвиток стресу визначається властивостями індукуючих факторів: сили, частоти і тривалості їх впливу, а також станом реактивності, у тому числі імунологічної, організму, що реагує [19]. За цими критеріями основні стреси поділяються на гострий, повторювальний і хронічний.
У теперішній час є дані про суттєву різницю між ними у механізмах формування і реалізації ефекту. Але ці питання недостатньо вивчені. Особливості розвитку стресової реакції залежно від властивостей діючих факторів і стану імунологічної реактивності продовжують всебічно досліджувати. Нині у вивченні стресу намітилися нові тенденції. Велике значення у подальшому розкритті стресових механізмів має їх висвітлення з позицій прогресу імунологічних підходів до вивчення стовбурових клітин.
Метою роботи було дослідити участь імунної системи у реалізації регенеративної активності МСК при стресовому виразкоутворенні.
Матеріал та методи дослідження
Досліди проведені на самцях щурів лінії Вістар масою 220–260 г з розплідника Інституту патології, онкології та радіобіології ім. Р.Є. Кавецького НАН України, які знаходилися у стандартних умовах віварію. Утримання тварин та робота з ними здійснювалися відповідно до міжнародних прийнятих правил проведення робіт з експериментальними тваринами. Усі роботи з експериментальними тваринами проводили з дотриманням вимог статті 26 Закону України «Про захист тварин від жорстокого поводження» (від 21.02.2006 р.) та «Європейської конвенції із захисту хребетних тварин, які використовуються з експериментальною та іншою науковою метою» (Страсбург, 1986), а також з дотриманням усіх принципів біоетики та норм біологічної безпеки.
Експериментальне виразкоутворення у шлунку піддослідних тварин викликали методом іммобілізаційного водно-імерсійного стресу. Згідно з даною моделлю, іммобілізованих тварин витримували 3 год у воді (23 °С), що доходила до рівня мечоподібного відростка [20]. Схема експерименту представлена на рис. 1. Стрес відтворювали у двох варіантах: гострий та повторювальний. Для отримання гострого стресу тварин стресували одноразово. Для отримання повторювального стресу щурів стресували тричі з інтервалом у 24 год у перші 3 дні, потім через 96 год, тобто через час, за який могли відбуватися більш-менш стабільні стрес-індуковані зміни в імунній системі, ще раз відтворювали стрес.
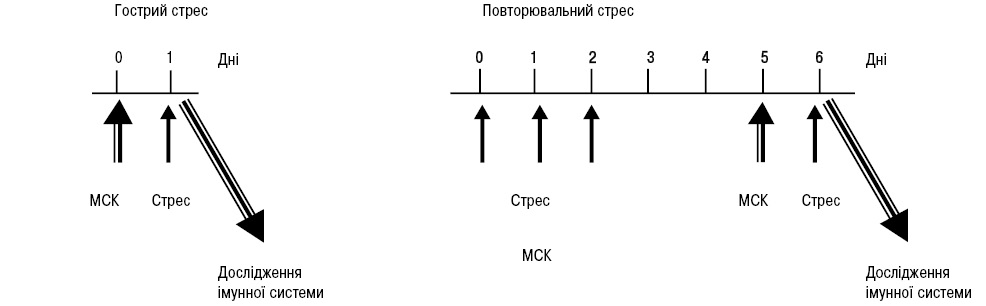
Для трансплантації використовували МСК кісткового мозку щурів лінії Вістар. Кістковий мозок отримували зі стегнової кістки методом механічної дезагрегації строми. Адгезуючу до пластику фракцію клітин культивували до 2-го пасажу. Враховуючи, що для проведення експерименту потрібна достатня кількість клітин, пул МСК 2‑го пасажу накопичували кріоконсервуванням, яке проводили за методикою, що розроблена в Інституті проблем кріобіології та кріомедицини НАН України [21] на програмному заморожувачі KRYO-516 (Planer, Англія) в кріопробірках (Nunc, США) по 1,8 мл з використанням диметилсульфоксиду (ДМСО) (5%). Процес заморожування клітин проводили згідно з 4‑етапною програмою. Після завершення програми кріопробірки переносили в низькотемпературний банк для довгострокового зберігання в рідкому азоті до використання в експерименті.
Розморожені МСК кісткового мозку (4·106 в 0,2 мл середовища DMEM/F12) вводили у хвостову вену за 24 год до гострого стресу або останнього відтворення стресу при моделюванні повторювального стресу.
Сформовано 5 експериментальних груп тварин: I — контрольна (інтактні щури) (n=14), II — щури, яким відтворювали гострий стрес (n=11), III — щури, яким вводили МСК кісткового мозку і відтворювали гострий стрес (n=8), IV — щури, яким відтворювали повторювальний стрес (n=6), V — щури, яким вводили МСК кісткового мозку і відтворювали повторювальний стрес (n=6).
Експериментальні дослідження здійснювали відразу після припинення дії стресових факторів. Розмір виразок (середній діаметр) в шлунках вимірювали за допомогою бінокулярної лупи з окуляр-мікрометром, визначаючи кількість та сумарну площу виразок в мм2. Визначали абсолютну і відносну масу тимуса і селезінки, кількість тимоцитів і спленоцитів, клітинність (кількість клітин в 1 мг органу) тимуса і селезінки, а також кількість клітин кісткового мозку. Кількість лейкоцитів, лімфоцитів, гранулоцитів, еритроцитів, тромбоцитів, концентрацію гемоглобіну в периферичній крові визначали на автоматичному гематологічному аналізаторі PARTICLE COUNTER (модель PCE-210) (ERMA INC, Японія). Вивчення проліферативної активності мононуклеарів периферичної крові, спленоцитів, клітин лімфатичних вузлів і природної цитотоксичності здійснювали МТТ-методом. Визначали також здатність нейтрофілів поглинати інактивовані клітини Staphylococcus aureus.
Отримані результати оброблені методами варіаційної статистики за допомогою програм Excell (MS Office XP) та Statistica 8.0 (StatSoft, Inc.). Для визначення відмінностей між досліджуваними групами використовували непараметричний критерій Манна — Уїтні (U) [22]. Усі дані на діаграмах представлені як медіана (Median), 25 та 75% процентилі, мінімальне та максимальне значення [23]. При інтерпретації результатів критичною величиною рівня значущості вважали р<0,05.
Результати та їх обговорення
Як можна побачити на рис. 2, у контрольній групі щурів лінії Вістар патології слизової оболонки шлунка не виявлено. Візуальне дослідження одразу після індукції стресу свідчить про умовно дві форми виразкових уражень у піддослідних тварин: перша — малі виразки (площею <0,5 мм2), друга — великі виразки (площею >4 мм2) з меншою кількістю малих виразок.
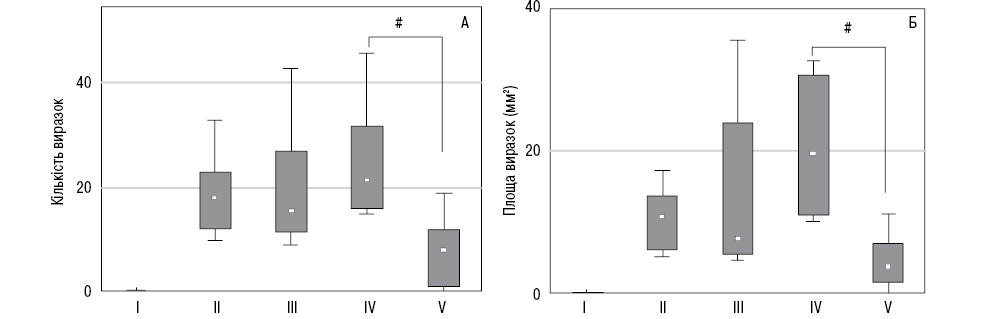
Кількість виразок та їх площа при гострому і повторювальному холодовому стресі достовірно не відрізнялися. Але з рис. 2 також видно, що обидва показники помітно вищі при повторювальному стресі. У результаті претрансплантації МСК тваринам з гострим стресом кількість виразок практично не змінювалася. Проте у щурів, які отримували МСК перед останньою індукцією повторювального стресу, кількість уражень значно зменшувалася. Так, саме у щурів цієї групи значно зменшувалася і площа виразок (див. рис. 2). Виходить, що введення МСК суттєво пригнічує виразкоутворення тільки при повторювальному стресі.
Щоб з’ясувати причетність певних імунологічних змін до реалізації дії МСК, треба було перш за все вивчити особливості впливу обох видів стресу на імунну систему. Дані представлені у табл. 1.
Таблиця 1. Показники імунної системи при гострому і повторювальному іммобілізаційному водно-імерсійному стресі
| Показники | Здорові тварини (n=14) |
Тварини після гострого стресу (n=11) |
Тварини після повторювального стресу (n=6) |
|---|---|---|---|
| Лейкоцити, 106/мл | 12,9 11,4–14,5 |
14,1 11,8–20,1 |
24,8* 18,2–29,5 |
| Лімфоцити, 106/мл | 9,0 7,3–10,0 |
11,8 8,6–13,9 |
15,9* 13,8–23,3 |
| Гемоглобін, г/л | 125 120–139 |
131 122–136 |
115* 108–121 |
| Відносна маса тимуса, % | 0,09 0,07–0,11 |
0,12* 0,11–0,17 |
0,07# 0,06–0,09 |
| Відносна маса селезінки, % | 0,49 0,40–0,60 |
0,41 0,36–0,42 |
0,33* 0,29–0,41 |
| Клітинність селезінки, 106/мг | 0,36 0,34–0,48 |
0,32 0,26–0,40 |
0,17*# 0,09–0,27 |
| Цитотоксична активність тимоцитів, % | 38 17–50 |
26 22–43 |
9# 8–13 |
| Цитотоксична активність спленоцитів, % | 57 48–68 |
34* 28–42 |
51# 47–55 |
| Проліферативна активність клітин ЛВ, у.о. | 1,43 1,35–1,73 |
1,16 1,08–1,36 |
2,15*# 1,87–2,24 |
*Порівняно з групою контрольних тварин;
#порівняно з групою тварин після гострого стресу.
Встановлено, що реакція імунної системи на досліджені види стресу дійсно значно відрізняється. Так, при гострому стресі відхилення від норми відзначають за двома показниками. Відносна маса тимуса збільшується, а цитотоксична активність спленоцитів суттєво знижується. При повторювальному стресі підвищуються кількість лейкоцитів і лімфоцитів у крові і проліферативна активність клітин лімфатичних вузлів, зменшуються кількість гемоглобіну, відносна маса і клітинність селезінки. Таким чином, на відміну від гострого, при повторювальному стресі від норми відрізняються 6 показників. Причому зміни обох задіяних показників при гострому стресі йдуть при повторювальному стресі в протилежний бік. Слід відмітити, що достовірні зміни при обох видах стресу теж значно відрізняються в групах за величиною показників: відносної маси тимуса і клітинності селезінки, цитотоксичної активності тимоцитів і спленоцитів, проліферативної активності лімфатичних вузлів.
Таким чином, реакція на стрес за показниками імунної системи має кількісні відмінності від норми і якісні та кількісні протилежні зміни між гострим і повторювальним стресом, що в цілому свідчить про більш значну і суттєво різну перебудову активності імунної системи при обох видах стресу.
Певна імунна композиція при обох видах стресу, мабуть, зумовлює різні зміни в імунній системі і після введення МСК. Як показано у табл. 2, претрансплантація МСК при гострому стресі призводить до підвищення поглинальної активності нейтрофілів і проліферативної активності тимоцитів, а при повторювальному стресі трансплантація МСК викликає тільки підвищення кількості лімфоцитів. При цьому введення МСК індукує зниження поглинальної активності при повторювальному стресі по відношенню до такого в групі тварин з гострим стресом, які отримували МСК. Дані свідчать про складний механізм дії МСК на імунну систему, результат реалізації якого залежить від вихідного стану імунної системи.
Таблиця 2. Відміни у впливі МСК на імунні порушення при гострому і повторювальному іммобілізаційному водно-імерсійному стресі
| Показники | Здорові тварини (n=14) |
Тварини після гострого стресу | Тварини після повторювального стресу | ||
|---|---|---|---|---|---|
| Без введення МСК (n=14) |
Із введенням МСК (n=14) |
Без введення МСК (n=14) |
Із введенням МСК (n=14) |
||
| Лімфоцити, 106/мл | 9,0 7,3–10,0 |
11,8 8,6–13,9 |
8,8 7,7–14,9 |
15,9* 13,8–23,3 |
14,5* 12,9–14,6 |
| Відносна маса тимуса, % | 0,09 0,07–0,11 |
0,12* 0,11–0,17 |
0,06# 0,06–0,07 |
0,07# 0,06–0,09 |
0,08# 0,05–0,10 |
| Проліферативна активність тимоцитів, у.о. | 0,87 0,82–0,92 |
0,93 0,89-1,20 |
1,12* 1,08–1,21 |
0,97# 0,88–0,99 |
0,96 0,86–1,11 |
| Поглинальна активність нейтрофілів, % | 56 52–60 |
60 58–62 |
63,5*# 62–71 |
59 52–69 |
55,5$ 54–61 |
*Порівняно з групою контрольних тварин;
#порівняно з групою тварин після гострого стресу;
$порівняно з групою тварин після гострого стресу і введення МСК.
Можна припустити, що при повторювальному стресі перебудова імунної системи попередніми стресовими реакціями створює умови, що сприяють реалізації притаманної МСК адаптогенної і регенеративної дії.
Значення певних імунних порушень для реалізації регенеративної дії МСК не з’ясовано [24]. Питання потребує подальшого вивчення на основі комплексного підходу з урахуванням особливостей функціонування імунної системи в цілому, а виражена регенеративна антивиразкова дія МСК може бути розглянута сьогодні як перспективна у майбутньому для клінічного застосування.
Висновки
Трансплантація МСК кісткового мозку щурам перед відтворенням у них гострого іммобілізаційного водно-імерсійного стресу не впливає на інтенсивність виразкоутворення у шлунку, а введення клітин перед останньою індукцією повторювального стресу призводить до значного пригнічення шлункового виразкоутворення зі зменшенням кількості і площі виразок.
Ефективна регенеративна дія МСК виявляється тільки при повторювальному стресі, коли відзначається значно більша перебудова імунної системи, що свідчить про імунозалежну дію МСК. Також трансплантовані МСК демонструють власну імунотропну активність, ефективно впливаючи на проліферативну активність тимоцитів і поглинальну активність нейтрофілів при гострому стресі, а також поглинальну активність нейтрофілів при повторювальному стресі.
Наявність імунозалежного механізму регенеративної дії МСК бажано брати до уваги при розробці методів терапії за трансплантації МСК.
Список використаної літератури
- 1. Horwitz E.M., Le Blanc K., Dominici M. et al. (2005) International Society for Cellular Therapy. Clarification of the nomenclature for MSC: The International Society for Cellular Therapy position statement. Cytotherapy, 7(5): 393–395. doi: 10.1080/14653240500319234. PMID: 16236628.
- 2. Urrutia D.N., Caviedes P., Mardones R. et al. (2019) Comparative study of the neural differentiation capacity of mesenchymal stromal cells from different tissue sources: An approach for their use in neural regeneration therapies. PLoS One, 14(3): e0213032. doi:10.1371/journal.pone.0213032.
- 3. Guerrouahen B.S., Sidahmed H., Al Sulaiti A. et al. (2019) Enhancing Mesenchymal Stromal Cell Immunomodulation for Treating Conditions Influenced by the Immune System. Stem. Cells Int., 5: 7219297. doi:10.1155/2019/7219297.
- 4. Нікольський І.С., Бутенко Г.М. (2021) Клітинна терапія в ревматології: можливі напрямки. Український ревматологічний журнал, 86(4): 8–17. doi: 10.32471/rheumatology.2707-6970.86.16532.
- 5. Nikolskaya K.I., Butenko G.M. (2016) Structural-functional organisation of the bone marrow hematopoietic stem cells niches. Cell and Organ Transplantology, 4(1): 101–117. doi:10.22494/COT.V4I1.9.
- 6. Nikolska K.I. (2018) Peculiarities of culture and in vitro contact interaction of cryopreserved thymic multipotent stromal cells and hemopoietic cells. Probl. Cryobiol. Cryomed., 28(1): 5–13. doi.org/10.15407/cryo28.01.005.
- 7. Coulson-Thomas V.J., Coulson-Thomas Y.M., Gesteira T.F. et al. (2016) Extrinsic and Intrinsic Mechanisms by Which Mesenchymal Stem Cells Suppress the Immune System. Ocul. Surf., 14(2): 121–134. doi:10.1016/j.jtos.2015.11.004.
- 8. Hong J., Hueckelhoven A., Wang L. et al. (2016) Indoleamine 2,3-dioxygenase mediates inhibition of virus-specific CD8(+) T cell proliferation by human mesenchymal stromal cells. Cytotherapy. 18(5): 621–629. doi:10.1016/j.jcyt.2016.01.009.
- 9. Denton A.E., Linterman M.A. (2017) Stromal networking: cellular connections in the germinal centre. Curr. Opin. Immunol., 45: 103–111. doi: 10.1016/j.coi.2017.03.001.
- 10. He S., Gleason J., Fik-Rymarkiewicz E. et al. (2017) Human Placenta-Derived Mesenchymal Stromal-Like Cells Enhance Angiogenesis via T Cell-Dependent Reprogramming of Macrophage Differentiation. Stem. Cells, 35(6): 1603–1613. doi:10.1002/stem.2598.
- 11. Galleu A., Riffo-Vasquez Y., Trento C. et al. (2017) Apoptosis in mesenchymal stromal cells induces in vivo recipient-mediated immunomodulation. Sci. Transl. Med., 9(416): eaam7828. doi:10.1126/scitranslmed.aam7828.
- 12. Li N., Hua J. (2017) Interactions between mesenchymal stem cells and the immune system. Cell Mol. Life Sci., 74(13): 2345–2360. doi: 10.1007/s00018-017-2473-5.
- 13. Pistoia V., Raffaghello L. (2017) Mesenchymal stromal cells and autoimmunity. Int. Immunol., 29(2): 49–58. doi: 10.1093/intimm/dxx008.
- 14. Alexandre Y.O., Mueller S.N. (2018) Stromal cell networks coordinate immune response generation and maintenance. Immunol Rev. 283(1): 77–85. doi: 10.1111/imr.12641.
- 15. Wang M., Yuan Q., Xie L. (2018) Mesenchymal Stem Cell-Based Immunomodulation: Properties and Clinical Application. Stem Cells Int. 2018: 3057624. doi: 10.1155/2018/3057624.
- 16. Wang S., Huang S., Gong L. et al. (2018) Human Neonatal Thymus Mesenchymal Stem Cells Promote Neovascularization and Cardiac Regeneration. Stem. Cells Int., 2018: 8503468. doi:10.1155/2018/8503468.
- 17. Selye H. (1998) A syndrome produced by diverse nocuous agents. 1936. J. Neuropsychiatry Clin. Neurosci., 10(2): 230–231. doi:10.1176/jnp.10.2.230a.
- 18. Szabo S., Yoshida M., Filakovszky J. et al. (2017) «Stress» is 80 Years Old: From Hans Selye Original Paper in 1936 to Recent Advances in GI Ulceration. Curr. Pharm. Des., 23(27): 4029–4041. doi:10.2174/1381612823666170622110046.
- 19. Krizanova O., Babula P., Pacak K. (2016) Stress, catecholaminergic system and cancer. Stress, 19(4): 419–428. doi:10.1080/10253890.2016.1203415.
- 20. Zhao D.Q., Xue H., Sun H.J. (2020) Nervous mechanisms of restraint water-immersion stress-induced gastric mucosal lesion. World J. Gastroenterol., 26(20): 2533–2549. doi:10.3748/wjg.v26.i20.2533.
- 21. Grishchenko V.I., Lobyntseva G.S., Votyakova I.A. et al. (1988) Hematopoietic cells of the embryonic liver. Naukova Dumka, 192 p.
- 22. Гржибовский А.М. (2016) Сравнение количественных данных двух независимых выборок с использованием программного обеспечения Statistica и SPSS: параметрические и непараметрические критерии. Наука и здравоохранение, 2: 5–28.
- 23. Реброва О.Ю. (2002) Статистический анализ медицинских данных: применение пакета прикладных программ STATISTICA. Медиа Сфера, 312 с.
- 24. Нікольський І.С., Нікольська В.В., та ін. (2018) Вплив трансплантації мультипотентних стромальних клітин тимуса на імунну систему мишей в умовах її регенерації. Фізіологічний журнал, 64(4): 3–11.
Адреса для листування:
Семенова Яніна-Марія Олексіївна
04114, м. Київ, вул. Вишгородська, 67
E-mail: yanina-mariya@ukr.net

Leave a comment