Аналіз виживання пацієнтів з легеневою артеріальною гіпертензією, асоційованою із захворюванням сполучної тканини
Сіренко Ю.М., Радченко Г.Д., Гарміш О.О., Деяк С.І., Живило І.О., Боцюк Ю.А.
Резюме. У роботі представлено аналіз виживання пацієнтів з легеневою артеріальною гіпертензією, асоційованою із захворюванням сполучної тканини за період 2014–2021 рр. на базі відділення вторинних і легеневих гіпертензій ДУ «ННЦ «Інституту кардіології ім. акад. М.Д. Стражеска» НАМН України. За даними нашого центру, частка таких хворих становила 6,1% (28 осіб). Усім пацієнтам проведені стандартне фізикальне обстеження, стандартний та біохімічний аналіз крові, тест 6-хвилинної ходьби, ехокардіографічне дослідження та катетеризацію правих відділів серця з проведенням термодилюції. У результаті проведеного аналізу виживання за допомогою використання кривих Kaplan — Meier, встановлено, що у пацієнтів з легеневою артеріальною гіпертензією, асоційованою із захворюванням сполучної тканини, виявлено один із найгірших показників — 51,2%. У даній групі хворих 1-, 2- і 3-річне виживання становило відповідно 93,3; 86,8 і 81,5%. Наші результати були дещо відмінними від результатів інших країн світу, що є поштовхом до ініціації нових дострокових загальнонаціональних реєстрових досліджень за участю пацієнтів із легеневою артеріальною гіпертензією в сучасних умовах в Україні.
DOI: 10.32471/rheumatology.2707-6970.87.16812
УДК 616.131-008.331.1-018.2-036.83
Легенева артеріальна гіпертензія (ЛАГ) — це група рідкісних захворювань, злоякісних за характером, які швидко призводять до летального результату без оптимального лікування [1]. ЛАГ є гемодинамічним та патофізіологічним станом, що характеризується підвищенням середнього тиску в ЛА в стані спокою більше 20 мм рт. ст., який вимірюють під час катетеризації правих відділів серця (КПС).
За даними світових реєстрів, серед загальної популяції пацієнтів з ЛАГ ЛАГ, асоційована із захворюванням сполучної тканини (ЗСТ), займає близько 15–30% [2]. У пацієнтів із системною склеродермією (ССД) ЛАГ виникає у 8–12% випадків та має поширеність близько 0,61 на 100 пацієнто-років [3, 4]. У цих хворих поява ЛАГ чинить значущий вплив на якість життя та прогноз. Останній покращився за останні роки через більшу поширеність вазоактивних препаратів, ранню діагностику та раннє лікування захворювання. За даними літератури, 1-, 3-, 5-річна виживаність хворих на ЛАГ, асоційовану із ССД, відповідно становить 81–85; 48–60 і 39–47% від моменту встановлення діагнозу [5, 6, 7].
ЛАГ, асоційована із ССД, характеризується різними клінічними фенотипами, що створює труднощі для клініцистів у повсякденній практиці. ССД поєднує загальну васкулопатію, запалення, аутоімунні процеси та фіброгенез, що веде до поширеного фіброзу та судинного ураження. Як наслідок цього, ЛАГ можна пояснити легеневою артеріальною васкулопатією (1-ша група), фіброзом легень (3-тя група) або ураженням лівих відділів серця (2-га група). Однак встановити провідний механізм у кожного конкретного пацієнта досить складно, оскільки в багатьох випадках вищеописані патофізіологічні процеси поєднуються. ЛАГ — це відносно часте та потенційно летальне ускладнення ССД. Цей стан характеризується підвищенням тиску в малому колі кровообігу та збільшенням легеневого судинного опору (ЛСО). Результатом цього є правошлуночкова недостатність, що є основною причиною несприятливого прогнозу в цій групі хворих.
Пацієнти і методи дослідження
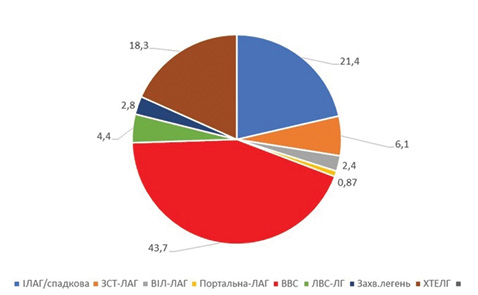
Пацієнти. За період з травня 2014 до травня 2021 р. амбулаторне або стаціонарне лікування в нашому центрі пройшли 458 хворих з ЛАГ і їх дані внесені в базу даних. Усі пацієнти включені до реєстру лише після підписання форми інформованої згоди для обробки персональних даних. Серед них з ідіопатичною (ІЛАГ)/спадковою ЛАГ — 98 (21,4%) пацієнтів, з ЛАГ, асоційованою із ЗСТ, — 28 (6,1%), з ЛАГ, асоційованою з ВІЛ-інфекцією, — 11 (2,4%), з ЛАГ, асоційованою з портальною гіпертензією, — 4 (0,87%), з ЛАГ, асоційованою з вродженими вадами серця (ВВС), — 200 (43,7%), з ЛАГ внаслідок захворювань лівих відділів серця — 20 (4,4%), ЛАГ внаслідок захворювань легень та/або гіпоксії — 13 (2,8%), хронічна тромбоемболічна ЛАГ — 84 (18,3%) (рис. 1). Серед пацієнтів 331 (72,3%) жінка та 127 (27,7%) чоловіків. Вік хворих — 18–80 років (у середньому 45,7±0,8 року). Пацієнти, які були госпіталізовані, становлять 74,9% (n=343), а амбулаторні — 25,1% (n=115).
Методи обстеження. ЛАГ була підтверджена КПС — середній тиск у легеневій артерії (серТЛА) >25 мм рт. ст., ЛСО >240 дин* с/см5 і тиск заклинювання легеневої артерії (ТЗЛА) <15 мм рт. ст. у спокої [8]. КПС проводилися в нашому центрі (у переважній більшості випадків) або в деяких хірургічних центрах для пацієнтів з ВВС. Пацієнти були поділені на підгрупи згідно з етіологією ЛГ за результатами обстеження відповідно до вимог Уніфікованого клінічного протоколу екстреної, первинної, вторинної (спеціалізованої) та третинної (високоспеціалізованої) медичної допомоги «Легенева гіпертензія у дорослих» (на основі рекомендацій 2015-ESC/ERS), затвердженого наказом МОЗ України від 21.06.2016 р. № 614.
Стандартне фізикальне обстеження проведено всім пацієнтам. Ознаки асциту оцінювалися під час медичного обстеження та ультразвукового дослідження органів черевної порожнини.
Систолічний (САТ) та діастолічний (ДАТ) артеріальний тиск оцінювали тричі за допомогою осцилометричного тонометра Omron M-10 (Omron Healthcare Co., Ltd., Kyoto, Japan) в положенні сидячи після 10 хв відпочинку. Середнє з трьох вимірювань вносили до бази даних. Частота серцевих скорочень (ЧСС) визначалася після другого вимірювання. Масу тіла та зріст оцінювали за допомогою комплексу SECA 220 (Seca GmbH & Co, Hamburg, Germany), а розрахунок індексу маси тіла проводили за стандартною формулою ІМТ= маса тіла/(зріст)², кг/м². Для виключення системної артеріальної гіпертензії додатково пацієнтам з підвищеним рівнем офісного АТ проводили добове моніторування АТ за допомогою приладу ABPM-04 (Meditech, Budapest, Hungary).
Тест 6-хвилинної ходьби за стандартною методикою згідно з рекомендаціями Американського торакального товариства [9] проводили двічі під час госпіталізації та двічі під час виписки (на фоні лікування). Кращий результат вводили в базу даних. Додатково під час тесту оцінювали ЧСС, АТ, сатурацію киснем (SaO2) та ступінь задишки (за шкалою Borg Dyspnoea) до та наприкінці тесту.
Ехокардіографічна оцінка (ЕхоКГ) проводилася одним і тим самим фахівцем з використанням стандартних вимірювань за допомогою приладу Artida, (Toshiba, Японія) [10]. Згідно з рекомендаціями Американського товариства ехокардіографії та Європейської асоціації з кардіоваскулярної візуалізації ми оцінювали розміри лівого (ЛП) та правого (ПП) передсердь (індекс площі та об’єму), фракцію викиду (ФВ) лівого шлуночка (ЛШ), ударний об’єм ЛШ, швидкість кровотоку на клапані легеневої артерії та швидкість регургітації на трикуспідальному клапані, розрахований систолічний тиск в легеневій артерії (рСТЛА), розмір та колабування нижньої порожнистої вени, індекси ексцентричності в систолу та діастолу, величину екскурсії кільця трикуспідального клапану (TAPSE).
У всіх пацієнтів, яким в нашому центрі проводили КПС, застосовували югулярний венозний доступ. Перед проведенням вимірювання тиску в легеневій артерії визначали нульовий рівень в позиції лежачи на рівні середньої пахової лінії. Вимірювали наступні параметри: середній тиск в правому передсерді та легеневій артерії, тиск заклинювання легеневої артерії, хвилинний об’єм крові (методом термодилюції у пацієнтів без відкритих шунтів та методом Фіка за наявності шунтів). На основі отриманих показників за допомогою стандартних формул розраховували ударний викид, серцевий індекс (CI), опір легеневих судин (ОЛС), системний судинний опір (ССО) та загальний судинний опір (ЗСО). Вазореактивний тест з інгаляційним ілопростом проводився у всіх пацієнтів, яким він був показаний, відповідно до рекомендацій Європейського товариства кардіологів 2015 р. двічі на початку та на фоні терапії антагоністами кальцію (при першому позитивному тесті).
Рутинний біохімічний аналіз проводився в лабораторії ДУ «ННЦ «Інститут кардіології імені М.Д. Стражеска» НАМН України. За допомогою автоматичного фотометра (Cormay Livia Chemistry Analyzer, Lublina, Poland) визначали наступні показники: глюкоза, білірубін, креатинін, холестерин, калій, натрій та сечова кислота. Швидкість клубочкової фільтрації (ШКФ) розраховували за допомогою формули CKD-ЕРІ. N-термінальний мозковий натрійуретичний про-пептид типу В (NT-proBNP), феритин та тироїдстимуляційний гормон також визначалися в лабораторії «ДІЛА» (Київ, Україна).
Усі обстеження проводилися одними і тими самими спеціалістами, які не були прямо залучені у дослідження. Всім пацієнтам проводили одні й ті самі дослідження згідно з локальним протоколом обстеження пацієнтів з легеневою гіпертензією, затвердженим наказом ДУ «ННЦ «Інститут кардіології ім. М.Д. Стражеска» НАМН України. Розподіл пацієнтів на групи проводили ретроспективно після закінчення періоду включення.
Статус виживання визначали за візитом пацієнта або телефонним контактом з пацієнтом або її/його родичами. Дати та причини смерті отримані зі свідоцтва про смерть, які надавали родичі пацієнта. Якщо інформації не було, пацієнт був класифікований як втрачений для подальшого спостереження. Дата останнього візиту визначена як кінцева дата спостереження. У даному дослідженні ми оцінювали лише загальну смертність. Демографічні показники, етіологія ЛАГ, застосування лікарських засобів, дані біохімічних аналізів, біомаркери (NТ-proBNP), рівень феритину, параметри ЕхоКГ, результати тесту 6-хвилинної ходьби і КПС вносилися до бази даних. Дата першого візиту до нашого центру була визначена як дата початку спостереження. Проведення дослідження ухвалено локальним етичним комітетом ДУ «ННЦ «Інститут кардіології ім. академіка М.Д. Стражеска» НАМН України.
Статистичний аналіз. Абсолютні показники (безперервні змінні) представлені у форматі середнє значення ± стандартне відхилення (M±SD). Відносні показники (безумовні змінні) — у вигляді абсолютного числа (n) і відсотка (%). Достовірність відмінностей між групами оцінювали для безперервних змінних за допомогою незалежного t-тесту для середніх значень і для безумовних змінних — за допомогою χ2-аналізу. Виявлені параметри, за якими відрізнялися групи, включені у покроковий бінарний логістичний регресійний аналіз для оцінки взаємозв’язків між параметром та виживанням. Аналіз виживання проводили з використанням кривих Kaplan — Meier, при цьому за дату початку дослідження брали дату першого відвідування центру. Логарифмічний тест (long-rank Mantel-Cox) та Wilcoxon Signed-Rank тест використовували для порівняння виживання груп з різною етіологією. Статистично значущі змінні, виявлені під час бінарного логістичного регресійного аналізу, включені до однофакторного пропорційного аналізу ризику Сох. Якщо ці змінні зберігали достовірність зв’язку із прогнозом, їх включали у багатофакторний Сох регресійний аналіз для визначення незалежних предикторів смерті в обстежених пацієнтів.
Результати дослідження
Характеристика пацієнтів, включених у реєстр, залежно від етіології ЛАГ представлена у табл. 1.
Таблиця 1. Загальна характеристика пацієнтів, включених в аналіз, залежно від етіології ЛАГ (M±SD), n (%)
| Показники, од. вим. | ІЛАГ
n=98 |
ЛАГ-ЗСТ
n=28 |
ЛАГ-ВІЛ
n=11 |
ЛАГ-Портальна
n=4 |
ЛАГ-ВВС
n=200 |
ЛАГ-ЛВС
n=20 |
ЛАГ-ЗЛ
n=13 |
ХТЕЛГ
n=84 |
|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |
| Вік, роки | 42,3±1,32, 4, 6–8* | 52,2±2,21, 3–6 | 39,7±2,22, 4, 6–8 | 24,8±3,91–3, 5–8 | 36,7±1,02, 4, 6–8 | 64,1±2,61–5, 7, 8 | 52,8±3,81, 3, 4, 5, 6, 8 | 53,1±1,41, 3–7 |
| ІМТ, кг/м2 | 25,9±0,73–5 | 24,1±0,86, 8 | 22,3±1,21, 6–8 | 21,2±1,31, 6–8 | 22,6±0,41, 6–8 | 29,6±2,12–5 | 31,6±3,73–5 | 27,8±0,72–5 |
| Тривалість скарг, міс | 36,4±5,45 | 29,7±6,65, 8 | 29,1±10,65 | 30,6±18,05 | 138,6±12,31–4, 7, 8 | 78,6±30,1 | 37,9±10,25 | 47,2±5,12, 5 |
| Тривалість від діагнозу, міс | 21,59,4±8,55 | 7,2±2,45, 8 | 12,3±6,25 | 39,8±22,85 | 205,4±12,51–4, 6–8 | 87,7±45,25 | 13,8±4,95 | 25,1±4,32, 5 |
| Чоловіки/жінки, n (%) | 16 (16,3)/ 82(83,7)2–8 |
3 (10,7)/ 25(89,3)1, 3–8 | 3(27,3)/ 8(72,7)1, 2, 6–8 |
1(25)/ 3(75)1, 2, 6–8 |
52(26)/ 148(74)1, 2, 6–8 |
4(20)/ 16(80)1–5 |
4(30,8)/ 9(69,2)1–5, 8 |
44(52,4)/ 40(47,6)1–5, 7 |
|
Функціональний клас ВООЗ І ІІ ІІІ ІV |
2 (2,0)2–4, 6, 7
64 (65,3)2–8 23 (23,5)3–8 9 (9,2)2–8 |
01
3 (10,7)1, 5, 8 20 (71,4)3–8 5 (17,9)1, 3, 4, 7 |
01, 5, 8
1 (9,1)1, 5, 8 8 (72,7)1, 2, 4–8 2 (18,2)1, 2, 5, 6, 8 |
01, 5, 8
2 (50)1, 5, 8 1 (25)1–3, 5–8 1 (25)1, 2, 5, 6, 8 |
2 (1)3, 4
54 (27)1–4, 6–8 140 (70)1–4, 6–8 4 (2)1, 3, 4, 7 |
01, 5, 8
2 (10)1, 5, 8 14 (70)1–5, 7, 8 4 (20)1, 3, 4, 7 |
01, 5, 8
2 (15,4)1, 5, 8 9 (69,2)1, 2, 4–8 2 (15,4)1, 2, 5, 6, 8 |
3 (3,6)2–4, 6, 7
16 (19)1–7 60 (71,4)1–7 5(6)1, 3, 4, 7 |
*1Достовірно (р< 0,05) порівняно з групою ІЛАГ; 2достовірно порівняно з групою ЛАГ-ЗСТ; 3достовірно порівняно з групою ЛАГ-ВІЛ; 4достовірно порівняно з групою ЛАГ-Портальна; 5достовірно порівняно з ЛАГ-ВВС; 6достовірно порівняно з групою ЛАГ-ЗЛВ; 7достовірно порівняно з групою ЛАГ-ЗЛ; 8достовірно порівняно з групою ХТЕЛГ.
Як вказувалося вище, переважна більшість — хворі з ЛАГ, асоційованою із ВВС, — 200 (43,7%). Вони (середній вік 36,7±1,0 року) та пацієнти з ЛАГ, асоційованою із ВІЛ-інфекцією (ЛАГ-ВІЛ) (середній вік 39,7±2,2 року) або портальною гіпертензією (ЛАГ-Портальна) (середній вік 24,8±3,9 року), були достовірно молодші, ніж пацієнти інших груп. Найстаршими були пацієнти з ЛАГ, асоційованою із ЗСТ (52,2±2,2 року), захворюваннями лівих відділів серця (ЛАГ-ЗЛВ) (64,1±2,6 року), захворюванням легень (ЛАГ-ЗЛ) (52,8±3,8 року) та хронічною тромбоемболічною легеневою гіпертензією (ХТЕЛГ) (53,1±1,4 року). Переважну кількість пацієнтів з ЛАГ та ЛАГ-ЗЛВ становили жінки. При цьому в групі ІЛАГ та ЛАГ-ЗСТ чоловіків було найменше: співвідношення чоловіки/жінки становило 1:5 та 1:8 відповідно. У групах інших форм ЛАГ це співвідношення становило приблизно 1:4, у групі ЛАГ-ЗЛ — 1:3. У групі ХТЕЛГ чоловіків було трохи більше: співвідношення чоловіки/жінки — 1:1. Час від появи симптомів захворювання до внесення у реєстр у хворих з ЛАГ, окрім пацієнтів з ВВС, коливався в межах від 29,1±10,6 міс у групі ЛАГ-ВІЛ до 36,4±5,4 міс у групі ІЛАГ. У пацієнтів з ЛАГ-ВВС тривалість існування скарг була найбільшою — 138,6±12,3 міс. При цьому в даній групі, групі портальної ЛАГ та групі ЛАГ-ЗЛВ тривалість від моменту встановлення діагнозу перевищувала тривалість існування скарг. Тобто скарги з’явилися вже після встановлення діагнозу. У всіх інших обстежених зазвичай скарги виникали раніше, ніж встановлювався діагноз ЛГ. При інших формах ЛАГ пізня діагностика відбувалася або через рідкісність патології і недостатню обізнаність про неї лікарів, або через тривалий перебіг основного захворювання, яке лише з часом ускладнюється ЛАГ (наприклад при ЗСТ або захворюваннях легень).
Пацієнти з ЛАГ-ЗЛВ, ЛАГ-ЗЛ та ХТЕЛГ мали достовірно більш високий індекс маси тіла, ніж пацієнти з ЛАГ. Рівень системного САТ та ДАТ у пацієнтів з ЛАГ-ЗЛВ та ХТЕЛГ був достовірно більш високим, ніж у пацієнтів групи ЛАГ, за винятком пацієнтів з ЛАГ-ЗСТ, які не відрізнялися від цих груп за рівнем АТ та мали достовірно більш високий САТ і ДАТ, ніж пацієнти з ЛАГ-ВІЛ та ЛАГ-ВВС. Сатурація крові киснем була найнижчою у пацієнтів з ВВС, захворюванням легень та ЗСТ.
Виявлено достовірні відмінності між групами в частці пацієнтів з різним функціональним класом (табл. 1). Так, переважна більшість пацієнтів з ІЛАГ (65,3%) та половина пацієнтів з портальною ЛАГ мали ІІ функціональний клас за ВООЗ. В той же час в інших групах достовірно більша (біля 70%) частка хворих належала до ІІІ функціонального класу за ВООЗ. За даними 6-хвилинного тесту при першому обстеженні в центрі, пацієнти із ЗСТ, ураженням лівих відділів серця та легень проходили достовірно меншу дистанцію, ніж пацієнти інших груп ЛАГ (табл. 2).
Таблиця 2. Результати стандартного обстеження пацієнтів у центрі легеневої гіпертензії
залежно від етіології ЛАГ (M±m)
| Показники, од. вим.
Достовірність |
ІЛАГ
n=98 |
ЛАГ-ЗСТ
n=28 |
ЛАГ-ВІЛ
n=11 |
ЛАГ-Портальна
n=4 |
ЛАГ-ВВС
n=200 |
ЛГ-ЛВС
n=20 |
ЛГ-ЗЛ
n=13 |
ХТЕЛГ
n=84 |
|---|---|---|---|---|---|---|---|---|
| ШКФ, мл/хв/1,73 м2 | 78,5±2,1*2, 6, 8 | 63,9±4,21 | 82,6±8,66 | 72,7±10,3 | 86,2±18,6 | 60,28±4,81,3 | 67,1±7,4 | 67,6±2,31 |
| NT-proBNP, пг/мл | 1885,9±111,52, 3, 5–8 | 7868,1±15,51, 3, 4–8 | 253,8±52,71, 2, 5, 6, 8 | 849,1±58,1 | 840,1±58,91, 2, 3, 7 | 857,3±63,61, 2, 3, 7 | 250,2±169,21, 2, 5, 6, 8 | 990,9±67,41, 2, 3, 7 |
| Феритин, нг/мл | 102,7±16,4 | 148,6±28,2 | 106,5±47,6 | 73,4±38,9 | 71,1±12,7 | 111,9±25,5 | 72,3±14,6 | 118,5±20,9 |
| Дистанція 6-ХТ при госпіталізації, м | 352,6±11,92, 6 | 294,8±24,61, 4, 5 | 343,3±39,3 | 365,3±10,42, 6–8 | 379,0±8,12, 6–8 | 270,6±3,01, 4, 5, 8 | 285,9±33,34, 5 | 325,1±14,44, 5, 6 |
| Задишка за Borg при госпіталізації, бали | 4,2±0,22, 4, 6 | 5,8±0,41, 4, 5 | 4,8±3,2 | 1,7±1,21, 2, 5–8 | 4,3±0,52, 4 | 5,4±0,51, 4 | 5,1±0,94 | 4,9±0,34 |
| Дистанція 6-ХТ при виписці, м | 375,0±12,42 | 295,7±28,14–6 | 291,7±61,5 | 402,1±20,22 | 387,4±16,82 | 374,0±21,92 | 292,5±141,5 | 365,0±25,6 |
| Задишка за Borg при виписці, бали | 3,46±0,32 | 5,0±0,61, 5 | 3,7±0,7 | 3,0±0,9 | 3,48±0,32 | 3,0 | 5,0±3,1 | 3,7±0,5 |
| САТ, мм рт. ст. | 116,2±1,56, 8 | 120,4±2,93, 5 | 111,6±3,12, 6, 8 | 115,5±8,3 | 114,2±1,12, 6, 8 | 128,6±4,91, 3, 5 | 121,1±5,7 | 124,7±1,81, 3, 5 |
| ДАТ, мм рт. ст. | 76,5±0,93, 8 | 80,3±2,03, 5 | 69,3±1,81, 2, 5–8 | 75,0±5,1 | 74,5±0,92, 3, 8 | 76,9±2,43 | 77,9±3,43 | 80,7±1,11, 3, 5 |
| ЧСС, уд./хв | 67,0±2,8 | 64,9±6,2 | 54,2±10,6 | 53,1±8,8 | 68,2±1,7 | 60,7±5,4 | 58,9±9,4 | 67,6±2,9 |
| Сатурація О2 до 6-ХТ, % | 95,0±0,45, 7, 8 | 89,1±3,03 | 96,5±0,92, 5, 7, 8 | 96,7±2,35, 7 | 87,4±0,81, 3, 4, 6, 8 | 94,2±1,7 | 88,9±2,61, 3, 4 | 93,2±0,51, 3, 5 |
| Сатурація О2 після 6-ХТ, % | 92,9±0,82, 5, 7, 8 | 70,5±3,91, 3–8 | 94,4±1,62, 5, 7, 8 | 94,0±1,52, 5, 7, 8 | 78,9±1,31–4, 6, 8 | 92,5±1,92, 5 | 83,1±4,71–4 | 89,3±0,91–5 |
*1Достовірно (р<0,05) порівняно з групою ІЛАГ; 2достовірно порівняно з групою ЛАГ-ЗСТ; 3достовірно порівняно з групою ЛАГ-ВІЛ; 4достовірно порівняно з групою ЛАГ-Портальна; 5достовірно порівняно з групою ЛАГ-ВВС; 6достовірно порівняно з групою ЛАГ-ЗЛВ; 7достовірно порівняно з групою ЛАГ-ЗЛ; 8достовірно порівняно з групою ХТЕЛГ. 6-ХТ — 6-хвилинний тест.
За показником задишки за Borg достовірно найнижчий бал мали пацієнти з портальною ЛАГ (1,7±1,2 бала), а найвищий — хворі з ЗСТ (5,8±0,4 бала), ЛАГ-ЗЛВ (5,4±0,5 бала) та ЛАГ-ЗЛ (51,1±0,9 бала). При виписці зі стаціонару (на фоні призначеного лікування) у пацієнтів майже всіх груп відмічено збільшення 6-хвилинної дистанції та зменшення оцінки задишки за Borg, за винятком пацієнтів із ЗСТ та ВІЛ. Після проведення тесту з 6-хвилинною ходьбою сатурація крові киснем достовірно знижувалася у пацієнтів з ІЛАГ (р=0,02), ЛАГ-ЗСТ (р=0,0004), ЛАГ-ВВС (р<0,001) та ХТЕЛГ (р=0,0002).
Між групами виявлена достовірна різниця за середнім рівнем NT-proBNP — він був достовірно вищим у пацієнтів із ЗСТ, а достовірно найнижчим у пацієнтів з ВІЛ-інфекцією та захворюванням легень. У пацієнтів з ЛАГ-ЗСТ, ЛАГ-ЗЛВ, ЛАГ-ЗЛ та ХТЕЛГ достовірно більш низькою була ШКФ порівняно з пацієнтами з ІЛАГ.
Показники ЕхоКГ та КПС представлені в табл. 3 та 4. Так, пацієнти з ЛАГ, окрім хворих із ВВС, характеризувалися найнижчими показниками площі та індексу ЛП (див. табл. 3).
Таблиця 3. Результати ЕхоКГ обстеження пацієнтів залежно від етіології ЛАГ (М±m)
| Показники, од. вим. | ІЛАГ
n=98 |
ЛАГ-ЗСТ
n=28 |
ЛАГ-ВІЛ
n=11 |
ЛАГ-Портальна
n=4 |
ЛАГ-ВВС
n=200 |
ЛАГ-ЛВС
n=20 |
ЛАГ-ЗЛ
n=13 |
ХТЕЛГ
n=84 |
|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |
| Показники ЕхоКГ | ||||||||
| Площа ЛП, см2 | 16,9±0,75, 6 * | 17,3±1,25, 6 | 15,9±1,05–8 | 15,7±1,35, 6, 8 | 21,4±0,96, 8, 1–4 | 28,3±1,67, 8, 1, 2, 4 | 20,2±1,73 | 18,6±0,63, 4, 5 |
| Індекс ЛП, мл/м2 | 23,8±0,75, 6, 8 | 25,9±1,75, 6 | 26,6±1,85, 6 | 23,4±3,65, 6 | 40,2±3,26–8, 1–4 | 55,3±4,87, 8, 1–5 | 27,3±1,85, 6 | 27,5±1,71, 5, 6 |
| Площа ПП, см2 | 25,8±0,92 | 21,9±0,96–8, 1 | 25,3±2,7 | 19,9±3,16, 8 | 24,1±0,96, 8 | 29,3±2,32, 4, 5 | 28,5±2,22 | 26,9±0,92, 4, 5 |
| Індекс ПП, мл/м2 | 52,6±2,9 | 47,4±4,4 | 54,9±8,2 | 37,5±9,9 | 52,5±3,5 | 59,3±7,4 | 55,2±6,0 | 56,5±3,2 |
| СТЛАр, мм рт. ст. | 88,1±2,85–7 | 82,7±4,45 | 87,3±6,4 | 91,0±12,4 | 96,1±2,26–8, 1, 2 | 70,7±6,38, 1, 5 | 74,6±6,11, 5 | 87,8±3,05, 6 |
| срТЛАр, мм рт. ст. | 52,5±3,65 | 57,6±4,7 | 56,7±13,0 | 49,2±8,9 | 63,9±2,06, 1 | 41,0±8,95 | 54,0±12,1 | 57,9±3,0 |
| TAPSE, мм | 15,5±0,44–6 | 15,7±0,85, 6 | 14.1±1,45–7 | 17,8±0,81, 8 | 17,7±0,58,1–3 | 19,3±0,98, 1–3 | 20,0±2,33 | 15,4±0,44, 5, 6 |
*1Достовірно (р<0,05) порівняно з групою ІЛАГ; 2достовірно порівняно з групою ЛАГ-ЗСТ; 3достовірно порівняно з групою ЛАГ-ВІЛ; 4достовірно порівняно з групою ЛАГ-Портальна; 5достовірно порівняно з групою ЛАГ-ВВС; 6достовірно порівняно з групою ЛАГ-ЗЛВ; 7достовірно порівняно з групою ЛАГ-ЗЛ; 8достовірно порівняно з групою ХТЕЛГ. ЛП — ліве передсердя, ПП — праве передсердя, СТЛАр — розрахований систолічний тиск в легеневій артерії, срТЛАр — розрахований середній тиск в легеневій артерії, TAPSE — екскурсія кільця трикуспідального клапану.
Таблиця 4. Показники катетеризації правих відділів серця залежно від етіології ЛАГ (М±m)
| Показники, од. вим. | ІЛАГ
n=98 |
ЛАГ-ЗСТ
n=28 |
ЛАГ-ВІЛ
n=11 |
ЛАГ-Портальна
n=4 |
ЛАГ-ВВС
n=200 |
ЛАГ-ЛВС
n=20 |
ЛАГ-ЗЛ
n=13 |
ХТЕЛГ
n=84 |
|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |
| СрТЛА, мм рт. ст. | 56,9±1,62, 5, 6 | 47,2±3,45, 1 | 52,4±3,85 | 55,8±11,6 | 67,1±2,26, 8, 1–3 | 44,9±5,61, 5 | 48,1±13,9 | 52,1±2,15 |
| Тиск ПП, мм рт. ст. | 9,1±0,52, 5, 7 | 6,8±0,86, 8, 1 | 7,9±1,1 | 8,0±2,0 | 7,2±0,66, 8, 1 | 12,3±2,27, 2, 5 | 5,3±1,81, 6, 8 | 10,1±0,72, 5, 7 |
| ТЗЛА, мм рт. ст. | 7,9±0,334, 6, 8 | 8,5±0,7 | 6,2±0,86, 8 | 9,3±1,41 | 9,9±0,91,6 | 17,6±0,81–5, 7, 8 | 7,7±1,55, 3, 6 | 9,2±0,41, 3, 6 |
| ХОК, л/хв | 4,2±0,13, 5 | 4,6±0,43, 5 | 4,1±1,01, 2, 4–8 | 6,1±1,33 | 7,2±0,61–3, 6–8 | 4,7±0,53, 5 | 5,0±0,43,5 | 4,5±0,23, 5 |
| СІ, л/хв/м2 | 2,2±0,084, 5 | 2,6±0,2 | 2,4±0,5 | 3,3±0,5 | 2,7±0,2 | 2,5±0,6 | 2,6±0,4 | 2,3±0,1 |
| ОЛС, дин/с/см5 | 1083,6±53,02, 4, 6–8 | 837,5±110,66, 1 | 1488,3±384 | 687,8±20,31, 5, 7, 8 | 1130,0±134,66, 7, 4 | 462,6±128,97, 8, 1, 2, 5 | 835,5±0,51, 4–6 | 864,1±62,61, 4, 6 |
| Системний опір, дин/с/см5 | 1815,5±63,63, 4, 7 | 1874,0±188,93, 7 | 2545,2±164,51, 2, 4–8 | 1246±274,91, 3 | 1743,8±197,17, 3 | 1540,3±164,77, 3 | 859,5±59,51–3, 5, 6, 8 | 1829,1±98,77, 3 |
| Загальний опір, дин/с/см5 | 1248,4±59,92, 6, 8 | 973,0±121,11, 5 | 1732,8±474,5 | 1010,3±207,8 | 1496,7±188,32, 6–8 | 770,7±128,85 | 1018,1±111,25 | 1025,1±82,51, 5 |
*1Достовірно (р<0,05) порівняно з групою ІЛАГ; 2достовірно порівняно з групою ЛАГ-ЗСТ; 3достовірно порівняно з групою ЛАГ-ВІЛ; 4достовірно порівняно з групою ЛАГ-Портальна; 5достовірно порівняно з ЛАГ-ВВС; 6достовірно порівняно з групою ЛАГ-ЗЛВ; 7достовірно порівняно з групою ЛАГ-ЗЛ; 8достовірно порівняно з групою ХТЕЛГ. СрТЛА — середній тиск в легеневій артерії. ПП — праве передсердя, ХОК — хвилинний об’єм крові, СІ — серцевий індекс, ОЛС — опір легеневих судин, ТЗЛА — тиск заклинювання легеневої артерії.
У пацієнтів групи ХТЕЛГ площа ЛП була достовірно більшою, ніж у пацієнтів із ВІЛ-інфекцією та портальною ЛАГ, достовірно не відрізнялася від такої груп ІЛАГ, ЛАГ-ЗСТ, ЛАГ-ЗЛ та була достовірно меншою, ніж у пацієнтів з ЛАГ-ВВС та ЛАГ-ЛВС. За індексом ПП групи достовірно не відрізнялися, але площа ПП була достовірно більшою у пацієнтів з ЛАГ-ЛВС, ЛАГ-ЗЛ та ХТЕЛГ. Розрахунковий СТЛА, за даними ЕхоКГ, найвищим був у пацієнтів з ЛАГ-ВВС (достовірно порівняно з пацієнтами з ІЛАГ, ЛАГ-ЗСТ, ЛАГ-ЗЛВ, ЛАГ-ЗЛ та ХТЕЛГ). Показник TAPSE, що характеризує функцію правого шлуночка, був найвищим у пацієнтів груп ЛАГ-Портальна, ЛАГ-ВВС, ЛАГ-ЗЛВ та ЛАГ-ЗЛ.
За даними КПС, у пацієнтів з ЛАГ СрТЛА був найнижчим в групі ЛАГ-ЗСТ (достовірно порівняно з групами ІЛАГ та ЛАГ-ВВС), найвищим — у групі пацієнтів з ЛАГ-ВВС.
Оцінка виживання пацієнтів, які пройшли обстеження та лікування у спеціалізованому центрі
За вказаний строк спостереження загалом померли 92 пацієнти з ЛАГ. Оцінка виживання пацієнтів, які пройшли лікування в спеціалізованому центрі, залежно від етіології представлена на рис. 2. Найкращий показник виживання зафіксований у пацієнтів з ЛАГ-Портальна — 100% (строк спостереження 71 міс). Найгірше виживали хворі з ХТЕЛГ — 44,4±12,3% (середній строк спостереження 65,7 міс), пацієнти із ЗСТ — 51,2±11,9% (середній строк спостереження 18 міс) та хворі із захворюванням легень — 52,6±16,3% (середній строк спостереження 24,9 міс). Виживання пацієнтів із ІЛАГ, ЛАГ-ВІЛ інфекцією та ЛАГ-ЗЛВ відповідно становило 62,7±6,8% (середній строк спостереження 75 міс), 60,0±18,4% (середній строк спостереження 28,1 міс) та 70,2±17% (середній строк спостереження 35,6 міс).
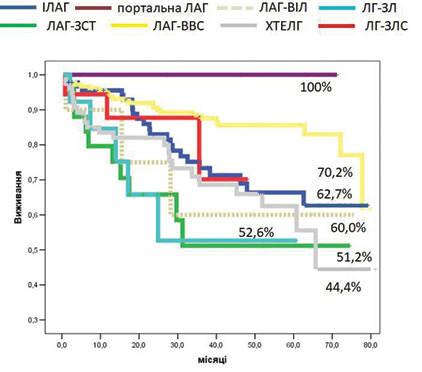
Порівняння виживання пацієнтів різних груп представлено у табл. 5.
Таблиця 5. Порівняння виживання обстежених пацієнтів залежно від етіології ЛАГ (Long rank Mantel-Cox тест)
| Група/χ2, P | ІЛАГ
n=98 |
ЛАГ-ЗСТ
n=28 |
ЛАГ-ВІЛ
n=11 |
ЛАГ-Портальна
n=4 |
ЛАГ-ВВС
n=200 |
ЛАГ-ЛВС
n=20 |
ЛАГ-ЗЛ
n=13 |
|---|---|---|---|---|---|---|---|
| ЛАГ-ЗСТ, n=28 | 4,2, р=0,041 | ||||||
| ЛАГ-ВІЛ, n=11 | 0,37, р=0,54 | 0,17, р=0,68 | |||||
| ЛАГ-Портальна, n=4 | 1,49, р=0,22 | 2,33, р=0,13 | 1,66, р=0,198 | ||||
| ЛАГ-ВВС, n=200 | 6,1, р=0,013 | 16,63, р<0,001 | 3,13, р=0,077 | 0,64, р=0,42 | |||
| ЛАГ-ЛВС, n=20 | 0,029, р=0,87 | 1,64, р=0,20 | 0,35, р=0,56 | 1,1, р=0,3 | 1,35, р=0,25 | ||
| ЛАГ-ЗЛ, n=13 | 3,3, р=0,068 | 0,001, р=0,98 | 0,16, р=0,69 | 2,35, р=0,13 | 10,9, р=0,001 | 1,27, р=0,26 | |
| ХТЕЛГ, n=84 | 1,16, р=0,28 | 1,12, р=0,29 | 0,001, р=0,99 | 1,98, р=0,16 | 12,8, р<0,001 | 0,27, р=0,61 | 1,19, р=0,28 |
При порівнянні за допомогою Long rank (Mantel-Cox) тесту пацієнти з ІЛАГ продемонстрували достовірно гірше виживання, ніж пацієнти з ЛАГ-ВВС (р=0,013). Пацієнти із ЛАГ-ЗСТ мали достовірно вищий ризик померти, ніж пацієнти з ЛАГ-ВВС (р<0,001) та ІЛАГ (р=0,041). Виживання у пацієнтів з ЛАГ-ВВС було достовірно кращим, ніж у пацієнтів із ЛАГ-ЗЛ та ХТЕЛГ. Відсутність достовірної різниці між іншими групами можна пояснити малою кількістю пацієнтів в окремих групах.
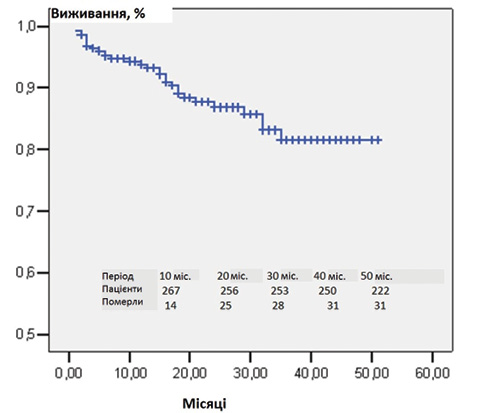
Другою частиною нашої роботи стала оцінка факторів, які асоціювалися із виживанням пацієнтів саме цих груп, нами було відібрано 281 пацієнта, які повністю пройшли обстеження в центрі та мали повний обсяг результатів лабораторних та інструментальних обстежень. За період спостереження 51 міс (середнє значення 23,6 ± 14,1 міс) 31 пацієнт помер. Усі пацієнти були розділені на дві групи: ті, що вижили (n=250), та ті, що не вижили (n=31).
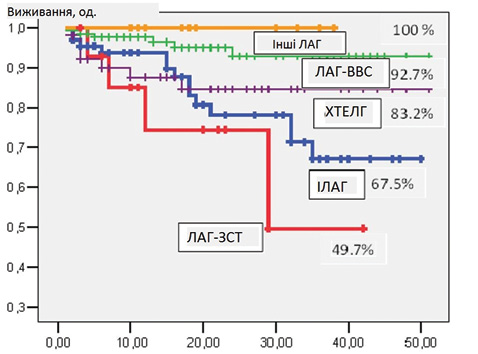
Крива виживання Kaplan — Meier для всієї когорти хворих показана на рис. 3. Показники виживання становили 93,3; 86,8 і 81,5% через 1, 2 і 3 роки відповідно. На рис. 4 представлено ймовірне кумулятивне виживання обстежених пацієнтів залежно від етіології. Виживання було достовірно кращим у пацієнтів з ЛАГ-ВВС порівняно з IЛАГ (P = 0,002), ЛАГ-ЗСТ (р=0,001) і ХТЕЛГ (р=0,04). Виживання було найгіршим у пацієнтів із ЛАГ-ЗСТ, але статистично значущі відмінності виявлені лише із пацієнтами з ЛАГ-ВВС (р=0,001) та пацієнтами з іншими формами ЛАГ (р=0,05).
Обговорення
Аналіз роботи центру легеневої гіпертензії ДУ «ННЦ «Інститут кардіології імені М.Д. Стражеска» НАМН України показав, що протягом зазначеного періоду вдалося обстежити 458 хворих з ЛАГ та на основі результатів обстеження створити реєстр. Проведено 299 КПС та 92 вазореактивні тести. Це відповідає вимогам Європейського товариства кардіологів, згідно з якими референтним може називатися лише центр, в якому спостерігається не менше 50 пацієнтів та проводиться не менше 20 вазореактивних тестів на рік [8]. Проте в нашому центрі структура пацієнтів з легеневою гіпертензією, а особливо з ЛАГ, дещо відрізнялася від структури пацієнтів в центрах інших країн. Так, ЛАГ діагностовано у 341 хворого, з них у переважної більшості — ЛАГ-ВВС (59%), ІЛАГ — 29% та ЛАГ-ЗСТ — лише 8%. А за даними Американського коледжу кардіологів, ІЛАГ становить 47% пацієнтів з ЛАГ. Серед інших форм ЛАГ-ЗСТ становить 50% (тобто серед усіх форм ЛАГ це майже 25%), а ЛАГ-ВВС — лише 19% (тобто серед усіх форм це лише 10%) [11].
Недостатню частку пацієнтів із ЗСТ в нашому центрі можна пояснити інертністю ревматологів в Україні, які або не скринують усіх хворих на наявність ЛАГ, або вважають, що даних ЕхоКГ достатньо для встановлення діагнозу ЛАГ і призначення специфічної терапії. Проте відомо, що ЗСТ можуть призводити до виникнення ЛАГ з декількох причин: 1) ураження судин легень — тоді такі пацієнти належать до 1-ї групи та дійсно потребують призначення специфічної терапії; 2) ураження серця — такі пацієнти належать до 2-ї групи та призначення специфічної терапії їм протипоказано; 3) ураження легень (пневмофіброз) — такі пацієнти належать до 3-ї групи та також не потребують специфічної терапії; 4) тромбоемболії легеневої артерії — таким пацієнтам може призначатися специфічна терапія і розглядатися питання щодо можливого хірургічного лікування. Правильно визначити, яке ураження превалює у пацієнтів із ЗСТ, можна лише при проведенні всебічного обстеження, яке обов’язково включає КПС, що можливо лише в спеціалізованих центрах.
Аналіз виживання загальної популяції пацієнтів, які пройшли обстеження та лікування (стаціонарне та/або амбулаторне), свідчить, що найкраще виживання — у пацієнтів з ЛАГ-Портальна — 100% (строк спостереження 71 міс). Найгірше виживали пацієнти з ХТЕЛГ — 44,4±12,3% (середній строк спостереження 65,7 міс), пацієнти із ЗСТ — 51,2±11,9% (середній строк спостереження 18 міс) та пацієнти із захворюванням легень — 52,6 ±16,3% (середній строк спостереження 24,9 міс). Виживання пацієнтів із ІЛАГ, ЛАГ-ВІЛ та ЛАГ-ЛВС відповідно становило 62,7±6,8% (середній строк спостереження 75 міс), 60,0±18,4% (середній строк спостереження 28,1 міс) та 70,2±17% (середній строк спостереження 35,6 міс). При цьому для пацієнтів з ураженням легень, ЗСТ та ВІЛ-інфекцією відмічено найменший середній строк спостереження та їх кількість була значно меншою, ніж пацієнтів інших груп (винятком є хворі з портальною гіпертензією). Саме ураження легень, яке в тому числі часто відмічається при ЗСТ, вірогідно асоціювалося із гіршим прогнозом.
У піданаліз оцінки факторів, що впливають на виживання, було включено малу частку хворих на ЛАГ-ЗСТ — лише 5,3% порівняно з французьким (15,3%) [12], шотландським (29,7%) [13] та португальським (24,6%) [14] реєстрами та реєстром центру в м. Гессен (Німеччина) (21,2%) [15]. Наші дані свідчать про найгірше виживання ЛАГ-ЗСТ порівняно з іншими формами ЛАГ. Оцінка виживання становила лише 49,7% за 3 роки. Це підтверджують дані інших досліджень [14, 15, 16]. У аналізі D. Launay та співавторів нескоригований ризик смерті при ЛАГ, асоційованій із системною склеродермією, порівняно з ІЛАГ становив 2,9 [17]. У нашому дослідженні він був подібний — 3,07. Враховуючи поганий прогноз у даної категорії пацієнтів, дуже важливо діагностувати ЛАГ при ЗСТ на ранній стадії та проводити агресивну комбіновану специфічну терапію.
Висновки
Дане дослідження є першим аналізом роботи єдиного центру легеневої гіпертензії в Україні. Воно демонструє, що структура хворих з ЛАГ в Україні суттєво відрізняється від такої в центрах інших країн: значно превалюють пацієнти з ЛАГ-ВВС (43,7%) і дуже мало хворих із ЗСТ (6,1%).
Найгірше виживали хворі з ХТЕЛГ — 44,4%, пацієнти з ЗСТ — 51,2% та пацієнти із ЗЛ — 52,6%. Загалом виживання всіх пацієнтів групи з ЛАГ становило 62,2%, що було достовірно краще, ніж у групі ЛАГ-ЗЛ, та ХТЕЛГ.
Аналіз виживання в когорті пацієнтів, яких було включено до аналізу факторів, асоційованих із ризиком смерті, показав, що у вибраній групі 1-, 2- і 3-річне виживання становило відповідно 93,3; 86,8 і 81,5% і відрізнялося між підгрупами з різною етіологією ЛГ.
Нам потрібно більше даних і ми повинні ініціювати нові довгострокові загальнонаціональні реєстрові дослідження для кращого догляду за хворими ЛАГ в сучасних умовах в Україні.
Список використаної літератури
- 1. Конопльова Л.Ф., Коваленко В.М., Амосова К.М. та ін. (2014) Діагностика та лікування легеневої гіпертензії. Рекомендації робочої групи з легеневих гіпертензій. Український кардіологічний журнал, Додаток № 3: 3–39.
- 2. Thenappan T., Shah S.J., Rich S. et al. (2007) USA-based registry for pulmonary arterial hypertension: 1982–2006. Eur. Respir. J. 306: 1103–1110. doi: 10.1183/09031936.00042107.
- 3. Mukerjee D., St George D., Coleiro B. et al. (2003) Prevalence and outcom in systemic sclerosis associated pulmonary arterial hypertension: application of a registry approach. Annals of the Rheumatic Diseases., 62(11): 1088–1093. doi: 10.1136/ard.62.11.1088.
- 4. Hachulla E., de Groote P., Gressin V. et al. (2009) The Three-Year Incidence of Pulmonary Arterial Hypertension Associated With Systemic Sclerosis in a Multicenter Nationwide. Arthritis&Rheumatism., 60(6): 1831–1839. doi: 10.1002/art.24525.
- 5. Clements P.J., Tan M., McLaughlin V.V. et al. (2012) Pulmonary Arterial Hypertension Quality Enhancement Research Initiative (PAH-QuERI) Investigators. The pulmonary arterial hypertension quality enhancement research initiative: comparison of patients with idiopathic PAH to patients with systemic sclerosis-associated PAH. Ann Rheum Dis., 71(2): 249 –252. doi: 10.1136/annrheumdis-2011–200265.
- 6. Luppino Assad A.P., Gavilanes Oleas F., Alves J.L. Jr et al. (2018) Survival of connective tissue disease associated pulmonary arterial hypertension. Clin Exp Rheumatol., 113(4): 186. PMID: 29745888.
- 7. Lefèvre G., Dauchet L., Hachulla E. et al. (2013) Survival and Prognostic Factors in Systemic Sclerosis-Associated Pulmonary Hypertension: A Systematic Review and Meta-Analysis. Arthritis & Rheumatism, 65(9): 2412–2423. doi: 10.1002/art.38029.
- 8. Galie N., Humbert M., Vachiery J.L. et al. (2015) ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC). Eur. Heart J., 37: 67–119. doi: 10.1093/eurheartj/ehv317.
- 9. Guyatt G., Sullivan M., Thompson P. et al. (1985) The 6-minute walk: a new measure of exercise capacity in subjects with chronic heart failure. Can. Med. Assoc. J. 132: 919–923. doi: 10.1164/ajrccm.166.1.at1102.
- 10. Lang R.M., Badano L.P., Mor-Avi V. et al. (2015) Recommendations for Cardiac Chamber Quantification by Echocardiography in Adults: An Update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. Journal of the American Society of Echocardiography. 28: 1–39. doi: 10.1016/j.echo.2014.10.003
- 11. McLaughlin V.V., Archer S.L., Badesch D.B. et al. (2009) ACCF/AHA 2009 Expert Consensus Document on Pulmonary Hypertension A Report of the American College of Cardiology Foundation Task Force on Expert Consensus Documents and the American Heart Association Developed in Collaboration With the American College of Chest Physicians; American Thoracic Society, Inc.; and the Pulmonary Hypertension Association. Circulation. 53(17): 1573–1619. doi:10.1016/j.jacc.2009.01.004.
- 12. Humbert M., Sitbon O., Yaïci A. et al. (2010) French Pulmonary Arterial Hypertension Network. Survival in incident and prevalent cohorts of patients with pulmonary arterial hypertension. Eur. Respir. J. 36: 549–555. doi: 10.1183/09031936.00057010.
- 13. Peacock A.J., Murphy N.F., McMurray J.J.V. et al. (2007) An epidemiological study of pulmonary arterial hypertension. Eur. Respir. J. 30: 104–109. doi: 10.1183/09031936.00092306.
- 14. Marques-Alvesa P., Baptista R., Marinho da Silva A. et al. (2017) Real-world, long-term survival of incident patients with pulmonary arterial hypertension. Rev. Port. Pneumol. 23(3): 124–131. doi:10.1016/j.rppnen.2017.01.006.
- 15. Gall H., Felix J., Schneck F. et al. (2017) The Giessen Pulmonary Hypertension Registry: Survival in pulmonary hypertension subgroups. J. Heart Lung Transplant. 36: 957–967. doi: 10.1016/j.healun.2017.02.016.
- 16. Thenappan T., Shah S.J., Rich S. et al. (2010) Survival in pulmonary arterial hypertension: a reappraisal of the NIH risk stratification equation. Eur. Respir. J. 35: 1079–1087. doi: 10.1183/09031936.00072709.
- 17. Launay D., Sitbon O., Hachulla E. et al. (2013) Survival in systemic sclerosis-associated pulmonary arterial hypertension in the modern management era. Ann. Rheum. Dis. 72: 1940–1946. doi: 10.1136/annrheumdis-2012–202489.
Анализ выживаемости пациентов с легочной артериальной гипертензией, ассоциированной с заболеванием соединительной ткани
ГУ «ННЦ «Институт кардиологии им. акад. М.Д. Стражеско» НАМН Украины»
Резюме. В работе представлен анализ выживаемости пациентов с легочной артериальной гипертензией, ассоциированной с заболеванием соединительной ткани, за период 2014–2021 гг. на базе отделения вторичных и легочных гипертензий ГУ ННЦ «Института кардиологии им. акад. М.Д. Стражеско» НАМН Украины. По данным нашего центра, доля таких больных составила 6,1% (28 человек). Всем пациентам проведены стандартное физикальное обследование, стандартный и биохимический анализ крови, тест 6-минутной ходьбы, эхокардиографическое исследование и катетеризацию правых отделов сердца с проведением термодилюции. В результате проведенного анализа выживаемости с использованием кривых Kaplan — Meier установлено, что у пациентов с легочной артериальной гипертензией, ассоциированной с заболеванием соединительной ткани, выявлен один из худших показателей — 51,2%. В данной группе больных 1-, 2- и 3-летняя выживаемость составила соответственно 93,3; 86,8 и 81,5%. Наши результаты несколько отличались от результатов других стран мира, что является толчком к инициации новых досрочных общенациональных реестровых исследований с участием больных легочной артериальной гипертензией в современных условиях в Украине.
Ключевые слова: легочная гипертензия, заболевание соединительной ткани, выживаемость.
Адреса для листування:
Сіренко Юрій Миколайович
03151, Київ, вул. Народного Ополчення, 5
ДУ «ННЦ «Інститут кардіології
ім. акад. М.Д. Стражеска» НАМН України»

Leave a comment