ДИФЕРЕНЦІЙОВАНИЙ ПІДХІД ДО УРАТЗНИЖУВАЛЬНОЇ ТЕРАПІЇ ПОДАГРИ ЗАЛЕЖНО ВІД ВІКУ, СТАТІ ТА СУПУТНЬОЇ ПАТОЛОГІЇ
Крилова А.С., Дубкова А.Г., Цимбалюк Т.С.
Резюме. Актуальність. Подагрична артропатія становить велику соціальну та економічну проблему для суспільства, супроводжується болем, утрудненням виконувати звичайні, повсякденні дії — і погіршує якість життя пацієнтів. У великій кількості досліджень, що проводяться у всьому світі, показано, що подагра та гіперурикемія є незалежними предикторами високого ризику розвитку коморбідної патології. Гіперурикемія пов’язана з усіма компонентами метаболічного синдрому, такими як порушення ліпідного обміну, високий індекс маси тіла, артеріальна гіпертензія, порушення обміну глюкози. З іншого боку, крім високого рівня сечової кислоти, подагра характеризується хронічним запаленням, поєднана дія цих факторів чинить патологічний вплив на судинне русло і є додатковим фактором ризику розвитку атеросклерозу та асоційованих з ним захворювань. Мета. Виконати огляд літератури та висвітлити сучасний підхід до уратзнижувальної терапії подагри залежно від віку, статі та супутньої патології. Методи. Проведено пошук у друкованих і електронних виданнях, наукових пошукових базах Medline та PubMed із застосуванням методів аналізу, порівняння та узагальнення інформаційних даних. Відповідні статті, що стосуються моніторингу та лікування подагри та гіперурикемії, ідентифіковані й розглянуті. Результати. У статті представлено особливості перебігу подагри залежно від віку, статі та супутньої патології. Авторами огляду розглянуті сучасні рекомендації Американського коледжу ревматології (American College of Rheumatology — ACR), Європейської антиревматичної ліги (нині — Європейський альянс асоціацій ревматологів, European League Against Rheumatism — EULAR), Британського товариства ревматології (British Society of Rheumatology — BSR) з діагностики та лікування подагри та гіперурикемії. У статті обговорюються питання медикаментозної терапії безсимптомної гіперурикемії, подагри залежно від віку, статі та супутньої патології, зокрема можливості застосування інгібітора ксантиноксидази фебуксостату. Висновки. Подагра та гіперурикемія — актуальна проблема сучасної ревматології, яка ще має багато питань та напрямків, що потребують подальшого дослідження. Особливо враховуючи неоднозначність впливу сечової кислоти на прогресування і перебіг супутньої патології. Застосування фебуксостату у хворих на подагру та гіперурикемію сприяє суттєвому зменшенню вираженості больового синдрому, уповільненню прогресування, поліпшенню функціонального стану суглобів і перебігу коморбідних захворювань завдяки його плейотропним ефектам. Необхідна подальша оцінка застосування уратзнижувальної терапії у пацієнтів різних вікових груп із супутньою патологією.
DOI: 10.32471/rheumatology.2707-6970.86.16684
УДК 616.72.-002.78-092-085.272
 Гіперурикемія — це порушення метаболізму сечової кислоти (СК) із підвищенням її рівня у плазмі крові >420 мкмоль/л, яке відбувається внаслідок збільшення синтезу СК, зниження екскреції СК або поєднання цих процесів. Гіперурикемія може формувати клінічно виражену подагру. З підвищеним рівнем СК пов’язують артеріальну гіпертензію (АГ), захворювання нирок, метаболічний синдром (МС), атеросклероз, ішемічну хворобу серця (ІХС), інсульт і судинну деменцію [25]. Рівні СК можна знизити медикаментозним шляхом, тобто застосуванням лікарських засобів, що гальмують вироблення СК (інгібітори ксантиноксидази (КО) алопуринол і фебуксостат), препаратів, що сприяють виведенню СК (пробенецид, бензбромарон і лезинурад) та інших лікарських засобів, що знижують рівень уратів (таких як аторвастатин або блокатор рецепторів ангіотензину — лозартан) [9]. Проте призначення препаратів для корекції гіперурикемії на сьогодні залишається дискутабельним питанням. В усіх рекомендаціях ревматологічних асоціацій: Європейської антиревматичної ліги (нині — Європейський альянс асоціацій ревматологів, European League Against Rheumatism — EULAR) [41], Британського товариства ревматології (BSR) [20], Американського коледжу ревматологів (ACR) [15] та ініціативи 3е (3e initiative) [47] не рекомендується застосування уратзнижувальної терапії (УЗТ) у пацієнтів із безсимптомною гіперурикемією. Але є повідомлення про те, що рівень СК та наявність коморбідної патології можуть впливати на призначення даної групи препаратів. Так, у пацієнтів похилого віку безсимптомну гіперурикемію не слід лікувати як таку, якщо тільки рівень сечової кислоти не перевищує 13 мг/дл для чоловіків і 10 мг/дл для жінок або на фоні синдрому лізису пухлини [44]. Рекомендації щодо лікування пацієнтів із безсимптомною гіперурикемією наразі наявні лише в японській настанові, де радять починати УЗТ при рівні СК 9 мг/дл (540 мкмоль/л) [58].
Гіперурикемія — це порушення метаболізму сечової кислоти (СК) із підвищенням її рівня у плазмі крові >420 мкмоль/л, яке відбувається внаслідок збільшення синтезу СК, зниження екскреції СК або поєднання цих процесів. Гіперурикемія може формувати клінічно виражену подагру. З підвищеним рівнем СК пов’язують артеріальну гіпертензію (АГ), захворювання нирок, метаболічний синдром (МС), атеросклероз, ішемічну хворобу серця (ІХС), інсульт і судинну деменцію [25]. Рівні СК можна знизити медикаментозним шляхом, тобто застосуванням лікарських засобів, що гальмують вироблення СК (інгібітори ксантиноксидази (КО) алопуринол і фебуксостат), препаратів, що сприяють виведенню СК (пробенецид, бензбромарон і лезинурад) та інших лікарських засобів, що знижують рівень уратів (таких як аторвастатин або блокатор рецепторів ангіотензину — лозартан) [9]. Проте призначення препаратів для корекції гіперурикемії на сьогодні залишається дискутабельним питанням. В усіх рекомендаціях ревматологічних асоціацій: Європейської антиревматичної ліги (нині — Європейський альянс асоціацій ревматологів, European League Against Rheumatism — EULAR) [41], Британського товариства ревматології (BSR) [20], Американського коледжу ревматологів (ACR) [15] та ініціативи 3е (3e initiative) [47] не рекомендується застосування уратзнижувальної терапії (УЗТ) у пацієнтів із безсимптомною гіперурикемією. Але є повідомлення про те, що рівень СК та наявність коморбідної патології можуть впливати на призначення даної групи препаратів. Так, у пацієнтів похилого віку безсимптомну гіперурикемію не слід лікувати як таку, якщо тільки рівень сечової кислоти не перевищує 13 мг/дл для чоловіків і 10 мг/дл для жінок або на фоні синдрому лізису пухлини [44]. Рекомендації щодо лікування пацієнтів із безсимптомною гіперурикемією наразі наявні лише в японській настанові, де радять починати УЗТ при рівні СК 9 мг/дл (540 мкмоль/л) [58].
Згідно з результатами досліджень депозиція кристалів моноурату натрію (МУН) при безсимптомній гіперурикемії наявна у близько 25% випадків [8]. Це можна пояснити тим, що розчинність СК в сироватці крові визначається певною межею — точкою насичення кристалів МУН. In vitro при температурі 37 °С МУН починають осаджуватися за концентрації 408 мкмоль/л при рН 7. Депонування та випадання в осад кристалів МУН може бути і при нижчому рівні СК при локальному зниженні температури тіла або при охолодженні всього організму [54]. Крім того, все більше даних літератури свідчать про те, що приховане відкладення кристалів СК може відбуватися в множинних позасуглобових ділянках, таких як ендокард, міокард, клапани серця, тонкий та товстий кишечник, хребет, структури ока (повіки, кон’юнктива, склера, рогівка, кришталик, райдужна оболонка, сітківка). Тому і гіперурикемія може проявлятися як біль у спині, захворювання судин або серця або навіть симптоми ураження очей, а не лише загальновідомими подагричними артропатією або нефропатією [24]. І тому Європейське агентство з лікарських засобів (European Medicines Agency — EMA) схвалило інгібітор ксантиноксидази — фебуксостат — для менеджменту пацієнтів із хронічною гіперурикемією з депозицією МУН.
Ще одна група пацієнтів, у яких може проводитися медикаментозна корекція рівня СК, — родичі хворих зі спадковими вадами ферментів гіпоксантин-гуанінфосфорибозилтрансферази (синдроми Леша — Ніхена і Келлі — Зігміллера), глюкозо-6-фосфатази або фруктозо-1-фосфатальдолази, що викликає надмірне утворення СК. Гіперурикемію в таких випадках зазвичай вдається добре контролювати при призначенні інгібіторів КО. Родичі пацієнта з подагрою повинні бути обстежені для виявлення підвищеної екскреції СК з сечею. Рівень СК >1100 мг/добу в сечі асоціюється з 50% ризиком сечокам’яної хвороби (СКХ). І якщо за допомогою дієти не вдається знизити екскрецію СК в сечі до ≤1000 мг/добу, слід використовувати інгібітори КО. Доза препаратів повинна бути скоригована для досягнення рівня СК у сечі <800 мг/ добу [32, 43].
Спонтанна або індукована протипухлинним лікуванням загибель пухлинних клітин призводить до розвитку ряду метаболічних порушень, узагальнено званих синдромом розпаду (лізису) пухлини (СЛП). Він є ускладненням проведеної цитотоксичної терапії, до якої належать хіміотерапія, іонізуюче опромінення, емболізація судин, радіочастотна абляція, використання моноклональних антитіл та інтерферону, високодозова хіміотерапія з трансплантацією стовбурових клітин периферичної крові. Найбільш часто розвиток цього синдрому відмічають у пацієнтів із лімфопроліферативними пухлинами і гемобластозами, що характеризуються високою швидкістю росту, великою фракцією клітин, які активно діляться, і чутливістю до цитостатичної терапії. Для нього характерні гіперурикемія, гіперфосфатемія, гіперкаліємія та гіпокальціємія. Наслідки потенційно тяжкі і включають гостре ураження нирок, серцеві аритмії, судоми та навіть смерть [2, 42, 56]. Активно проліферуючі пухлинні клітини мають високий вміст нуклеотидів і фосфату. Загибель клітин призводить до вивільнення калію, фосфору, СК та інших метаболітів пурину, які наводнюють міжклітинний простір. Раптове надходження великої кількості продуктів клітинного розпаду може перевищити здатність організму до їх виведення. Таким чином можуть розвинутися вторинна гіперурикемія, подагрична артропатія [21]. Тому і шляхи усунення гіперурикемії при СЛП та подагри схожі. Так, наприклад, расбуриказа схвалена для запобігання та лікування СЛП у пацієнтів, які отримують хіміотерапію з приводу лейкозів і лімфом, в літературі є повідомлення про її застосування при тофусній подагрі [50]. Натомість, у дослідженні 2017 р. призначення 10 мг фебуксостату на добу зумовило помітний ефект у зниженні рівня СК у сироватці крові у дітей з гемобластозами із ризиком розвитку СЛП від середнього до високого. Оскільки контроль рівня СК в сироватці крові відіграє вирішальну роль у профілактиці СЛП, результати дослідження показали, що фебуксостат є потужним засобом профілактики СЛП у дітей з онкологічними захворюваннями [28]. У попередніх дослідженнях 2014 р. у дорослих пацієнтів, які отримували хіміотерапію, показано, що фебуксостат значно знижує рівень СК у сироватці крові [52, 53]. У нещодавньому подвійному сліпому рандомізованому дослідженні 2015 р., в якому порівнювали фебуксостат з алопуринолом у дорослих із гематологічними злоякісними утвореннями, встановлено більш високу ефективність фебуксостату у підгрупах пацієнтів з різним вихідним рівнем СК у сироватці крові, рівнем креатиніну та ступенем ризику СЛП. Слід зазначити, що пацієнти в цьому дослідженні отримували 120 мг фебуксостату на добу, що було значно вище, ніж доза, наведена в попередніх дослідженнях, і у 12 разів вище, ніж доза, що призначалася у дослідженні з дітьми [49].
Тому, узагальнюючи вищевикладене, можна зробити висновок, що згідно з рекомендаціями безсимптомну гіперурикемію не потрібно лікувати медикаментозно, необхідно лише надати рекомендації щодо модифікації стилю та способу життя, проте в окремих випадках ми все ж можемо рекомендувати УЗТ, а саме фебуксостат при таких показниках:
- рівень СК ≥540 мкмоль/л;
- СЛП;
- депозити кристалів МУН;
- родичі хворих зі спадковими вадами ферментів (після дообстеження).
УРАТЗНИЖУВАЛЬНА ТЕРАПІЯ ТА СТАТЬ
Традиційно одним із факторів ризику розвитку подагри вважають чоловічу стать. Вроджені порушення пуринового обміну пов’язані з аутосомно-домінантним типом спадковості і призводять до формування так званої первинної подагри. До найбільш відомих генетичних розладів належать підвищення активності фосфорибозилпірофосфатсинтетази, частковий дефіцит гіпоксантин-гуанінфосфорибозилтрансферази. За наявності таких вроджених вад ферментів, які беруть участь в обміні пуринів, ознаки подагри можуть виникати в ранньому віці, як при синдромах Льоша — Ніхена (Lesch — Nyhan syndrome) або Келлі — Сігміллера (Kelly — Seegmiller syndrome). Дані дефіцити ферментів зчеплені з Х-хромосомою, саме тому захворювання частіше розвивається у чоловіків, а приблизно у 25% родичів визначається гіперурикемія.
Згідно з даними літератури подагра виникає лише у 0,2 на 1000 випадків жінок молодшого віку (молодше 45 років). Жінки з подагрою, як правило, літнього віку і мають більше супутніх захворювань, таких як ожиріння та захворювання нирок, порівняно з чоловіками [18]. Ще наявні відмінності у порушенні «протиподагричної» дієти, відтак алкоголь, який може підвищити ризик розвитку подагри у чоловіків, не відіграє важливої ролі у жінок, у той час як застосування сечогінних засобів, на відміну від дієтичних тригерів, частіше відмічають у жінок, ніж у чоловіків. Паління виявлено як фактор ризику гіперурикемії лише у жінок [48].
L.R. Harrold, Yood R.A., Mikuls T.R. та співавтори показали, що подагра у жінок була найбільш взаємопов’язана з гіпертонічною хворобою, дисліпідемією, захворюванням периферичних судин і цукровим діабетом [18].
У жінок відмічаються нетипове ураження суглобів у дебюті захворювання (не перший плюснефаланговий суглоб), залучення в запальний процес гомілковоступневих суглобів, можуть відмічати початковий поліартикулярний синдром, домінуюче ураження верхніх кінцівок або тофуси, які можна сплутати з ревматоїдними вузликами, тофуси також можуть виявляти у вузлах Гебердена, а загострення подагри менш часті [4].
З патогенетичної точки зору, естроген захищає жінок від подагри через його зв’язок із посиленою нирковою екскрецією СК, та подібний ефект має естроген при гормонозамісній терапії. Більша частка жінок з підвищеним рівнем СК у період постменопаузи порівняно з репродуктивним віком може бути пояснена зниженням із віком рівня естрогену, що призводить до зниження канальцевої екскреції нирками сечової кислоти [5].
Крім того, K.Y. Kim та співавтори розглядають як можливий варіант вплив естрадіолу на регулювання біосинтезу пурину [26].
Відповідно, є особливості у виборі УЗТ, відтак у досліджені 2014 р. продемонстровано ефективність фебуксостату у пацієнток старшого віку, в аналіз включили 82 пацієнти, які були розділені на 2 групи за статтю (чоловіки, n=53; жінки, n=29). Середній вік пацієнтів становив 75 та 78 років у чоловіків та жінок відповідно. У жінок дослідники виявили, що середній час для досягнення мети лікування становив 53 дні, що було значно менше, ніж у їхніх колег-чоловіків, у яких середній час до досягнення мети лікування становив 71 день [39]. Це свідчить на користь застосування саме фебуксостату у даної когорти пацієнтів.
УРАТЗНИЖУВАЛЬНА ТЕРАПІЯ ТА ВІК
Прийнято вважати, що подагрична артропатія найчастіше розвивається у віці 40–65 років, проте в клінічній практиці ми все частіше почали виявляти пацієнтів із ранньою (вік до 45 років) та пізньою (старше 60 років) подагрою. Спробуємо розібрати особливості перебігу подагри та призначення УЗТ у цих групах пацієнтів. Близько 25% пацієнтів з подагрою мають обтяжений сімейний анамнез. Однак у 80% пацієнтів з раннім початком подагри (вік <25 років) відмічають хоча б одного члена сім’ї з подагрою [12].
Французьке дослідження 2019 р. (GOSPEL) показало, що у пацієнтів з подагрою віком до 40 років часто виявляли поліартикулярні атаки, сімейний анамнез подагри, більш тривалу УЗТ, більш високий рівень СК у сироватці крові та метаболічний синдром [40].
Chen and Shen встановили, що подагра, яка виникала у віці до 20 років, пов’язана з ожирінням та сімейним анамнезом подагри [6].
У дослідженні 2016 р. Zhang та співавтори повідомили, що у пацієнтів з подагрою віком до 40 років відмічені частіші загострення, більша кількість уражених суглобів, більша тривалість захворювання та менша частка серцево-судинних, цереброваскулярних та ниркових супутніх захворювань на момент її появи. Однак у пацієнтів з раннім початком подагри виявлено вищий ризик розвитку тяжкої подагри та майбутніх серцево-судинних подій [61].
У дослідженні 2019 р. пацієнти з початком подагри у віці 30 років і молодші мали значно вищі рівні СК в сироватці крові, сімейний анамнез подагри, індекс маси тіла (ІМТ) та ожиріння, фактори розвитку серцево-судинних захворювань (гіперліпідемія) порівняно з пацієнтами віком старше 40 років. Серед пацієнтів віком до 30 років частіше переважали чоловіки [33].
Щодо супутньої патології, то у когорті молодих пацієнтів (n=4752, середній вік 25 років) підвищений ризик розвитку артеріальної гіпертензії був пов’язаний з рівнями СК навіть нижчими, ніж допустима межа визначення. У підлітків зареєстровано більш тісну кореляцію між артеріальною гіпертензією та рівнями СК, що може бути пояснено тим, що поліморфізм гена, що кодує ксантиноксидоредуктазу, асоційований не тільки з гіперурикемією, а й з артеріальною гіпертензією [62]. Отже, серед особливостей ранньої подагри можна виділити наступні:
- чоловіча стать;
- частіші загострення;
- поліартикулярні атаки (більша кількість уражених суглобів);
- сімейний анамнез подагри;
- більш високий рівень СК у сироватці крові;
- більша тривалість захворювання;
- частіша наявність метаболічного синдрому та ожиріння.
Важливими перевагами фебуксостату, що мають особливе значення у пацієнтів з ранньою подагрою, є забезпечення швидкого досягнення цільових показників СК, утричі ефективніший за алопуринол контроль цільових значень СК пацієнтів, значно ефективніша за алопуринол дія при початкових високих рівнях СК. Крім того, у пацієнтів з ожирінням та жировою дистрофією печінки частота виявлення ознак гепатотоксичності була достовірно нижче в групі фебуксостату (3/32, 9,4%) порівняно з групою алопуринолу (36/102, 35,3%, р=0,005) [30].
Щодо пізньої подагри, високий рівень СК зумовлює раннє старіння судин. Внутрішньоклітинна СК може індукувати оксидативний стрес. У кровоносних судинах СК гальмує утворення NO, водночас посилюючи синтез активних форм кисню (АФК), запалення судин і проліферацію клітин гладких м’язів судин при гальмуванні росту клітин ендотелію [14, 22]. Також описано, що підвищені рівні СК пов’язані з посиленням запальної відповіді на оксидативний стрес, ендотеліальною дисфункцією та патологічним ремоделюванням судин, що може пояснити підвищений ризик розвитку судинної деменції у літніх пацієнтів із гіперурикемією [51] (табл. 1).
| Дослідження | Кількість пацієнтів | Тривалість | Хвороба | Результат |
|---|---|---|---|---|
| Latourte et al., 2018 [29] | 1598 | 10 років | Судинна деменція | Значний ризик розвитку судинної або змішаної деменції у пацієнтів з більш високими показниками СК (відносний ризик (ВР) 3,66; 95% ДІ 1,29–10,41; p=0,015) |
| Khan A.A. et al., 2016 [23] | 16 688 | – | Судинна деменція | Не виявлено значного зв’язку між СК і маніфестацією судинної/змішаної деменції (середнє абсолютне відхилення (САВ) –0,05 (95% ДІ) і САВ —0,19 (95% ДІ) відповідно) |
| Singh J.A., Cleveland J., 2018 [45] | 111 656 | – | Судинна деменція | Подагра була незалежно пов’язана з достовірно більш високим ВР деменції, що вперше виникла, з ВР=1,15 (95% ДІ 1,12–1,18); порівняно з віком 65–75 років, вік 75–85 років і вік ≥85 років асоційовані з в 3,5 і в 7,8 раза вищим ризиком розвитку деменції |
У пацієнтів літнього віку (старше 65 років) з подагрою в 2 рази підвищений ризик розвитку раптового апное уві сні [46].
У пацієнтів цієї когорти частіше відмічають супутню патологію, а отже, вони приймають більше лікарських засобів для її корекції. Застосування при АГ тіазидних та тіазидоподібних діуретиків у 50% хворих зумовлює підвищення рівня СК [1].
Проведені метааналізи показали, що наявність гіперурикемії помірно підвищує ризик розвитку інсульту та смерті від інсульту [27]. Серед патогенетичних механізмів, які зумовлюють розвиток інсульту, можна виділити посилення перекисного окиснення ліпідів і адгезії тромбоцитів, стимуляцію проліферації гладком’язових клітин судин, що викликає запалення судин, пошкоджуючи ендотеліальні клітини, прискорення атеросклерозу [3]. Так, підвищений рівень СК пов’язаний з товщиною інтими медіа сонної артерії [36], і така ж тенденція була виявлена при стенозі проксимальної екстракраніальної артерії [59]. СК зумовлює прогресування атеросклеротичної активності, збільшуючи вироблення вільних радикалів і полегшуючи окиснення холестерину ліпопротеїдів низької щільності (ХС ЛПНЩ) і перекисне окиснення ліпідів [57]. СК посилює дисфункцію ендотелію судин [57] і проліферацію гладком’язових клітин судин, що може призвести до прегломерулярного ураження судин і високого артеріального тиску (АТ) [38]. Підвищений рівень СК відмічений при мікросудинній травмі [31], посиленні агрегації тромбоцитів та утворенні тромбу [60].
З іншого боку, застосування комбінації СК та рекомбінантного тканинного активатора плазміногену у дослідженні гострого ішемічного інсульту (URICO-ICTUS) призводило до зменшення вираженості нейрофункціональних порушень [34].
У той же час слід зазначити, що надмірне зниження рівня СК або низький рівень є ризиком розвитку дегенеративно-дистрофічних процесів центральної нервової системи (ЦНС), таких як хвороба Паркінсона або хвороба Альцгеймера [16, 17](табл. 2).
| Дослідження | Кількість пацієнтів | Тривалість | Хвороба | Результат |
|---|---|---|---|---|
| Euser et al., 2009 [13] | 7983 | 11 років | Хвороба Альцгеймера | Зниження ризику розвитку деменції на тлі вищого рівня СК (ВР 0,89; 95% ДІ 0,80–0,99; p=0,030) |
| Verhaaren et al., 2013 [55] | 814 | – | Хвороба Альцгеймера | Значний зв’язок між гіперурикемією і гіршими когнітивними здібностями (Z бал різниці -0,28 (-0,48; -0,08)) |
| Hong et al., 2015 [19] | 28 769 | 6 років | Хвороба Альцгеймера | Більш низький ризик розвитку хвороби Альцгеймера (ВР = 0,77; 95% ДІ 0,72–0,83; p <0,001) і судинної деменції (ВР=0,76; 95% ДІ 0,65–0,88; p <0,001) у пацієнтів з гіперурикемією |
| Lu et al., 2016 [35] | 59 224 | 5 років | Хвороба Альцгеймера | Більш високий ризик деменції у пацієнтів з подагрою (ВР=0,76; 95% ДІ 0,66–0,87) при багатофакторному і 0,71 (95% ДІ 0,62–0,80) при однофакторному аналізі |
| N. Du et al., 2016 [11] | 10 953 | – | Хвороба Альцгеймера | Більш високі значення СК пов’язані зі значним зниженням ризику хвороби Альцгеймера (ВР 0,66; 95% ДІ 0,52–0,85; р=0,001), |
| Chen X. et al., 2014 [7] | 2708 | – | Хвороба Альцгеймера | Не виявлено статистично значимої різниці значень цього передбачуваного маркера (САВ –0,50; 95% ДІ 1,23–0,22) |
| Khan A.A. et al., 2016 [23] | 16 688 | – | Хвороба Альцгеймера | Більш сильна асоціація між СК і хворобою Альцгеймера порівняно з пацієнтами з хворобою Паркінсона (САВ —0,33 (95% ДІ), p<0,001 і 0,67 (95% ДІ), p <0,001 відповідно) |
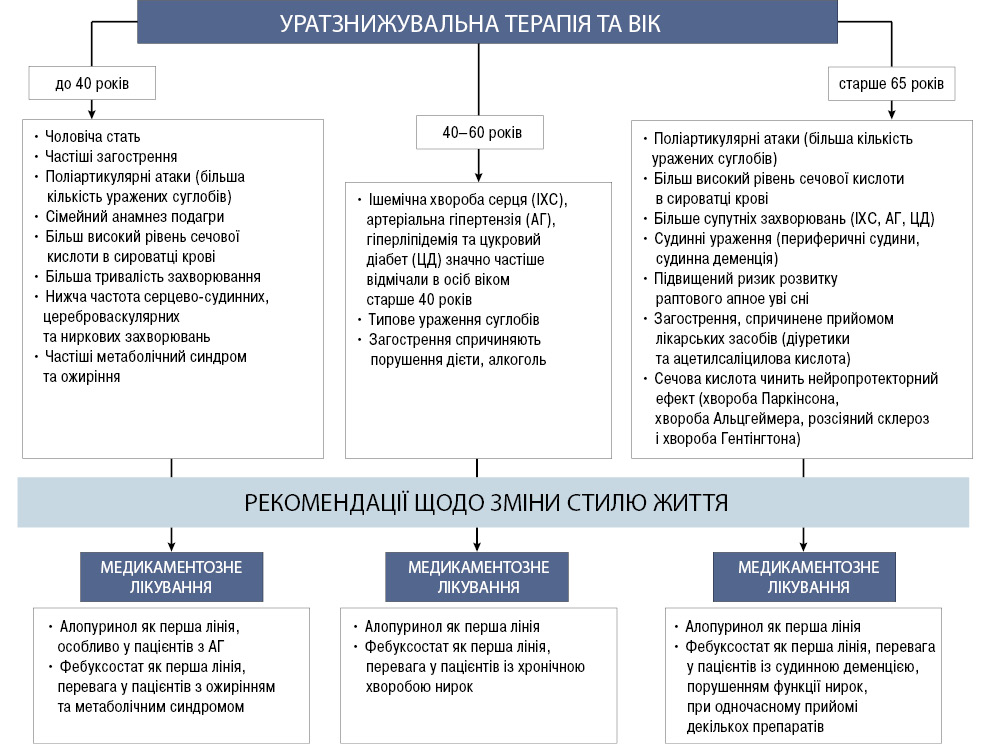
Отже, особливостями пізньої подагри є:
- більш високий рівень СК у сироватці крові;
- більше супутніх захворювань (ІХС, АГ, ЦД);
- судинні ураження (периферичні судини, судинна деменція);
- підвищений ризик розвитку раптового апное уві сні;
- загострення, спричинене прийомом лікарських засобів (діуретики та ацетилсаліцилова кислота);
- СК чинить нейропротекторний ефект (хвороба Паркінсона, хвороба Альцгеймера, розсіяний склероз і хвороба Гентінгтона).
Важливими перевагами фебуксостату, що мають особливе значення у пацієнтів з пізньою подагрою, є: 1) відсутність необхідності в корекції дози у пацієнтів похилого віку; 2) відсутність необхідності в корекції дози у пацієнтів з хронічною хворобою нирок І–ІІІ стадії; 3) відсутність міжмедикаментозної взаємодії з кардіологічними препаратами і дезагрегантами.
Серцево-судинний ризик має велике значення для пацієнтів літнього віку із серцево-судинною патологією, супутніми захворюваннями та факторами ризику, повідомлення про підвищення ризику серцево-судинної смертності при прийомі фебуксостату призвело до того, що деякі лікарі вважають, що фебуксостат не повинен розглядатися як препарат першої лінії у пацієнтів віком старше 65 років [10]. Проте наприкінці 2020 р. мультицентрове рандомізоване дослідження FAST показало відсутність підвищення рівня серцево-судинної смерті, пов’язаної із застосуванням фебуксостату. При цьому фебуксостат у дозі 80–120 мг не поступався алопуринолу у дозі 100–800 мг/добу за профілем безпеки щодо впливу на несприятливі серцево-судинні події. Автори дослідження вважають за потрібне переглянути та змінити нормативні рекомендації щодо уникнення застосування фебуксостату у пацієнтів із серцево-судинними хворобами [37]. Узагальнити УЗТ залежно від віку можна за допомогою алгоритму (рисунок).
ВИСНОВКИ
Подагра та гіперурикемія — актуальна проблема сучасної ревматології, яка ще має багато питань та напрямків, що потребують подальшого дослідження. Особливо, враховуючи неоднозначність впливу сечової кислоти на прогресування і перебіг супутньої патології. Застосування фебуксостату у хворих на подагру та гіперурикемію сприяє суттєвому зменшенню вираженості больового синдрому, уповільненню прогресування, поліпшенню функціонального стану суглобів і перебігу коморбідних захворювань завдяки його плейотропним ефектам. І хоча в усіх рекомендаціях ревматологічних асоціацій в якості першої лінії УЗТ рекомендується застосування алопуринолу, фебуксостат може бути розглянутий як перша лінія у хворих на подагру з коморбідністю.
Список використаної літератури
- 1. Насонова В.А., Барскова В.Г. (2004) Лекции для практикующих врачей. Рос. национ. конгресс «Человек и лекарство», Москва.
- 2. Abou Mourad Y., Taher A., Shamseddine A. (2003) Acute tumor lysis syndrome in large B-cell non-Hodgkin lymphoma induced by steroids and anti-CD 20. Hematol. J., 4(3): 222–224.
- 3. Ae R., Kanbay M., Kuwabara M. (2020) The causality between the serum uric acid level and stroke. Hypertens Res., 43(4): 354–356. doi: 10.1038/s41440-019-0346-z
- 4. Aslam F., Michet C. Jr. (2017) My Treatment Approach to Gout. Mayo Clin. Proc.,92(8):1234–1247. doi: 10.1016/j.mayocp.2017.05.026
- 5. Вero L.A., Grilli R., Grimshaw J.M. et al. (1998) Closing the gap between research and practice: an overview of systematic reviews of interventions to promote the implementation of research findings. The Cochrane effective practice and organization of care review group. BMJ, 317(7156): 465–468.
- 6. Chen S.Y., Shen M.L. (2007) Juvenile gout in Taiwan associated with family history and overweight. J. Rheumatol., 34: 2308–11.
- 7. Chen X., Guo X., Huang R. et al. (2014) Serum uric acid levels in patients with Alzheimer’s disease: A meta-analysis. PLoS ONE, 9: 94084 doi: 10.1371/ journal.pone.0094084.
- 8. Dalbeth N., House M.E., Aati O. et al. (2015) Urate crystal deposition in asymptomatic hyperuricaemia and symptomatic gout: a dual energy CT study. Ann. Rheum. Dis., 74(5): 908–911. doi: 10.1136/annrheumdis-2014-206397
- 9. Daskalopoulou S.S., Tzovaras V. et al. (2005) Effect on serum uric acid levels of drugs prescribed for indications other than treating hyperuricaemia.Curr. Pharm. Des., 11: 4161–4175. doi: 10.2174/138161205774913309
- 10. Day R.O., Lau W., Stocker S.L. et al. (2019), Management of gout in older people. J. Pharm. Pract. Res., 49: 90–97. doi.org/10.1002/jppr.1511
- 11. Du N., Xu D., Hou X. et al. (2016) Inverse Association Between Serum Uric Acid Levels and Alzheimer’s Disease Risk. Mol. Neurobiol., 53: 2594–2599.
- 12. Edwards N.L. (2015) Clinical gout. In: Hochberg MC, Silman AJ, Smolen JS, Weinblatt ME, Weisman MH, eds. Rheumatology. 6th ed., Vol. 2. Philadelphia, PA: Elsevier: 1569–1574.
- 13. Euser S.M., Irizarry M.C., Raman R. et al. (2009) Plasma urate and progression of mild cognitive impairment. Neurodegener. Dis., 6: 23–28. doi: 10.1159/000170883
- 14. Feig D.I., Soletsky B., Johnson R.J. (2008) Effect of allopurinol on blood pressure of adolescents with newly diagnosed essential hypertension: a randomized trial. JAMA., 300: 924–932. doi: 10.1001/jama.300.8.924
- 15. FitzGerald J.D., Dalbeth N., Mikuls T. et al. (2020) American College of Rheumatology Guideline for the Management of Gout. Arthritis Care Res. (Hoboken), 72(6): 744–760. doi: 10.1002/acr.24180
- 16. Gariballa S.E., Hutchin T.P., Sinclair A.J. (2002) Antioxidant capacity after acute ischaemic stroke. QJM, 95(10): 685–690.
- 17. Gordon M.H. (2012) Sigmificance of dietary Significance of dietary antioxidants for health. Int. J. Mol. Sci., 13(1): 173–179.
- 18. Harrold L.R., Yood R.A., Mikuls T.R. et al. (2006) Sex differences in gout epidemiology, evaluation and treatment. Ann. Rheum. Dis., 65: 1368–1372. doi: 10.1136/ard.2006.051649
- 19. Hong J.Y., Lan T.Y., Tang G.J. et al. (2015) Gout and the risk of dementia: a nationwide population-based cohort study. Arthritis Res. Ther., 17: 139.
- 20. Hui M., Carr A., Cameron S. et al. (2017) British Society for Rheumatology Standards, Audit and Guidelines Working Group. The British Society for Rheumatology Guideline for the Management of Gout. Rheumatology (Oxford), 56(7): e1-e20. doi: 10.1093/rheumatology/kex156
- 21. Jones G.L., Will A., Jackson G.H. et al. (2015) British Committee for Standards in Haematology. Guidelines for the management of tumour lysis syndrome in adults and children with haematological malignancies on behalf of the British Committee for Standards in Haematology. Br. J. Haematol.,169(5): 661–71. doi: 10.1111/bjh.13403
- 22. Kelkar A., Kuo A., Frishman W.H. (2011) Allopurinol as a cardiovascular drug. Cardiol. Rev., 19: 265–271. doi: 10.1097/crd.0b013e318229a908
- 23. Khan A.A., Quinn T.J., Hewitt J. et al. (2016) Serum uric acid level and association with cognitive impairment and dementia: Systematic review and meta-analysis. Age., 38: 16. doi: 10.1007/s11357-016-9871-8
- 24. Khanna P., Johnson R.J., Marder B. et al. (2020) Systemic Urate Deposition: An Unrecognized Complication of Gout? J. Clin. Med., 9(10): 3204. doi: 10.3390/jcm9103204
- 25. Khimion L., Yashchenko O., Sytiuk T. et al. (2019) A modern strategy for managing gout patients. Simeina medytsyna, 1(81): 6–11.
- 26. Kim K.Y., Schumacher H.R. et al. (2003) A literature review of epidemiology and treatment in acute gout.Clin. Ther., 25: 1617.
- 27. Kim S.Y., Guevara J.P., Kim K.M. et al. (2009) Hyperuricemia and risk of stroke: a systematic review and meta-analysis. Arthritis Rheum., 61(7): 885–92. doi: 10.1002/art.24612
- 28. Kishimoto K., Kobayashi R., Hori D. et al. (2017) Febuxostat as a Prophylaxis for Tumor Lysis Syndrome in Children with Hematological Malignancies. Anticancer Res., 37(10): 5845–5849.
- 29. Latourte A., Soumaré A., Bardin T. et al. (2018) Uric acid and incident dementia over 12 years of follow-up: a population-based cohort study. Ann. Rheum. Dis., 77: 328–335. doi:10.1136/annrheumdis-2016-210767
- 30. Lee J.S., Won J., Kwon O.C. et al. (2019) Hepatic Safety of Febuxostat Compared with Allopurinol in Gout Patients with Fatty Liver Disease. J. Rheumatol., 46(5): 527–531. doi: 10.3899/jrheum.180761
- 31. Lee S.W., Kim H.C., Nam C. et al. (2019) Age-differential association between serum uric acid and incident hypertension. Hypertens Res., 42: 428–37.
- 32. Levy G., Cheetham T.C. (2015) Is It Time to Start Treating Asymptomatic Hyperuricemia? Am. J. Kidney Dis., 66(6): 933–5. doi: 10.1053/j.ajkd.2015.09.002
- 33. Li Y., Piranavan P., Sundaresan D. et al. (2019) Clinical Characteristics of Early-Onset Gout in Outpatient Setting. ACR Open Rheumatol., 1(7): 397–402. doi: 10.1002/acr2
- 34. Llull L., Laredo C., Renú A. et al. (2015) Uric Acid Therapy Improves Clinical Outcome in Women With Acute Ischemic Stroke. Stroke., 46(8): 2162–7.
- 35. Lu N., Dubreuil M., Zhang Y. et al. (2016) Gout and the risk of Alzheimer’s disease: a population-based, BMI-matched cohort study. Ann. Rheum. Dis., 75: 547–551.
- 36. Ma M., Wang L., Huang W. et al. (2021) Meta-analysis of the correlation between serum uric acid level and carotid intima-media thickness. PLoSONE, 16(2): e0246416. doi.org/10.1371/journal.pone.0246416
- 37. Mackenzie I.S., Ford I., Nuki G. et al. (2020) FAST Study Group. Long-term cardiovascular safety of febuxostat compared with allopurinol in patients with gout (FAST): a multicentre, prospective, randomised, open-label, non-inferiority trial. Lancet, 396(10264): 1745–1757. doi: 10.1016/S0140-6736(20)32234-0
- 38. Mazzali M., Hughes J., Kim Y.G. et al. (2001) Elevated uric acid increases blood pressure in the rat by a novel crystal-independent mechanism. Hypertension, 38(5): 1101–6. doi: 10.1161/hy1101.092839
- 39. Mizuno T., Hayashi T., Hikosaka S. et al. (2014) Efficacy and safety of febuxostat in elderly female patients. Clin Interv Aging., 9: 1489–93.
- 40. Pascart T., Norberciak L., Ea H.K. et al. (2019) Patients with early-onset gout and development of earlier severe joint involvement and metabolic comorbid conditions: results from a cross-sectional epidemiologic survey. Arthritis Care Res (Hoboken), 71: 986–92. doi: 10.1002/acr.23706
- 41. Richette P., Doherty M., Pascual E. et al. (2016) updated EULAR evidence-based recommendations for the management of gout. Ann. Rheum. Dis., 76(1): 29–42. doi: 10.1136/annrheumdis-2016-209707
- 42. Sallan S. (2001) Management of acute tumor lysis syndrome. Semin. Oncol., 28: 9.
- 43. Seifert R. (2016) Towards rational drug treatment of Lesch-Nyhan disease. Mol. Genet. Metab., 118(3): 145–146. doi: 10.1016/j.ymgme.2016.05.004
- 44. Singh H. (2007) Diagnosis and Management of Gout in the Long-Term Care Setting. Annals of Long-Term Care, Population Health. http://www.hmpgloballearningnetwork.com/site/altc/article/7335
- 45. Singh J.A., Cleveland J.D. (2018) Gout and the Risk of Incident Dementia in the Elderly: A Medicare Claims Study [abstract]. Arthritis Rheumatol., 70 (suppl. 10).
- 46. Singh J.A., Cleveland J.D. (2018) Gout and the Risk of Incident Obstructive Sleep Apnea in Adults 65 Years or Older: An Observational Study. J. Clin. Sleep Med., 14(9): 1521–1527. doi: 10.5664/jcsm.7328
- 47. Sivera F., Andrés M. et al. (2014) Multinational evidence-based recommendations for the diagnosis and management of gout: integrating systematic literature review and expert opinion of a broad panel of rheumatologists in the 3e initiative. Ann. Rheum. Dis., 73(2): 328–35. doi: 10.1136/annrheumdis-2013-203325
- 48. Song P., Wang H., Xia W. et al. (2018) Prevalence and correlates of hyperuricemia in the middle-aged and older adults in China. Sci Rep., 8: 4314. doi: 10.1038/s41598-018-22570-9.
- 49. Spina M., Nagy Z., Ribera J.M. et al. (2015) FLORENCE Study Group: FLORENCE: a randomized, double-blind, phase III pivotal study of febuxostat versus allopurinol for the prevention of tumor lysis syndrome (TLS) in patients with hematologic malignancies at intermediate to high TLS risk. Ann. Oncol., 26: 2155–2161.
- 50. Sundy J.S., Baraf H.S., Yood R.A. et al. (2011) Efficacy and tolerability of pegloticase for the treatment of chronic gout in patient’s refractory to conventional treatment: two randomized controlled trials. JAMA, 306(7): 711–720.
- 51. Тanaka A., Kawaguchi A., Tomiyama H. et al. (2018) Crosssectional and longitudinal associations between serum uric acid and endothelial function in subjects with treated hypertension. Int. J. Cardiol., 272: 308–313. doi:10.1016/j.ijcard.2018.06.017
- 52. Takai M., Yamauchi T. (2014) Febuxostat for management of tumor lysis syndrome including its effects on levels of purine metabolites in patients with hematological malignancies — a single institution’s, pharmacokinetic and pilot prospective study. Anticancer Res., 34: 7287–7296.
- 53. Takai M., Yamauchi T., Fujita K. et al. (2014) Controlling serum uric acid using febuxostat in cancer patients at risk of tumor lysis syndrome. Oncol. Lett., 8: 1523–1527.
- 54. Tejera B. et al. (2014) Artritis séptica asociada a gota y seudogota: la importancia de la artrocentesis. Reumatol. Clin.,10: 61–62. doi: 10.1016/j.reumae.2013.01.010
- 55. Verhaaren B.F., Vernooij M.W., Dehghan A. et al. (2013) The relation of uric acid to brain atrophy and cognition: The Rotterdam Scan Study. Neuroepidemiology, 41: 29–34. doi: 10.1159/000346606
- 56. Will A., Tholouli E. (2011) The clinical management of tumour lysis syndrome in haematological malignancies. Br. J. Haematol., 154(1): 3–13. doi: 10.1111/j.1365-2141.2011.08697.x
- 57. Wong L.K. (2006) Global burden of intracranial atherosclerosis. Int. J. Stroke, 1(3): 158–9. doi: 10.1111/j.1747-4949.2006.00045.x
- 58. Yamanaka H. (2011) Japanese Society of Gout and Nucleic Acid Metabolism. Nucleosides Nucleotides Nucleic Acids, 30(12): 1018–1029.
- 59. Yang X., Lv H., Hidru T. H. et al. (2018) Relation of serum uric acid to asymptomatic proximal extracranial artery stenosis in a middle-aged Chinese population: a community-based cross-sectional study. BMJ Open, 8(8)e020681. doi: 10.1136/bmjopen-2017-020681.
- 60. Zapolski T., Wacinski P., Kondracki B. et al. (2011) Uric acid as a link between renal dysfunction and both pro-inflammatory and prothrombotic state in patients with metabolic syndrome and coronary artery disease. Kardiol. Pol.,69: 319–326.
- 61. Zhang B., Fang W., Zeng X. et al. (2016) Clinical characteristics of early- and late-onset gout: a cross-sectional observational study from a Chinese gout clinic. Medicine (Baltimore). 95: e5425. doi: 10.1097/MD.0000000000005425
- 62. Zhang W., Sun K., Yang Y. et al. (2009) Plasma uric acid and hypertension in a Chinese community: prospective study and metaanalysis. Clin. Chem., 55(11): 2026–34. doi: 10.1373/clinchem.2009.124891
Дифференцированный подход к уратснижающей терапии подагры в зависимости от возраста, пола и сопутствующей патологии
Национальный университет здравоохранения Украины им. П.Л. Шупика, Киев
Резюме. Актуальность. Подагрическая артропатия представляет большую социальную и экономическую проблему для общества, сопровождается болью, затруднением выполнять обычные, повседневные действия и ухудшает качество жизни пациентов. В большом количестве исследований, проводимых во всем мире, показано, что подагра и гиперурикемия являются независимыми предикторами высокого риска развития коморбидной патологии. Гиперурикемия связана со всеми компонентами метаболического синдрома, такими как нарушение липидного обмена, высокий индекс массы тела, артериальная гипертензия, нарушение обмена глюкозы. С другой стороны, кроме высокого уровня мочевой кислоты, подагра характеризуется хроническим воспалением, сочетанное действие этих факторов оказывает патологическое влияние на сосудистое русло и является дополнительным фактором риска развития атеросклероза и ассоциированных с ним заболеваний. Цель. Выполнить обзор литературы и осветить современный подход к уратснижающей терапии подагры в зависимости от возраста, пола и сопутствующей патологии. Методы. Проведен поиск в печатных и электронных изданиях, научных поисковых базах Medline и PubMed с использованием методов анализа, сравнения и обобщения информационных данных. Соответствующие статьи, касающиеся мониторинга и лечения подагры и гиперурикемии, идентифицированы и рассмотрены. Результаты. В статье приведены особенности течения подагры в зависимости от возраста, пола и сопутствующей патологии. Авторами обзора рассмотрены современные рекомендации Американского колледжа ревматологии (American College of Rheumatology — ACR), Европейской антиревматической лиги (ныне — Европейский альянс ассоциаций ревматологов, European League Against Rheumatism — EULAR), Британского общества ревматологии (British Society of Rheumatology — BSR) по диагностике и лечению подагры. В статье обсуждаются вопросы медикаментозной терапии бессимптомной гиперурикемии, подагры в зависимости от возраста, пола и сопутствующей патологии, в частности, возможности применения ингибитора ксантиноксидазы, фебуксостата. Выводы. Подагра и гиперурикемия — актуальная проблема современной ревматологии, у которой еще много вопросов и направлений, требующих дальнейшего исследования. Особенно учитывая неоднозначность влияния мочевой кислоты на прогрессирование и течение сопутствующей патологии. Применение фебуксостата у больных подагрой и гиперурикемией способствует существенному уменьшению выраженности болевого синдрома, замедлению прогрессирования, улучшению функционального состояния суставов и течению коморбидных заболеваний благодаря его плейотропным эффектам. Необходима дальнейшая оценка применения уратснижающей терапии у пациентов разного возраста с сопутствующей патологией.
Ключевые слова: гиперурикемия, мочевая кислота, коморбидность, фебуксостат.
Адреса для листування
Крилова А.С.
04112, Київ, вул. Дорогожицька, 9
Національний університет охорони здоров’я України імені П.Л. Шупика
Е-mail: Ann_Krylova@bigmir.net

Leave a comment