ЭФФЕКТИВНОСТЬ И ПЕРЕНОСИМОСТЬ ИММУНОБИОЛОГИЧЕСКОЙ ТЕРАПИИ У БОЛЬНЫХ РЕВМАТОИДНЫМ АРТРИТОМ
Яременко О.Б.1, Ивашковский А.И. 2, Федьков Д.Л. 1
Резюме. Резюме. Изучена эффективность и переносимость иммунобиологической терапии (ИБТ) ингибиторами фактора некроза опухоли-α (ИФНО-α) и ритуксимабом (РТ) у 11 больных ревматоидным артритом (РА). Через 3 мес ИБТ значительно снизилась активность РА и улучшился функциональный статус больных: DAS28 снизился на 27,9%, HAQ — на 40%, длительность утренней скованности сократилась в 4,8 раза. Достоверные изменения этих показателей сохранялись на протяжении всех 9 мес наблюдения. Уровень С-реактивного белка и СОЭ через 3 мес снизился на 58 и 32,9% соответственно, в дальнейшем наблюдалось некоторое повышение их уровня. В течение 9 мес терапии уровень ревматоидного фактора снизился в 2,3 раза. Из 7 больных, получавших до начала ИБТ нестероидные противовоспалительные препараты, они были отменены у 5 (71,4%) человек. Глюкокортикоиды удалось отменить у 1 из 5 больных, у остальных 4 больных доза преднизолона была снижена в среднем вдвое. Эффект от ИБТ был несколько выше и устойчивее при использовании РТ по сравнению с ИФНО-α, особенно по динамике лабораторных показателей. Переносимость лечения была хорошей у 6 (54,5%) больных, удовлетворительной — у 4 (36,4%) и неудовлетворительной — у 1 (9,1%) больной, которая прекратила терапию в связи с повторными инфузионными реакциями. Зарегистрирован факт заживления костных эрозий при лечении РТ.
ВСТУП
Ревматоїдний артрит (РА) — хронічне запальне ревматичне захворювання, яке характеризується набряком, болючістю і деструкцією суглобів, що призводить до ранньої інвалідизації та передчасної смерті [22, 24, 27, 32]. Оскільки у більшості хворих виявляють аутоантитіла — ревматоїдний фактор (РФ) та/чи антитіла до циклічного цитрулінованого пептиду (анти-ЦЦП), поява яких може передувати розвитку суглобового синдрому, РА вважається аутоімунним захворюванням [4, 23, 25]. Поширеність РА у світі становить близько 0,3–1,2%, жінки хворіють у 2–4 рази частіше за чоловіків. Поширеність РА cеред чоловіків і жінок з віком зростає [10, 26].
Основним завданням у веденні хворих на РА є рання діагностика та своєчасне призначення терапії, що гальмує запально-деструктивний процес в суглобах [14]. Рання діагностика РА є досить складною у зв’язку з пізнім розвитком патогномонічних для РА кісткових ерозій та незначною (від 15 до 43% хворих) серопозитивністю в дебюті захворювання [2]. Покращити ситуацію зі своєчасністю встановлення діагнозу і, відповідно, початку патогенетичної терапії можуть нові, більш чутливі, класифікаційні критерії РА, розроблені спільно фахівцями Європейської протиревматичної ліги (EULAR) та Американської колегії ревматологів (ACR) [8]. Лікування РА спрямовано на досягнення клініко-лабораторної та рентгенологічної ремісії, зниження рівня інвалідизації та покращання якості життя хворих. Основою лікування РА є базисна терапія (БТ), яка передбачає застосування синтетичних і біологічних базисних протиревматичних препаратів (БП). Паралельно застосовуються нестероїдні протизапальні препарати (НПЗП) та глюкокортикоїди (ГК). Вибір та порядок використання БП при лікуванні РА визначається індивідуальним рішенням лікаря з урахуванням міжнародних рекомендацій, що базуються на даних доказової медицини і постійно оновлюються. Відповідно до існуючих рекомендацій БТ у більшості хворих на РА слід починати з монотерапії [20]. Оптимальним БП для початку лікування є метотрексат (MT), ефективність і безпека якого доведена у чисельних рандомізованих клінічних дослідженнях. Важливим фактором, що аргументує доцільність першочергового призначення саме МТ, є його висока ефективність і безпека в комбінації з іншими БП, у тому числі біологічними [7, 18]. Якщо МТ не можна застосовувати у зв’язку з протипоказанням або непереносимістю, для ініціальної терапії показане застосування лефлуноміду (ЛФ), сульфасалазину (СС) або хлорохіну/гідроксихлорохіну; значно рідше застосовують препарати золота, D-пеніциламін та азатіоприн. НПЗП зумовлюють переважно симптоматичну дію, не впливають на продукцію та більшість біологічних ефектів цитокінів і, відповідно, не модифікують деструктивний процес у суглобах та перебіг хвороби в цілому, на відміну від БП [3]. Питання щодо системного застосування ГК в ініціальній терапії РА залишається спірним [29, 31], хоча згідно з останніми рекомендаціями їх пероральне чи парентеральне застосування в дебюті хвороби є ефективним, у тому числі стосовно гальмування ерозивно-деструктивного процесу, та безпечним [31, 29].
При неефективності початкової терапії протягом 3 міс слід застосовувати комбіновану БТ (КБТ). Нещодавно опубліковані рекомендації EULAR регламентують початок КБТ з додавання інгібітора фактора некрозу пухлини (ІФНП)-α, особливо у хворих, які мають фактори негативного прогнозу (висока активність захворювання, раннє виникнення кісткових ерозій, позитивність за РФ та/чи анти-ЦЦП у високому титрі) [29]. На сьогодні у світі з цієї групи препаратів для лікування хворих на РА зареєстровано інфліксимаб (ІНФ), який слід застосовувати на додаток до МТ, адалімумаб (АДА), етанерцепт, голімумаб та цертолізумаб [1].
Ефективність різних представників ІФНП-α при РА вірогідно не відрізняється, принаймні в перші місяці застосування, і вкладається у формулу «60–40–20»: 60–70% хворих, які отримують ІФНП-α, досягають відповіді за ACR 20, близько 40% — за ACR 50 і 20% — за ACR 70. Також суттєво не відрізняється їх безпека та вплив на швидкість рентгенологічного прогресування у хворих на РА [16, 17, 19, 28].
Серед інших біологічних БП застосовують модулятор Т-клітинної активації (абатацепт), антагоністи рецепторів інтерлейкіну-1 (анакінра) та інтерлейкіну-6 (тоцилізумаб), а також анти-В-клітинний препарат ритуксимаб (РТ) [13]. РТ — це химерні моноклональні антитіла до CD20-рецепторів B-лімфоцитів. Його ефективність при РА доведена, хоча механізм дії остаточно не вивчений і може полягати у зниженні презентації аутоантигенів, гальмуванні експресії цитокінів та виробленні аутоантитіл [11]. Клінічна відповідь на РТ більше виражена у хворих, позитивних за РФ [15, 21] та/чи анти-ЦЦП [30]. Згідно з останніми рекомендаціями щодо застосування біологічних БП [13] РТ використовують у лікуванні хворих на РА з середнім або високим ступенем активності за умов відсутності ефекту або непереносності ІФНП-α та за наявності протипоказань до їх застосування. Однак за інформацією, що міститься в оновленому консенсусі з використання РТ при РА [9], в реальній практиці 17–20,5% хворих на РА отримували РТ як перший біологічний БП.
Мета проведеної роботи — підвести підсумки власного досвіду застосування ІФНП-α та РТ у хворих на РА.
ОБ’ЄКТ І МЕТОДИ ДОСЛІДЖЕННЯ
У дослідження було включено 11 хворих на РА, які отримували біологічні БП в Центрі імунобіологічної терапії (ІБТ) на базі ревматологічного відділення № 1 Олександрівської клінічної лікарні м. Києва, термін спостереження за якими становив не менше 6 міс. Діагноз РА встановлювали відповідно до критеріїв ACR (1987) [6].
ІБТ призначалася відповідно до рекомендацій EULAR [29]. Серед 11 хворих, включених у розробку, 5 осіб отримували ІНФ в дозі 3 мг/кг маси тіла шляхом внутрішньовенної інфузії тривалістю 2 год за схемою, передбаченою інструкцією до препарату, 4 особи — РТ (2 пацієнти у дозі 1000 мг внутрішньовенно крапельно 2 рази з інтервалом у 2 тиж за схемою, передбаченою інструкцією до препарату, 2 пацієнти — в дозі 500 мг за тією ж схемою), 2 особи — АДА в дозі 40 мг підшкірно 1 раз на 2 тиж.
Серед хворих, яким було призначено РТ, до включення в дослідження 3 особи раніше отримували інші біологічні БП (2 хворих — ІНФ протягом 6 та 9 міс, 1 хвора — АДА протягом 6 міс). Заміна біологічного БП у цих пацієнтів зумовлена неефективністю (2 хворих) та непереносимістю (1 хвора) попереднього імунобіологічного засобу. У 1 хворої застосовували РТ як перший біологічний БП.
Згідно з існуючими вітчизняними рекомендаціями [3] та прийнятого в нашому центрі протоколу перед початком ІБТ усі хворі були ретельно обстежені, зокрема стосовно туберкульозної інфекції (рентгенографія легень у 2 проекціях) та вірусного гепатиту (HBsAg, antiHCV Ig G та M). З метою профілактики активації туберкульозної інфекції всім хворим було призначено ізоніазид по 300 мг/добу протягом 6 міс.
При обстеженні хворих оцінювали індекс активності захворювання — DAS28 [5], тривалість ранкової скутості та зміни у якості життя хворих, які визначали за Стенфордським опитувальником оцінки стану здоров’я HAQ [12]. Визначали швидкість осідання еритроцитів (ШОЕ), рівень у сироватці крові С-реактивного білка (СРБ), РФ і анти-ЦЦП.
Загальну характеристику включених у дослідження хворих на РА і підгруп, де застосовувались ІФНП-α або РТ, наведено в табл. 1. Як свідчать дані, усі хворі, які увійшли до аналізу, були жінками. У загальній когорті хворих середній вік становив 54,9 року. Більшість пацієнтів мали ІІ (45,4%) рентгенологічну стадію, по 27,3% — мали ІІІ та IV стадію, що пояснюється значною середньою тривалістю захворювання до початку ІБТ — більше 12 років. Майже ⅔ хворих на момент включення були серопозитивними за РФ та/чи анти-ЦЦП, у 1 хворої підвищення рівня РФ («серопозитивізація») вперше було виявлено на 3-му місяці спостереження. Переважна більшість пацієнтів (по 81,8%) мали активність захворювання та функціональну недостатність суглобів (ФНС) ІІ ступеня, решта — ІІІ ступеня. Ці дані в цілому відповідають достатньо високим середнім величинам інтегральних показників активності захворювання за DAS28 (5,70) та функціонального статусу хворих за даними опитувальника HAQ (1,67). Середні величини рівня СРБ та ШОЕ, тривалості ранкової скутості також підтверджують значну активність запального процесу. Більше половини хворих на момент початку ІБТ приймали небіологічні БП (5 хворих — МТ в дозі від 7,5 до 15 мг/тиж, 1 — ЛФ в дозі 20 мг/добу, 1 — СС в дозі 2 г/добу). Решта пацієнтів не приймали небіологічні БП у зв’язку з непереносимістю (3 хворих) або неефективністю (1 хвора). 7 з 11 пацієнтів отримували НПЗП, майже половина хворих — ГК перорально в дозі від 10 до 20 мг/добу в перерахунку на преднізолон, що свідчить про низьку ефективність БТ.
| Показник | Загалом (n=11) | ІФНП-α (n=7) | РТ (n=4) | |
|---|---|---|---|---|
| Вік, років | 54,9±12,6 | 52,7±15,4 | 58,7±4,86 | |
| Стать, n (%) | чол. (%) | 0 (0,00) | 0 (0,00) | 0 (0,00) |
| жін. (%) | 11 (100) | 7 (100) | 4 (100) | |
| Активність, n (%) | ІІ | 9 (81,8) | 5 (71,4) | 4 (100,0) |
| ІІІ | 2 (18,2) | 2 (38,6) | 0 (0,00) | |
| Рентгенологічна стадія, n (%) | ІІ | 5 (45,4) | 4 (57,1) | 1 (25,0) |
| ІІІ | 3 (27,3) | 1 (14,3) | 2 (50,0) | |
| ІV | 3 (27,3) | 2 (28,6) | 1 (25,0) | |
| ФНС, n (%) | ІІ | 9 (81,8) | 5 (71,4) | 4 (100,0) |
| ІІІ | 2 (18,2) | 2 (38,6) | 0 (0,00) | |
| Тривалість захворювання від дебюту симптомів, міс | 144,6±116,2 | 145,0±128,9 | 144,0±108,7 | |
| Тривалість захворювання від часу встановлення діагнозу, міс | 127,1±113,4 | 131,1±127,2 | 120,0±101,8 | |
| Прийом БП, n (%) | 7 (63,6) | 5 (71,4) | 2 (50,0) | |
| Прийом ГК, n (%) | 5 (45,4) | 3 (42,8) | 2 (50,0) | |
| Прийом НПЗП, n (%) | 7 (63,6) | 5 (71,4) | 2 (50,0) | |
| DAS28 | 5,70±1,25 | 5,69±1,19 | 5,71±1,56 | |
| HAQ | 1,67±0,79 | 1,67±0,82 | 1,67±0,86 | |
| Тривалість ранкової скутості, хв | 227,3±262,3 | 222,8±246,3 | 235,0±328,5 | |
| Серопозитивність за РФ та/або анти-ЦЦП, n (%) | 7 (63,6) | 4 (57,1) | 3 (75,0) | |
| Титр РФ, МО/мл | 438,8±240,7 | 432±241,6 | 448±293,3 | |
| ШОЕ, мм/год | 30,4±18,7 | 25,4±15,2 | 39,2±23,2 | |
| СРБ, мг/л | 157,1±133,8 | 150,8±130,5 | 168,0±159,2 | |
За демографічними та клініко-анамнестичними показниками підгрупи хворих, яким було призначено ІФНП-α або РТ, були зіставними. Серед пацієнтів, які отримували ІФНП-α, дещо більша кількість мали ІІІ ступінь активності захворювання, ІІ рентгенологічну стадію і отримували небіологічні БП і НПЗП порівняно з тими, у кого застосовували РТ.
Оцінку ефективності та переносимості лікування проводили на запланованих візитах кожні 3 міс лікування. На час проведення аналізу 9 хворих на РА спостерігалися не менше 9 міс (від 9 міс до 3,1 року), 3 хворих — протягом 6 міс (2 хворих, які отримували АДА, та 1 хвора cialis maximum dose — ІНФ).
Статистичну обробку отриманих результатів здійснювали з використанням непараметричних методів. Для оцінки вірогідності змін показників між окремими візитами застосовували метод Вілкоксона, при оцінці різниці динаміки показників у підгрупах хворих залежно від призначеного препарату — тест Колмогорова — Смирнова. Відмінності вважали вірогідними при p<0,05.
РЕЗУЛЬТАТИ ТА ЇХ ОБГОВОРЕННЯ
За час спостереження 3 хворих припинили лікування у зв’язку з неефективністю чи побічними ефектами ІБТ (по 1 хворому — неефективність ІНФ та АДА протягом перших 3 міс лікування, у 1 хворої — непереносимість ІНФ). Отримані в загальній когорті хворих на РА результати свідчать про значне вірогідне покращання переважної більшості клініко-лабораторних показників через 3 міс лікування (табл. 2), що підтверджує високу ефективність ІБТ вже на ранніх етапах її застосування. Так, тривалість ранкової скутості скоротилася майже у 5 разів, величина інтегрального індексу активності хвороби DAS28 зменшилася на 27,9%, функціональна здатність хворих згідно з опитувальником HAQ покращилася на 40,7%, ШОЕ знизилася на ⅓, а рівень СРБ — на 58% порівняно з вихідними значеннями. Значні вірогідні зміни тривалості ранкової скутості, індексу DAS28 та величини HAQ зберігалися протягом усіх 9 міс спостереження. Середні значення ШОЕ та рівня СРБ почали дещо підвищуватися з 6-го місяця спостереження (з 3-го по 9-й місяць — на 21,1 та 34,1% відповідно), внаслідок чого їх зміни порівняно з початковими величинами стали статистично незначущими. Рівень РФ мав стійку і виражену тенденцію до зниження (протягом 9 міс — у 2,3 раза; р>0,05).
| DAS28 | Тривалість ранкової скутості, хв | HAQ | Титр РФ, МО/мл | ШОЕ, мм/год | СРБ, мг/л | ||
|---|---|---|---|---|---|---|---|
| Загалом
(n=11) |
До лікування | 5,70±1,26 | 227,3±262,3 | 1,67±0,69 | 438,8±240,7 | 30,4±18,7 | 157,1±133,8 |
| 3 міс | 4,11±1,47** | 47,7±56,1** | 0,99±0,76** | 317,1±334,0 | 20,4±15,5* | 66,0±81,9** | |
| 6 міс | 4,31±1,57* | 64,1±65,9* | 1,00±0,75** | 226,3±275,3 | 21,0±15,5 | 77,4±77,5 | |
| 9 міс | 4,52±1,03* | 58,1±48,4* | 0,97±0,57* | 193,7±262,9 | 24,7±13,2 | 88,5±123,9 | |
| ІФНП-α
(n=7) |
До лікування | 5,69±1,19 | 222,8±246,3 | 1,67±0,82 | 432,0±241,6 | 25,4±23,2 | 150,8±130,5 |
| 3 міс | 4,33±1,55 | 53,6±59,3* | 1,07±0,89* | 339,0±323,8 | 21,0±18,0 | 68,6±85,6* | |
| 6 міс | 4,7±1,58 | 83,6±73,6 | 1,11±0,85* | 336,0±327,9 | 22,7±18,0 | 108,0±82,8 | |
| 9 міс | 5,02±0,67 | 78,7±48,0 | 1,15±0,60 | 276,0±262,9 | 26,5±15,6 | 150,0±159,6 | |
| РТ
(n=4) |
До лікування | 5,71±1,56 | 235,0±328,5 | 1,67±0,86 | 448,0±293,3 | 39,2±23,2 | 168,0±159,2 |
| 3 міс | 3,72±1,45 | 37,5±56,8 | 0,85±0,56 | 288,0±418,4 | 19,5±12,5 | 61,5±87,4 | |
| 6 міс | 3,63±1,51 | 30,0±34,6 | 0,80±0,58 | 80,0±99,9 | 18,0±11,7 | 24,0±17,0 | |
| 9 міс | 4,01±1,15 | 37,5±45,0 | 0,80±0,58 | 84,0±95,2 | 23,0±12,5 | 27,0±15,1 | |
*р<0,05, **р<0,01 порівняно з вихідними значеннями; р<0,05 порівняно з групою ІФНП-α.
Серед інших показників ефективності лікування слід звернути увагу на те, що протягом 3 міс НПЗП було відмінено у 5 (71,4%) хворих, які отримували їх до початку ІБТ. У 1 хворої на 9-му місяці спостереження прийом НПЗП було відновлено. Серед 5 хворих, які планово отримували ГК, припинити їх прийом вдалося 1 хворій (на 3-му місяці ІБТ), у решти хворих дозу преднізолону було знижено в середньому у 2 рази — до 5–10 мг/добу. Пацієнти, які отримували небіологічні БП, продовжували їх прийом протягом всього періоду спостереження, за винятком 1 хворої, у якої на фоні лікування РТ було ступінчато знижено дозу і через 3 міс повністю відмінено СС.
При аналізі ефективності ІБТ у групах хворих, які приймали ІФНП-α або РТ, виявлено тенденцію до більш вираженого покращання всіх клініко-лабораторних показників при лікуванні РТ. Так, індекс DAS28 і оцінка за HAQ у цих хворих через 9 міс знизились відповідно на 29,8 і 52,2% порівняно з 11,8 і 31,2% у групі хворих, які отримували ІФНП-α (p>0,05). Динаміка лабораторних показників також була кращою у хворих, які отримували РТ. Зокрема, через 9 міс лікування рівень СРБ у цій групі знизився на 84,0% порівняно з 0,6% у хворих, які отримували ІФНП-α (р<0,05). На фоні лікування РТ зниження ШОЕ було стійким протягом усього періоду спостереження, найбільшим — через 6 міс (на 54,1%), тоді як у групі ІФНП-α максимальне зниження показника (лише на 17,4%) спостерігалося через 3 міс, а на 9-му місяці лікування середні величини ШОЕ були навіть дещо вищими за вихідний рівень. Досить показовим був вплив РТ (препарату, що забезпечує елімінацію зрілих В-клітин — продуцентів аутоантитіл) на рівень РФ: за 9 міс лікування він знизився у 5,3 раза порівняно зі зниженням у 1,6 раза у хворих, які отримували ІФНП-α.
Однак зазначені відмінності між групами пацієнтів не дають достатніх підстав для висновків про порівняльну ефективність РТ та ІФНП-α через малу кількість спостережень.
Переносимість лікування була доброю у 6 (54,5%) хворих, задовільною — у 4 (36,4%) та незадовільною — у 1 (9,1%) хворої. Одна хвора припинила терапію після 7-ї інфузії ІНФ у зв’язку з повторним інфузійними реакціями зі зниженням артеріального тиску. Серед несприятливих явищ, які не потребували відміни препарату, спостерігались інфузійні реакції (по 1 епізоду) у 3 хворих, що проявлялись у 2 випадках кропив’янкою, у 1 — зниженням артеріального тиску. Ці реакції не повторювались і дозволяли продовжити лікування. Крім інфузійних реакцій, зафіксовано один випадок Herpes Zoster, який не рецидивував після відповідного лікування і також не потребував відміни препарату. Переносимість ІБТ із використанням РТ та ІФНП-α суттєво не відрізнялася.
Наведемо приклад застосування ІБТ, в ході проведення якої зареєстровано факт загоєння кісткових ерозій.
Пацієнтка Д., 67 років, хворіє на серопозитивний РА з 1999 р. За час хвороби застосовували хлорохін, МТ, ЛФ, які було відмінено у зв’язку з відсутністю ефекту (хлорохін) або з наявністю побічні дії (МТ, ЛФ). З квітня 2007 р. приймала СС у дозі 2 г/добу. На фоні лікування СС персистували синовіт дрібних та великих суглобів, зберігавася підвищений рівень ШОЕ (24–39 мм/год) та СРБ (48–192 мг/л). Спостерігалися побічні ефекти СС у вигляді множинних вогнищ гіперкератозу шкіри зі свербежем. У зв’язку з низьким ефектом БТ з червня 2007 р. постійно приймала 8 мг/добу метилпреднізолону. Серед системних проявів у 2007 р. діагностовано синдром Шегрена та пневмопатію. На той же час рентгенологічний рахунок звуження суглобових щілин за шкалою Шарпа-ван дер Хейде становив 80 балів, рахунок ерозій — 12 балів. Враховуючи незадовільну відповідь і побічні ефекти БТ, збереження неприйнятної активності хвороби (DAS28 >3,2), постійну потребу в прийомі ГК, було прийнято рішення про доцільність застосування ІБТ.
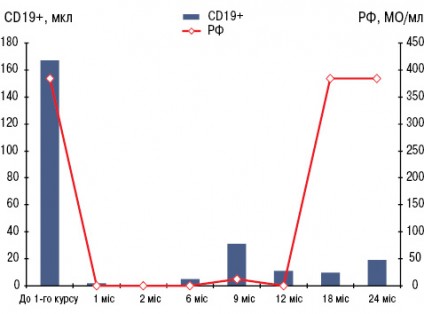
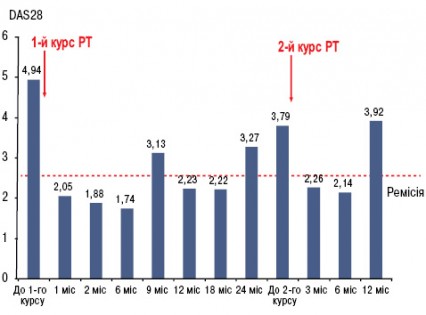
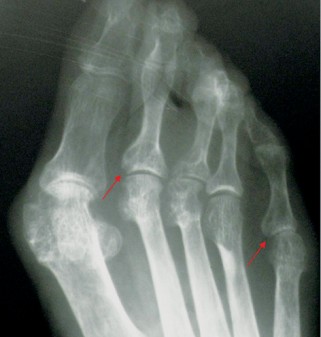
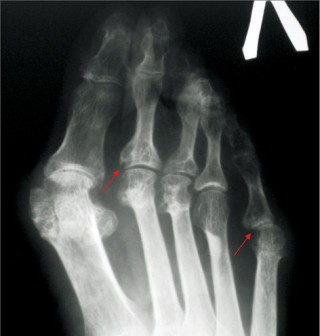
У грудні 2007 р. проведено стандартний курс лікування РТ — 2 інфузії препарату по 500 мг з інтервалом у 2 тиж. Вже через 1 міс і протягом наступних 22 міс у хворої не було ранкової скутості, запалених і болючих суглобів (за винятком одного короткочасного епізоду помірного запалення променезап’ясткового суглоба після перевантаження), значно знизилися ШОЕ та СРБ. Кількість В-клітин (CD19+) зменшилася зі 167 мкл до поодиноких, протягом майже 1,5 року не визначався РФ (рис. 1). Рівень імуноглобуліну А, М, G за весь період спостереження практично не змінювався. Починаючи з 1-го місяця після початку ІБТ і протягом 22 міс, судячи з величин DAS28, стан хворої відповідав критеріям ремісії — DAS28 ≤2,6 (рис. 2). Відзначено також виражений регрес проявів синдрому Шегрена — ксеростомії та ксерофтальмії. Через 3 міс від початку ІБТ було відмінено СС, добова доза метилпреднізолону була знижена і коливалася від 0 до 4 мг. Потреба у проведенні повторного курсу РТ виникла лише через 2 роки, коли підвищилися до початкових величин ШОЕ, СРБ, з’явилися 2 болючих і 1 набряклий суглоб. Після проведення другого курсу лікування РТ (2 інфузії по 500 мг) в лютому 2010 р. знову спостерігалася значна позитивна динаміка всіх клінічних і лабораторних показників, за величинами DAS28 — ремісія (див. рис. 2), що зберігалося протягом 1 року. Побічних явищ, за винятком помірного зниження артеріального тиску під час першої інфузії РТ, протягом 3,5 року спостереження не зареєстровано. При рентгенологічному контролі у січні 2011 р. в суглобах кистей і стоп не виявлено ознак прогресування структурних змін, більше того — зафіксовано факт загоєння 3 кісткових ерозій у плеснефалангових суглобах (2 із них проілюстровано на рис. 3). Крім репарації кісткової тканини, цей випадок цікавий ще й тим, що клініко-лабораторно-рентгенологічна ремісія зберігалась у хворої протягом 2 років після першого і протягом 1 року — після другого курсу лікування РТ (рекомендована частота проведення курсів РТ — кожні 6 міс).
Отже, отримані нами результати свідчать про високу ефективність і прийнятну переносимість ІФНП-α та РТ у лікуванні хворих на РА, у тому числі при переході з одного імунобіологічного засобу на інший. Вірогідні позитивні зміни основних показників клініко-лабораторної активності спостерігалися вже через 3 міс лікування як у разі призначення ІФНП-α, так і РТ, та були достатньо стійкими, особливо при застосуванні РТ.
ЛІТЕРАТУРА
1. Коваленко В.М., Шуба Н.М., Борткевич О.П., Яременко О.Б. та ін. (2008) Застосування антагоністів фактора некрозу пухлин в лікуванні хворих на ревматичні захворювання суглобів (ревматоїдний артрит, анкілозивний спондилоартрит, псоріатична артропатія): Метод. рекомендації. Київ, 40 с.
2. Лапин С.В., Тотолян А.А. (2006) Иммунологическая лабораторная диагностика ревматических заболеваний: пособие для врачей. Человек, Санкт-Петербург, 128 с.
3. Насонов Е.Л. (2001) Нестероидные противовоспалительные препараты при ревматических заболеваниях: стандарты лечения. РМЖ, 9: 265–270.
4. Aho K., Heliövaara M., Maatela J. et al. (1991) Rheumatoid factors antedating clinical rheumatoid arthritis. J. Rheumatol., 18: 1282–1284.
5. American College of Rheumatology Subcommitee on Rheumatoid arthritis Guidelines. Guidelines for the Management of Rheumatoid arthritis (2002) Arthritis Rheum., 46: 328–346.
6. Banal F., Dougados M., Combescure C. (2009) Sensitivity and specificity of the American College of Rheumatology 1987 criteria for the diagnosis of rheumatoid arthritis according to disease duration: a systematic literature review and meta-analysis. Ann. Rheum. Dis., 68: 1184–1191.
7. Breedveld F.C., Weisman M.H., Kavanaugh A.F. et al. (2006) The PREMIER study: a multicenter, randomized, double-blind clinical trial of combination therapy with adalimumab plus methotrexate versus methotrexate alone or adalimumab alone in patients with early, aggressive rheumatoid arthritis who had not had previous methotrexate treatment. Arthritis Rheum., 54: 26–37.
8. Britsemmer K., Ursum J., Gerritsen M. et al. (2011) Validation of the 2010 ACR/EULAR classification criteria for rheumatoid arthritis: slight improvement over the 1987 ACR criteria Ann. Rheum. Dis., 70: 1468–1470.
9. Buch M.H., Smolen J.S., Betteridge N. et al. (2011) Updated consensus statement on the use of rituximab in patients with rheumatoid arthritis Ann. Rheum. Dis., 70: 909–920.
10. Buckwalter J.A., Lappin D.R. (2000) The disproportionate impact of chronic arthralgia and arthritis among women. Clin. Orthop. Relat. Res., 372: 159–168.
11. Edwards J.C., Szczepanski L., Szechinski J. et al. (2004) Efficacy of B-cell-targeted therapy with rituximab in patients with rheumatoid arthritis. N. Engl. J. Med., 350: 2572–2581.
12. Fries J.F., Spitz P.W., Young D.Y. (1982) The dimensions of health outcomes: the health assessment questionnaire, disability and pain scales. J. Rheumatol. 9: 789–793.
13. Furst D.E., Keystone E.C., Braun J. et al. (2010) Updated consensus statement on biological agents for the treatment of rheumatic diseases, 2010. Ann. Rheum. Dis., 70: 2–36.
14. Iain B. McInnes, James R. O’Dell (2010) State-of-the-art: rheumatoid arthritis, Ann. Rheum. Dis., 69: 1898–1906.
15. Іn Ho L., Chiu Mok C., Hung To C. et al. (2007) Rituximab for refractory rheumatoid arthritis: a 24-week open-label prospective study. Open. Rheumatol., 1: 1–4.
16. Kay J., Matteson E.L., Dasgupta B. et al. (2008) Golimumab in patients with active rheumatoid arthritis despite treatment with methotrexate: a randomized, double-blind, placebo-controlled, dose-ranging study. Arthritis Rheum., 58: 964–975.
17. Keystone E., Weinblatt M., Furst D. et al. (2001) The ARMADA trial: a double-blind placebo controlled trial of the fully human anti-TNF monoclonal antibody, adalimumab (D2E7) in patients with active RA on methotrexate (MTX). Arthritis Rheum., 44: 213.
18. Klareskog L., van der Heijde D., de Jager J.P. et al. (2004) TEMPO (Trial of Etanercept and Methotrexate with Radiographic Patient Outcomes) study investigators. Therapeutic effect of the combination of etanercept and methotrexate compared with each treatment alone in patients with rheumatoid arthritis: double-blind randomised controlled trial. Lancet, 363: 675–681.
19. Maini R.N., Breedveld F.C., Kalden J.R. et al. (1998) Therapeutic efficacy of multiple intravenous infusions of anti-tumor necrosis factor alpha monoclonal antibody combined with low-dose weekly methotrexate in rheumatoid arthritis. Arthritis Rheum., 41:1552–1563.
20. Majka D.S., Deane K.D., Parrish L.A. et al. (2008) Duration of preclinical rheumatoid arthritis-related autoantibody positivity increases in subjects with older age at time of disease diagnosis. Ann. Rheum. Dis. 67; 801–807.
21. Mease P.J., Revicki D.A., Szechinski J. et al. (2008) Improved health-related quality of life for patients with active rheumatoid arthritis receiving rituximab: Results of the Dose-Ranging Assessment: International Clinical Evaluation of Rituximab in Rheumatoid Arthritis (DANCER) Trial. J. Rheumatol., 35: 20–30.
22. Mitchell D.M., Spitz P.W., Young D.Y. et al. (1986) Survival, prognosis, and causes of death in rheumatoid arthritis. Arthritis Rheum., 29: 706–714.
23. Nielen M.M., van Schaardenburg D., Reesink H.W. et al. (2004) Specific autoantibodies precede the symptoms of rheumatoid arthritis: a study of serial measurements in blood donors. Arthritis Rheum., 50: 380–386.
24. Pincus T., Callahan L.F., Sale W.G. et al. (1992) Severe functional declines, work disability, and increased mortality in seventy-five rheumatoid arthritis patients studied over nine years; somäki H. Long-term outcome of rheumatoid arthritis. Scand. J. Rheumatol. , 95: 3–8.
25. Rantapää-Dahlqvist S., de Jong B.A., Berglin E. et al. (2003) Antibodies against cyclic citrullinated peptide and IgA rheumatoid factor predict the development of rheumatoid arthritis. Arthritis Rheum., 48: 2741–2749.
26. Sangha O. (2000) Epidemiology of rheumatic diseases. Rheumatology (Oxford), 39 (2): 3–12.
27. Scott D.L., Symmons D.P., Coulton B.L. et al. (1987) Long-term outcome of treating rheumatoid arthritis: results after 20 years. Lancet, 1: 1108–1111.
28. Smolen J.S., Kay J., Doyle M.K. et al. (2009) GO-AFTER study investigators. Golimumab in patients with active rheumatoid arthritis after treatment with tumour necrosis factor alpha inhibitors (GO-AFTER study): a multicentre, randomised, double-blind, placebo-controlled, phase III trial. Lancet, 374: 210–221.
29. Smolen J.S., Landewé R., Breedveld F.C. et al. (2010) EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs. Ann. Rheum. Dis., rezeptfrei viagra 69: 964–975.
30. Tak P.P., Rigby W.F., Rubbert-Roth A. et al. (2011) Inhibition of joint damage and improved clinical outcomes with rituximab plus methotrexate in early active rheumatoid arthritis: the IMAGE trial. Ann Rheum Dis., 70: 39–46.
31. van der Goes M.C., Jacobs J.W., Boers M. et al. (2010) Monitoring adverse events of low-dose glucocorticoid therapy: EULAR recommendations for clinical trials and daily practice. Ann. Rheum. Dis., 69: 1913–1919.
32. Wolfe F. (1996) The natural history of rheumatoid arthritis. J. Rheumatol., 44 (1): 13–22.
Адреса для листування:
Яременко Олег Борисович
01601, Київ, бульв. Тараса Шевченка, 13
Національний медичний університет ім. О.О. Богомольця, кафедра внутрішніх хвороб стоматологічного факультету

Leave a comment