Потенційні можливості клінічної оцінки пацієнта з ANCA-асоційованим системним васкулітом
Резюме. Відсутність біомаркера для виявлення рецидивуючого або стійкого захворювання викликає ризик зростання захворюваності, рецидивів і смертності у зв’язку з обмеженням контролю хвороби або негативного впливу на пацієнта потенційно небезпечної терапії. Мета дослідження: вивчити дані з ідентифікації нових маркерів — кандидатів на основі аналізу інноваційних аналітичних інструментів, покращення розуміння імунопатогенезу і кінцевої мети лікування АNCA (антинейтрофільні цитоплазматичні антитіла)-асоційованих васкулітів. Матеріали і методи дослідження. У роботі представлені проблемні питання, присвячені ролі АNCA при АNCA-асоційованних васкулітах з акцентом на особливостях клінічних фенотипів носіїв PR3- і MPO-ANCA, рецидивів на основі проведеного інформаційного пошуку в Medline та PubMed даних, опублікованих в останні 3 десятиріччя. Результати і обговорення. За останні 25 років досягнуто значного прогресу в розробці методики виявлення ANCA. Це стосується досягнень у характеристиці антигена, стандартизації аналізів ANCA, включенні ANCA в номенклатуру і класифікаційні пропозиції і в технології. Консенсусні заяви щодо тестування ANCA мали обґрунтування з урахуванням різних варіацій стосовно їх оцінки. Відкриття ANCA було важливим етапом у діагностиці і лікуванні для пацієнтів з клінічними синдромами гранулематозного поліангіїту (ГПА) або мікроскопічного поліангіїту (МПА). Відповідно до міжнародних документів з визначення й оцінки результатів тестування ANCA, при визначенні даних аутоантитіл в усіх пацієнтів застосовується метод реакції імунної флуоресценції (РНІФ). Потім з метою класифікації захворювань була рекомендована специфічність ANCA до PR3 або MPO. Це зумовлено тим, що різниця в генетиці, патогенезі, факторах ризику, відповіді на лікування і результатах більше відповідає типу PR3 або MPO-ANCA, а не клінічному діагнозу. Ризик рецидиву тісно пов’язаний з типом захворювання, а не з типом ANCA. У МРО-ANCA+ пацієнтів з ГПА частота рецидивів така ж, як у PR3-ANCA+ у пацієнтів. При зміні стратегії лікування слід спиратися на комплексне клінічне обстеження, а не на результати ANCA. Значення ANCA як предиктора рецидиву не визначено та не доведено, негативні результати тестів на ANCA не виключають активної фази захворювання. Рекомендована регулярна комплексна клінічна оцінка стану пацієнта, для якої слід застосовувати високоінформативні клінічні індекси — BVAS, індекс пошкодження (Vasculitis Damage Index — VDI), ступеня захворювання (Disease Extent Index) та 5-факторну шкалу (Five Factor Score). Висновки. Відсутність біомаркера для виявлення рецидивуючого або стійкого захворювання викликає ризик зростання захворюваності, рецидивів і смертності у зв’язку з обмеженням контролю хвороби або негативного впливу на пацієнта потенційно небезпечної терапії. Отже, існує необхідність у розробці функціонального біомаркера, який відповідатиме можливостям стратифікації ризику і персоніфікації лікування. Активація альтернативного шляху комплемента має фундаментальне значення для розвитку захворювання, а продукти розпаду в сечі є потенційним біомаркером васкуліту нирок.
DOI: 10.32471/rheumatology.2707-6970.85.16450
УДК 616.13/.16–002–031б81–036–07–08.
ANCA (антинейтрофільні цитоплазматичні антитіла)-асоційований системний васкуліт — захворювання, яке характеризується поліорганними ураженнями, гетерогенністю клініко-імунологічних форм і різноманіттям клінічних проявів. Первинні системні васкуліти являють собою групу захворювань, яким притаманні рецидиви і ремісії імуноопосередкованого запалення кровоносних судин. Унікальні діагностичні та терапевтичні проблеми найчастіше виникають саме у цієї категорії пацієнтів. Системний васкуліт (СВ) може часто визначатися за розміром уражених судин. Так, при СВ дрібних судин, на відміну від великих‚ запалення починається з ендотеліального пошкодження і запалення інтими, поширюючись зовнішньо (адвентицій). Раннє запальне пошкодження інтими з подальшою активацією каскаду коагуляції в судинах малого калібра є підґрунтям до розуміння тромботичної і некротичної патології, яка притаманна саме такому варіанту СВ [5, 6]. Гранулематозний поліангіїт (ГПА), мікроскопічний поліангіїт (МПА) та еозинофільний гранулематоз з поліангіїтом (EГПA) мають відповідні щорічні показники захворюваності 2,1–14,4; 2,4–10,1 і 0,5–3,7 на 1 млн населення в Європі, а поширеність ANCA-асоційованого системного васкуліту оцінюється в 46–184 на 1 млн. 5-річна виживаність для ГПА, МПА і EГПA оцінюється в 74–91, 45–76 і 60–97% відповідно [2, 9‚ 19]. Широкомасштабні випробування генома продемонстрували виражену генетичну асоціацію з аутоантитілами: мієлопероксидаза — ANCA (MPO) асоціюється з HLA-DQ, HLA-DP, протеїназою-3-ANCA (PR3) та її антипротеїназою (α1-антитрипсин). Останнє підтверджує ключову роль аутоантитіл у розвитку ANCA-асоційованого васкуліту [2‚ 3‚ 7].
За останні 25 років досягнутий значний прогрес у розробці методики для виявлення ANCA. Він стосується досягнень у характеристиці антигену, стандартизації аналізів ANCA, включенні ANCA в номенклатуру та класифікаційні пропозиції та у технології ANCA. Консенсусні заяви щодо тестування на ANCA мали певне підґрунтя з огляду на різні варіації щодо їх оцінки. Відкриття ANCA у пацієнтів з клінічними синдромами ГПА або МПА було важливим етапом у діагностиці і лікуванні цих станів. Після відкриття ANCA і підвищення доступності тестування діагноз ГПА або MПA все частіше встановлювали впевнено в належних клінічних умовах, у тому числі без біопсії.
У 2016 р. міжнародною групою експертів, членів Європейського альянсу асоціацій ревматологів (European Alliance of Associations for Rheumatology — EULAR), Європейської асоціації нирок — Європейської асоціації діалізу та трансплантації (European Renal Association-European Dialysis and Transplant Association — ERA–EDTA) і Європейського товариства васкулітів (European Vasculitis Society — EUVAS), опубліковані рекомендації з діагностики і лікування ANCA-асоційованих СВ, які узагальнили сучасні наукові досягнення, міжнародний клінічний досвід та висвітлили широке коло проблем ANCA-асоційованих СВ. Відповідно до міжнародних погоджувальних документів із визначення та оцінки результатів тестування на ANCA, при визначенні даної групи аутоантитіл у всіх пацієнтів використовується метод реакції імунної флуоресценції (РНІФ). Після отримання позитивного результату РНІФ ANCA-позитивної сироватки проводиться повторне тестування за допомогою імуноферментного аналізу (ІФА) для визначення типоспецифічних ANCA, оскільки РНІФ — це лише скринінговий тест для виявлення ANCA усіх типів. З метою визначення останніх за типом використовується ІФА «ELISA». Специфічними антитілами для ГПА є cANCA (цитоплазматичний тип світіння) й антитіла до PR3 [2, 16, 19].
Останнім часом з метою класифікації захворювань рекомендована специфічність ANCA до PR3 або MPO. Це пов’язано з тим, що різниця в генетиці, патогенезі, факторах ризику, відповіді на лікування і результатах більше відповідає типу PR3 або MPO-ANCA, ніж клінічному діагнозу. Велика увага приділялася специфічності ANCA‚ навіть вважали її головною.
Негативний ANCA не виключає ANCA-асоційованого васкуліту у відповідному клінічному контексті активного захворювання. Деякі дослідження показали, що пацієнти, у яких титри ANCA або зберігаються, або зростають у 4 рази, або стають позитивними, мають більшу частоту рецидивів, тоді як інші дослідження не підтвердили таку асоціацію. Ризик рецидиву більш тісно пов’язаний з типом захворювання, ніж із типом ANCA. У МРО-ANCA+ пацієнтів з ГПА частота рецидивів така сама, як у PR3-ANCA+ у пацієнтів з ГПА [14].
Стандартом діагностики ANCA-асоційованого васкуліту є біопсія тканини (шкіра, м’язи і т.п.). На основі типової гістопатологічної картини (біопсія ураженого органа, найкраще верхніх дихальних шляхів або нирки) в особи з характерними змінами в легенях та/або в осаді сечі та наявністю ANCA (переважно PR3-ANCA) [3]. Чутливість трансбронхіальної біопсії легень нерівноцінна при різних нозологічних формах ANCA-асоційованих васкулітів: при ГПА вона становить лише 12%, а при ЕГПА — 66,7%. Суттєво вища діагностична цінність відкритої біопсії легень, складного інвазивного втручання. Черезшкірна біопсія нирки для зниження ризику виконується під контролем УЗД. Ризик кровотеч після біопсії нирки вищий у пацієнтів, яким проводиться плазмаферез, осіб похилого віку, за наявності артеріальної гіпертензії і тяжкої ниркової недостатності.
Європейське молекулярно-генетичне випробування щодо ANCA-асоційованих васкулітів встановило, що захворювання, асоційовані з PR3-ANCA, пов’язані з генами HLA-DP, SERPINA1 і PRTN3, в той час як васкуліт, асоційований з ANCA до МPО нейтрофілів, пов’язаний з HLA-DQ-фенотипом. Ген SERPINA1 кодує α1-антитрипсин-серинову протеазу, яка має PR3 в якості однієї з мішеней. Ген PRTN3 кодує PR3. Імунна відповідь проти аутоантигена PR3 є головною етіологічною особливістю PR3-ANCA-асоційованого васкуліту [13, 19]. Нещодавнє випробування підтвердило попереднє повідомлення про те, що саме хвороба PR3-ANCA+, але не MPO-ANCA+, пов’язана с варіантами генів HLA-DPA1 і DPB1. HLA-DPB1 гаплотип пояснює велику частку генетичного ризику у пацієнтів з ANCA-асоційованим васкулітом. Навпаки, у носіїв MPO-ANCA пов’язане з варіантами HLA-DQA2 і DQB1. Тому генетичне тестування набуває актуальності щодо визначення ризику розвитку ANCA-асоційованого васкуліту.
Нез’ясованим дотепер залишається патогенез ANCA-асоційованого васкуліту. Хоча вважається‚ що MPO- і PR3-ANCA відіграють суттєву роль в патофізіології хвороби більшості пацієнтів‚ однак прямих доказів зв’язку між наявністю цих антитіл і виникненням захворювання до цих пір не визначено. MPO і PR3 виявляють у гранулах нейтрофілів і лізосомах моноцитів, вони є мішенями для МРО-ANCA-позитивних ANCA-асоційованих васкулітів. PR3 експресується майже завжди на поверхні нейтрофільних клітин, тоді як MPO, навпаки, не експресується спонтанно на поверхні нейтрофільних клітин, однак поверхнева експресія MPO визначається після активації нейтрофілів. При ANCA-асоційованих васкулітах зв’язування MPO- або PR3-ANCA з нейтрофілами викликає активацію і дегрануляцію, а також адгезію і трансміграцію нейтрофілів через ендотелій судин, що призводить до пошкодження ендотеліальних клітин. Патогенетичне значення MPO-ANCA підтверджується здатністю цих антитіл викликати синдром васкуліту, який нагадує експериментально набутий некротизуючий васкуліт. Важливість PR3- та МРО-ANCA безумовна як для розуміння патогенезу, так і клінічних характеристик СВ. Відомо, що PR3-ANCA+ антитіла з’являються в крові пацієнтів за роки до клінічних проявів. Однак наявність MPO- або PR3-ANCA+ не завжди корелює з активністю хвороби, що дозволяє припустити необхідність у сукупності множинних факторів, що сприяють утворенню васкулітних і гранулематозних утворень [6]. До таких належать інфекції (стафілокок), ліки, фактори зовнішнього середовища, специфічність ANCA. Позаклітинні пастки нейтрофілів (NET) все частіше визнаються важливими для патогенезу аутоімунних станів, включаючи MPO- і PR3-ANCА+ СВ. В умовах запального процесу NET можуть активувати імунні клітини, які визначаються, включаючи аутореактивні B-клітини, та викликаючи пошкодження органів-мішеней. Спонтанне утворення NET частіше відмічається у пацієнтів з СВ та корелює з активністю захворювання. При стимуляції мережі, яка містить PR3 і MPO, вони виділяються як у кровотік, так і в пошкоджені тканини [4].
Останнім часом стало відомо про активацію альтернативного шляху, важливого для патогенезу MPO-ANCA+ та PR3-ANCA+, ANCA-асоційованого васкуліту. Wu та співавтори навіть запропонували вважати, що класичний або лектиновий шлях комплемента активується в PR3-ANCA+, але не в MPO-ANCA+. До речі, саме це стало початком для застосування такого лікарського засобу, як інгібітор рецептора C5a — авакопан, який є ефективним при заміні високих доз глюкокортикоїдів (ГК) [1‚ 8‚ 14].
На сьогодні вже відома й окреслена потенційна різниця між носіями MPO- і PR3-ANCA+. Нещодавно порівнювалася різниця в профілях цитокінів у сироватці крові, пов’язаних із запаленням, проліферацією, пошкодженням судин, репарацією тканин у пацієнтів з ANCA-асоційованим васкулітом. Різниця за фенотипом (PR3- на відміну від MPO-ANCA+) при ГПА на відміну від MПA виявлена незалежно від того, застосовувався тип ANCA чи клініко-патологічний стан для групування пацієнтів, однак різниця була більш вираженою, коли пацієнти з PR3- і MPO-ANCA порівнювалися один з одним. Серед біомаркерів у носіїв PR3-ANCA+ визначено: інтерлейкін (ІL)-6, ІL-2, ІL-15, ІL-8, ІL-18 і гранулоцитарно-макрофагальний колонієстимулюючий фактор. Тоді як у носіїв MPO-ANCA+ виділено розчинний рецептор IL-6, розчинний рецептор фактора некрозу пухлини (TNF) типу II, ліпокалін, зв’язаний з желатиназою нейтрофілів, і розчинну молекулу міжклітинної адгезії. У багатофакторних аналізах рівні цитокинів не залишалися вірогідно зв’язаними ні з ГПА, ні з MПA, але зберігалися деякі асоціації між цитокінами і ANCA-типом [16].
Модель патогенезу васкуліту передбачає, що MPO- і PR3-ANCA+ мають багато схожих патогенетичних властивостей. Однак випробуваннями останніх років доведено, що також можлива різниця в профілях активації комплемента і цитокінів залежно від типу ANCA. Не виключено, що різниця в патогенезі між пацієнтами з PR3- і MPO-ANCA+ може впливати на вибір терапевтичного засобу лікування з огляду на специфічність ANCA.
Безумовно, не в усіх пацієнтів з підвищеним титром ANCA очікується загострення хвороби. При цьому розвиток загострення може тривати від місяців до понад року від моменту підвищення рівня ANCA. Оцінювання ризиків, переваг у виборі лікування з огляду на специфічність і титри ANCA є складовою персоніфікованої компоненти у веденні пацієнта. Тип ANCA та його варіації можуть впливати на здатність прогнозування в змінах титрів, тому користь серійності вимірювань ANCA не викликає сумнівів. Більшість випробувань, в яких оцінювали прогностичну компоненту в змінах титру ANCA, були обмежені частотою вимірювань титру, варіацій у визначенні результатів. Користь повторного тестування передбачається за умови застосування сучасних стратегій лікування. Наприклад, у випробуванні RAVE (застосування ритуксимабу (RTX)) при ANCA-асоційованому васкуліті подана додаткова інформація про потенційну цінність серійного тестування ANCA, хоча роль такого тестування у веденні пацієнтів з ANCA-асоційованим васкулітом, а не в діагностиці, залишається суперечливою. Титри PR3- і MPO-ANCA знижуються під час індукції ремісії (trials-WGET). Негативний ANCA та навіть залишений негативним під час наступного спостереження не є надійним індикатором того, що пацієнт досягнув або збереже ремісію. Серед пацієнтів з PR3-ANCA+, які отримували RTX в RAVE, виявлене підвищення (подвійне) титру PR3-ANCA було пов’язане з більш високим ризиком тяжкого загострення протягом одного року, особливо з історією ураження нирок або альвеолярної кровотечі. Тому користь серійного тестування PR3-ANCA може бути специфічною для пацієнтів, що отримували RTX, на відміну від інших засобів лікування.
Проблемним серед ANCA-асоційованих васкулітів є раннє виявлення рецидивів задля запобігання пошкодженню органів та збільшення терміну виживання. На сьогодні не визначена прогнозована цінність потенційних біомаркерів ANCA-асоційованих СВ та В-клітин. При аналізі результатів одноцентрового випробування (період спостереження 2006–2018 рр.) доведено‚ що ANCA та статус В-клітин пов’язаний з рецидивами СВ у пацієнтів, які отримували RTX на етапі індукції ремісії (RI). У частини пацієнтів (31) рецидив стався протягом 2 років після лікування RTX RI. У пацієнтів, які досягли та залишалися негативними за PR3-ANCA (n=29), рецидиви відмічено лише в 3% випадків. Частота рецидивів зростала до 37% випадків при стійкому рівні PR3-ANCA (n=49) та повторній їх появі. Тому слід зауважити‚ що стійкий зростаючий рівень‚ особливо повторний PR3-ANCA, суттєво асоціюється з більшою кількістю рецидивів (37%, p=0,002 та 50%, p=0,002). Серед досліджуваних пацієнтів з неповним виснаженням В-клітин відмічено значно більше рецидивів (54%) порівняно з пацієнтами з виснаженням В-клітин (26%, p=0,02). У пацієнтів з репопуляцією В-клітин виявлено значно більше рецидивів (41%) порівняно з пацієнтами без В-клітин (15%, p=0,03). Загалом відсутність позитивності до PR3- або MPO-ANCA була дуже передбачуваною щодо збереження рецидивів. У PR3-ANCA-позитивних пацієнтів 96% рецидивів виникло при стійкій або повторній появі PR3-ANCA та 81% при повторному заселенні В-клітин [20].
Чому хвороби нирок мають більш тяжкий перебіг у носіїв MPO-ANCA+ з СВ? Останнім часом виживаність пацієнтів з ураженням нирок при ANCA-асоційованих васкулітах покращилася. У пацієнтів з МРО-ANCA+ з підтвердженим ураженням (біопсія), як правило, відмічають більш хронічний характер, що відрізняється від активних пошкоджень на момент встановлення діагнозу. Небезпечне для життя пацієнта ураження нирок при ANCA-асоційованих СВ може варіювати від першого прояву гострого пошкодження нирок до повільного прогресування та термінальної втрати функції нирок. Біопсія нирок може показати значну частку глобально склеротичних клубочків або клітинних півмісяців, або в основному нормальних клубочків. Низька розрахункова швидкість клубочкової фільтрації (рШКФ) при надходженні, MPO-ANCA, MПA та нирковообмежене захворювання пов’язані з більш високим ризиком втрати функції нирок (ESRD); а більш висока рШКФ, PR3-ANCA та ГПA мають кращий прогноз. На наш погляд, тяжкий перебіг у носіїв MPO-ANCA+ зумовлюється активацією альтернативного шляху комплемента, який має фундаментальне значення для розвитку захворювання. Продукти розпаду в сечі є потенційним біомаркером васкуліту нирок. Випробуваннями Gou та співавторів доведено, що рівні Bb, C3a, C5a і розчинного C5b-9 в сечі були значно вищими при активному захворюванні, на додаток до Bb — фактично, забезпечуючи сурогатний маркер гістопатології нирок зі зворотною кореляцією з процентним вмістом нормальних клубочків. Підтверджена гіпотеза Chen та співавторів (2015) про те, що більш високі рівні в плазмі крові фактора комплемента (CFH) пригнічують ANCA-індуковану активацію нейтрофілів зі зниженою функціональною активністю у пацієнтів з активним захворюванням. Вимір цього маркера дозволить виявляти таких пацієнтів, а також наступний рецидив [15‚ 19].
Поряд з появою все більш ефективних терапевтичних стратегій, постійно існує потреба в надійному біомаркері, який здатен визначити ступінь активності захворювання і ризик рецидиву. Біомаркер майбутнього сприятиме розробці індивідуальної терапії, оптимізації контролю над захворюванням, водночас допомагаючи зменшенню негативного впливу терапії та потенційної шкоди, пов’язаної з лікуванням [10]. Хоча серологія ANCA і популяція B-клітин далекі від досконалості, вони є двома основними інструментами біомаркерів, які широко застосовуються на практиці для доповнення клінічної оцінки. Одним із кандидатів біомаркерів є аутоантитіла до плазміногену тканин, які вважаються невід’ємною частиною фібринолітичної системи і відмічаються у 25% пацієнтів з позитивними анти-PR3 і анти-МРО.
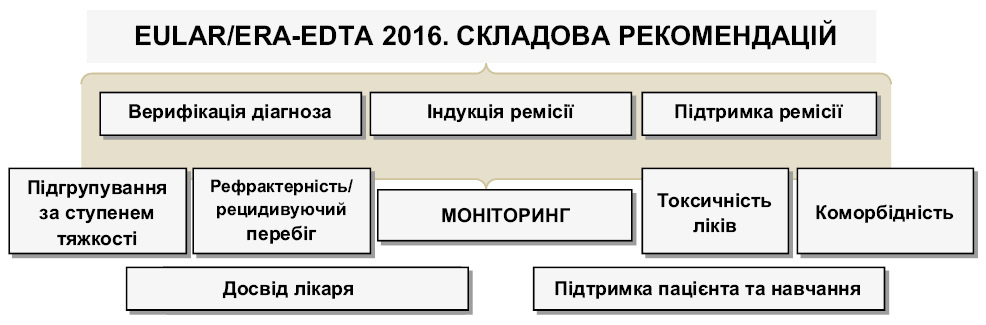
Ключовими у складовій EULAR рекомендацій є основні компоненти, які стосуються верифікації васкуліту, індукції ремісії, моніторингу і підтримки ремісії.
Для індукції ремісії ANCA-асоційованого васкуліту без ураження життєво важливих органів рекомендовано лікування ГК у поєднанні з метотрексатом (МТ) або мікофенолату мофетилом (ММФ). МТ або ММФ не застосовують для індукції ремісії при менінгеальному синдромі, ретроорбітальному ураженні, залученні серця, мезентеріальних судин, легеневій кровотечі, вперше діагностованому множинному мононевриті. Запропоновано призначення МТ (20–25 мг на тиждень) за умови відсутності ознак ураження нирок у наступних випадках: при недеструктивному ураженні носа і додаткових пазух (без порушення нюху або появи глухоти); невиразковому ураженні шкіри; міозиті; вузликах у легенях без деструкції і кровохарканні; при протипоказаннях або відсутності можливості застосування циклофосфаміду або RTX. У разі серйозного рецидиву ANCA-асоційованого васкуліту, який загрожує життю, або з ураженням важливих для життя органів, як і в дебюті цієї патології, рекомендовано лікування ГК у поєднанні з циклофосфамідом або RТХ.
Звернено увагу на зв’язок токсичності з кумулятивною дозою циклофосфаміду, яка вища при пероральному застосуванні, у зв’язку з чим RTX може бути більш перспективним, ніж циклофосфамід. Для лікування нетяжких рецидивів ANCA-асоційованого васкуліту ефективне тимчасове підвищення дози ГК, але в подальшому, як правило, відмічають повторні рецидиви, тому задля підтримки ремісії рекомендовані посилення або модифікація імуносупресивного лікування, застосування альтернативних методів. Підтримка ремісії — посилення або модифікація імуносупресивного лікування, застосування альтернативних методів.
Моніторинг рівнів ANCA — один із варіантів для вибору терапевтичних засобів для запобігання рецидиву СВ. Аналіз результатів випробування MAINRITSAN показав відносно низьку частоту загострень за умови підтримувальної стратегії препаратом RTX у фіксованих дозах (3% через 22 міс і 10% через 28 міс). Більшість осіб, долучених до випробування, були PR3-ANCA+, тому складно оцінити, як частота загострення змінюється між носіями PR3- і MPO-ANCA+. Прогностична значимість АNCA з урахуванням вимірювань досить відома. Однак точність ANCA в прогнозуванні рецидиву залежить від кількості та ступеня ураження органів-мішеней. Дослідженнями останніх років підкреслено, що точність ANCA в прогнозуванні рецидиву залежить саме від наявності ураження нирок. Так, випробування RAVE довело, що підвищення ANCA значною мірою пов’язано з рецидивом у носіїв останніх за умови поєднаного ураження нирок, легень (альвеолярною кровотечею).
Постає питання, чи може моніторинг титру MPO- або PR3-ANCA+ передбачити загострення залежно від стратегії лікування? Низкою випробувань доведена важливість моніторингу підвищення рівня ANCA в якості орієнтиру для оцінки ефективності лікування васкуліту. ANCA залишається найбільш важливим біомаркером у класифікації захворювань і прогнозуванні рецидивів у пацієнтів з більш тяжкими васкулітними проявами, такими як альвеолярна кровотеча і нирковий васкуліт [1‚ 19]. З огляду на низку опрацювань слід зауважити, що незалежно від застосованого лікування носії PR3-ANCA з рецидивуючим ГПA мають значно більш високий ризик рецидиву на відміну від пацієнтів з нещодавно діагностованим MПA або позитивним МРО-ANCA. У підході з позиції персоналізованої медицини титри ANCA можуть бути більш інформативними при прогнозуванні рецидивів [17‚ 18‚ 20].
Проблемним для лікаря є прийняття рішення щодо подальшої стратегії лікування у випадку рефрактерної хвороби до терапії після 4 тиж лікування стандартною терапією (циклофосфамід або RTX). EULAR пропонує рефрактерною хворобою вважати таку, перебіг якої характеризується відсутністю змін або супроводжується підвищенням активності захворювання при гострому ANCA-асоційованому васкуліті після 4 тиж лікування стандартною терапією [20]. Згідно з рекомендаціями EULAR/ERA 2016 р. з лікування ANCA-асоційованого васкуліту клініцист може замінити циклофосфамід на RTX або навпаки. Рішення про зміни схеми лікування ANCA-асоційованого СВ повинно спиратися на комплексне клінічне обстеження, а не на результати визначення ANCA (рівень доказів 4, сила рекомендації D). Підкреслюється, що значення ANCA як предиктора рецидиву не визначено та не доведено, негативні результати тестів на ANCA не виключають наявності активної фази захворювання.
Загострена увага на небажаних реакціях на циклофосфамід для профілактики інфекції Pneumocystis jirovecii, схвалено тривале призначення триметоприму/сульфаметоксазолу (800/160 мг через день або 400/80 мг/добу). Небажані реакції на циклофосфамід відомі. Виявлена висока ефективність RTX при рецидивуючому ANCA-асоційованому васкуліті [2]. В окремих випадках RTХ може мати додаткові переваги, наприклад у жінок репродуктивного віку. Лікування циклофосфамідом або RTX поєднується з призначенням ГК 1 мг/ кг/добу (не більше 80 мг/добу), дозу преднізолону поступово знижують до 7,5–10 мг після 12 тиж лікування.
Для підтримки ремісії ANCA-асоційованого васкуліту рекомендовано лікування низькими дозами ГК в поєднанні з азатіоприном, RTX, МТ або МMФ [2]. Рання відміна підтримувальної терапії пов’язана з ризиком рецидиву. Підтримувальна терапія ANCA-асоційованого васкуліту — азатіоприн, RTX, МТ або ММФ, у зв’язку з гіршою переносимістю лефлуномід віднесено до препаратів другого ряду [2‚ 4]. Додаткове призначення пацієнтам з ГПА триметоприму/сульфаметоксазолу (800/160 мг двічі на добу) може сприяти зниженню ризику рецидиву, монотерапія триметопримом/сульфаметоксазолом для підтримки ремісії не рекомендована. Пацієнтам з ураженням верхніх дихальних шляхів та носіям Staphylococcus aureus призначають топічні антибіотики (мупіроцин).
Коморбідність підкреслена в рекомендаціях EULAR і є основою для періодичної оцінки ризику розвитку серцево-судинних захворювань у пацієнтів з ANCA-асоційованим СВ. У 14% пацієнтів з ГПА протягом 5 років від встановлення діагнозу розвиваються серцево-судинні захворювання [7]. До незалежних факторів ризику їх розвитку відносять похилий вік, діастолічну гіпертензію, специфічність ANCA до PR3.
Рекомендована регулярна комплексна клінічна оцінка стану пацієнта, для якої запропоновано застосовувати такі високоінформативні клінічні індекси, як шкала активності васкуліту (Birmingham Vasculitis Activity Score — BVAS), індекс пошкодження (Vasculitis Damage Index — VDI), ступеня захворювання (Disease Extent Index) та 5 факторів прогнозу (Five Factor Score). Запропоноване EULAR визначення рефрактерного ANCA-СВ включає відсутність покращення або підвищення активності ANCA-СВ після 4 тиж стандартної індукційної терапії або зниження показників BVAS менш ніж на 50% після 6 тиж лікування, або персистуючого захворювання зі збереженням одного великого або 3 малих ознак активності після 12 тиж терапії. Обов’язковий пошук причин формування рефрактерного перебігу ANCA-СВ, включаючи перегляд правильності діагнозу та істини рефрактерності, оцінки адекватності лікування та застосування цільових доз препаратів, уточнення достовірності наявності активності ANCA-СВ, виключення пошкоджень, зумовлених наслідками ANCA-СВ, виключення зв’язку проявів з інфекцією, іншою коморбідною патологією або злоякісним новоутворенням [12‚ 13].
Відсутність відповіді визначається як знижена активність захворювання менше ніж на 50% за шкалами оцінки (наприклад BVAS або BVAS/ГПA) після 6 тиж лікування. Хронічна стійка хвороба визначається як наявність принаймні одного захворювання за шкалами оцінки після 12 тиж лікування. Пацієнтам, які не в змозі досягти ремісії і мають постійну низьку активність хвороби, додатково вводиться внутрішньовенний імуноглобулін (ВВІГ).
Рандомізовані клінічні випробування, в яких вивчалася б оптимальна тривалість лікування ANCA-асоційованих васкулітів, відсутні. Відповідно до даних когортних довгострокових спостережень раннє зупинення терапії асоціюється з підвищеним ризиком рецидиву. На практиці підтверджується‚ що інформованість пацієнта покращує результати лікування. Обізнаний про особливості своєї хвороби пацієнт здатен краще розпізнавати перші ознаки рецидиву. Нині ANCA-асоційований васкуліт є контрольованим, але невиліковним захворюванням, і часто має віддалені наслідки, які потребують тривалого комплексного лікування [1‚ 5]. Як висновок експерти відзначили найбільш перспективні напрямки подальших випробувань різних аспектів патології, які містять діагностичні і класифікаційні критерії, вивчення біомаркерів, клінічні випробування нових біологічних препаратів для лікування рефрактерного ANCA-асоційованого васкуліту.
ВИСНОВКИ
Відсутність надійного біомаркера для виявлення рецидивуючого або стійкого захворювання створює ризик зростання захворюваності, рецидивів і смертності через обмеження контролю хвороби або негативного впливу на пацієнта потенційно шкідливої терапії. Таким чином, існує потреба в розробці функціонального біомаркера, який буде відповідати можливості стратифікації ризику і персоніфікації лікування. Активація альтернативного шляху комплемента має фундаментальне значення для розвитку захворювання, а продукти розпаду в сечі є потенційним біомаркером васкуліту нирок.
Список використаної літератури
- 1. ACR/EULAR study to develop classification and diagnostic criteria for primary systemic vasculitis (research.ndorms. ox.ac.uk/public/ dcvas/).
- 2. Alba M.A., Flores-Suárez L.F. (2016) Rituximab as maintenance therapy for ANCA associated vasculitis: how, when and why? Reumatol. Clínica (English Edition), 12(1): 39–46.
- 3. Berden A.E., Ferrario F., Hagen E.C. et al. (2010) Histopathologic classification of ANCA-associated glomerulonephritis. J. Am. Soc. Nephrol.; 21: 1628–1636.
- 4. Cartin-Ceba R., Golbin J.M., Keogh K.A. et al. (2012) Rituximab for remission induction and maintenance in refractorygranulomatosis with polyangiitis: ten-year experience at a singlecenter. Arthritis Rheum., 64: 3770–3778.
- 5. Cornec D., Cornec-Le Gall E., Fervenza F.C. et al. (2016) ANCA-associated vasculitis [mdash] clinical utility of using ANCA specificity to classify patients. Nat. Rev. Rheumatol., 35: 953–960.
- 6. Cottin V., Bel E., Bottero P. et al. (2017) Revisiting the systemic vasculitis in eosinophilic granulomatosis with polyangiitis (Churg-Strauss): A study of 157 patients by the Groupe d’Etudes et de Recherche sur les Maladies Orphelines Pulmonaires and the European Respiratory Society Taskforce on eosinophilic granulomatosis with polyangiitis (Churg-Strauss). Autoim. Rev., 16 (1): 1–9.
- 7. Csernok E., Moosig F. (2014) Current and emerging techniques for ANCA detection in vasculitis. Nat. Rev. Rheumatol., 10(8): 494–501.
- 8. Cuminetti G., Regazzoni V., Vizzardi E. et al. (2016). Cardiac ANCA-associated vasculitis mimicking an acute coronary syndrome. Int. J. Сardiol., 214: 200–201.
- 9. Ohlsson S. et al. (2019) Neutrophils from ANCA-associated vasculitis patients show an increased capacity to activate the complement system via the alternative pathway after ANCA stimulation. PLos One, 14: e0218272.
- 10. de Joode A.A., Roozendaal C., van der Leij M.J. et al. (2014) Performance of two strategies for urgent ANCA and anti-GBM analysis in vasculitis. Eur. J. Іnt. Мed., 25 (2): 182–186.
- 11. Flint S.M., McKinney E.F., Smith K.G. (2015) Emerging concepts in the pathogenesis of antineutrophil cytoplasmic antibody-associated vasculitis. Curr. Оpin. Rheumatol., 27 (2): 197–203.
- 12. Furuta S., Jayne D. (2014) Emerging therapies in antineutrophil cytoplasm antibody-associated vasculitis. Curr. Оpin. Rheumatol., 26 (1): 1–6.
- 13. Fussner L.A., Hummel A.M., Schroeder D.R. et al. (2016) Factors determining the clinical utility of serial measurements of antineutrophil cytoplasmic antibodies targeting proteinase 3. Arthritis Rheum., 68 (7): 1700–1710.
- 14. Huang Y.M., Wang H., Wang C. et al. (2015) Promotion of hypercoagulability in antineutrophil cytoplasmic antibody-associated vasculitis by C5a-induced tissue factor — expressing microparticles and neutrophil extracellular traps. Arthritis Rheum., 67 (10): 2780–2790.
- 15. Jennette J.C., Falk R.J. (2014) Pathogenesis of antineutrophil cytoplasmic autoantibody-mediated disease. Nat. Rev. Rheumatol., 10 (8): 463–473.
- 16. Jennette J.C., Falk R.J., Bacon P.A. et al. (2013) 2012 revised international chapel hill consensus conference nomenclatureof vasculitides. Arthritis Rheum., 65(1): 1–11.24.
- 17. Miloslavsky E.M., Lu N., Unizony S. et al. (2016) Myeloperoxidase-antineutrophil cytoplasmic antibody (ANCA)-positive and ANCA-negative patients with granulomatosis with polyangiitis: Distinct patient subsets. Arthritis Rheum., 68(12): 2945–2952.
- 18. Murphy J.M., Young I.G. (2006) IL-3, IL-5, and GM-CSF signaling: crystal structure of the human beta-common receptor. Vitam. Horm., 74: 1–30.
- 19. Pagnoux C., Springer J. (2016) Editorial: Classifying antineutrophil cytoplasmic antibody (ANCA)-associated vasculitides according to ANCA type or phenotypic diagnosis: Salt or Pepper? Arthritis Rheum., 68(12): 2837–2840.
- 20. Van Dam L.S., Dirikgit E., Ray A. et al. (2020) PR3-ANCAs predict relapses in ANCA-associated vasculitis patients after rituximab.Published online Jun 30. doi:10. 1093/ndt/gfaa066.
Потенциальные возможности клинической оценки пациента с ANCA-ассоциированным системным васкулитом
Днепровский государственный медицинский университет
Резюме. Отсутствие биомаркера для выявления рецидивирующего или устойчивого заболевания создает риск роста заболеваемости, рецидивов и смертности в связи с ограничением контроля болезни или негативного воздействия на пациента потенциально небезопасной терапии. Цель исследования: изучить данные по идентификации многообещающих новых маркеров кандидатов на основе анализа инновационных аналитических инструментов, улучшенного понимания иммунопатогенеза и конечных целей лечения АNCA (антинейтрофильные цитоплазматические антитела)-ассоциированных васкулитов. Материалы и методы. В работе представлен обзор литературы, посвященный роли АNCA при АNCA-ассоциированных васкулитах с акцентом на особенностях клинических фенотипов носителей PR3- и MPO-ANCA, рецидивов, на основании проведенного поиска англоязычных статей в базах Medline и PubMed, опубликованных в последние 3 десятилетия. Результаты и обсуждение. За последние 25 лет достигнут значительный прогресс в разработке методики выявления ANCA. Это касается достижений в характеристике антигена, стандартизации анализов ANCA, включении ANCA в номенклатуру и классификационные предложения и в технологии. Консенсусные заявления по тестированию ANCA имели обоснования с учетом различных вариаций относительно их оценки. Открытие ANCA было важным этапом в диагностике и лечении пациентов с клиническими синдромами гранулематозного полиангиита (ГПА) или микроскопического полиангиита (МПА). Согласно Международным документам по определению и оценке результатов тестирования ANCA, при выявлении данных аутоантител у всех пациентов применяется метод реакции иммунной флуоресценции (РНИФ). Затем с целью классификации заболеваний была рекомендована специфичность ANCA к PR3 или MPO. Это обусловлено тем, что разница в генетике, патогенезе, факторах риска, ответе на лечение и результатах больше соответствует типу PR3 или MPO-ANCA, а не клиническому диагнозу. Риск рецидива тесно связан с типом заболевания, а не с типом ANCA. У МРО-ANCA+ пациентов с ГПА частота рецидивов такая же, как и у PR3-ANCA+ пациентов. При изменении стратегии лечения следует базироваться на комплексном клиническом обследовании, а не на результатах ANCA. Значение ANCA как предиктора рецидива не определено и не подтверждено, негативные результаты тестов на ANCA не исключают активной фазы заболевания. Рекомендуется регулярная комплексная клиническая оценка состояния пациента, для которой следует применять высокоинформативные клинические индексы — BVAS, индекс повреждения (Vasculitis Damage Index — VDI), степени заболевания (Disease Extent Index) и 5-факторная шкала (Five Factor Score). Выводы. Отсутствие соответствующего биомаркера для выявления рецидивирующего или устойчивого заболевания вызывает риск повышения заболеваемости, рецидивов и смертности в связи с ограничением контроля болезни или негативного воздействия на пациента потенциально опасной терапии. Таким образом, существует необходимость в разработке функционального биомаркера, который будет отвечать возможностям стратификации риска и персонификации лечения. Активация альтернативного пути комплемента имеет фундаментальное значение для развития заболевания, а продукты распада в моче являются потенциальным биомаркером васкулита почек.
Ключевые слова: системный васкулит, антинейтрофильные цитоплазматические антитела, диагностика, предикторы.
Адреса для листування:
Кузьміна Ганна Петрівна
revmatologymedd@gmail.com

Leave a comment