Рекомендації Всеукраїнської асоціації кардіологів України з діагностики та лікування міокардиту
Коваленко В.М., Несукай О.Г., Чернюк С.В., Козлюк А.С., Кириченко Р.М.
Резюме. Рекомендації присвячені сучасним аспектам епідеміології, етіології, патогенезу, діагностики, патогенетичного та симптоматичного лікування міокардиту. Детально описані різні патогенетичні механізми, які спричиняють розвиток та прогресування запальних захворювань серця та дилатацію і систолічну дисфункцію, призводять до серцевої недостатності та розвитку інших ускладнень міокардиту. Ці рекомендації представляють сучасну класифікацію міокардиту, затверджену в Україні, та сучасні алгоритми діагностики та клінічного ведення пацієнтів, зокрема алгоритм, який виправдовує призначення глюкокортикоїдів пацієнтам з міокардитом. Характеристики різних варіантів міокардиту також представлені з поясненнями щодо діагностики та лікування. Велика увага приділяється різним підходам до етіотропного та патогенетичного лікування міокардиту та їх можливим перспективам. Очевидно, що для стандартизації підходів до діагностики та лікування гострого та хронічного міокардиту необхідно провести масштабні багатоцентрові дослідження та створити спеціальні реєстри. Крім того, в сучасних умовах пандемії COVID-19 патологічні наслідки SARS-CoV-2 як тригера міокардиту потребують подальшого вивчення, зокрема з точки зору впливу на прогноз та підходи до патогенетичної терапії у таких пацієнтів. Уніфікація термінології та підходів до діагностики та клінічного моніторингу пацієнтів з міокардитом може покращити тактику ведення та підвищити виживаність таких пацієнтів. Для виявлення пацієнтів з високим ризиком (з аритміями, високою ймовірністю рецидиву або перетворення міокардиту в дилатаційну кардіоміопатію) та кандидатів на трансплантацію серця найбільш перспективним є створення спеціальних баз даних таких пацієнтів.
DOI: 10.32471/rheumatology.2707-6970.85.16392
УДК: 616.127–002–073
Визначення та епідеміологія
Міокардит — це запалення серцевого м’яза, що зумовлене переважно вірусами, іншими інфекційними агентами, включаючи бактерії, найпростіші та гриби, також може бути викликане різними токсичними речовинами, ліками та системними імуноопосередкованими захворюваннями. Хронічний дифузний міокардит (ХДМ), або запальна кардіоміопатія, визначається як міокардит у поєднанні з дисфункцією серця та ремоделюванням шлуночків [16, 18, 78].
Реальну поширеність міокардиту визначити важко, однак відповідно до Глобального регістру вивчення захворювань вона становить 22 випадки на 100 тис. населення на рік [8]. Згідно із Французьким регістром міокардит знаходиться на 2-му місці (близько 3% випадків) серед усіх випадків госпіталізацій пацієнтів із загруднинним болем [9]. Гострий міокардит (ГМ) відмічають частіше у молодих пацієнтів (віком 30–45 років), є дані, що чоловіки хворіють частіше (60–80%) [27, 72]. Розвиток ХДМ виявляють у ≥10% діагностованого або пропущеного гострого міокардиту (ГМ) в результаті спричиненого ним пошкодження міокарда та розвитку систолічної дисфункції [31].
Етіопатогенез
Етіопатогенез та перебіг міокардиту, що пов’язані з різними інфекційними агентами, значно відрізняються. До найпоширеніших вірусів, асоційованих із міокардитом, належать первинні кардіотропні віруси (включаючи аденовіруси та ентеровіруси); васкулотропні та лімфотропні віруси, які можуть персистувати протягом усього життя; віруси, які опосередковано запускають міокардит шляхом активації імунної системи (включаючи вірус імунодефіциту людини, вірус гепатиту С, віруси грипу А та В) [31, 39, 48]. Віруси з сімейства Coronaviridae (включаючи MERS-CoV, SARS-CoV та SARS-CoV-2), які мають тропність до ангіотензинперетворювального фермента-2 (АПФ2), потенційно можуть зумовлювати пряме ураження серця, а також опосередковано викликати міокардит за рахунок кардіотоксичності, зумовленої цитокінами, або аутоімунну відповідь на структури серця (табл. 1) [78].
Таблиця 1. Віруси, асоційовані із міокардитом
| Тропність | Вірус | Геном | Вірулентність | Лікування асоційованого ураження серця |
|---|---|---|---|---|
| Кардіотропні | Аденовіруси | длДНК | Вірулентний | Інтерферон-α та β (?); пряма противірусна терапія (?); імуноглобуліни(?) |
| Ентеровіруси (віруси Коксакі, ехо-віруси) | (+)олРНК | |||
| Васкулотропні | Парвовірус В19 | олДНК | Латентний: незначна кількість вірусних часток у міокарді за наявності або відсутності кардіального запалення | Не потребує противірусної терапії |
| Вірулентний: велика кількість вірусних часток у міокарді (>500 копій вірусної ДНК на мікрограм міокардіальної ДНК) в умовах кардіального запалення або системної інфекції | В/в введення імуноглобуліну (?) | |||
| Лімфотропні | Цитомегаловірус, вірус Епштейна — Барр, вірус герпесу 6-го типу | длДНК | Латентний: незначна кількість вірусних часток у міокарді за наявності або відсутності кардіального запалення | Не потребує противірусної терапії |
| Вірулентний: велика кількість вірусних часток у міокарді в умовах кардіального запалення | Протигерпетичні препарати | |||
| Кардіотоксичні | Вірус гепатиту С, ВІЛ, віруси грипу | (+)олРНК | Вірулентний: кардіальне запалення з віремією | Противірусні препарати прямої дії |
| АПФ2-тропні; кардіотоксичні? | Коронавіруси (MERS-CoV,
SARS-CoV, SARS-CoV-2) |
(+)олРНК | Вірулентний: віремія; кардіальне запалення (?) | Потенційне лікування на етапі вивчення: ремдесивір; гідроксихлорохін та азитроміцин; фавіпіравір, дарунавір та кобіцистат, лопінавір-ритонавір, рибавірин, інтерферон α, камостат мезилат |
Примітки: (?) — недостовірно, потребує подальшого вивчення; ВІЛ — вірус імунодефіциту людини; длДНК — дволанцюгова ДНК; олДНК — одноланцюгова ДНК; (+)олРНК — позитивно спрямована РНК; MERS-CoV — коронавірус близькосхідного респіраторного синдрому; SARS-CoV — коронавірус тяжкого гострого респіраторного синдрому
Для виявлення вірусного геному рекомендації Європейського товариства кардіологів вимагають аналізу зразків ендоміокардіальної біопсії (ЕМБ) за допомогою кількісної полімеразної ланцюгової реакції (ПЛР) [18]. Натомість Американська асоціація серця не рекомендує рутинний аналіз вірусного геному, але ця методика розглядається як потенційний підхід у випадках нез’ясованого діагнозу [43]. Користь виявлення вірусного геному в серці для вибору тактики лікування міокардиту має бути підтвердженою в подальших клінічних дослідженнях.
Індукований вірусом ГМ може бути як безпосередньо спричинений вірусом, так і розвиватися внаслідок опосередкованих механізмів, пов’язаних із вірусною персистенцією.
Ентеровіруси, найчастіше віруси Коксакі В, та деякі аденовіруси інфікують кардіоміоцити, зв’язуючись із загальним трансмембранним рецептором (коксакі та аденовірусний рецептор), і таким чином можуть викликати пряме пошкодження міокарда, включаючи порушення цитоскелету, і неконтрольовану імунну відповідь навіть після кліренсу вірусу. Ці віруси є прикладами цитолітичних вірусів, які викликають міокардит, індукуючи реплікацію вірусу всередині клітини-хазяїна з подальшим лізисом кардіоміоцитів, порушенням цитоархітектоніки та лізисом скоротливих білків міокарда [14, 66, 76]. Можливо, такий механізм лежить в основі розвитку блискавичних форм міокардиту [14]. Персистенція аденовірусів та ентеровірусів у міокарді призводить до дисфункції ЛШ, поганих клінічних результатів та підвищення смертності у цих пацієнтів [31]. Однак близько 50% пацієнтів з індукованим ентеровірусом або аденовірусом міокардитом повністю одужують без залишкових ушкоджень міокарда. Пацієнти, які переносять делецію CCR5Δ32 (що призводить до дефіциту CC-хемокінового рецептора 5 (CCR5)), як гетерозиготну, так і гомозиготну, демонстрували спонтанне очищення від ентеровірусної інфекції порівняно з пацієнтами, носіями дикого типу CCR5, що підкреслює важливість генетичного фону для прогресування та прогнозу захворювання [8]. Припускається, що звичайна ПЛР мутантні віруси може не виявляти [54].
Парвовірус В19 може бути причиною вірусопосередкованого, а також віруспровокованого міокардиту. У дорослих осіб у випадках як ГМ, так і хронічного міокардиту геном парвовірусу В19 у серцевому м’язі визначається в різних титрах, але більшість зразків ЕМВ має низьку кількість копій ДНК парвовірусу B19, що наводить на думку, що B19V за умови відсутності аутоімунної відповіді швидше є латентним неспецифічним супутником міокардиту, а не основним патогеном, що спричиняє захворювання [50]. Інфекція B19 може персистувати в серці з епізодами реактивації вірусу, він може потрапляти в ендотеліальні клітини і викликати вивільнення прозапальних цитокінів, опосередкованих токсичним неструктурним вірусним білком NS1, та індукувати апоптоз кардіоміоцитів [82]. Згідно з даними міжнародного регістру парвовірус B19 є єдиним виявленим вірусом у пацієнтів із лімфоцитарним фульмінантним міокардитом [82].
До невірусних інфекцій і інвазій, при яких може розвиватися міокардит, відносять дифтерію, токсоплазмоз, хламідіоз, бруцельоз, туляремію, туберкульоз, правець, сифіліс, лептоспіроз, сальмонельоз, хворобу Чагаса (трипаносомоз), стрептококові та стафілококові інфекції, скарлатину, висипний тиф, кандидоз, актиномікоз, гістоплазмоз, аспергільоз [15]. Відомі випадки виникнення міокардиту при отруєнні токсичними речовинами, зокрема миш’яком, свинцем, кобальтом, кадмієм [17]. У літературі описані випадки захворювання на міокардит після прийому доксорубіцину, антрациклинів, стрептоміцину, циклофосфаміду, пеніциліну, левоміцетину, сульфаніламідів, ацетамінофену, катехоламінів, зидовудину, спіронолактону, амфетаміну, кокаїну [16]. Реакції гіперчутливості, що виникають після укусів змій і комах, також можуть призводити до запального ушкодження серцевого м’яза. Із запальним процесом у міокарді можуть асоціюватися саркоїдоз, хвороба Крона, неспецифічний виразковий коліт, гранулематоз Вегенера, хвороба Кавасакі, системний червоний вовчак, склеродермія, ревматоїдний артрит, дерматоміозит [14]. Запальні зміни міокарда іноді виникають і після трансплантації серця [15].
На сьогодні доведено, що запальний процес у міокарді не може розвиватися спонтанно, для його запуску необхідний ініціальний вплив тригерного фактора, основним з яких є вірус [8, 40, 45].
Роль імунних клітин у патогенезі міокардиту продовжує вивчатися. Пошкоджувальний вплив імунопатологічних реакцій можна розділити на три взаємопов’язані складові: а) ушкодження міокарда та інших тканин серця, зумовлене реакціями клітинного імунітету; б) ураження, зумовлене впливом гуморальних факторів, у першу чергу антитіл до скоротливих білків різноманітних структур серця; в) патологічні ефекти прозапальних цитокінів, що активно синтезуються імунними клітинами [14, 36, 38, 52].
В основі патогенетичних механізмів вірусного міокардиту лежить комплекс чинників — пряма цитотоксична дія вірусу на кардіоміоцити (КМЦ), активація процесів апоптозу, а також реакцій первинного і вторинного імунітету, ураження мікросудинного русла, ремоделювання скоротливого апарату серцевого м’яза [16, 40]. Ці процеси, як правило, проходять три послідовні фази.
У початковій фазі захворювання відбувається проникнення вірусу в КМЦ, ендотеліальні клітини і фібробласти шляхом ендоцитозу [75]. Пошкодження міокарда може реалізовуватися шляхом прямого вірусопосередкованого лізису КМЦ або через активацію первинної імунної відповіді [14, 75]. У разі блискавичних форм міокардиту масова загибель КМЦ може призводити до серйозного порушення скоротливої функції серця і швидкого прогресування серцевої недостатності (СН). Макрофаги і натуральні кілери посилюють пошкодження серцевого м’яза, знищуючи інфіковані вірусом КМЦ за допомогою перфоринів і гранзимів, а також підтримують активне запалення в міокарді, продукуючи прозапальні цитокіни [75]. Початкова фаза міокардиту в разі адекватної імунної відповіді може закінчуватися повною елімінацією вірусу з міокарда із подальшим одужанням, проте може перейти в другу фазу — аутоімунну.
Друга фаза вірусного міокардиту починається, як правило, через 10–14 днів після проникнення вірусу в міокард і характеризується активацією реакцій вторинного (специфічного) імунітету із виробленням специфічних антиміокардіальних імуноглобулінів класів G, M і A плазматичними клітинами і проліферацією клонів антигенспецифічних Т-лімфоцитів [1, 31, 65]. Специфічні Т-лімфоцити інфільтрують міокард і розпізнають копії деградованих фрагментів вірусу в головному комплексі гістосумісності 1-го типу на мембрані інфікованих клітин. Взаємодія специфічних Т-лімфоцитів із інфікованими вірусом КМЦ здійснюється через молекули міжклітинної адгезії за участю прозапальних цитокінів, які виробляються імунними клітинами у вогнищі запалення, основними серед яких є γ-інтерферон (γ-ІФ), фактор некрозу пухлини α (ФНП-α), інтерлейкін (ІЛ)-1β, ІЛ-2, ІЛ-6, ІЛ-17А, ІЛ-23 [1, 65, 52, 75].
Цей процес завершується не тільки знищенням вірусних частинок, але й пошкодженням структурних елементів міокардіальної тканини — КМЦ, ендотеліоцитів, компонентів міжклітинного матриксу, білків міолеми і сарколеми та ін. [12, 14, 16]. Даний аутоімунний процес стосується і гуморальної ланки імунітету та відображає власне сутність поняття «імунопатологічна реакція».
У разі тривалого запального процесу в серцевому м’язі відбувається перехід захворювання в третю, хронічну фазу, в якій основним патологічним процесом є ремоделювання серцевого м’яза з прогресуючою дилатацією серця і розвитком ХДМ з хронічною СН [7, 17, 26, 51]. При гістологічному дослідженні ознаки запалення в міокарді можуть не виявлятися, проте глибокі структурно-функціональні зміни контрактильного апарату серця із розвитком фіброзу, як правило, незворотні. Надалі може відбуватися трансформація захворювання в дилатаційну кардіоміопатію (рисунок) [15].
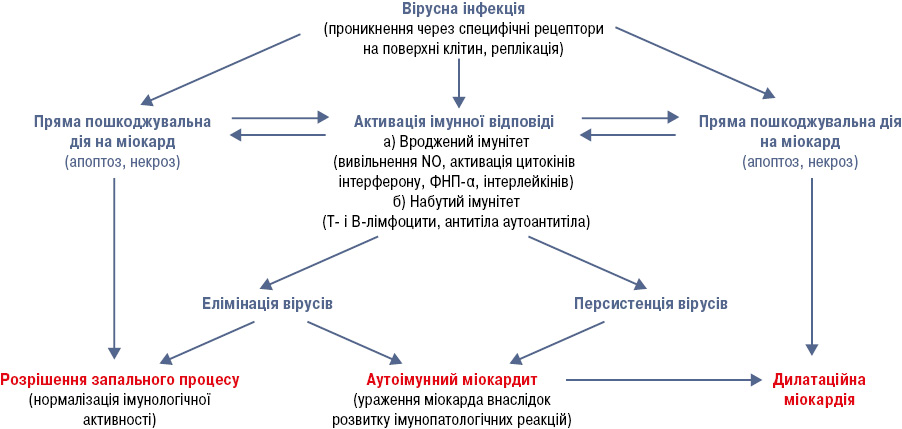
Іншим патогенетичним механізмом пошкодження серця при міокардиті є розвиток імунопатологічних реакцій гуморального типу, що супроводжуються синтезом аутологічних антитіл різних класів. В експериментальних моделях на лабораторних тваринах показано, що синтез аутоантитіл до різних структур серцевого м’яза може зумовлювати тяжке запальне ураження серця [52, 75]. Під дією вірусних частинок відбувалося виділення кардіального міозину в кровотік, що призводило до синтезу аутоантитіл, до тяжкого ланцюга міозину й ураження основного скоротливого білка міокарда, причому цей патологічний процес тривав навіть після елімінації вірусу з міокарда.
У патогенезі аутоімунного ураження серця важлива роль відводиться антитілам до β1-адреноцерецептора (β1-АР). У декількох дослідженнях показано, що введення лабораторним тваринам антитіл до β1-АР призводить до розвитку стійкої дилатації і систолічної дисфункції серця через 6–9 міс [52, 73]. Довготривала стимуляція β1-АР супроводжується активацією апоптозу КМЦ і підвищенням ризику виникнення аритмій внаслідок зростання внутрішньоклітинної концентрації іонів Са2+. Одним із механізмів, за допомогою яких здійснюється шкідлива дія β-агоністів на міокард, є гіперпродукція прозапальних цитокінів, що відмічається при активації симпатоадреналової системи [75]. Основною гіпотезою, що пояснює гіперпродукцію антитіл до β1-АР, є феномен «молекулярної мімікрії», сутність якого полягає в схожості антигенної структури вірусів до антигенів макроорганізму, зокрема β1-АР [55].
У сучасній вітчизняній і зарубіжній літературі також описані інші види антитіл, що можуть зумовлювати аутоімунне ураження серця при міокардиті: антитіла до холінергічних рецепторів, антимітохондріальні та антицитоплазматичні антитіла, антитіла до актину, кардіального міозину, тропоніну І, ламініну, віментину, фібронектину, колагену, транспортного білка Са2+ АТФ-ази [14, 52, 54].
У патогенезі ураження екстрацелюлярного матрикса серцевого м’яза, що зумовлює прогресування порушень систолічної і діастолічної функції серця та розвиток СН, важливу роль відіграють матриксні металопротеїнази (ММП). У численних експериментальних дослідженнях доведено, що прозапальні цитокіни регулюють утворення й активацію ММП: гіперекспресія ФНП-α та ІЛ-1β обумовлює активацію синтезу ММП 2-го і 9-го типу [34, 66]. Нині вважається, що довготривала гіперпродукція ММП під впливом прозапальних цитокінів на фоні хронічного запального процесу в міокарді обумовлює незворотне ураження компонентів строми серцевого м’яза [12, 52, 66].
Протягом останніх років із прогресивним розвитком молекулярно-біологічних технологій почала з’ясовуватися роль експресії різних типів мікроРНК в патогенезі міокардиту. Вже доведено, що одночасна гіперекспресія мікроРНК 146b та мікроРНК 499 є високоспецифічним маркером фульмінантного міокардиту; окрім цього, встановлено значиму роль мікроРНК-21, мікроРНК-155, мікроРНК-221 та мікроРНК-222 як предикторів тяжкого перебігу хронічного міокардиту [23, 35, 46, 80, 83].
На сьогодні доведена важлива роль Toll-подібних рецепторів (TLR) в активації імунних клітин і кардіоміоцитів. Вони експресуються на поверхні різних типів клітин серцевої тканини: КМЦ, ендотеліальних клітин, клітинах гладких м’язів, причому найбільш активно відбувається експресія TLR2, TLR3 та TLR4 [22, 74]. Особливо важливу роль TLR 2-го і 4-го типу відіграють в активації запального ураження серця та розвитку прогресуючої СН [74, 84]. Прозапальні ефекти стимуляції TLR2 та TLR4 здійснюються шляхом активації ендонуклеарного фактора kappa-B, що, у свою чергу, зумовлює синтез прозапальних цитокінів: ІЛ-1, ІЛ-6, та ФНП-α, а також інтерферону β [1, 22, 84]. Ще одним важливим механізмом, через який здійснюється патологічний вплив TLR2 та TLR4 при аутоімунному міокардиті, є їх медіаторний вплив на активацію Т-хелперів 17-го типу з гіперпродукцією ІЛ-17 та ІЛ-6 [22]. Роль гіперекспресії TLR4, що супроводжується синтезом ФНП-α, ІЛ-1β, ІЛ-6 як одного з ключових механізмів, які зумовлюють запальне ураження міокарда, є настільки значимою, що нині проводяться клінічні дослідження, переважно 2-ї фази, із застосуванням інгібіторів TLR4, таких як, наприклад, ериторан та птеростілбен, з метою пригнічення цього патогенетичного шляху [22, 84].
Класифікація міокардиту [2]
І. Варіанти перебігу (в дужках вказано відповідний код за МКХ-10):
- гострий (до 3 міс від початку захворювання) — (І40);
- підгострий (3–6 міс від початку захворювання) — (І40.10);
- хронічний міокардит/запальна кардіоміопатія (більше 6 міс від початку захворювання) — (І51.4);
- гігантоклітинний міокардит — (І 40.1);
- міокардіофіброз — (І 51.4).
ІІ. Етіологія:
- з установленою етіологією: інфекційний — (І40), бактеріальний — (І41.0), вірусний (HHV-реактивний, ентеровірусний, аденовірусний) — (І41.1), паразитарний — (І41.2), при інших хворобах (кардіальний саркоїдоз, еозинофільний міокардит) — (І41.8);
- неуточнений — (І40.9).
ІІІ. Поширеність:
- ізольований;
- дифузний.
ІV. Характер перебігу:
- легкий;
- середньої тяжкості;
- тяжкий.
V. Ускладнення:
- периміокардит;
- порушення серцевого ритму і провідності, тромбоемболії та ін.
VI. СН І–III стадія, I–IV ФК (NYHA):
- зі збереженою ФВ ЛШ;
- зі зниженою ФВ ЛШ.
Діагностика
Симптоми та клінічні прояви
Типові симптоми у пацієнтів із ГМ включають біль у грудях (85–95% випадків), задишку (19–49% випадків), втому, серцебиття та синкопальні стани (до 6% випадків) [8, 18]. У 65% хворих відмічається лихоманка, в той час як частота розвитку інших симптомів продромального періоду захворювання, які включають клінічні прояви застуди, шлунково-кишкові розлади, закладеність горла, інфекції респіраторного тракту, в гостру стадію захворювання варіює в межах 18–80% [48].
В одному з останніх регістрів ГМ, що включив 443 пацієнти, у 26,6% обстежених виявлено систолічну дисфункцію ЛШ, шлуночкові порушення ритму або кардіогенний шок, при цьому фульмінантний перебіг міокардиту встановлено у 8,6% хворих [8]. З іншого боку, в більшості випадків (73,4%) подібних ускладнень не задокументовано, однак хворі скаржилися на біль у ділянці серця (97%), що супроводжувався елевацією сегмента ST в 62,3% випадків, причому серед цих хворих за 5-річний термін спостереження не зареєстровано жодного випадку кардіальної смерті або трансплантації серця [8].
При зборі анамнезу у пацієнтів із підозрою на ГМ необхідно особливу увагу приділяти зв’язку клінічної симптоматики з нещодавнім прийомом лікарських засобів (антибіотиків, клозепіну, інгібіторів імунної відповіді та ін.), токсичних речовин (кокаїн, амфетамін), різноманітними інфекціями та інвазіями, зокрема гельмінтозами.
У 2013 р. Робочою групою із захворювань міокарда та перикарда Європейського товариства кардіологів було введено поняття «клінічно підозрюваного міокардиту», діагностика якого ґрунтується на наявності клінічних проявів і діагностичних критеріїв (табл. 2) [18].
Таблиця 2. Клінічні прояви та діагностичні критерії клінічно підозрюваного міокардиту
Клінічні прояви:
Діагностичні критерії: 1. Дані електрокардіографії (ЕКГ), тесту із фізичним навантаженням, холтерівського моніторування (ХМ)
2. Маркери лізису кардіоміоцитів
3. Функціональні та структурні порушення при використанні візуалізаційних методик
4. Характеристика міокардіальної тканини за допомогою МРТ серця
|
Лабораторні дослідження
При підозрі на наявність ГМ рекомендованими лабораторними тестами є визначення біомаркерів кардіального некрозу (високочутливий тропонін, креатинкіназа-МВ). Водночас кореляційний зв’язок між підвищенням рівня тропоніну та розвитком дисфункції міокарда має слабку силу [18]. Слід враховувати, що у хворих на ГМ та гострий перикардит часто відмічають приблизно однакові скарги і підвищення рівнів високочутливих тропонінів, що є діагностичною ознакою на користь саме міокардиту. До інших лабораторних тестів, які зазвичай використовують у діагностиці ГМ, відносять маркери запалення, зокрема, С-реактивний білок є позитивним у 80–90% випадків [16]. Швидкість осідання еритроцитів (ШОЕ) також зростає та може застосовуватися для обстеження пацієнта із ГМ, проте в невідкладних випадках використання цього методу є невиправданим [16]. Стійке підвищення ШОЕ часто є свідченням наявності асоційованої аутоімунної патології. Оцінка лейкоцитарної формули дозволяє виявити еозинофілію — одну з ознак еозинофільного міокардиту (ЕМ). Серологічний та вірусологічний аналіз периферичної крові є малоінформативним [15].
Визначення наявності вірусів методом ПЛР в секреті дихальних шляхів та фарингеальному мазку має доцільність для ідентифікації тропних респіраторному тракту збудників (грип, коронавірус та ін.), які також можуть бути тригерами ГМ [8]. Оцінка титру антитіл (наприклад антинуклеарних антитіл) та такого ж роду тести показані пацієнтам у разі наявності підозри на аутоімунну природу захворювання [73].
Визначення рівнів передсердного натрійуретичного пептиду та його попередника не має діагностичної цінності при міокардиті, однак може використовуватися для моніторингу перебігу СН у хворих на ХДМ [18].
ЕКГ та добове моніторування ЕКГ
Патологічні зміни на ЕКГ у хворих на ГМ реєструються в 85% випадків, типовою є інфарктоподібна елевація сегмента ST, що відмічається частіше у відведеннях ІІІ і aVF та правих грудних відведеннях. Для виключення гострого коронарного синдрому проводять комп’ютерну томографію коронарних судин або коронарографію. Розширення комплексу QRS до 120 мс і більше, шлуночкові порушення ритму, атріовентрикулярна (АВ) блокада, симптомна тахі- або брадикардія підвищують ризик розвитку ускладнень при ГМ [60, 73]. У хворих з нормальною фракцією викиду (ФВ) лівого шлуночка (ЛШ) (>50%) АВ-блокаду ІІ та ІІІ ст. при ГМ виявляють досить рідко за винятком кардіального саркоїдозу, хвороби Лайма та при ГМ, асоційованому з прийомом інгібіторів імунної відповіді [72].
Добове моніторування ЕКГ є високоінформативним методом для виявлення, прогнозування і динамічного спостереження найчастіших ускладнень міокардиту — порушень ритму і провідності. Найбільшу загрозу у хворих на ГМ та ХДМ становлять шлуночкові порушення ритму, зокрема наявність шлуночкової тахікардії (ШТ). Нещодавно опубліковано результати метааналізу 45 досліджень, присвячених пошуку предикторів раптової кардіальної смерті (РКС) у хворих із дилатацією ЛШ неішемічного ґенезу [25]. Серед основних прогностичних маркерів РКС (поряд із класичними предикторами, такими як ФВ ЛШ, кінцево-діастолічний розмір ЛШ, ширина комплексу QRS) авторами вказано наявність епізодів ШТ, причому її висока значимість доведена за результатами метааналізу 18 досліджень [24, 60].
Ехокардіографічне дослідження
Ехокардіографія (ехоКГ) є обов’язковим компонентом обстеження пацієнта із гострою кардіальною патологією. Навіть за умови збереженої систолічної функції запідозрити ГМ дозволяють наявність потовщення та локального гіпокінезу ЛШ (особливо в нижній та нижньо-латеральній ділянці), відхилення при тканинній допплерографії, діастолічна дисфункція, поява перикардіального випоту та змінена ехогенність тканин міокарда [18, 36]. На ранніх стадіях ГМ значного розширення порожнини ЛШ зазвичай не відмічають, що в умовах зниженої ФВ ЛШ спричинює зниження ударного об’єму та розвиток тахікардії. Тому зниження ФВ ЛШ є значимим прогностичним маркером при госпіталізації, незважаючи на можливе її швидке відновлення як під впливом лікування, так і самостійно [7, 51].
У даний час у клінічній практиці валідовано новітню методику ультразвукової діагностики — спекл-трекінг (СТ) ехоКГ. Застосування СТ-ехоКГ для діагностики міокардиту базується на оцінці деформації і швидкості деформації міокарда в поздовжньому, радіальному і циркулярному напрямках [21, 33, 42]. На сьогодні доведено, що запальне ураження міокарда характеризується зниженням глобальної систолічної деформації і її швидкості в поздовжньому напрямку, зниження показників циркулярної глобальної деформації є також характерним, але виявляється з меншою частотою [21, 41, 42].
Кардіальна МРТ
Магнітно-резонансна томографія (МРТ) є важливим та інформативним методом для діагностики та моніторингу міокардиту завдяки її здатності забезпечити детальну характеристику тканин серця, а також виявити та кількісно оцінити в них запальний та фібротичний компоненти. Крім того, МРТ є золотим стандартом для вимірювання бівентрикулярних об’ємів, ФВ та маси міокарда. Для верифікації ішемічної/неішемічної природи ураження серця та за умови відсутності протипоказань, МРТ серця рекомендовано пацієнтам із підозрою на ГМ або із кардіальним болем, інтактними коронарними артеріями та підвищенням рівня тропоніну [29]. МРТ серця необхідно проводити пацієнтам із фульмінантними формами міокардиту в період їх стабілізації для оцінки наявності залишків запального процесу та вираженості замісного фіброзоутворення [13]. Відомо, що за відсутності появи нових вогнищ запалення, вже через 4 тиж від початку захворювання відмічається тенденція до регресу тканинного набряку. Для надійного виключення чи підтвердження наявності запального процесу в міокарді МРТ серця доцільно виконувати через 2–3 тиж від появи симптомів, оскільки більш рання діагностика має недостатню інформативність [10, 29]. Доступність використання МРТ разом із визначенням високочутливого тропоніну дозволяє із високою точністю ідентифікувати хворих на ГМ більш легкого перебігу.
У 2009 р. консенсусною групою опубліковано критерії Lake Louise, згідно з якими визначено 3 ознаки запалення в міокарді та їх МРТ-еквіваленти: 1) гіперемія — зростання інтенсивності сигналу при ранньому підсиленні гадолінієм; 2) набряк тканин — збільшення міокардіального Т2 часу релаксації або підвищення інтенсивності сигналу на Т2 зважених зображеннях; 3) некроз/фіброз, що виявляються на знімках із відстроченим контрастуванням (ВК) гадолінійвмісними препаратами [29]. За наявності двох із 3 критеріїв діагноз ГМ вважався достовірним із чутливістю 74% та специфічністю 86%. Збільшення доказової бази щодо підвищення за допомогою МРТ-картування загальної діагностичної точності методу зумовило необхідність модифікації Lake Louise критеріїв. Так, в останній версії затверджено високу верифікаційну цінність Т2 картування для виявлення набряку, а також нативного Т1 та позаклітинного об’єму (ECV) для визначення запального пошкодження міокарда [28]. Згідно з даними останніх досліджень внесення доповнень у Lake Louise критерії посилило їх чутливість та специфічність до 87,5 та 96,2% відповідно [11, 19, 59, 77]. Для підтвердження наявності запалення в міокарді за умови значної клінічної підозри достатньо наявності навіть одного із зазначених критеріїв. У пацієнтів із первинною маніфестацією міокардиту або при шлуночкових аритміях нез’ясованої етіології МРТ-діагностика на основі визначення регіонального ВК дозволяє виявити запалення серцевого м’яза, однак при хронічному перебігу діагностична цінність такого підходу є невисокою [13, 44]. При первинному обстеженні пацієнта наявність ВК у середньому шарі міжшлуночкової перегородки в поєднанні з низькою ФВ ЛШ є сильним предиктором негативного прогнозу [47]. МРТ-спостереження за станом пацієнтів із ГМ зазвичай виконується через 6 та 12 міс після первинного епізоду. У динаміці клінічного перебігу ГМ зникнення набряку є звичайним явищем (більше 84% випадків), тоді як ВК тривало персистує (більше 89% випадків) [47].
В італійському багатоцентровому дослідженні за участю 189 хворих на ГМ вираженість ВК зменшувалася з 6,2% маси ЛШ в дебюті захворювання до 4,1% маси ЛШ 6 міс потому [11]. Інтенсивність ВК при міокардиті є непостійною величиною, яка на ранніх стадіях хвороби переважно пов’язана із гострофазним тканинним набряком, тоді як на пізніх етапах захворювання більшою мірою є відображенням замісного фіброзу [44, 47]. Наявність лише ВК без супутніх ознак набряку є несприятливою прогностичною характеристикою порівняно із повною відсутністю ВК, або ж сумісною появою обох проявів [28, 47]. Потенційне пояснення такого феномену полягає в тому, що персистенція набряку передбачає ймовірність активного запального процесу та високої вірогідності його подальшого розрішення під впливом патогенетичної терапії.
Високоінформативним є одночасне застосування СТ-ехоКГ та МРТ серця, оскільки обидві методики доповнюють одна одну: за допомогою МРТ серця виявляють запальні зміни в міокарді, а за допомогою СТ-ехоКГ можна оцінити тяжкість порушення скоротливої здатності тих сегментів серця, в яких власне виявлено ці запальні зміни. Так, в одному з недавніх досліджень показано, що в тих сегментах ЛШ, де виявлялося відстрочене субепікардіальне накопичення контрастного препарату, відзначалося достовірне зниження показників поздовжньої і циркулярної деформації міокарда [42]. Чутливість СТ-ехоКГ за результатами цього дослідження становила 87%, специфічність 71%, що доводить високу інформативність методу для характеристики порушення скоротливої здатності міокарда в локальних вогнищах запалення при міокардиті [41].
Позитронна-емісійна томографія
Позитронно-емісійну томографію (ПЕТ) не відносять до рутинних методів діагностики міокардиту. Метод може розглядатися як альтернатива для виявлення запального процесу у стабільних пацієнтів із протипоказаннями до МРТ або в осіб із системними аутоімунними захворюваннями, коли ймовірним є ураження й інших органів [20]. Використання ПЕТ має доцільність при кардіальному саркоїдозі (КС). Відомо, що Т-клітини, макрофаги, гранулоцити в інфільтраті міокарда внаслідок неспецифічної відповіді на пошкодження клітин чи прямого ураження при КС, характеризуються активним метаболізмом глюкози, що проявляється фокальним поглинанням 18-фтордеоксиглюкози [45, 57]. До того ж ПЕТ дозволяє виявляти гіперметаболічні медіастинальні та скелетні лімфовузли, що є диференційною ознакою КС від інших аутоімунних хвороб із ураженням серця (наприклад васкулітів) [16]. Такий підхід застосовують для моніторингу вираженості пошкодження та його динаміки в ході імуносупресивної терапії. Нещодавно розроблені вченими-онкологами імуно-ПЕТ-індикатори значно розширили можливості методу для виявлення ендогенних імунних клітин та дають нові перспективи його застосування й у хворих на міокардит [8].
Ендоміокардіальна біопсія
ЕМБ є загальновизнаним золотим стандартом діагностики міокардиту, проте метод має інвазивний характер та передбачає певні ризики. В експертних центрах постпроцедурні ускладнення з боку серця відмічають в 1–2% випадків та досягають 8,9% у клініках більш низької спеціалізації [8]. Чутливість ЕМБ при стандартному фарбуванні гематоксилін-еозином є відносно невисокою, особливо враховуючи можливе неспівпадіння точок забору матеріалу та вогнищ запалення. Інформативність методу може бути підвищена шляхом відбору зразків у більшій кількості, ніж мінімально рекомендовано (4–6 зразків). Додаткове застосування імуногістохімічних специфічних антитіл до лейкоцитів (СD45), макрофагів (СD68), Т-клітин (СD3), хелперів (СD4), цитотоксичних клітин (СD8) та В-клітин (СD19/СD20) також суттєво підвищує чутливість ЕМБ [8, 36]. У схвалених Європейським товариством кардіологів Марбурзьких критеріях використовується кількісний принцип, що також збільшує діагностичну користь ЕМБ. На основі цих критеріїв діагноз міокардиту може бути підтверджений за наявності у відібраних зразках >14 мононуклеарних лейкоцитів/мм2 із них >7 Т-лімфоцитів/мм2. Незважаючи на досить низьку чутливість методу, в деяких клінічних ситуаціях дані, отримані за допомогою ЕМБ, мають фундаментальний характер для розуміння патогенетичних механізмів та вибору тактики лікування [8].
Клінічними показаннями до проведення ЕМБ є:
1. ГМ із дебютом у вигляді гострої СН та кардіогенного шоку.
2. ГМ, який ускладнився вираженою кардіальною дисфункцією, гострою СН, шлуночковими аритміями або АВ-блокадою високого ступеня.
3. ГМ або підозрюваний ХДМ у поєднанні з периферичною еозинофілією.
4. ГМ або підозрюваний ХДМ із персистуючим або епізодичним зростанням рівнів біомаркерів кардіального некрозу. Особливо у разі супутньої наявної/підозрюваної аутоімунної патології, наявності шлуночкових аритмій або АВ-блокади високих градацій.
5. Міокардит в умовах лікування інгібіторами імунних контрольних точок (ІКТ), якщо діагноз є важливим для пацієнта, який отримує антинеопластичне лікування.
Діагностична цінність ЕМБ у хворих на ГМ вважається більшою при її виконанні упродовж 2 тиж з моменту появи симптомів у разі нормальних розмірів або легкого розширення ЛШ, за наявності певних маркерів (шлуночкових аритмій, АВ-блокади високого ступеня), а також в особливих випадках (гігантоклітинного міокардиту чи КС) [18]. ГМ у ряді випадків може розрішуватися самостійно та не потребувати тактики інвазивного втручання. Проте, за даними останніх досліджень за участю хворих на фульмінантний міокардит з тимчасовою механічною підтримкою циркуляції крові, ЕМБ навіть за наявності показань використовується недостатньо [78]. Також існують протиріччя щодо взаємозалежності між поширеністю запальних інфільтратів із прогнозом та об’ємом терапевтичного втручання. Хоча, за даними ретроспективного аналізу, пацієнти із лімфоцитарним міокардитом, які померли упродовж госпіталізації або потребували штучної підтримки кровообігу, характеризувалися наявністю більшої площі запальних вогнищ порівняно із пацієнтами, що вижили без потреби механічної підтримки циркуляції крові [8]. У табл. 3 наведено рекомендації щодо використання ЕМБ та кардіальної МРТ у різних клінічних ситуаціях [78].
Таблиця 3. Зіставлення кардіальної МРТ і ЕМБ в рутинній клінічній практиці
| Клінічний сценарій | Характеристика | МРТ серця | ЕМБ |
|---|---|---|---|
| Підозра на ГМ (≤30 днів від початку захворювання) | Кардіогенний шок | – | ++a,b |
| Ускладнений перебіг, систолічна дисфункція, або аритмії | ++ | -/(+)a,c | |
| Неускладнений перебіг, систолічна функція збережена, аритмії нема | + | +a,b | |
| Підозра на ХДМ (>30 днів від початку захворювання) | Синдром СН зі збереженою ФВ | ++с | +a,b |
| Синдром СН зі зниженою ФВ попри оптимальне лікування | ++с | ++a,b | |
| Значимі аритмії попри оптимальне лікування | ++с | ++a,b | |
| Підозра на ДКМП (тривалість хвороби міс і більше) | Зниження ФВ та розширення ЛШ невідомої етіології | ++a,b | ++a,b |
| У процесі спостереження | н/з | + | ++d |
Примітки: «-» — не рекомендовано; «+» — рекомендовано; «++» — високо рекомендовано; н/з — не застосовується; aдля диференційної діагностики, вибору специфічного лікування та селекції; bкардіальне МРТ або електроанатомічне картування для спрямування біотому при ЕМБ; cнегативний результат не виключає наявності низькоградієнтного запалення у пацієнтів із вираженими специфічними скаргами та рефрактерністю до лікування; dу пацієнтів із рефрактерністю до лікування для перевірки діагнозу, або виключення вірусної інфекції. ДКМП — дилатаційна кардіоміопатія.
Лікування
Важливою складовою успішного лікування СН є певні режимні заходи, що включають обмеження вживання рідини і солі, контроль маси тіла та діурезу на фоні проведення активної діуретичної терапії, що може включати як монотерапію, так і комбінацію різних груп препаратів [4, 62]. Обмеження фізичної активності є обов’язковим у веденні хворих, особливо в гострий період міокардиту, адже нині відомо, що фізичні навантаження можуть призводити до стимуляції реплікації вірусу в міокарді та активації симпато-адреналової системи, результатом чого є збільшення вираженості запального ушкодження серцевого м’яза [71]. Також пацієнтам з міокардитом необхідно проводити санацію вогнищ хронічних інфекцій за їх наявності та уникати переохолодження і контактів з особами, які мають гострі респіраторні вірусні інфекції.
Призначення терапії хронічної СН згідно із сучасними рекомендаціями, що включає інгібітори АПФ, а при їх непереносимості — блокатори рецепторів ангіотензину, та блокатори β-АР із титрацією доз до цільових або максимально переносимих, є основним підходом у лікуванні хворих на міокардит зі зниженою ФВ ЛШ і його дилатацією [62]. При недостатній ефективності і збереженні симптомів СН на фоні максимально переносимих або цільових доз цих препаратів до лікування додають спіронолактон або еплеренон. У пацієнтів із синусовим ритмом у разі неадекватного контролю частоти серцевих скорочень (ЧСС ≥ 70 уд./хв) на фоні прийому цільових або максимально переносимих доз блокаторів β-АР за наявності ФВ ЛШ ≤35% до лікування додають івабрадин, а при постійній формі фібриляції передсердь можливе застосування дигоксину [62]. Також у хворих на хронічну СН на сьогодні доведено ефективність застосування комбінації сакубітрилу і валсартану, яка є альтернативою інгібіторам АПФ [4, 71].
Антиаритмічні препарати, антикоагулянти, інотропні агенти, імплантація штучного водія ритму та/або кардіовертера-дефібрилятора, кардіоресинхронізувальна терапія призначаються за наявності відповідних показань, однак їх застосування не має певної специфіки для хворих на міокардит [4]. За наявності тяжкої резистентної до лікування СН розглядають питання про проведення кардіоресинхронізувальної терапії у пацієнтів із ФВ ЛШ <35% з повною блокадою лівої ніжки пучка Гіса або шириною комплексу QRS ≥150 мс [62].
Патогенетична терапія
За даними нещодавнього метааналізу, проведеного за медичними базами Medline, Embase, Cochrane та Chinese Biomedical Literature Database, у 342 хворих, які отримували імуносупресивну терапію, встановлено достовірно краще відновлення ФВ та кінцево-діастолічного розміру ЛШ, однак цей ефект не був достатньо стійким і не чинив достовірного впливу на частоту трансплантацій серця і показник виживання [49]. Вважається, що імуномодифікуюча та імуносупресивна терапія у хворих на міокардит може застосовуватися для відновлення ФВ ЛШ та зменшення його порожнини, особливо в разі недостатньої ефективності стандартної терапії СН, однак необхідні подальші дослідження.
Показанням до призначення імуносупресивної терапії при ГМ є тяжкий перебіг, що характеризується наявністю як мінімум 4 ознак із нижче перелічених [2, 4]:
- зниження систолічного артеріального тиску ≤90 мм рт. ст.;
- індекс кінцево-діастолічного об’єму ЛШ ≥95 мл/м² за результатами ехоКГ;
- зниження ФВ ЛШ <40% та/або зниження поздовжньої глобальної систолічної деформації ЛШ ≤9,0% за результатами СТ-ехоКГ;
- наявність ≥3,0 сегментів ЛШ, уражених запальними змінами або загального об’єму ураження ≥5,0 сегментів ЛШ (включаючи ВК);
- наявність епізодів нестійкої та/або стійкої ШТ, фібриляції передсердь, АВ-блокади ІІ ст. і вище;
- наявність ІІ або вищого ФК СН за NYHA;
- наявність антитіл до β1-АР та кардіального міозину.
Патогенетичне лікування проводиться за наступною схемою: дексаметазон 8 мг/добу вводиться внутрішньовенно крапельно протягом 5 днів. Далі переходять на пероральний прийом метилпреднізолону в дозі 0,25 мг/кг маси тіла на добу або преднізолону в еквівалентній дозі (0,31 мг/кг маси тіла) протягом 3 міс із подальшим зниженням дози на 1–2 мг щотижня до повної відміни. Загальний термін лікування і доза глюкокортикоїдів можуть бути скориговані залежно від клінічної ситуації [2, 4].
Застосування різних схем імуносупресивної та імуномодифікуючої терапії запальних уражень міокарда, зокрема хронічного аутоімунного міокардиту/запальної кардіоміопатії наведено в табл. 4 [69].
Таблиця 4. Схеми імуносупресивної та імуномодифікуючої терапії у хворих із запальними ураженнями міокарда
| Гігантоклітинний міокардит |
|
| Саркоїдоз серця |
|
| Еозинофільний міокардит |
|
| Хронічний аутоімунний міокардит/запальна кардіоміопатія |
|
| Ентеровірусна/аденовірусна кардіоміопатія |
|
| Рецидиви інфекційного процесу, зумовленого герпесвірусом 6-го типу |
|
Згідно з думкою експертів Європейського товариства кардіологів підходи до лікування віруснегативного та віруспозитивного ХДМ мають свої особливості.
Віруснегативний ХДМ. За даними клінічних досліджень, імуносупресивна терапія (преднізолон та азатіоприн) покращує кардіальну функцію у хворих на гістологічно підтверджений віруснегативний ХДМ [3, 4, 30, 56, 63]. Нещодавно в одноцентровому дослідженні виявлено, що у 53% хворих на ХДМ з відсутністю відповіді на терапію глюкокортикоїдами в зразках ЕМБ визначались CD20+ B-клітини [78]. З іншого боку, у 6 CD20+B-позитивних пацієнтів з відсутністю вірусного геному в біоптаті лікування ритуксимабом (химерні моноклональні антитіла до поверхневого антигену B-лімфоцитів CD20) зменшувало вираженість кардіальної дисфункції та СН, що відкриває нові перспективи для цієї категорії хворих. До альтернативних способів лікування віруснегативного або аутоімунного міокардиту відносять застосування циклоспорину або мофетилу мікофенолату на тлі базової терапії глюкокортикоїдами, а також імуноадсорбцію із подальшим внутрішньовенним введенням імуноглобуліну (ВВІГ) [53]. У пілотних дослідженнях отримано дані, що імуноадсорбція та ВВІГ спроможні покращувати кардіальну функцію у хворих на ХДМ та знижувати активність запального процесу в міокарді [64]. Однак ці нові дані потребують підтвердження в рандомізованих дослідженнях, які вже розпочато. Альтернативою імуноадсорбції є внутрішньовенне введення дрібних розчинних молекул (наприклад пептидів або аптамерів), які здатні специфічно та цілеспрямовано нейтралізувати антитіла до β1-АР [52]. Слід зазначити, що застосування такого підходу не залежить від наявності запалення в міокарді.
Віруспозитивний ХДМ. Важливо диференціювати вірус-індукований активний міокардит (аденовірусний, ентеровірусний) та вірусопосередкований міокардит (наприклад латентний перебіг герпесвірусної або В19-інфекції) — коли геном вірусу виявлено в зразках ЕМБ, але достеменно невідомо, що саме стало причиною запального процесу в міокарді. Нині бракує даних рандомізованих досліджень щодо ефективності противірусного лікування при вірусному ГМ. У дослідженні ВІСС (ІІ фаза) вивчалася ефективність імуномодуляції інтерфероном-β на вірусну елімінацію у пацієнтів із ХДМ (ентеровірусним, аденовірусним або парвовірус-В19 зумовленим) [70]. Після курсу інтерферонотерапії в біоптатах міокарда уражених аденовірусів та ентеровірусів не виявлено, тоді як таке лікування не асоціювалося зі зменшенням кількості геному парвовіруса В19. У хворих із латентною Епштейна — Бар, цитомегаловірусною та герпесвірусною інфекцією протигерпетичні лікарські засоби можуть бути корисними для зниження вірусного навантаження [78]. Комбіноване лікування імуносупресантами та противірусними препаратами у віруспозитивних пацієнтів на різних етапах хвороби потребує подальшого вивчення. ВВІГ зазвичай використовується у хворих із тяжкою парвовірус В19-віремією та ускладненим клінічним перебігом. За даними клінічних досліджень, у пацієнтів із гістологічно підтвердженим В19-міокардитом застосування ВВІГ асоціювалося із суттєвим клінічним покращенням та зниженням градації запального процесу, хоча і не супроводжувалося ерадикацією вірусу із міокарда [53].
Новітні противірусні препарати для боротьби із парвовірусом В19 (цидофовір, бринцидофовір, флавоноїди та гідроксисечовина) нині знаходяться на стадії випробувань, тому етіологічного лікування В19-асоційованого ХДМ сьогодні немає. Існує консенсус, що у разі невеликої кількості вірусних часток В19 у тканинах серця та відсутності кардіального запалення необхідності в терапевтичному втручанні немає [78]. У невеликих оглядових дослідженнях отримано дані щодо позитивного ефекту імуносупресивного лікування у хворих із запальним процесом у міокарді та низьким вірусним навантаженням (дослідження CaPACITY), які потребують валідації у великих плацебо-контрольованих програмах [78]. Таким чином, метод імуноадсорбція+ВВІГ нині залишається єдиним безпечним та клінічно ефективним заходом при В19 та герпесвірус 6-позитивному ХДМ.
Застосування нестероїдних протизапальних препаратів (НПЗП) у хворих на міокардит може бути рекомендовано тільки у випадку запального ураження перикарда, тобто за наявності периміокардиту, причому перевагу слід надавати ібупрофену та ацетилсаліциловій кислоті [18, 73]. В інших випадках НПЗП не застосовують і навіть не згадують у сучасній світовій літературі як групу препаратів, що має перспективи щодо застосування у хворих на міокардит, — це можна пояснити тим, що застосування НПЗП супроводжується затримкою натрію і рідини в організмі і посиленням проявів СН.
Характеристика різних варіантів міокардиту
Хронічний дифузний міокардит
ХДМ варто запідозрити за наявності незначно підвищеного рівня тропоніну, розширення порожнини ЛШ у поєднанні з нормальною/незначно збільшеною товщиною його стінки.
Результати МРТ та ЕМБ в таких умовах свідчитимуть про наявність залишків запалення та замісного фіброзоутворення [10]. Хворі на ХДМ зазвичай мають ознаки хронічної СН, відносно стабільну гемодинаміку та можуть отримувати лікування як при дилатаційній кардіоміопатії (ДКМП). Дані анамнезу, наявність відхилень на ЕКГ (таких як низький вольтаж, розширення комплексу QRS у периферичних відведеннях, незначні порушення провідності та неспецифічні зміни сегмента ST і зубця T), персистенція низькоградієнтного підвищення рівня тропоніну, а також недостатня відповідь на стандартне лікування СН повинні спонукати до розгляду можливості запального генезу захворювання [18, 61]. Наявність великої кількості лімфоцитів та/або макрофагів у біоптаті за даними ЕМБ має дуже високу прогностичну цінність для хворих на ХДМ на період наступного десятиріччя та передбачає підвищений ризик летальності чи необхідність трансплантації серця [18]. У той же час необхідно оцінювати ступінь замісного фіброзоутворення, оскільки його вираженість пов’язана із можливістю одужання. Експертами Європейського товариства кардіологів для визначення можливостей імуносупресивної терапії рекомендовано в зразках міокарда додатково визначати наявність кардіотропних вірусів (РНК ентеровірусів та ДНК аденовірусів), бактерій та паразитів методом кількісної ПЛР в реальному часі [16, 18].
ІКТ-асоційований міокардит
Впровадження в клінічну практику інгібіторів імунних контрольних точок (ІКТ) докорінно трансформувало лікування близько 20 різних типів раку [37]. Частка хворих на онкопатологію, яким показана ІКТ-терапія, зросла з 1,5% у 2011 р. до ≈50% у 2020 р. В основі методу лежить застосування моноклональних антитіл для блокади імунних регуляторів, зокрема CTLA-4 (від англ. cytotoxic T-lymphocyte antigen-4 — антиген 4 цитотоксичних Т-лімфоцитів), PD-1 (від англ. programmed death — програмована смерть) та його рецептора на дендритній клітині (PD-1 (від англ. programmed death ligand 1 — ліганд програмованої смерті (ПС-Л1)), активація яких пригнічує імунну відповідь на чужорідний білок [37, 78]. Блокуючи ці контрольні точки від зв’язування з білками-партнерами, ІКТ пригнічують сигнал вимкнення, активуючи Т-клітини та сприяючи знищенню ракових клітин. Проте активація імунітету може призводити до побічних ефектів аутоімунного характеру (наприклад коліти, дерматити та пневмоніти).
У зв’язку із ширшим впровадженням у клінічну практику ІКТ пропорційно збільшилася кількість повідомлень про нові випадки ІКТ-асоційованого міокардиту. За даними аналізу найбільшої вибірки пацієнтів із ІКТ-асоційованим міокардитом (122 випадки), для його перебігу характерними є рання клінічна маніфестація (від ініціації ІКТ-терапії до появи симптомів медіана становила 30 днів) та більш ніж 50% летальність [78]. Тож пацієнтам перед початком терапевтичного курсу ІКТ (наприклад ніволумаб або іпілімумаб) варто оцінити рівень тропоніну в крові та провести ЕКГ-обстеження. Надалі, в перші 6 тиж лікування, контроль вмісту тропоніну в крові необхідно виконувати щотижня. Зважаючи на часте поєднання ІКТ-міокардиту із розвитком міозиту, за наявності підозри важливим є діагностичний пошук у цьому напрямку (в тому числі визначення креатинфосфокінази в крові та, можливо, біопсії скелетних м’язів).
Терапією вибору ІКТ-асоційованого міокардиту є внутрішньовенне введення високих доз глюкокортикоїдів, оскільки, за даними досліджень, таке лікування асоціюється із зростанням частки одужання [8, 37]. Препаратами другого ряду запропоновано алемтузумаб (анти-CD52 антитіла), антитимоцитарний імуноглобулін (анти-CD3 антитіла) та абатацепт (CTLA-4 агоніст) [37]. У подальшому застосування преклінічних моделей може поглибити розуміння природи ІКТ-асоційованого міокардиту та удосконалити профілактично-терапевтичні заходи.
Еозинофільний міокардит
ЕМ вважається рідкісною, проте часто нерозпізнаною патологією, тож дані щодо його поширеності можуть бути заниженими. У випадку фульмінантного перебігу ЕМ частка летальних випадків та необхідності трансплантації серця на період 60 днів після виписки із стаціонару перевищує 26% [8].
ЕМ зазвичай асоціюється із гіперчутливістю до певних хімічних речовин (зокрема клозапіну, карбамазепіну, міноцикліну, β-лактамів та в одиничних випадках до вакцинації), системних передумов, таких як еозинофільний гранулематоз із поліангіїтом (ЕГПА; раніше синдром Чарга — Стросса), гіпереозинофільним синдромом (ГЕС; ідіопатичним чи клональним) або паразитарною інвазією (зазвичай Toxocara Canis, шлях передачі — сире м’ясо) [16, 32]. Нечасто ЕМ може виступати як паранеопластичний процес при раку солідних органів (наприклад рак легені). Перебіг ЕМ розподіляють на 3 фази: фаза початкового запалення, некротична фаза (відмічається під час ГМ), фаза тромбозів та фіброзного ремоделювання ендоміокарда (типово для кардіопатії Лефлера) [8].
ЕМ уражує переважно осіб середнього віку чоловічої та жіночої статі із маніфестацією у вигляді болю в грудях, задишки та проявів систолічної дисфункції серця. У той же час різноманіття етіологічних чинників передбачає варіації можливого перебігу ЕМ. Зокрема, лихоманка та шкірний висип є характерними для ЕМ гіперсенситивного походження, тоді як бронхіальна астма зазвичай є симптомом ЕГПА. Наявність еозинофілії є важливим критерієм для підтвердження діагнозу, проте у 26% хворих на етапі госпіталізації її не виявлено [32]. ЕхоКГ та МРТ дозволяють оцінити кардіальну функцію та виявити наявність тромбів (у першу чергу в ділянці верхівки ЛШ), що в більшості випадків відмічається при ГЕС- (29% випадків) та ЕГПА-асоційованому (19% випадків) ЕМ [8]. На противагу типовому субепікардіальному пізньому накопиченню гадолінію при інших формах міокардиту у випадку ЕМ зазвичай має місце субендокардіальна локалізація МРТ-контрасту [16].
Попри недостатню кількість рандомізованих досліджень, у нещодавньому метааналізі 179 випадків ЕМ відмічали нижчі показники госпітальної смертності при застосуванні кортикостероїдів [32]. У той же час необхідно спрямувати діагностичні та терапевтичні зусилля на першопричину ЕМ. Зокрема, при лікуванні ЕМ внаслідок гіперчутливості введення глюкокортикоїдів необхідно проводити одночасно з елімінацією специфічної речовини-антигену. У випадку токсокарозасоційованого ЕМ разом із кортикостероїдною терапією призначається альбендазол, тоді як при мієлопроліферативному варіанті ГЕС препаратом вибору є іматиніб [78]. При лікуванні ЕГПА- та ГЕС-асоційованого ЕМ розглядають комбіноване застосування кортикостероїдів та циклофосфаміду, азатіоприну або метотрексату [69, 78]. На сьогодні частота рецидивування ЕМ є невідомою, проте зафіксовано випадки фатальних рецидивів. Пацієнти із ГЕС та ЕГПА знаходяться в групі ризику віддалених рецидивів, особливо у разі відміни імуносупресивної терапії [32].
Гігантоклітинний міокардит (ГКМ)
ГКМ є формою швидкопрогресуючого некротизуючого міокардиту із несприятливим прогнозом та смертністю ≈85% [8]. Частка ГКМ становить 1 на 200 випадків усіх міокардитів та близько 10% при фульмінантному перебігу [8].
В основі генезу ГКМ лежить масивне ураження тканин міокарда цитотоксичними Т-лімфоцитами, макрофагами, гігантськими клітинами та еозинофілами, що зумовлює дисфункцію ЛШ та розвиток шлуночкових аритмій [16]. У 20% випадків ГКМ виявляють супутні аутоімунні порушення, зокрема запальні захворювання товстого кишечнику та щитовидної залози [16].
ГКМ однаково поширений серед чоловіків та жінок. Вікова медіана маніфестації захворювання є вищою, ніж у випадку ЕМ, та лежить у діапазоні 43–53 років [31]. Першими проявами ГКМ нерідко є гостра СН, кардіогенний шок із ШТ або повною АВ-блокадою. Зазвичай основним діагностичним інструментом є ЕМБ, за даними якої при ГКМ та КС можуть відмічати деякі подібні гістологічні ознаки, що утруднює диференційну діагностику [8, 31].
Негайний старт імуносупресивної терапії є вкрай важливим. У пацієнтів, що не потребують механічної підтримки гемоциркуляції, лікування інгібітором кальциневрину та анти-Т-лімфоцитарними препаратами (наприклад антитимоцитарний глобулін) дозволяє досягнути клінічної ремісії більш ніж у ⅔ випадків [8, 52]. Рекомендовано прийом оральних глюкокортикоїдів у дозуванні 1 мг/кг маси тіла із поступовим зниженням дози упродовж 1 року лікування. У той же час курс прийому циклоспорину, як правило, становить >2 років із дотриманням цільового плазмового рівня в межах 80–100 нг/л [8, 69]. Додатково може бути застосовано азатіоприн (1–2 мг/кг маси тіла на добу у 2 прийоми), або мофетилу мікофенолат (500–1000 мг 2 рази на добу). Пацієнти із ГКМ характеризуються високим ризиком розвитку ШТ, тож навіть після повного видужання зазвичай потребують імплантації кардіовертера-дефібрилятора [52, 69]. У цілому застосування комбінованої імуносупресивної терапії дозволило збільшити однорічне виживання пацієнтів із ГКМ без трансплантації серця з 11% за попередніми даними до 55% на сьогодні [72]. Однак трансплантація серця є ефективним методом лікування, який вирівнює шанси постхірургічного виживання хворих на ГКМ та при інших кардіальних хвороб [8].
Кардіальний саркоїдоз (КС)
Поширеність саркоїдозу у світі коливається від 4,7 до 64 випадків на 100 тис. населення [8]. Найбільша частка уражених виявлена серед мешканців Північної Європи та осіб афроамериканського походження, особливо жіночої статі.
Саркоїдоз є мультисистемним гранулематозним захворюванням із невідомою етіологією. Нині накопичені спостереження дозволяють припускати, що в основі розвитку даної патології лежить імунологічна відповідь на невстановлений антиген у генетично схильних осіб. У більшості пацієнтів виявляється ураження легень та лімфатичних вузлів, хоча поширення патологічного процесу на інші органи є звичайним явищем. Клінічні прояви ураження серця виявляють у 5% хворих на системний/легеневий саркоїдоз [8]. Для саркоїдозного міокардиту характерна інфільтрація тканин серця активованими макрофагами, що в деяких випадках спричинює розвиток хронічного запального процесу, замісного фіброзоутворення та безнекротичних гранульом [16]. Макрофаги саркоїдних гранульом трансформуються до епітеліоїдної форми із утворенням багатоядерних гігантських клітин. Наявність у міокарді еозинофілів та некрозу визначається вкрай рідко.
У більшості випадків КС виявляють у пацієнтів віком 25–60 років. До трьох основних проявів маніфестації КС відносять порушення провідності, розвиток шлуночкових аритмій та СН. Нині з’являється все більше даних про те, що КС може бути первинним клінічним проявом системного саркоїдозу. Зокрема, у 16–35% пацієнтів із виниклою повною АВ-блокадою або ШТ невідомої етіології виявлено раніше не діагностований саркоїдоз, зазвичай при КС уражуються вільна базальна стінка ЛШ та міжшлуночкова перегородка [8]. Для підтвердження діагнозу необхідними є гістологічна верифікація саркоїдозу серця або іншого органу, а також наявність ознак ураження серця, виявленого за допомогою МРТ серця або ПЕТ [16].
Більшість фахівців вважають виправданим застосування глюкокортикоїдів у хворих на КС [8, 63, 69]. Проте стандарти їх дозування та оптимальний спосіб оцінки відповіді на лікування чітко не визначені. Крім того, достеменно не відома необхідність терапевтичних заходів у пацієнтів без клінічних проявів захворювання. У випадках рефрактерності та виражених побічних явищ до лікування кортикостероїдами препаратом другої лінії зазвичай є метотрексат [8, 69]. Інші терапевтичні підходи, що можуть застосовуватися при КС, включають азатіоприн, циклофосфамід, інфліксимаб та рідко — ритуксимаб [69]. Пацієнти із КС знаходяться в групі ризику щодо РКС, проте дані щодо можливості зниження такої вірогідності є обмеженими. Варто відзначити, що КС може рецидивувати в трансплантованому серці. Зрештою в нещодавньому загальнонаціональному дослідженні, проведеному в США, за участю 102 пацієнтів із КС 10-річне виживання становило 92,5% [8]. Тож основними невирішеними питаннями щодо терапевтичної тактики при КС є розподіл лікарських засобів у першу та другу лінію лікування та необхідність медикаментозного втручання при безсимптомному його перебігу.
COVID-19-асоційований міокардит
У сучасних умовах пандемії COVID-19 з’являється все більше даних про SARS-CoV-2-асоційований міокардит, тому окремо зупинимося на ролі коронавірусів як можливої причини запального ураження міокарда. До сімейства коронавірусів відносять 4 групи: альфа-коронавіруси, бета-коронавіруси, гамма-коронавіруси та дельта-коронавіруси [78]. Альфа-коронавіруси та бета-коронавіруси тривало циркулюють у людській популяції та зазвичай викликають легкі респіраторні захворювання. У противагу цьому MERS-CoV, SARS-CoV та SARS-CoV-2 нещодавно проникли із тваринного світу та стали чинником тяжкого респіраторного синдрому [68]. Передумовами для негативного прогнозу у хворих на COVID-19 є вік старше 60 років, чоловіча стать та наявність коморбідної патології (включаючи артеріальну гіпертензію та ожиріння) [67, 68].
Незалежними сильними факторами ризику летального наслідку є кардіальне ушкодження (виявлене за зростанням вмісту тропоніну в сироватці крові), підвищення плазменного рівня D-димеру та інтерлейкіну-6, а також розвиток гострого респіраторного дистрес-синдрому в процесі захворювання [67]. Вірогідно, в основі пошкодження міокарда при COVID-19 лежить ураження тканин серця внаслідок «цитокінового шторму» і розбалансування відповіді Т-хелперів 1-го та 2-го типу (TH1 та TH2 відповідно), а також вплив гіпоксемії на тлі респіраторної дисфункції [58, 78, 81]. Додатковим патогенетичним механізмом є зниження активності вісі АПФ2 — ангіотензин (1–7) та її кардіопротекторних ефектів як контррегулятора сигналу ангіотензину II [78]. Відомо, що проникнення коронавірусів та зокрема SARS-CoV-2 в середину клітин здійснюється шляхом взаємодії з рецептором АПФ 2-го типу. Проникнення SARS-CoV-2 у клітину-хазяїна потребує зв’язування вірусного спайкового білка з АПФ2 та опосередковується TMPRSS2, катепсином В, катепсином L та сериновими протеазами клітини-хазяїна [78]. TMPRSS2 широко представлений у клітинах легень та, вірогідно, відіграє важливу роль у вірусній інвазії. Групою вчених Європейського товариства кардіологів на підставі аналізу біоптату тканин міокарда хворого на ХДМ виявлено, що в КМЦ, перицитах та фібробластах переважає експресія АПФ2 за відсутності TMPRSS2 [78]. Крім того, SARS-CoV-2 виявлений у міокардіальних макрофагах, що свідчить про здатність вірусу проникати в тканини серця в період транзиторної віремії або через інфільтрацію інфікованих макрофагів у міокард [67]. Зафіксовані дані щодо наявності вірусних часток в ендотелії, накопичення запальних клітин у міокарді, а також їх загибель, що, вірогідно, є наслідком ендотеліту.
Тим не менше донині розвиток класичного гострого лімфоцитарного міокардиту та лімфоцитарного ХДМ у пацієнтів з COVID-19 не підтверджено. Вважається, що сам по собі SARS-CoV-2 не здатен викликати ураження КМЦ, однак може слугувати тригером, що запускає імунопатологічні реакції клітинного і гуморального імунітету, що призводять до «цитокінового шторму» й розвитку аутоімунного міокардиту [58, 81]. Проте необхідним є подальший пошук у напрямку вивчення SARS-CoV-2-інфекції та можливості розвитку асоційованої з ним кардіальної патології.
Алгоритм ведення хворих з міокардитом, асоційованим з перенесеною COVID-19 інфекцією, затверджений на XXI Національному конгресі кардіологів України (2020), який включив рекомендовані підходи щодо діагностики і лікування:
Діагностика
1) Оцінка симптомів (задишка, біль у грудній клітці, поява тахікардії/аритмій, проявів СН).
2) Лабораторні дослідження (тест на тропоніни та натрійуретичний пропептид (NT-proBNP), імунологічні дослідження).
3) Інструментальні дослідження (ЕКГ, ехоКГ в динаміці, МРТ серця, комп’ютерна томографія коронарних судин або коронарографія, ЕМБ).
Підходи до лікування
1) Слід уникати застосування препаратів з негативним інотропним ефектом при синусовій тахікардії.
2) Не рекомендується застосування НПЗП.
3) При лікуванні СН і кардіогенного шоку додатково до стандартних протоколів можуть бути застосовані тоцилізумаб або сирілумаб для зменшення наслідків «цитокінового шторму». Можуть застосовуватися глюкокортикоїди та внутрішньовенний імуноглобулін.
4) У разі наявності брадиаритмії рекомендується встановлення штучного водія ритму.
5) За наявності шлуночкових тахіаритмій розглядається питання про встановлення кардіовертера-дефібрилятора та застосування антиаритмічних засобів.
На сьогодні накопичено недостатньо клінічного досвіду щодо особливостей перебігу міокардиту, який розвивається після перенесеної COVID-19-інфекції, однак отримано дані, що свідчать про частий розвиток шлуночкових порушень ритму, зокрема частої шлуночкової екстрасистолії та епізодів ШТ, причому їх наявність має прямий зв’язок із кількістю сегментів ЛШ, в яких визначалися запальні зміни та/або ВК [68]. Показано, що застосування 6-місячного курсу терапії ГК у 32 хворих з тяжким міокардитом зі зниженою ФВ ЛШ, що розвинувся в середньому через 1,5 міс після перенесеної COVID-19-інфекції, є ефективним для зменшення дилатації і поліпшення скоротливої здатності ЛШ та призводило до значного зменшення кількості сегментів ЛШ, уражених запальними змінами [6]. Слід також наголосити, що застосування НПЗП не рекомендується, оскільки вони можуть погіршити перебіг COVID-19, призвести до затримки натрію в організмі і погіршити перебіг ниркової недостатності [74].
Інноваційні терапевтичні стратегії
Пацієнти із міокардитом, які є резистентними до загальнорекомендованого нейрогормонального лікування та гемодинамічної корекції, є потенційними відповідачами на терапію, спрямовану на інші ланки імунного компонента хвороби. Результати останніх досліджень свідчать, що в умовах ХДМ можуть бути активовані різні шляхи передачі сигналів. Варто відзначити, що в дизайні сучасних клінічних випробувань враховано помилки попередніх досліджень, зокрема відсутність ефективності високих доз інгібіторів ФНП у пацієнтів із систолічною СН. Нові покоління терапевтичних засобів передбачають системний та персоналізований підхід до таргетної терапії у хворих на ХДМ, а також спрямовані на мінімізацію токсичності та підвищення ймовірності одужання:
- розчинні анти-CAR антитіла (CAR — від англ. сhimeric antigen receptor — химерний рецептор антигену). Терапія розчинними CAR, зв’язаними із карбоксильною групою IgG людини, що знижує поглинання клітиною вірусних часток, асоціювалася із призупиненням розвитку гострого та хронічного Коксакі В3-асоційованого міокардиту у мишей [52, 78]. Потенційна користь для людини цього методу лікування потребує подальшого вивчення в клінічних дослідженнях;
- антитіла до рецептора IЛ-1β. Нещодавні дослідження на тваринах показали ключову роль активації NLRP3 iнфламасом із подальшою продукцією ІЛ-1β в патогенезі вірусного та аутоімунного міокардиту [76]. Лікування мишей із ентеровірусною інфекцією антитілами до ІЛ-1β попереджало у них розвиток хронічного вірусного міокардиту шляхом пригнічення запалення, інтерстиціального фіброзу та кардіального ремоделювання. В одному клінічному випробуванні та в серії клінічних випадків визначався позитивний ефект моноклональних антитіл до ІЛ-1β при лікуванні рекурентного периміокардиту [76]. Дизайн нині триваючих досліджень ARAMIS та RHAPSODY покликаний визначити клінічну ефективність ІЛ-1β-блокуючих агентів у хворих із поєднанням міокардиту та перикардиту [78];
- антитіла до ІЛ-17. Результати експериментальних та клінічних досліджень свідчать, що вираженість ІЛ-17-асоційованих ефектів та активація профібротичних механізмів поєднується із зростанням летальності у мишей із Коксакі В3-індукованим міокардитом та є обернено пропорційною частоті одужання хворих з ХДМ [52]. Існують дані, що T-хелпери 17-го типу зумовлюють прогресування ХДМ у мишей, тоді як T-регуляторні клітини призупиняють розвиток міокардиту шляхом пригнічення запалення. Нині планується проведення клінічного випробування у хворих на міокардит препарату секукінумабу — моноклональних антитіл до ІЛ-17 [31];
- клітинна терапія. Застосування T-регуляторних клітин, або агоністів ІЛ-2 (які зумовлюють продукцію T-регуляторних клітин, а також підвищують виживання та супресорну функцію уже зрілих їх форм) в лікуванні міокардиту є потенційним альтернативним методом імуномодуляції та підвищення співвідношення Т-регуляторних/Т-хелперів-17 [14, 78]. Іншим перспективним напрямком лікування ХДМ є введення мезенхімальних стовбурових клітин, які в експериментальних дослідженнях міокардиту на мишах демонструють здатність підвищувати кількість Т-регуляторних клітин та модулювати кардіоспленальну вісь. Терапія алогенними мезенхімальними стовбуровими клітинами вже зарекомендувала себе в дослідженні POSEIDONDCM як безпечний та ефективний спосіб лікування ДКМП [78]. У цьому випробуванні отримано значиме покращення систолічної функції в усіх пацієнтів, за винятком осіб із генетично детермінованими формами, що зумовлює важливість оцінки генетичного профілю перед застосуванням такого роду терапії. Крім того, клінічна відповідь на лікування поєднувалася із суттєвим зниженням вмісту циркулюючого ФНП-α, що дозволяє припустити важливість імуномодуляції для корекції перебігу хвороби. Об’єднавши всі дані, можна зробити висновок, що клітинна терапія є перспективним напрямком для вивчення та потенційно ефективним заходом при лікуванні ХДМ;
- канабідіол та антагомір. Нині шляхом вивчення в експериментальній моделі міокардиту оцінюють потенційні можливості лікування канабідіолом та хімічно модифікованим олігонуклеотидом — антагоміром, або анти-miRs (блокує зв’язування молекул із мРНК) [78]. Антагомір як при системному, так і при локальному застосуванні може пригнічувати запальний процес та вірусну реплікацію [78].
Засоби гемодинамічної підтримки і трансплантація серця
Пацієнти з ГМ, ускладненим рефрактерною СН і кардіогенним шоком, можуть потребувати застосування засобів гемодинамічної підтримки (ЗГП) та інотропних лікарських препаратів. До ЗГП відносять венозно-артеріальну екстракорпоральну мембранну оксигенацію (ЕКМО), внутрішньоаортальну балонну контрапульсацію (ВАБК), інтрааортальну аксіальну пульсацію (ІАП), імплантовані шлуночкові допоміжні пристрої TandemHeart та ProtekDuo, мікроаксіальні насоси на основі катетера Impella [8, 78]. Оскільки в багатьох випадках можна очікувати розрішення запального процесу в міокарді, тимчасове використання ЗГП — ВАБК, ЕКМО та ІАП може бути доцільним у певних клінічних ситуаціях. За даними обсерваційних досліджень та багатоецентрових регістрів, застосування ЗГП підвищує показник виживання хворих з фульмінантним міокардитом без необхідності проведення трансплантації серця з 55 до 80% [8]. Аналіз клінічних випадків міокардиту в США в період з 2005 по 2014 р. показав зростання частоти застосування ЗГП з 4,5 до 8,6% за винятком ВАБК [8]. Теоретично використання ІАП в поєднанні з ЕКМО покращує прогноз щодо виживання хворих з тяжким міокардитом порівняно із застосуванням лише одного методу гемодинамічної підтримки. Однак за даними багатоцентрових регістрів застосування ІАП (34 хворих на фульмінантний міокардит з 2009 по 2016 р.) порівняно з ЕКМО (185 хворих на фульмінантний міокардит з 2001 по 2011 р.) мало приблизно однакову ефективність щодо виживання пацієнтів (62 і 61% відповідно) [8, 9]. У разі відсутності позитивної динаміки протягом 2–3 тиж використання ЗГП рекомендовано проведення трансплантації серця або застосування засобів довготривалої гемодинамічної підтримки.
Невирішені питання і перспективи
Стосовно діагностики, прогнозування перебігу і лікування ГМ та ХДМ донині залишається багато невирішених питань [18, 61]. ЕМБ, залишаючись золотим стандартом верифікації діагнозу міокардиту, виконується недостатньо часто або залишається недоступною в більшості кардіологічних центрів світу, а застосування лише гістологічних критеріїв має низьку чутливість. Таким чином, на сьогодні існує потреба як у пошуку новітніх гістологічних біомаркерів міокардиту, так і в удосконаленні методів візуалізації запальних змін міокарда. Перспективними в плані вивчення тканини міокарда є сучасні імуноонкологічні методи дослідження — мультимодальна імунофлуоресценція, масс-цитометрія, секвенування клітинної РНК, високочастотне секвенування рецепторів Т-клітин та ін. З метою стандартизації діагностичних та терапевтичних підходів до ГМ та ХДМ необхідні великі проспективні дослідження та створення масштабних регістрів. Для виявлення пацієнтів високого ризику (з наявністю аритмій, високою вірогідністю рецидивів або трансформації захворювання в ДКМП) і кандидатів на проведення трансплантації серця найбільш перспективним є створення спеціальних регістрів таких хворих. Необхідні дослідження, спрямовані на вивчення патогенних механізмів запального ураження серцево-судинної системи, пов’язаної з SARS-CoV-2, і розробка вакцин проти вірусів щодо профілактики в тому числі міокардиту. І нарешті, уніфікація термінології і підходів до діагностики і клінічного моніторингу хворих на ГМ та ХДМ може удосконалити тактику ведення і підвищити частоту виживання таких пацієнтів.
Конфлікту інтересів немає
Список використаної літератури
- 1. Гавриленко Т.І., Чернюк С.В., Підгайна О.А. та ін. (2019) Визначення діагностичної і прогностичної ролі імунологічних біомаркерів у пацієнтів з міокардитом. Світ медицини та біології, № 2(68): 34–39. doi: 10.26724/2079–8334–2019–2-68–34–39.
- 2. Коваленко В.М., Лутай М.І., Сіренко Ю.М., Сичов О.С. (2020) Серцево-судинні захворювання: класифікація, стандарти діагностики та лікування. 239 с.
- 3. Коваленко В.М., Несукай О.Г., Чернюк С.В. та ін. (2019) Імуносупресивна терапія у хворих на міокардит: обгрунтування для використання в клінічній практиці. Український кардіологічний журнал, № 4: 18.
- 4. Коваленко В.М., Несукай О.Г., Чернюк С.В. та ін. (2020) Лікування міокардиту: сучасні підходи та перспективні напрямки. Український кардіологічний журнал, № 6: 61—70.
- 5. Коваленко В.М., Несукай О.Г., Чернюк С.В. та ін. (2020) Діагностика міокардиту як одна з актуальних проблем кардіології. Український кардіологічний журнал, № 4: 78—89.
- 6. Коваленко В.М., Несукай О.Г., Тітова Н.С. та ін. (2021) COVID-19-асоційований міокардит: власний досвід патогенетичного лікування. Український кардіологічний журнал, № 3 (прийнято до друку).
- 7. Чернюк С.В. (2019) Динамічні зміни структурно-функціонального стану серця у хворих на гострий міокардит. Запорізький медичний журнал, № 5 (21): 576—581. DOI: 10.14739/2310–1210.2019.5.179404.
- 8. Ammirati E., Frigerio M., Adler D.E. et al. (2020) Management of Acute Myocarditis and Chronic Inflammatory Cardiomyopathy. Circ. Heart Fail., Vol. 13: e007405. DOI: 10.1161/CIRCHEARTFAILURE.120.007405.
- 9. Ammirati E., Veronese G., Bottiroli M. et al. (2020) Update on acute myocarditis. Trends in Cardiovascular Medicine. doi: 10.1016/j.tcm.2020.05.008.
- 10. Arnold J.R., McCann G.P. (2020) Cardiovascular Magnetic Resonance: Applications and Practical Considerations for the General Cardiologist. Heart, Vol. 106(3): 174–181. doi: 10.1136/heartjnl-2019–314856.
- 11. Aquaro G.D., Habtemicael G.Y., Camastra G. et al. (2019) Prognostic Value of Repeating Cardiac Magnetic Resonance in Patients With Acute Myocarditis. J. Am. Coll. Cardiol., Vol. 74(20): 2439–2448. DOI: 10.1016/j.jacc.2019.08.1061.
- 12. Beling A., Kespohl M. (2018) Proteasomal Protein Degradation: Adaptation of Cellular Proteolysis With Impact on Virus-and Cytokine-Mediated Damage of Heart Tissue During Myocarditis. Front Immunol., Vol. 9: 2620. doi: 10.3389/fimmu.2018.02620.
- 13. Bettencourt N. (2019) Cardiac Magnetic Resonance in Myocarditis — Do We Need More Tools? Rev. Port. Cardiol., Vol. 38(11): 777–778. doi: 10.1016/j.repc.2020.01.002.
- 14. Błyszczuk P. (2019) Myocarditis in Humans and in Experimental Animal Models. Front Cardiovasc Med., Vol. 6: 64. doi: 10.3389/fcvm.2019.00064.
- 15. Blauwet L.A., Cooper L.T. (2016) Myocarditis. Prog. Cardiovasc. Dis., Vol. 52(4): 274–88. DOI: 10.1016/j.pcad.2009.11.006.
- 16. Caforio A.L.P., Adler Y., Agostini C. et al. (2017) Diagnosis and management of myocardial involvement in systemic immune-mediated diseases: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Disease. Eur. Heart J., Vol. 38(35): 2649–2662. doi: 10.1093/eurheartj/ehx321. PMID: 28655210.
- 17. Caforio A.L., Malipiero G., Marcolongo R. et al. (2017) Myocarditis: a clinical overview. Curr. Cardiol. Rep., Vol. 19(7): 63. doi: 10.1007/s11886–017–0870-x.
- 18. Caforio A.L., Pankuweit S., Arbustini E. et al. (2013) Current state of knowledge on aetiology, diagnosis, management and therapy of myocarditis: a position statement of the ESC Working group on myocardial and pericardial diseases. Eur. Heart J., Vol. 34(33): 2636–48. doi: 10.1093/eurheartj/eht210.
- 19. Cecco C.N.D., Monti C.B. (2020) Use of Early T1 Mapping for MRI in Acute Myocarditis. Radiology, Vol. 295(2): 326–327. doi: 10.1148/radiol.2020200171.
- 20. Chen W., Jeudy J. (2019) Assessment of Myocarditis: Cardiac MR, PET/CT, or PET/MR? Curr. Cardiol Rep., Vol. 21(8): 76. doi:10.1007/s11886–019–1158–0.
- 21. Cherniuk S. (2019) Speckle-tracking parameters as predictors of left ventricular systolic dysfunction in patients with myocarditis. Zaporozhye medical journal Запорізький медичний журнал, Vol. 5 (21): 576—581. DOI: 10.14739/2310–1210.2019.5.179404.
- 22. Chimenti C., Verardo R., Scopelliti F. et al. (2017) Myocardial expression of Toll-like receptor 4 predicts the response to immunosuppressive therapy in patients with virus-negative chronic inflammatory cardiomyopathy. Eur. J. Heart Fail., Vol. 19(7): 915–925. doi: 10.1002/ejhf.796.
- 23. Corsten M., Heggermont W., Papageorgiou A.P. et al. (2015) The microRNA-221/-222 cluster balances the antiviral and inflammatory response in viral myocarditis. Eur. Heart J., Vol. 36: 909–19. doi: 10.1093/eurheartj/ehv321.
- 24. Ebert M., Richter S., Dinov B. et al. (2019) Evaluation and management of ventricular tachycardia in patients with dilated cardiomyopathy. Heart Rhythm., Vol. 16(4): 624–631. doi: 10.1016/j.hrthm.2018.10.028.
- 25. Eichhorn C., Bière L., Schnell F. et al. (2019) Myocarditis in Athletes Is a Challenge: Diagnosis, Risk Stratification, and Uncertainties. JACC Cardiovasc Imaging, Vol. 13: 494–507. doi: 10.1016/j.jcmg.2019.01.039.
- 26. Escher F., Kühl U., Lassner D. et al. (2016) Long-term outcome of patients with virus-negative chronic myocarditis or inflammatory cardiomyopathy after immunosuppressive therapy. Clin. Res. Cardiol., Vol. 105: 1011–1020. doi: 10.1007/s00392–016–1011-z.
- 27. Fairweather D., Cooper L.T., Blauwet L.A. (2013) Sex and gender differences in myocarditis and dilated cardiomyopathy. Curr. Probl. Cardiol., Vol. 38(1): 7–46. doi: 10.1016/j.cpcardiol.2012.07.003.
- 28. Ferreira V.M., Schulz-Menger J., Holmvang G. et al. (2018) Cardiovascular magnetic resonance in nonischemic myocardial inflammation: Expert recommendations. J. Am. Coll. Cardiol., Vol. 72(24): 3158–3176. doi: 10.1016/j.jacc.2018.09.072.
- 29. Friedrich M.G., Sechtem U., Schulz-Menger J. et al. (2009) Cardiovascular magnetic resonance in myocarditis: a JACC white paper. J. Am. Coll. Cardiol., Vol. 53(17): 1475–1487. doi: 10.1016/j.jacc.2009.02.007.
- 30. Frustaci A., Chimenti C. (2014) Immunosupressive therapy in myocarditis. Circulation J., Vol. 79: 4–7. doi.org/10.1253/circj.CJ-14–1192.
- 31. Fung G., Luo H., Qiu Y. et al. (2016) Myocarditis. Circ. Res., Vol. 118(3): 496–514. doi: 10.1161/CIRCRESAHA.115.306573.
- 32. Hase H., Saito T., Yamazaki H. et al. (2016) Successful treatment using corticosteroids in early phase of eosinophilic myocarditis with eosinophilic granulomatosis with polyangiitis. Journal of Cardiology Cases, Vol. 14 (6): 177–180. doi: 10.1016/j.jccase.2016.08.006.
- 33. He J., Yang L. (2019) Value of three-dimensional speckle-tracking imaging in detecting left ventricular systolic function in patients with dilated cardiomyopathy. Echocardiography, Vol. 36(8): 1492–1495. doi: 10.1111/echo.14427.
- 34. Hendry R.G., Bilawchuk L.M., Marchant D.J. (2014) Targeting matrix metalloproteinase activity and expression for the treatment of viral myocarditis. J. Cardiovasc. Transl. Res., Vol. 7 (2): 212—215. doi: 10.1007/s12265–013–9528–2.
- 35. Heymans S., Corsten M.F., Verhesen W. et al. (2013) Macrophage microRNA-155 promotes cardiac hypertrophy and failure. Circulation, Vol. 128: 1420 — 32. doi: 10.1161/CIRCULATIONAHA.112.001357.
- 36. Heymans S., Eriksson U., Lehtonen J. et al. (2016) The quest for new approaches in myocarditis and inflammatory cardiomyopathy. J. Am. Coll. Cardiol., Vol. 68(21): 2348–2364. doi: 10.1016/j.jacc.2016.09.937.
- 37. Hu J.R., Florido R., Lipson E.J. et al. (2019) Cardiovascular toxicities associated with immune checkpoint inhibitors. Cardiovasc. Res., Vol. 115: 854–868. doi: 10.1093/cvr/cvz026.
- 38. Hua X., Song J. (2019) Immune cell diversity contributes to the pathogenesis of myocarditis. Heart Fail Rev., Vol. 24 (6): 1019–1030. doi: 10.1007/s10741–019–09799-w.
- 39. Huber S.A. (2016) Viral myocarditis and dilated cardiomyopathy: etiology and pathogenesis. Curr. Pharm. Des., Vol. 22(4): 408–426. doi: 10.2174/1381612822666151222160500.
- 40. Imanaka-Yoshida K. (2020) Inflammation in myocardial disease: From myocarditis to dilated cardiomyopathy. Pathology International., Vol. 1: 1–11. doi: 10.1111/pin.12868.
- 41. Kasner M., Sinning D., Escher F. et al. (2013) The utility of speckle tracking imaging in the diagnostic of acute myocarditis, as proven by endomyocardial biopsy. Int. J. Cardiol., Vol. 168(3): 3023–3024. doi: 10.1016/j.ijcard.2013.04.016.
- 42. Kim M.J., Hong G.R., Ha J.W. et al. (2020) Acute Localized Myocarditis: Role of Speckle Tracking Echocardiography. Korean Circ. J., Vol. 50(7): 638–640. doi: 10.4070/kcj.2019.0378.
- 43. Kociol R.D., Cooper L.T., Fang J.C. et al. (2020) American Heart Association Heart Failure and Transplantation Committee of the Council on Clinical Cardiology. Recognition and Initial Management of Fulminant Myocarditis: A Scientific Statement From the American Heart Association. Circulation, Vol. 141(6): e69–e92. doi: 10.1161/CIR.0000000000000745.
- 44. Kovalenko V., Nesukay E., Cherniuk S. et al. (2020) Role of myocardial inflammation and fibrosis in the development of ventricular arrythmias in patients with inflammatory cardiomyopathy (results of 1-year follow-up). Eur. Heart J., Vol. 41 (Suppl. 2). ESC Congress. Abstract Supplement: 2054. doi.org/10.1093/ehjci/ehaa946.2054.
- 45. Krejci J., Mlejnek D., Sochorova D. et al. (2016) Inflammatory cardiomyopathy: a current view on pathophysiology, diagnosis and treatment. BioMed Research International: 1–11. doi: 10.1155/2016/4087632.
- 46. Kuhl U., Lassner D., Gast M. et al. (2015) Differential cardiac microRNA expression predicts the clinical course in human enterovirus cardiomyopathy. Circ. Heart Fail, Vol. 8: 605–618. doi: 10.1161/CIRCHEARTFAILURE.114.001475.
- 47. Kuruvilla S., Adenaw N., Katwal A.B. et al. (2014) Late gadolinium enhancement on cardiac magnetic resonance predicts adverse cardiovascular outcomes in nonischemic cardiomyopathy: a systematic review and meta-analysis. Circ. Cardiovasc. Imaging, Vol. 7(2): 250–258. doi: 10.1161/CIRCIMAGING.113.001144.
- 48. Leone O., Pieroni M., Rapezzi C. et al. (2019) The spectrum of myocarditis: from pathology to the clinics. Virchows Arch., Vol. 475(3): 279–301. doi: 10.1007/s00428–019–02615–8.
- 49. Lu C., Qin F., Yan Y. et al. (2017) Immunosupressive treatment for myocarditis: a meta-analysis of randomized controlled trials. J. Cardiovasc. Med., Vol. 17: 631–637. DOI: 10.2459/jcm.0000000000000134.
- 50. Lu M., Samblanet K., Roberts C. (2020) Myocarditis: A Heart on Fire. Curr. Sports Med. Rep., Vol. 19(3): 110–112. doi: 10.1249/JSR.0000000000000698.
- 51. Mahrholdt H., Greuilich S. (2017) Prognosis in myocarditis. J. Am. Col. Cardiol., Vol. 70: 1988–1990. doi: 10.1016/j.jacc.2017.08.062.
- 52. Maisch B. (2019) Cardio-Immunology of Myocarditis: Focus on Immune Mechanisms and Treatment Options. Frontiers in Cardiovascular Medicine, Vol. 6: 48. doi: 10.3389/fcvm.2019.00048.
- 53. Maisch B., Alter P. (2018) Treatment options in myocarditis and inflammatory cardiomyopathy: focus on i. v. immunoglobulins. Herz, Vol. 43(5): 423–430. doi: 10.1007/s00059–018–4719-x.
- 54. Maisch B., Ristic A.D., Pankuweit S. (2017) Inflammatory cardiomyopathy and myocarditis. Herz, Vol. 42(4): 425–438. doi: 10.1007/s00059–017–4569-y.
- 55. Massilamany C., Huber S.A., Cunningham M.W. et al. (2014) Relevance of molecular mimicry in the mediation of infectious myocarditis. J. Cardiovasc. Trans Res., Vol. 7(2): 165–71. doi: 10.1007/s12265–013–9519–3.
- 56. Merken J., Hazebroek M., Van Paassen P. et al. (2018) Immunosuppressive Therapy Improves Both Short- and Long-Term Prognosis in Patients With Virus Negative Nonfulminant Inflammatory Cardiomyopathy. Circulation: Heart Failure, Vol. 11: e004228. DOI: 10.1161/ CIRCHEARTFAILURE.117.004228.
- 57. Nensa F., Kloth J., Tezgah E. et al. (2016) Feasibility of FDG-PET in myocarditis: Comparison to CMR using integrated PET/MRI. J. Nucl. Cardiol., Vol. 25: 616– 624. doi: 10.1007/s12350–016–0616-y.
- 58. Ozieranski K., Tyminska A., Jonik S. et al. (2021) Clinically Suspected Myocarditis in the Course of Severe Acute Respiratory Syndrome Novel Coronavirus-2 Infection: Fact or Fiction? J. Card. Fail, Vol. 27(1): 92–96. doi: 10.1016/j.cardfail.2020.11.002.
- 59. Palmisano A., Benedetti G., Faletti R. et al. (2020) Early T1 Myocardial MRI Mapping: Value in Detecting Myocardial Hyperemia in Acute Myocarditis. Radiology, Vol. 295(2): 316–325. doi: 10.1148/radiol.2020191623.
- 60. Peretto G., Sala S., Rizzo S. et al. (2019) Arrhythmias in myocarditis: state of the art. Heart Rhythm Case Reports., Vol. 16 (5): 793–801. doi.org/10.1016/j.hrthm.2018.11.024.
- 61. Pinto Y.M., Elliott P.M., Arbustini E. et al. (2016) Proposal for a revised definition of dilated cardiomyopathy, hypokinetic non-dilated cardiomyopathy, and its implications for clinical practice: a position statement of the ESC working group on myocardial and pericardial diseases. Eur. Heart J., Vol. 37 (23): 1850–1858. doi: 10.1093/eurheartj/ehv727.
- 62. Ponikowski P., Voors A.A., Anker S.D. et al. (2016) 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur. Heart J., Vol. 37: 2129—2200. doi:10.1093/eurheartj/ehw128.
- 63. Qin F., Yan Y., Liu T. et al. (2016) Immunosuppressive treatment for myocarditis: a meta-analysis of randomized controlled trials. J. Cardiovasc. Med. Hagerstown., Vol. 17(8): 631–7. doi: 10.2459/JCM.0000000000000134.
- 64. Robinson J., Hartling L., Vandermeer B. et al. (2015) Intravenous immunoglobulin for presumed viral myocarditis in children and adults. Cochrane Database Syst. Rev., Vol. 20(5): CD004370. doi: 10.1002/14651858.CD00437.
- 65. Rose N.R. (2011) Critical cytokine pathways to cardiac inflammation. J. Interferon. Cytok. Res., Vol. 31: 705–9. doi: 10.1089/jir.2011.0057
- 66. Rutschow S., Leschka S., Westermann D. et al. (2010) Left ventricular enlargement in coxsakievirus-B3 induced myocarditis ongoing inflammation and an imbalance of the matrix degrading system. Eur. Pharmacol., Vol. 630: 145—151. doi: 10.1016/j.ejphar.2009.12.019.
- 67. Sakibuzzaman M., Fariza T.T., Rahman S.M. et al. (2020) A Clinical Review of COVID-19 Associated Myocarditis. Archives of Clinical and Biomedical Research, Vol. 4(5): 468–480. doi: 10.26502/acbr.50170119.
- 68. Sawalha K., Abozenah M., Kadado A.J. et al. (2021) Systematic Review of COVID-19 Related Myocarditis: Insights on Management and Outcome. Cardiovasc. Revasc. Med., Vol. 23: 107–113. doi: 10.1016/j.carrev.2020.08.028
- 69. Schultheiss H.P., Escher F. (2018) Chapter «Tratment of myocarditis» in ESC CardioMed (3 edn.) edited by Camm A.J., Luscher T.F., Maurer G., Serruys P.W. Oxford University Press. DOI: 10.1093/med/9780198784906.003.0368.
- 70. Schultheiss H.P., Piper C., Sowade O. et al. (2016) Betaferon in chronic viral cardiomyopathy (BICC) trial: effects ofinterferon-b treatment in patients with chronic viral cardiomyopathy. Clin. Res. Cardiol., Vol. 105: 763–769. doi: 10.1007/s00392–016–0986–9.
- 71. Seferovic P.M., Polovina M., Bauersachs J. et al. (2019) Heart failure in cardiomyopathies: a position paper from the Heart Failure Association of the European Society of Cardiology. European Journal of Heart Failure, Vol. 21: 553–576. doi: 10.1002/ejhf.1461.
- 72. Shah Z., Mohammed M., Vuddanda V. et al. (2019) National Trends, Gender, Management, and Outcomes of Patients Hospitalized for Myocarditis. Am. J. Cardiol., Vol. 124(1): 131–136. doi: 10.1016/j.amjcard.2019.03.036.
- 73. Sinagra G.F., Anzini M., Pereira N.L. et al. (2016) Myocarditis in clinical practice. Mayo Clin. Proc., Vol. 91 (9): 1256–1266. doi: 10.1016/j.mayocp.2016.05.013.
- 74. Siripanhong B., Nazarian S., Muser D. et al. (2020) Recognizing COVID-19-related myocarditis: The possible pathophysiology and proposed guideline for diagnosis and management. Heart Rhythm., Vol. 17 (9): 1463—1471. doi: 10.1016/j.hrthm.2020.05.001.
- 75. Swirski F.K., Nahrendorf M. (2018) Cardioimmunology: the immune system in cardiac homeostasis and disease. Nat. Rev. Immunol., Vol. 18: 733–744. DOI: 10.1038/s41577–018–0065–8.
- 76. Tong R., Jia T., Shi R. et al. (2020) Inhibition of microRNA-155 protects H9c2 cells against CVB3-induced myocardial injury by targeting NLRX1 to regulate the NLRP3 inflammasome. Cellular & Molecular Biology Letters, Vol. 25(6). doi: 10.1186/s11658–020–00203–2.
- 77. Treibel T.A., Fridman Y., Bering P. et al. (2020) Extracellular Volume Associates With Outcomes More Strongly Than Native or Post-Contrast Myocardial T1. JACC: Cardiovascular Imaging., Vol. 13(1): 44–54. doi: 10.1016/j.jcmg.2019.03.017.
- 78. Tschöpe C., Ammirati E., Bozkurt B. et al. (2021) Myocarditis and inflammatory cardiomyopathy: current evidence and future directions. Nat. Rev. Cardiol., Vol. 18(3): 169–193. doi: 10.1038/s41569–020–00435-x.
- 79. Tschöpe C., Cooper L.T., Torre-Amione G. et al. (2019) Management of Myocarditis-Related Cardiomyopathy in Adults. Circ Res., Vol. 124(11): 1568–1583. doi: 10.1161/CIRCRESAHA.118.313578.
- 80. Van Den Hoogen P., Van Den Akker F., Deddens J.C. et al. (2015) Heart failure in chronic myocarditis: a role for microRNAs? Curr. Genomics., Vol. 16 (2): 88–94. doi: 10.2174/1389202916999150120153344.
- 81. Van Linthout S., Klingel K., Tschope C. (2020) SARS-CoV-2-related myocarditis-like syndroms: Shakespeare’s question: What’s in a name? Eur. J. Heart Fail, Vol. 22: 922–925. doi: 10.1002/ejhf.1899.
- 82. Van Linthout S., Tschöpe C. (2018) Viral myocarditis: a prime example for endomyocardial biopsy-guided diagnosis and therapy. Curr. Opin. Cardiol., Vol. 33 (3): 325–333. doi: 10.1097/HCO.0000000000000515.
- 83. Yan L., Hu F., Yan X. et al. (2016) Inhibition of microRNA-155 ameliorates experimental autoimmune myocarditis by modulating Th17/Treg immune response. J. Mol. Med. (Berl)., Vol. 94: 1063–79. doi: 10.1007/s00109–016–1414–3
- 84. Yang Y., Lv J., Jiang S. et al. (2016) The emerging role of Toll-like receptor 4 in myocardial inflammation. Cell. Death and Disease, Vol. 7: e2234. doi: 10.1038/cddis.2016.140.
- 85. Zanatta A., Carturan E., Rizzo S. et al. (2019) Story telling of myocarditis. Int. J. Cardiol., Vol. 294: 61–64. DOI: 10.1016/j.ijcard.2019.07.046.
Рекомендации Всеукраинской ассоциации кардиологов Украины по диагностике и лечению миокардита
ДУ «ННЦ «Институт кардиологии имени Н.Д. Стражеско» НАМН Украины
Резюме. Рекомендации посвящены современным аспектам эпидемиологии, этиологии, патогенеза, диагностики, патогенетического и симптоматического лечения миокардита. Подробно описаны различные патогенетические механизмы, которые вызывают развитие и прогрессирование воспалительных заболеваний сердца и дилатацию и систолическую дисфункцию, приводят к сердечной недостаточности и развитию других осложнений миокардита. Эти рекомендации представляют современную классификацию миокардита, утвержденную в Украине, и современные алгоритмы диагностики и клинического ведения пациентов, в частности алгоритм, который оправдывает назначение глюкокортикоидов пациентам с миокардитом. Характеристики различных вариантов миокардита также представлены с объяснениями по диагностике и лечению. Большое внимание уделяется различным подходам к этиотропному и патогенетическому лечению миокардита и их возможным перспективам. Очевидно, что для стандартизации подходов к диагностике и лечению острого и хронического миокардита необходимо провести масштабные многоцентровые исследования и создать специальные реестры. Кроме того, в современных условиях пандемии COVID-19 патологические последствия SARS-CoV-2 как триггера миокардита требуют дальнейшего изучения, в частности с точки зрения влияния на прогноз и подходы к патогенетической терапии у таких пациентов. Унификация терминологии и подходов к диагностике и клинического мониторинга пациентов с миокардитом может улучшить тактику ведения и повысить выживаемость таких пациентов. Для выявления пациентов с высоким риском (с аритмиями, высокой вероятностью рецидива или преобразования миокардита в дилатационную кардиомиопатию) и кандидатов на трансплантацию сердца наиболее перспективным является создание специальных баз данных таких пациентов.
Ключевые слова: миокардит, этиология, патогенез, диагностика, лечение

Leave a comment