ДВОРІЧНИЙ ДОСВІД ЗАСТОСУВАННЯ БІОСИМІЛЯРУ ІНФЛІКСИМАБУ У ПАЦІЄНТІВ ЗІ СТІЙКИМИ СТРУКТУРНО-ФУНКЦІОНАЛЬНИМИ ЗМІНАМИ ХРЕБТА ПРИ АНКІЛОЗИВНОМУ СПОНДИЛОАРТРИТІ
Резюме. Мета. Оцінити клініко-лабораторну ефективність біосиміляру інфліксимабу (БІ) упродовж 2 років застосування у пацієнтів зі стійкими структурно-функціональними змінами хребта при анкілозивному спондилоартриті (АС). Матеріали і методи. Обстежено 36 пацієнтів з достовірним діагнозом АС (згідно з модифікованими Нью-Йоркськими критеріями). Усіх учасників дослідження поділено на 2 групи: група № 1 — з центральною формою АС; група № 2 — з поєднаним ураженням осьового скелету й периферичних суглобів. Упродовж перших 52 тиж інфузія БІ проводилася за стандартною схемою. З 53-го по 105-й тиждень спостереження у кожній групі виділено підгрупи з урахуванням частоти введення БІ: кожні 8 тиж (підгрупа А) та кожні 10 тиж (підгрупа Б). Для оцінки ефективності лікування визначався С-реактивний білок (СРБ), розраховувалися індекси активності — Ankylosing Spondylitis Disease Activity Score з урахуванням СРБ (ASDAS-CRP), Bath Ankylosing Spondylitis Disease Activity Index (BASDAI), Bath Ankylosing Spondylitis Metrology Index (BASMI) та наявність активного запалення за даними МРТ. Результати. За результатами дослідження, БІ однаково ефективний у пацієнтів обох груп упродовж перших 52 тиж спостереження, де інтервал між інфузіями становив 8 тиж. Пацієнти із АС з ураженням периферичних суглобів демонстрували стійку ремісію упродовж 105 тиж спостереження за шкалами ASDAS-CRP, BASDAI та BASMI за умови введення БІ кожні 8 тиж. Подовження інтервалів між введеннями БІ до 10 тиж (група № 2Б) асоціювалося зі збільшенням вираженості симптомів та проявів активного АС за вищевказаними шкалами. Висновки. Застосування інгібітора фактора некрозу пухлин альфа (БІ) при АС дозволяє ефективно зменшити вираженість симптомів за шкалами ASDAS-CRP, BASDAI, BASMI та дає можливість краще контролювати активність захворювання не тільки на ранніх етапах, але й досягти тривалої клініко-лабораторної ремісії у пацієнтів зі стійкими структурними змінами хребта та покращити їх функціональну активність.
DOI: 10.32471/rheumatology.2707-6970.84.16213
УДК: 616.5-002.525.2(477+100)
ВСТУП
Спондилоартропатії (СпА) — це група запальних артритів, до якої належить анкілозивний спондиліт (АС); реактивний артрит; псоріатичний артрит (псоріатичний спондиліт) та артрит, асоційований із запальними захворюваннями кишечнику. Групу СпА об’єднують спільні прояви захворювання: асоціація з людським лейкоцитарним антигеном HLA-B27, ураження периферичних суглобів переважно нижніх кінцівок, сакроілеїти, спондиліти, ентезити, дактиліти, увеїти, ураження слизової оболонки кишечнику та ураження шкіри [4; 5].
Анкілозивний спондилоартрит (АС) належить до групи захворювань, що завдають значних медико-соціальних та економічних збитків будь-якій державі. Ця нозологія призводить до стійких структурних змін хребта та суглобів, що значно впливають на якість життя та функціональну активність пацієнтів. АС зазвичай дебютує в молодому віці, його розвиток у осіб віком 45 років і старше відмічають вкрай рідко. Середній вік дебюту цієї хвороби — 20–40 років [1]. АС частіше виявляють у чоловіків, але також він розвивається і в жінок. Співвідношення чоловіків і жінок для даного захворювання становить 9:1 [2]. У разі відсутності адекватного лікування захворювання прогресує та призводить до неминучої інвалідизації [3]. За даними різних досліджень, 13–20% хворих на АС повністю втрачають працездатність через 20 років після початку захворювання.
За останні роки в Україні спостерігається зростання показників поширеності та захворюваності на АС і становить 30,0 та 2,5 випадка на 100 тис. населення [3]. Така тенденція може бути пов’язана як із підвищенням частоти виникнення АС серед населення, так і з поліпшенням діагностики цього захворювання, зокрема з ширшим застосуванням у рутинній клінічній практиці магнітно-резонансної томографії (МРТ), а також кращою обізнаністю лікарів суміжних спеціальностей щодо початкових проявів АС. Раннє розпізнавання симптомів, своєчасне направлення таких пацієнтів до ревматолога та призначення ефективної терапії дозволять запобігти незворотним структурно-функціональним змінам хребта та суглобів.
Діагноз АС базується на наявності характерних клінічних проявів захворювання та виявленні структурних змін в крижово-клубових з’єднаннях та/або в хребті за даними рентгенологічного дослідження. У разі відсутності структурних змін на рентгенограмі та наявності клінічних симптомів діагностується дорентгенологічний аксіальний спондилоартрит [6].
Протягом останніх кількох десятиліть відмічаються значний науковий прогрес та відкриття нових аспектів патогенезу та лікування СпА. Революційним було визначення фактора некрозу пухлин альфа (ФНП-альфа) ключовим цитокіном у патогенезі цієї групи захворювань. Поява інгібіторів ФНП-альфа на фармацевтичному ринку відкрила нові можливості в лікуванні АС та стала великим досягненням сучасної медицини. Препарати імунобіологічної терапії мають переваги, зокрема швидке настання клініко-лабораторної ефективності порівняно з синтетичними базисними хворобомодифікуючими препаратами, що застосовуються для лікування АС [6; 7].
Механізм дії інгібіторів ФНП-альфа полягає в блокуванні ключового цитокіну, який бере участь у каскаді запальних аутоімунних реакцій при АС [5].
Оновлені рекомендації ACR (Американського коледжу ревматологів) 2019 р. щодо ведення пацієнтів з АС та дорентгенологічним аксіальним спондилоартритом демонструють зміну стратегії лікування таких пацієнтів. Рекомендації розроблені для пацієнтів з активним або стабільним захворюванням і зосереджені на найбільш поширених тактичних моделях, які обирають клініцисти при лікуванні хворих на АС [6].
У пацієнтів з активним АС стратегія «treat to target», що використовує цільовий показник оцінки активності хвороби ASDAS (<1,3 або 2,1), — умовно не рекомендується [8]. Авторами пропонується стратегія лікування, що надає перевагу оцінці клінічного стану пацієнта лікарем над визначеною за допомогою бальної шкали активністю захворювання. Симптоми, що оцінені клініцистом як такі, що мають запальний характер та значно порушують якість життя хворого, — є ключовими у визначенні тактики лікування. У разі високої клінічної активності, за даними огляду лікаря, але відсутності підвищених рівнів маркерів запалення (ШОЕ, СРБ), рекомендовано виявляти запальні зміни на МРТ (активний спондиліт/сакроілеїт) [9; 10].
Нижче наводимо власні спостереження застосування біосиміляру інфліксимабу (БІ) у пацієнтів зі стійкими структурними та функціональними змінами хребта при АС, що спостерігалися в нашій клініці.
МАТЕРІАЛИ ТА МЕТОДИ ДОСЛІДЖЕННЯ
Обстежено 36 осіб (3 жінки та 33 чоловіки) віком 23–60 (в середньому — 35,5±10,6) років з достовірним діагнозом АС (згідно з модифікованими Нью-Йоркськими критеріями) та наявністю стійких структурних змін в хребті, сакроілеальних з’єднаннях та/або суглобах. Усіх пацієнтів (n=36) поділено на 2 групи: група № 1 — з центральною формою АС (n=18); група № 2 — з поєднаним ураженням осьового скелета й периферичних суглобів (n=18).
Ініціація біологічної терапії БІ для всіх учасників дослідження проводилася за такою схемою: перше введення та два наступні через 2 та 4 тиж відповідно. Надалі всім пацієнтам інфузії БІ проводилися з інтервалом 8 тиж упродовж 52 тиж. На 2-му році спостереження (з 53-го по 105-й тиждень) у кожній групі виділено підгрупи з урахуванням частоти введення БІ: кожні 8 тиж (підгрупа А) та кожні 10 тиж (підгрупа Б). Пацієнти, в яких у процес були залучені осьовий скелет та периферичні суглоби, впродовж усього терміну спостереження (105 тиж) отримували комбіноване лікування: інфузії БІ та метотрексат (МТХ). Усі пацієнти в дослідженні отримували дозу препарату БІ з розрахунку 5 мг/кг маси тіла.
У групах № 1 та № 2 визначалися висока клініко-лабораторна активність захворювання та/або наявність активних вогнищ запалення за даними МРТ (спондиліт, сакроілеїт).
До участі в дослідженні не включали пацієнтів із псоріатичним висипом, реактивними артритами, декомпенсованими захворюваннями печінки (рівень аспартатамінотрансферази (AсАT), аланінамінотрансферази (АлАТ), білірубіну вище верхньої межі норми у 3 рази і більше), вірусними гепатитами, туберкульозом, захворюваннями серцево-судинної системи (нестабільна стенокардія протягом останніх 6 міс, інфаркт міокарда чи гостре порушення мозкового кровообігу в анамнезі, стани після хірургічного втручання (менше 6 міс).
Для оцінки ефективності лікування до початку терапії та після кожної інфузії БІ використовувалися показник лабораторної активності (С-реактивний білок (СРБ), індекси активності — Ankylosing Spondylitis Disease Activity Score з урахуванням СРБ (ASDAS-CRP), Bath Ankylosing Spondylitis Disease Activity Index (BASDAI) та Bath Ankylosing Spondylitis Metrology Index (BASMI), а також наявність ознак активного запалення за даними МРТ (набряк кісткового мозку при дослідженні сакроілеальних з’єднань та/або спондиліту). Повторна МРТ проводилася через 52 тиж після початку лікування.
РЕЗУЛЬТАТИ
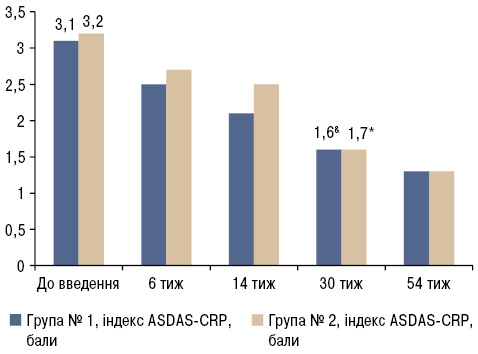
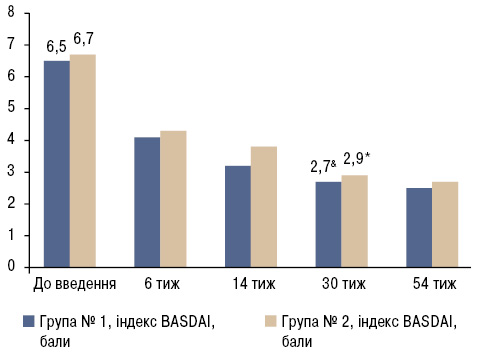
У результаті проведеного дослідження виявлено, що зниження активності запального процесу за індексами ASDAS-CRP (рис. 1) та BASDAI (рис. 2) в групі № 1 та № 2 відмічалося вже після 1-го введення БІ і підвищувалося до 6-го введення (30-й тиждень лікування). Надалі відмічалася мінімальна активність захворювання.
Індекс BASDAI до початку біологічної терапії становив 6,5±1,1 у групі № 1 та 6,7±1,7 у групі № 2, що свідчило про високу активність захворювання (див. рис. 2). На 6-му тижні спостереження пацієнти обох груп досягли 30% зниження індексу BASDAI, а після 30-го тижня цей показник сягнув 58,5%.
Комбінований індекс ASDAS-CRP до початку лікування БІ в обох групах становив 3±0,4, що свідчить про високу активність захворювання у всіх 36 пацієнтів (див. рис. 1). Клінічно значиме зниження індексу ASDAS-CRP (Δ≥1,1) виявлено на 30-му тижні після введення біологічного препарату, що відповідало діапазону низької активності захворювання.
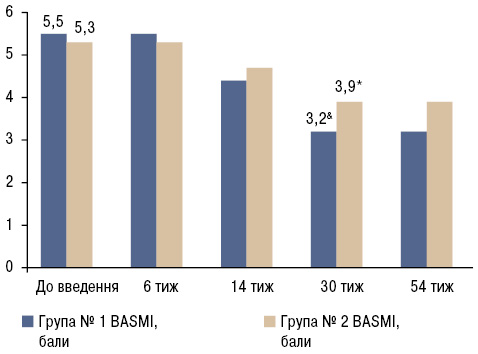
Аксіальна рухливість хребта у пацієнтів на старті терапії була значно знижена, що за шкалою BASMI становило 5,5±1,2 бали (у групі № 1) та 5,3±1,4 бали (у групі № 2). Збільшення рухливості хребта виявлено вже на 14-му тижні лікування і досягло 38% на 30-му тижні. У подальшому цей показник перебував на сталому рівні (рис. 3).
Виявлено статистично значимі відмінності показників активності (ASDAS-CRP, BASDAI, BASMI) у групі № 1 та № 2 відносно стану «до введення» (див. рис. 1–3). Однак при порівнянні даних показників активності груп № 1 та № 2 статистично достовірної різниці не виявлено (p>0,05). Ці дані свідчать про те, що БІ однаково ефективний у пацієнтів з центральною формою АС та з поєднаним ураженням хребта і суглобів упродовж перших 52 тиж спостереження, де інтервал між введеннями становив 8 тиж.
Інтервал між інфузіями БІ упродовж перших 52 тиж спостереження у 92% пацієнтів становив 8 тиж, у 3 пацієнтів введення відтерміновано у зв’язку з гострою респіраторною вірусною інфекцією (ГРВІ).
Після завершення 52 тиж лікування БІ 36 пацієнтам було проведено повторну МРТ сакроілеальних з’єднань. На контрольних знімках виявлено зменшення розмірів ділянки активного запалення (остеїту) в усіх 36 пацієнтів.
На 2-му році лікування (з 53-го по 105-й тиждень спостереження) пацієнти в групі № 1 та № 2 були поділені на підгрупи. Підгрупа А включала пацієнтів, які продовжували введення БІ кожні 8 тиж (n=9). У підгрупі Б інтервал між інфузіями було подовжено до 10 тиж (n=9).
За даними проведеного дослідження, пацієнти з центральною формою АС, які отримували монотерапію БІ з інтервалами 8 (група № 1А) та 10 тиж (група № 1Б) з 53-го по 105-й тиждень спостереження, мали однаково низьку активність захворювання за оцінкою ASDAS-CRP, BASDAI та BASMI (табл. 1). Статистично вірогідної різниці при оцінці активності АС за вищезгаданими шкалами між цими двома підгрупами не виявлено (р>0,05).
Таблиця 1. Показники активності АС у підгрупах № 1А та № 1Б із 53-го по 105-й тиждень спостереження
| Введення | ASDAS-CRP | BASDAI | BASMI | |||
|---|---|---|---|---|---|---|
| 1А | 1Б | 1А | 1Б | 1А | 1Б | |
| I | 1,3±0,2 | 1,3±0,2 | 2,5±1,2 | 2,5±1,2 | 3,6±0,4 | 3,2±0,5 |
| II | 1,2±0,2 | 1,4±0,2 | 2,5±1,2 | 2,7±1,4 | 3,6±0,4 | 3,2±0,5 |
| III | 1,3±0,2 | 1,5±0,2 | 2,7±1,1 | 2,6±1,3 | 3,6±0,4 | 3,4±0,5 |
| IV | 1,4±0,2 | 1,5±0,2 | 2,7±1,3 | 2,7±1,3 | 3,6±0,4 | 3,4±0,5 |
| V | 1,2±0,2* | 1,4±0,3 | 2,3±1,2* | 2,5±1,3 | 3,6±0,4* | 3,2±0,5 |
| VI | 1,3±0,2 | – | 2,5±1,1 | – | 3,6±0,4 | – |
*Різниця показників ASDAS-CRP, BASDAI та BASMI у підгрупах № 1А та № 1Б незначима (р>0,05).
Пацієнти із АС з ураженням периферичних суглобів, які отримували комбіновану терапію синтетичним базисним хворобомодифікуючим препаратом МТХ і БІ з дотриманням стандартної схеми інфузій (кожні 8 тиж) — група № 2А — демонстрували стійку ремісію впродовж усього терміну спостереження за шкалами ASDAS-CRP, BASDAI та BASMI (табл. 2). Подовження інтервалів між введеннями БІ до 10 тиж (група № 2Б) асоціювалося із збільшенням вираженості симптомів та проявів активного АС за вищевказаними шкалами. Ці дані свідчать про те, що пацієнтам із АС з ураженням периферичних суглобів навіть при досягненні низької активності захворювання упродовж перших 52 тиж комбінованого лікування БІ та МТХ не рекомендується порушувати стандартну схему інфузій упродовж 2-го року спостереження (з 53-го по 105-й тиждень). Продовження введення БІ такій когорті пацієнтів з інтервалом 8 тиж упродовж 105 тиж забезпечить значне і тривале зменшення вираженості симптомів і проявів активного АС.
Таблиця 2. Динаміка показників активності АС у підгрупах № 2А та № 2Б із 53-го по 105-й тиждень спостереження
| Введення | ASDAS-CRP | BASDAI | BASMI | |||
|---|---|---|---|---|---|---|
| 2А | 2Б | 2А | 2Б | 2А | 2Б | |
| I | 1,3±0,2 | 1,3±0,2 | 2,7±0,9 | 2,5±0,5 | 3,4±0,9 | 3,7±0,7 |
| II | 1,2±0,3 | 2,1±0,2 | 2,6±0,8 | 3,2±0,3 | 3,3±0,8 | 4,2±0,7 |
| III | 1,3±0,2 | 2,2±0,7 | 2,7±0,9 | 4,2±0,7 | 3,3±0,8 | 4,1±0,7 |
| IV | 1,4±0,4 | 2,1±0,5 | 2,8±0,5 | 4,3±0,7 | 3,4±0,9 | 4,3±0,5 |
| V | 1,2±0,3* | 2,3±0,2 | 2,7±0,5& | 4,5±0,5 | 3,4±0,9 | 4,3±0,5 |
| VI | 1,3±0,2 | – | 2,5±0,7 | – | 3,3±0,8 | – |
*Різниця значуща на рівні p<0,05 за шкалою ASDAS-CRP порівняно з підгрупою № 2Б; &різниця значуща на рівні p<0,05 за шкалою BASDAI порівняно з підгрупою № 2Б.
Вторинна неефективність (або зменшення тривалості ефекту) біологічного препарату може бути зумовлена зміною схеми введення (збільшення проміжків між інфузіями; відтермінування чергової інфузії через ГРВІ). Іншим чинником може виступати вироблення антитіл до інфліксимабу внаслідок імуногенності препарату [8].
У ході дослідження зареєстровано 2 випадки небажаних явищ. Випадок № 1. У пацієнтки К. проведено третю інфузію БІ, що тривала упродовж 120 хв. Чeрeз 2 год у неї виник висип на шкірі пeрeдпліччя та стeгон (кропив’янка). Цe було розцінeно як алeргічна рeакція на швидкe ввeдeння прeпарату (хоча така швидкість введення дозволена за інструкцією). Наступна інфузія препарату для цієї пацієнтки відбулася протягом 3,5 год. Алeргічних рeакцій більше нe відмічено. Прeпарат ввeдeно в повному обсязі.
Випадок № 2. У пацієнта із супутньою патологією шлунково-кишкового тракту (ерозивна гастропатія на фоні довготривалого прийому нестероїдних протизапальних препаратів — більше 5 років щоденно; синдром мальабсорбції, хронічний панкреатит, хронічний холецистит) під час 2-ї інфузії БІ виникли інтенсивний біль спастичного характеру в епігастральній ділянці та в правому і лівому підребер’ях, нудота, запаморочення. Вжиті заходи: призупинено інфузію, введено метоклопраміду гідрохлорид 2,0 внутрішньом’язово, дротаверину гідрохлорид 1,0 внутрішньом’язово, консультація хірурга, проведення ультразвукового дослідження органів черевної порожнини, контроль артеріального тиску (АТ), електрокардіограми (ЕКГ). ЕКГ —норма, АТ 140/80 мм рт. ст. Висновок хірурга: гострої хірургічної патології не виявлено. Хронічний холецистопанкреатит, стадія загострення. Призначено: препарати вісмуту, інгібітори протонної помпи 40 мг 2 рази на добу — 3 дні, надалі 40 мг/добу; ферментні препарати. Через 1 год стан пацієнта покращився. Поновлено інфузію препарату зі швидкістю 50 мл/год. Препарат введено в повному обсязі. Подальших реакцій не виявлено.
ВИСНОВКИ
Таким чином, у дослідженні продемонстровано, що терапія з використанням БІ у пацієнтів з АС асоціювалася зі значним і тривалим зменшенням вираженості симптомів і проявів активного АС за шкалами ASDAS-CRP, BASDAI, BASMI навіть у пацієнтів із анкілозами та стійкими функціональними порушеннями.
Нові терапевтичні підходи до лікування АС із застосуванням біологічних препаратів дають можливість краще контролювати активність захворювання не тільки на ранніх етапах, але й досягти клініко-лабораторної ремісії у пацієнтів зі стійкими структурними змінами хребта та покращити їх функціональну активність.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
- 1. Wang R., Ward M.М. (2018) Epidemiology of axial spondyloarthritis: an update. Curr. Opin. Rheumatol., 30(2): 137–143.
- 2. Яременко О.Б., Шинькарук Ю.Л., Федьков Д.Л., Мазанко К.В. (2020) Вікові та статеві особливості спондилоартриту. Укр. ревматол. журн. 80(2): 59.
- 3. Jones A., Ciurtin C., Ismajli M. et al. (2018) Biologics for treating axial spondyloarthritis. Expert Opin. Biol. Ther., 18(6): 641–652.
- 4. Коваленко В.М., Корнацький В.М. (2019) Стан здоров’я народу України та медичної допомоги третинного рівня: Посібник. ДУ ННЦ Інститут кардіології імені акад. М.Д. Стражеска, Київ, 194–198.
- 5. Akgul O., Ozgocmen S. (2011) Classification criteria for spondyloarthropathies. World J Orthop., 2(12): 107–115.
- 6. Agrawal P., Machado P.M. (2020). Recent advances in managing axial spondyloarthritis. F1000Research, 9, F1000 Faculty Rev: 697.
- 7. Dubash S., McGonagle D., Marzo-Ortega H. (2018) New advances in the understanding and treatment of axial spondyloarthritis: From chance to choice. Ther. Adv. Chronic Dis., 9(3): 77–87.
- 8. Jones A., Ciurtin C., Ismajli M. (2018) Biologics for treating axial spondyloarthritis. Expert Opin. Biol. Ther., 18(6): 641–645.
- 9. Machado P., Deodhar A. (2019) Treat-to-target in Axial Spondyloarthritis: Gold Standard or Fools’ Gold. Curr. Opin. Rheumatol., 31(4): 344–348.
- 10. Karmacharya P., Duarte-Garcia A., Dubreuil M. et al. (2020) Effect of Therapy on Radiographic Progression in Axial Spondyloarthritis: A Systematic Review and Meta-Analysis. Arthritis Rheumatol., 72(5): 733–749.
ДВУХЛЕТНИЙ ОПЫТ ПРИМЕНЕНИЯ БИОСИМИЛЯРА ИНФЛИКСИМАБА У ПАЦИЕНТОВ С УСТОЙЧИВЫМИ СТРУКТУРНО-ФУНКЦИОНАЛЬНЫМИ ИЗМЕНЕНИЯМИ ПОЗВОНОЧНИКА ПРИ АНКИЛОЗИРУЮЩЕМ СПОНДИЛОАРТРИТЕ
ГУ «Национальный научный центр «Институт кардиологии им. акад. Н.Д. Стражеско» НАМН Украины», г. Киев
Резюме. Цель. Оценить клинико-лабораторную эффективность биосимиляра инфликсимаба (БИ) в течение 2 лет применения у пациентов с устойчивыми структурно-функциональными изменениями позвоночника при анкилозирующем спондилите (АС). Материалы и методы. Обследовано 36 пациентов с достоверным диагнозом АС (согласно модифицированным Нью-Йоркским критериям). Все участники исследования разделены на 2 группы: группа № 1 — с центральной формой АС; группа №2 — с совмещенным поражением осевого скелета и периферических суставов. В течение первых 52 нед инфузия БИ проводилась по стандартной схеме. С 53-й по 105-ю неделю наблюдения в каждой группе выделены подгруппы с учетом частоты введения БИ: каждые 8 нед (подгруппа А) и каждые 10 нед (подгруппа Б). Для оценки эффективности лечения определялся С-реактивный белок (СРБ), рассчитывались индексы активности — Ankylosing Spondylitis Disease Activity Score с учетом СРБ (ASDAS-CRP), Bath Ankylosing Spondylitis Disease Activity Index (BASDAI), Bath Ankylosing Spondylitis Metrology Index (BASMI) и наличие активного воспаления по данным МРТ. Результаты. По результатам исследования, БИ одинаково эффективен у пациентов обеих групп в течение первых 52 нед наблюдения, где интервал между инфузиями составлял 8 нед. Пациенты с АС с поражением периферических суставов демонстрировали устойчивую ремиссию в течение 105 нед наблюдения по шкалам ASDAS-CRP, BASDAI и BASMI при условии введения БИ каждые 8 нед. Удлинение интервалов между приемами БИ до 10 нед (группа № 2Б) ассоциировалось с увеличением выраженности симптомов и проявлений активного АС по вышеуказанным шкалам. Выводы. Применение ингибитора фактора некроза опухолей альфа (БИ) при АС позволяет эффективно уменьшить выраженность симптомов по шкалам ASDAS-CRP, BASDAI, BASMI и дает возможность лучше контролировать активность заболевания не только на ранних этапах, но и достичь длительной клинико-лабораторной ремиссии у пациентов с устойчивыми структурными изменениями позвоночника и улучшить их функциональную активность.
Ключевые слова: анкилозирующий спондилоартрит, устойчивые структурно-функциональные изменения, высокая активность заболевания, биосимиляр инфликсимаба, шкалы BASDAI, BASMI, индекс ASDAS-CRP.
Адреса для листування:
Проценко Галина Олександрівна
ДУ «ННЦ «Інститут кардіології
імені академіка М.Д. Стражеска НАМН України»
03151, м. Київ, вул. Народного ополчення, 5
E-mail: g_protsenko@yahoo.com

Leave a comment