ОСОБЛИВОСТІ ПЕРІОПЕРАЦІЙНОГО ПЕРІОДУ У ПАЦІЄНТІВ З ІХС ВИСОКОГО РИЗИКУ ТА ПОДАГРОЮ В КАРДІОХІРУРГІЧНІЙ ПРАКТИЦІ
Резюме. Мета: вивчити особливості періопераційного періоду у пацієнтів з ішемічною хворобою серця (ІХС) високого ризику та подагрою в кардіохірургічній практиці. Матеріал і методи: проведено ретроспективний аналіз 354 пацієнтів з ІХС високого ризику. Усім хворим проведено електрокардіографію, ехокардіографію, коронарографію та хірургічне лікування ІХС. У рамках цього дослідження скринінг гіперурикемії не проводили, фіксували лише пацієнтів з нападами подагричного артриту. Результати: серед 354 пацієнтів з ІХС високого кардіохірургічного ризику у 30 (8,47%) хворих було виявлено подагру, за якої достовірно частіше діагностували цукровий діабет 2-го типу (56,6 проти 22,5% без подагри, p<0,01), хронічну хворобу нирок G3a–4 стадії (63,3% проти 32,4% без подагри, р<0,01), ожиріння (60 проти 35,4% без подагри, р<0,01), варикозне розширення вен нижніх кінцівок (50 проти 29,6%, р<0,05). Операційний етап пацієнтів з подагрою характеризувався більшою кількістю шунтів — 3,3 проти 3,04 та частим використанням внутрішньої грудної артерії (66,6 проти 55,8%). При порівнянні інтраопераційних знахідок пацієнтів з та без порушень обміну сечової кислоти, при подагрі було відмічено переважання кальцинозу вінцевих артерій (16,6 проти 6,7%), малого діаметру артерій (16,6 та 9,5%) та інтрамурального розташування коронарних артерій (56,6 проти 19,7%). Післяопераційний період пацієнтів з порушенням обміну сечової кислоти характеризувався достовірно частішим розвитком фібриляції передсердь у пацієнтів з подагрою — 43,3 проти 14,6% (p<0,01), пневмонії (6,66 проти 0,92%, р<0,05), загострення виразки гастродуоденальної ділянки (6,66 проти 0,3%, р<0,01) та інфекції рани грудини (6,66 проти 1,23%, р<0,01). Висновки: враховуючи високий ризик ускладнень у пацієнтів з подагрою, рекомендовано контролювати рівень сечової кислоти у всіх хворих перед кардіохірургічним втручанням для попередження негативного впливу цього патологічного стану на організм. З метою профілактики виникнення загострень подагричного артриту не рекомендовано відміняти інгібітори ксантиноксидази напередодні операції.
УДК 616-002.78:616.12-005.4-089
DOI: 10.32471/rheumatology.2707-6970.83.15962
Подагричний артрит належить до метаболічних артритів, для нього характерне відкладання кристалів сечової кислоти в суглобах, формування тофусів, уролітіаз [1]. Гіперурикемія та подагра розглядаються як незалежний фактор ризику розвитку серцево-судинних подій [2–6] та кардіальної смертності [7, 8]. Подагра — інвалідизуюче та розповсюджене захворювання в Європі; його поширеність коливається в межах від 0,9% до 2,5% залежно від країни [9–10]. Можливі механізми виникнення ішемічної хвороби серця (ІХС) при подагрі включають оксидативний стрес [11] та запалення [12]. Літературні дані стосовно подагричного артриту у пацієнтів, яким проводиться хірургічна реваскуляризація міокарда обмежені поодинокими повідомленнями авторів та носять лише інформаційний характер [13]. Y. Tavil зі співавторами [14] вивчали вплив гіперурикемії на функціонування венозних шунтів. Вченими було обстежено 192 пацієнти через 5 років після вінцевого шунтування, у 102 хворих виникла дисфункція венозних шунтів, розвиток стенозу одного венозного шунта спостерігався у 67 пацієнтів (65,7%), двох венозних трансплантатів — у 30 хворих (29,4%), дисфункція трьох та більше венозних шунтів діагностована у 5 (4,9%) пацієнтів, без істотної різниці середніх рівнів сечової кислоти. Дисфункція шунтів незалежно асоціювалася з гіперурикемією (p<0,001), цукровим діабетом (p = 0,028) та курінням (p = 0,039). У дослідженні було виявлено, що у пацієнтів з дисфункцією венозних шунтів рівень сечової кислоти був значно вищим, ніж у хворих з функціонуючими шунтами, а кількість стенозів венозних шунтів не корелювала з рівнем сечової кислоти. Негативний вплив гіперурикемії на функціонування шунтів реалізувався за рахунок шкідливого впливу кристалів уратів на функцію ендотелію та гіперагрегації тромбоцитів.
У своєму метааналізі T.P. Singh зі співавторами [15] проаналізували дані 6 досліджень з приводу протективних властивостей алопуринолу при коронарному шунтуванні (КШ), дані представлені в табл. 1.
| Автор,
(рік) |
Кількість пацієнтів | Країна | Алопуринол/контроль | Протокол застосування алопуринолу | Середня кількість шунтів | Середній час перетискання аорти | Загальна кількість ІМ | Кількість ІМ в групі алопуринолу | Кількість ІМ у контрольній групі |
|---|---|---|---|---|---|---|---|---|---|
| Emerit et al. (1988) | 14 | Франція | 7/7 | 100 мг у кардіоплегічний розчин, 2 рази інтраопераційно. Сумарна доза: 200 мг | 2,3 | 50 | 0 (0%) | 0 (0%) | 0 (0%) |
| Rashid et al. (1991) | 90 | Швеція | 45/45 | Таблетована форма: 300 мг 2 рази/добу за 2 доби до КШ та 600 мг зранку до КШ, та 300 мг 2 рази/добу, 2 доби після КШ. Сумарна доза: 3000 мг | 3,6 | 76,5 | 8 (8,9%) | 0 (0%) | 8 (17,8%) |
| Coghlan et al. (1994) | 50 | Англія | 25/25 | Таблетована форма: 300 мг ввечері напередодні КШ та 300 мг за годину до КШ; сумарна доза: 600 мг | 3,7 | 44,5 | 3 (6%) | 1 (4%) | 2 (8%) |
| Taggart et al. (1994) | 20 | Англія | 10/10 | Таблетована форма: 600 мг, ввечері напередодні КШ та 600 мг о 6:00 в день операції; сумарна доза: 1200 мг | 2,9 | 33,5 | 0 (0%) | 0 (0%) | 0 (0%) |
| Castelli et al. (1995) | 33 | Італія | 18/15 | 200 мг внутрішньовенно за 1 год до КШ; сумарна доза: 200 мг | 3,0 | 65,5 | 3 (9,1%) | 1 (5,6%) | 2 (13,3%) |
| Gimpel et al. (1995) | 22 | Нідерланди | 8/14 | 200 мг внутрішньовенно на початку наркозу та 100 мг внутрішньовенно кожну годину КШ; сумарна доза залежить від тривалості КШ | 3,4 | 79,3 | 2 (9,1%) | 0 (0%) | 2 (14,3%) |
Шляхом порівняння результатів усіх включених досліджень [15] було встановлено, що інфаркт міокарда (ІМ) виник у 16 (6,99%) пацієнтів. У межах групи алопуринолу (n = 113) повідомлялося про ІМ у 2 (1,77%) пацієнтів. Для порівняння, ІМ діагностували у 14 (12,07%) хворих контрольної групи (n = 116).
Серед пацієнтів, які перенесли аортокоронарне шунтування та протезування серцевих клапанів, К. Tabayashi et al. (1991) встановлено, що введення алопуринолу у високих дозах значно зменшило ішемічні маркери, включаючи аспартатамінотрансферазу, креатинфосфокіназу, лактатдегідрогеназу, в післяопераційний період [16]. Але все ж таки T.P. Singh зі співавторами наполягають [17], що необхідні додаткові дослідження, щоб визначити, чи залежать серцево-судинні переваги алопуринолу від дози, як було запропоновано раніше [18, 19]. N. Weimert зі співавторами [20] також проаналізували дослідження впливу різних доз алопуринолу на результати виконання вінцевого шунтування. Ці дослідження виявили, що алопуринол може знизити смертність, покращити роботу серця, зменшити частоту виникнення аритмій, знизити маркери ішемії, рівень вільних радикалів та потребу в інотропній підтримці.
Мета: вивчити особливості періопераційного періоду пацієнтів з ІХС високого ризику та подагрою в кардіохірургічній практиці.
Матеріал і методи: проведено ретроспективний аналіз 354 пацієнтів з ІХС високого ризику. Усім пацієнтам проведено електрокардіографію, ехокардіографію, коронарографію та хірургічне лікування ІХС. У рамках цього дослідження скринінг гіперурикемії не проводився, фіксували лише пацієнтів з нападами подагричного артриту.
Результати
Серед пацієнтів дослідної групи у 30 (8,47%) пацієнтів було виявлено подагру, наявність якої відобразилася на всіх етапах перебування пацієнтів в інституті. Серед 194 пацієнтів з неускладненою ІХС 20 (10,3%) скаржилися на подагру, а в групі 160 хворих з ускладненою ІХС подагричний артрит діагностовано у 10 (6,25%) випадках. Достовірно значущих відмінностей в кардіологічних клінічних проявах у пацієнтів з подагрою та без зафіксовано не було (табл. 2).
| Пацієнти з подагрою, n=30 | Пацієнти без подагри, n=324 | p | |
|---|---|---|---|
| Гіпертонічна хвороба | 30 (100%) | 318 (98,1%) | NS |
| Гострий ІМ в анамнезі | 25 (83,3%) | 272 (83,9%) | NS |
| Фібриляція передсердь | 1 (3,3%) | 29 (8,9%) | NS |
| Відсутність стенокардії | 8 (26,6%) | 69 (21,2%) | NS |
| І функціональний клас (ФК) | 0 (0%) | 3 (0,92%) | NS |
| ІІ ФК | 1 (3,3%) | 24 (7,4%) | NS |
| ІІІ ФК | 17 (56,6%) | 169 (52,1%) | NS |
| IV ФК | 4 (13,3%) | 59 (18,2%) | NS |
| ІІ ФК | 3 (10%) | 67 (20,6%) | NS |
| ІІІ ФК | 25 (83,3%) | 237 (73,1%) | NS |
| ІV ФК | 2 (6,6%) | 20 (6,1%) | NS |
| Фракція викиду, % | 44,2±8,5% | 44,05±10,1% | – |
Серед супутніх захворювань у хворих із подагрою достовірно частіше виявляли цукровий діабет 2-го типу — 17 (56,6%) пацієнтів проти 73 (22,5%) без подагри (p<0,01), аналогічна ситуація спостерігалася з ожирінням — 18 (60%) серед пацієнтів з подагрою проти 115 (35,4%) без подагри (р<0,01). Слід відмітити значну кількість пацієнтів з хронічною хворобою нирок G3–G4 стадій серед пацієнтів з подагрою — 19 (63,3%) проти 105 (32,4%) без подагри (р<0,01). Детальний аналіз коморбідних станів пацієнтів з подагрою представлено в табл. 3.
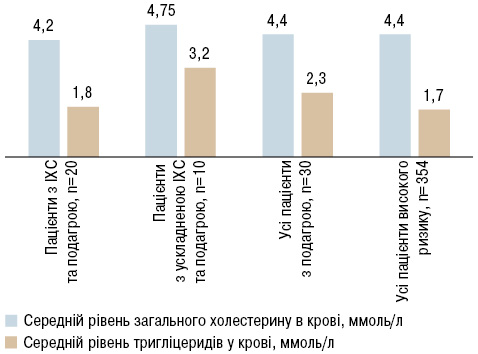
Аналіз ліпідограми пацієнтів з подагрою під час надходження показав, що для пацієнтів з порушеним обміном сечової кислоти характерна гіпертригліцеридемія, найвищі значення ліпідів спостерігалися у пацієнтів з ускладненими формами ІХС (рис.1).
| Пацієнти з подагрою, n=30 | Пацієнти без подагри, n=324 | р | |
|---|---|---|---|
| Цукровий діабет 2-го типу | 17 (56,6%) | 73 (22,5%) | <0,01 |
| Порушення толерантності до глюкози | 9 (30%) | 152 (46,9%) | NS |
| Гіпотиреоз | 2 (6,6%) | 9 (2,7%) | NS |
| Зайва маса тіла | 8 (26,6%) | 146 (45,06%) | NS |
| Ожиріння | 18 (60%) | 115 (35,4%) | <0,01 |
| Нормальна маса тіла | 4 (13,3%) | 63 (19,4%) | NS |
| Гостре порушення мозкового кровообігу в анамнезі | 4 (13,3%) | 39 (12,03%) | NS |
| Стенози ВСА >50% | 8 (26,6%) | 87 (26,8%) | NS |
| Хронічна хвороба нирок G3–G5 | 19 (63,3%) | 105 (32,4%) | <0,01 |
| Хронічне обструктивне захворювання легень | 22 (73,3%) | 257 (79,3%) | NS |
| Куріння | 16 (53,3%) | 244 (75,3%) | <0,01 |
| Варикозне розширення вен нижніх кінцівок | 15 (50%) | 96 (29,6%) | <0,05 |
Серед пацієнтів з подагрою 24 (80%) під час госпіталізації приймали блокатори β-адренорецепторів, статини отримували 23 (76,6%) хворих. Необхідно відмітити, що лише 3 (10%) пацієнти, потрапивши до лікарні, продовжували приймати препарати для лікування подагри, інші самостійно відміняли інгібітори ксантиноксидази разом з антиагрегантами та антикоагулянтами.
Передопераційна стратифікація ризику пацієнтів за шкалами показала, що у хворих на подагру відмічали вищий ризик ускладнень за усіма шкалами, не дивлячись на те, що жодна шкала не враховує рівень сечової кислоти в крові. Так, серед пацієнтів з подагричним артритом ризик летального наслідку за Європейською логістичною шкалою EuroSCORE I становив 28,6%, EuroSCORE II — 9,4% та за американською шкалою STS — 3,71%, у той час як при стратифікації ризику пацієнтів без подагри (n=324) ризик ускладнень становив 24,1, 8,7 та 3,1% відповідно. Аналогічно за шкалою STS для пацієнтів з подагрою був характерним більш високий прогнозований ризик додаткових ускладнень у порівнянні з усіма хворими — виникнення гострого пошкодження нирок 4,5 проти 2,5%, виникнення гострого порушення мозкового кровообігу — 1,8 проти 1,45%, тривала штучна вентиляція легень (ШВЛ) — 14,08 проти 10,7%, ризик реоперації — 3,1 проти 2,9%, захворюваність та смертність — 20,7 проти 15,6% та тривалий термін перебування у стаціонарі — 8,5 проти 6,6%. Детальну інформацію про стратифікацію ризику у пацієнтів з подагрою та без представлено в табл. 4.
| Показник | Усі пацієнти з подагрою, n=30 | Усі пацієнти дослідної групи, n=354 | Пацієнти без подагри, n=324 |
|---|---|---|---|
| Середній ESA
[діапазон] ESL, % [діапазон] |
10,1
[6–18] 28,6 [7,1–78,8] |
9,4
[6–20] 24,5 [5,96–89,6] |
9,4
[6–20] 24,1 [5,96–89,6] |
| Середній ES II
[діапазон] |
9,4
[5,01–39,38] |
8,8
[5,01–68,2] |
8,7
[5,01–68,2] |
| Середній STS, %
[діапазон] |
3,78
[0,53–27,3] |
3,2
[0,4–42,2] |
3,1
[0,4–42,2] |
| Середній STS, гостра ниркова недостатність, %
[діапазон] |
4,5
[0,19–28,3] |
2,75
[0,05–60,6] |
2,5
[0,05–60,6] |
| Середній STS, гостре порушення мозкового кровообігу, %
[діапазон] |
1,8
[0,56–6,4] |
1,48
[0,2–6,8] |
1,45
[0,2–6,8] |
| Середній STS, тривала ШВЛ, %
[діапазон] |
14,08
[3,74–59,1] |
10,9
[0,2–82,8] |
10,7
[0,2–82,8] |
| Середній STS, раньова інфекція, %
[діапазон] |
0,39
[0,1–0,8] |
0,28
[0,07–1,3] |
0,27
[0,07–1,3] |
| Середній STS, реоперація, %
[діапазон] |
3,1
[1,07–8,6] |
2,9
[0,9–9,4] |
2,9
[0,9–9,4] |
| STS, захворюваність і смертність, %
[діапазон] |
20,7
[6,3–74,2] |
16,1
[4,4–91,4] |
15,6
[4,4–91,4] |
| Середній STS, коротке перебування, %
[діапазон] |
33,7
[5,09–70,7] |
40,9
[1,5–87,3] |
41,6
[1,5–87,3] |
| Середній STS, тривале перебування, %
[діапазон] |
8,5
[1,45–30,1] |
6,8
[0,9–64,8] |
6,6
[0,9–64,8] |
Оперативне втручання проводилося в екстреному порядку у 7 (23,3%) пацієнтів з подагрою, у яких середній час відміни антиагрегантної та антикоагулянтної терапії становив 2,4±1,9 добу. Серед пацієнтів, яким було проведено хірургічну реваскуляризацію міокарда у плановому порядку, середній час відміни антиагрегантів становив 5,8±4,4 доби. Операція була виконана в середньому на 9,4±4,2 добу з моменту госпіталізації, що було пов’язано з загостренням подагричного артриту на тлі самостійної відміни інгібіторів ксантиноксидази пацієнтами. Усі оперативні втручання у разі неускладненої форми ІХС виконувалися на працюючому серці. Операційний етап лікування пацієнтів з подагрою характеризувався більшою кількістю шунтів — 3,3 проти 3,04 у пацієнтів без подагри та частим використанням внутрішньої грудної артерії — 66,6% проти 55,8%. При порівнянні інтраопераційних знахідок у пацієнтів з та без порушень обміну сечової кислоти було виявлено, що за наявності подагри було відмічено більший діаметр вінцевих артерій басейну лівої коронарної артерії та менший діаметр гілок правої коронарної артерії, переважання кальцинозу вінцевих артерій (16,6 проти 6,7%), малого діаметру артерій (16,6 та 9,5%) та інтрамурального розташування коронарних артерій (56,6 проти 19,7%).
Із анестезіологічних особливостей привертає увагу менша тривалість операції у пацієнтів з подагрою 276,9±61,07 хв проти 284,6±84,1 хв без подагри, меншою тривалістю ШВЛ 7,3±2,9 год проти 9,8±2,4 год відповідно та меншою кількістю гемотрансфузій —11 (36,6%) проти 138 (42,5%).
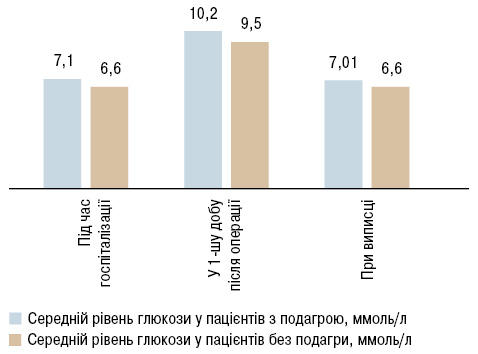
Ранній післяопераційний період у пацієнтів з порушенням обміну сечової кислоти характеризувався достовірно частішим розвитком фібриляції передсердь (ФП) у пацієнтів з подагрою — 43,3 проти 14,6% пацієнтів без подагри (p<0,01). У післяопераційний період інфекція рани груднини у пацієнтів з подагрою виникла у 2 (6,66%) випадках, які потребували виконання стернопластики з накладанням вторинних швів на груднину за Донаті, у той час як у пацієнтів без подагри частота виникнення раньової інфекції становила 1,23% (р<0,01). Хоча розвиток раньової інфекції у пацієнтів з подагрою більше асоційований із супутнім цукровим діабетом 2-го типу. У пацієнтів з порушенням обміну сечової кислоти достовірно частіше виникала пневмонія (6,66 проти 0,92%, р<0,05), загострення виразки гастродуоденальної ділянки (6,66 проти 0,3%, р<0,01). Ретельне спостереження та своєчасне реагування на показники крові дозволяє уникнути негативних наслідків. Для всіх пацієнтів з подагричним артритом характерним є підвищення рівня глюкози в першу післяопераційну добу з субнормалізацією показника глюкози в крові під час виписки. Динаміка середнього рівня глюкози в крові в періопераційний період у пацієнтів з та без подагри представлений на рис. 2.
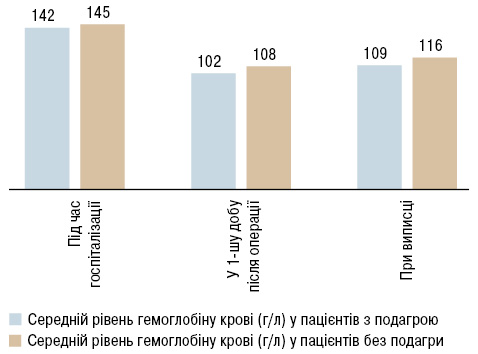
Аналіз середнього рівня гемоглобіну у пацієнтів з подагрою та без показав, що серед пацієнтів з подагрою вихідний рівень гемоглобіну є нижчим на 2% порівняно з таким у хворих без подагри, а у 1-шу добу після операції та під час виписки ця різниця становить 6%. Динаміка середнього рівня гемоглобіну у пацієнтів з та без порушення обміну сечової кислоти в періопераційний період представлена на рис. 3.
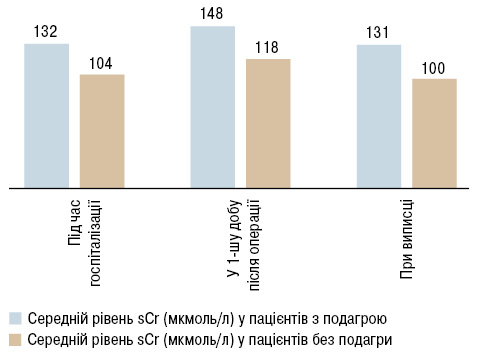
Для пацієнтів з подагричним артритом характерним є порушення ренальної функції, при порівнянні з пацієнтами без подагри виявлено підвищення рівня сироваткового креатиніну на 27% під час надходження, на 25% — у 1-шу добу після операції та на 31% — при виписці. Динаміка середнього рівня сироваткового креатиніну представлена на рис. 4.
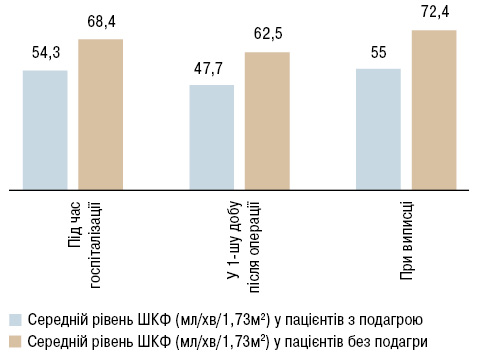
Під час розрахунку швидкості клубочкової фільтрації (ШКФ) за формулою CKD-EPI для пацієнтів з подагрою, у порівнянні з пацієнтами без подагри було характерним зниження ШКФ під час надходження на 21%, а у 1-шу добу після операції та при виписці — на 24%, що представлено на рис. 5.
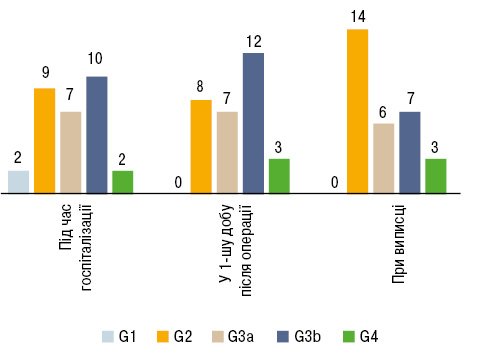
Гостре пошкодження нирок зі збільшенням сироваткового креатиніну на 50% виникло у 1 (3,3%) пацієнта з подагрою, у 9 (2,7%) хворих без подагри. Динаміка стадійності хронічної хвороби нирок у періопераційний період у пацієнтів із подагрою представлена на рис. 6.
Виписка пацієнтів з подагрою в середньому відбувалася на 9,4±4,2 добу, а серед пацієнтів без подагри — на 8,8±4,3 добу.
Висновки
1. Серед 354 пацієнтів з ІХС високого кардіохірургічного ризику у 30 (8,47%) хворих було виявлено подагру, за якої достовірно частіше діагностували цукровий діабет 2-го типу (56,6 проти 22,5% без подагри, p<0,01), хронічну хворобу нирок G3a-4 стадії (63,3 проти 32,4% без подагри, р<0,01), ожиріння (60 проти 35,4% без подагри, р<0,01), варикозне розширення вен нижніх кінцівок (50 проти 29,6%, р<0,05).
2. Операційний етап пацієнтів з подагрою характеризувався більшою кількістю шунтів — 3,3 проти 3,04 та частим використанням внутрішньої грудної артерії (66,6% проти 55,8%). При порівнянні інтраопераційних знахідок у пацієнтів з та без порушень обміну сечової кислоти, у разі наявності подагри було відмічено переважання кальцинозу вінцевих артерій (16,6 проти 6,7%), малого діаметру артерій (16,6 та 9,5%) та інтрамурального розташування коронарних артерій (56,6 проти 19,7%).
3. Післяопераційний період у пацієнтів з порушенням обміну сечової кислоти характеризувався достовірно частішим розвитком фібриляції передсердь у пацієнтів з подагрою — 43,3 проти 14,6% (p<0,01), пневмонії (6,66 проти 0,92%, р<0,05), загострення виразки гастродуоденальної ділянки (6,66 проти 0,3%, р<0,01) та інфекції рани грудини (6,66 проти 1,23%, р<0,01).
4. Враховуючи високий ризик ускладнень у пацієнтів з подагрою, рекомендовано контролювати рівень сечової кислоти у всіх хворих перед кардіохірургічним втручанням для попередження негативного впливу цього патологічного стану на організм.
5. З метою профілактики виникнення загострень подагричного артриту не рекомендовано відміняти інгібітори ксантиноксидази перед операцією.
Список використаної літератури
- 1. Choi H.K., Mount D.B., Reginato A.M. (2005) Pathogenesis of gout. Ann Intern Med., 143: 499–516.
- 2. Liu S.C., Xia L., Zhang J. et al. (2015) Gout and risk of myocardial infarction: a systematic review and meta-analysis of cohort studies. PLoS ONE, 10: e0134088. doi: 10.1371/journal.pone.0134088.
- 3. Clarson L.E., Hider S.L., Belcher J. et al. (2015) Increased risk of vascular disease associated with gout: a retrospective, matched cohort study in the UK clinical practice research datalink. Ann Rheum Dis, 74: 642–7. doi: 10.1136/annrheumdis-2014-205252.
- 4. Baker J.F., Schumacher H.R., Krishnan E. (2007) Serum uric acid level and risk for peripheral arterial disease: analysis of data from the multiple risk factor intervention trial. Angiology, 58: 450–7. doi: 10.1177/0003319707303444.
- 5. Seminog O.O., Goldacre M.J. (2013) Gout as a risk factor for myocardial infarction and stroke in England: evidence from record linkage studies. Rheumatology (Oxford), 52: 2251–9. doi: 10.1093/rheumatology/ket293.
- 6. Krishnan E., Akhras K.S., Sharma H. et al. (2013) Relative and attributable diabetes risk associated with hyperuricemia in US veterans with gout. QJM, 106: 721–9. doi: 10.1093/qjmed/hct093.
- 7. Perez-Ruiz F., Martínez-Indart L., Carmona L. et al. (2014) Tophaceous gout and high level of hyperuricaemia are both associated with increased risk of mortality in patients with gout. Ann Rheum Dis, 73: 177–82. doi: 10.1136/annrheumdis-2012-202421.
- 8. Choi H.K., Curhan G. (2007) Independent impact of gout on mortality and risk for coronary heart disease. Circulation, 116: 894–900.
- 9. Bardin T., Bouée S., Clerson P. et al. (2016) Prevalence of gout in the Adult Population of France. Arthritis Care Res (Hoboken), 68: 261–6. doi: 10.1002/acr.22660
- 10. Kuo C.F., Grainge M.J., Mallen C. et al. (2015) Rising burden of gout in the UK but continuing suboptimal management: a nationwide population study. Ann Rheum Dis, 74: 661–7. doi: 10.1136/annrheumdis-2013-204463.
- 11. Khanna D., Fitzgerald J.D., Khanna P.P. et al. (2012) 2012 American College of Rheumatology guidelines for management of gout, part 1: systematic nonpharmacologic and pharmacologic therapeutic approaches to hyperuricemia. Arthritis Care Res (Hoboken), 64: 1431–1446.
- 12. Lyngdoh T., Marques‐Vidal P., Paccaud F. et al. (2011) Elevated serum uric acid is associated with high circulating inflammatory cytokines in the population‐based colaus study. PLoS One, 6: e19901.
- 13. Ugurlucan M., Filizcan U., Caglar I.M. et al. (2012) Coronary artery bypass grafting in a patient with gout arthritis. J Cardiovasc Dis Res., 3(1): 52–54. doi: 10.4103/0975-3583.91591
- 14. Tavil Y., Sen N., Hizal F. et al. Relationship between elevated levels of serum uric acid and saphenous vein graft disease. Turk Kardiyol Dern Ars. 2008 Jan;36(1):14-8.
- 15. Singh, T.P., Skalina, T., Nour, D. et al. (2018) A meta-analysis of the efficacy of allopurinol in reducing the incidence of myocardial infarction following coronary artery bypass grafting. BMC Cardiovasc Disord, 18: 143.
- 16. Tabayashi K., Suzuki Y., Nagamine S. et al. (1991) A clinical trial of allopurinol (Zyloric) for myocardial protection. J Thorac Cardiovasc Surg., 101(4): 713–8.
- 17. Singh, T.P., Skalina T., Nour D. et al. (2018) A meta-analysis of the efficacy of allopurinol in reducing the incidence of myocardial infarction following coronary artery bypass grafting. BMC Cardiovasc Disord, 18: 143.
- 18. Guthikonda S., Sinkey C., Barenz T. et al. (2003) Xanthine oxidase inhibition reverses endothelial dysfunction in heavy smokers. Circulation., 107(3): 416–21.
- 19. MacIsaac R.L., Salatzki J., Higgins P., et al. (2016) Allopurinol and cardiovascular outcomes in adults with HypertensionNovelty and significance. Hypertension., 67(3): 535–40.
- 20. Weimert N.A., Tanke W.F., Sims J.J. (2003) Allopurinol as a cardioprotectant during coronary artery bypass graft surgery. Ann Pharmacother., 37(11): 1708–11.
Особенности периоперационного периода у пациентов высокого риска с ИБС и подагрой в кардиохирургической практике
ГУ «Национальный Институт сердечно-сосудистой хирургии им. Н.М. Амосова НАМН Украины».
Резюме. Цель: изучить особенности периоперационного периода у пациентов с ишемической болезнью сердца (ИБС) высокого риска и подагрой в кардиохирургической практике. Материал и методы: проведен ретроспективный анализ 354 пациентов с ИБС высокого риска. Всем больным проведены электрокардиография, эхокардиография, коронарография и хирургическое лечение ИБС. В рамках этого исследования скрининг гиперурикемии не проводили, фиксировали только пациентов с приступами подагрического артрита. Результаты: среди 354 пациентов с ИБС высокого кардиохирургического риска у 30 (8,47%) больных была выявлена подагра, при которой достоверно чаще диагностировали сахарный диабет 2-го типа (56,6 против 22,5% без подагры, p<0, 01), хроническую болезнь почек G3a-4 стадии (63,3% против 32,4% без подагры, р<0,01), ожирение (60 против 35,4% без подагры, р<0,01), варикозное расширение вен нижних конечностей (50 против 29,6%, р<0,05). Операционный этап пациентов с подагрой характеризовался большим количеством шунтов — 3,3 против 3,04 и частым использованием внутренней грудной артерии (66,6 против 55,8%). При сравнении интраоперационных находок у пациентов с и без нарушений обмена мочевой кислоты в случае наличия подагры было отмечено преобладание кальциноза коронарных артерий (16,6 против 6,7%), малого диаметра артерий (16,6 и 9,5%) и интрамурального расположения коронарных артерий (56,6 против 19,7%). Послеоперационный период пациентов с нарушением обмена мочевой кислоты характеризовался достоверно более частым развитием фибрилляции предсердий у пациентов с подагрой — 43,3 против 14,6% (p<0,01), пневмонии (6,66 против 0,92%, р<0,05), обострения язвы гастродуоденальной области (6,66 против 0,3%, р<0,01) и инфекции раны грудины (6,66 против 1,23%, р <0,01). Выводы: учитывая высокий риск развития осложнений у пациентов с подагрой, рекомендуется контролировать уровень мочевой кислоты у всех больных перед кардиохирургическим вмешательством для предотвращения негативного влияния этого патологического состояния на организм. С целью профилактики возникновения обострений подагрического артрита не рекомендуется отменять ингибиторы ксантиноксидазы накануне операции.
Ключевые слова: пациент высокого риска, ишемическая болезнь сердца, подагра, реваскуляризация миокарда, коморбидность.
Адреса для листування:
Гогаєва Олена Казбеківна
02000, Київ, вул. Миколи Амосова, 6
ДУ «Національний інститут серцево-судинної хірургії
ім. М.М. Амосова НАМН України»
E-mail: olenagogayeva@gmail.com

Leave a comment