РЕВМАТОЇДНИЙ АРТРИТ І КОМОРБІДНИЙ ПАРОДОНТИТ: КЛІНІКО-ПАТОГЕНЕТИЧНІ ОСОБЛИВОСТІ ЗВ’ЯЗКІВ
Синяченко О.В., Єрмолаєва М.В., Лівенцова К.В., Верзілов С.М., Алієва Т.Ю., Гавілей Д.О.
Резюме. Актуальність. Коморбідний пародонтит підсилює системне імунне запалення при ревматоїдному артриті (РА), підвищуючи чутливість хворих до аутоантигенів. РА і пародонтит мають подібні остеоклазію, алельні гени та загальний дисбаланс стану цитокінової мережі, але спільність патогенетичних механізмів потребує подальшого вивчення. Мета і завдання дослідження: вивчити особливості перебігу РА на тлі коморбідного пародонтиту, визначити роль ясенної мікробіоти в патогенетичних побудовах обох захворювань, оцінити властивості ротової рідини при пародонтиті й РА, значимість змін фізико-хімічних, імуноферментних та біохімічних показників. Матеріали і методи. Під спостереженням перебували 173 хворих на РА. Для оцінки кількості мікроорганізмів на слизовій оболонці ясен використовували методику стерильних паперових дисків. Вивчали фізико-хімічні адсорбційно-реологічні властивості ротової рідини, рівні в ній прозапальних цитокінів, концентрацій окремих фракцій молекул середньої маси (МСМ). Результати. У 46% хворих на РА діагностовано коморбідний пародонтит, розвиток якого був тісно пов’язаний з активністю та стадією суглобового синдрому, наявністю системного остеопорозу, серопозитивністю захворювання за ревматоїдним фактором і антитілами до циклічного цитрулінового пептиду. Виявлено підвищення концентрації в ротовій рідині прозапальних цитокінів, зростання рівня МСМ усіх фракцій, що пов’язано з тяжкістю перебігу і суглобового синдрому, і пародонтиту, особливостями ясенної мікробіоти. Висновки. Отримані дані свідчать про спільність патогенетичних побудов РА і коморбідного пародонтиту, обґрунтовують можливість розроблення нових підходів до індивідуальної патогенетичної терапії РА з урахуванням етіології фонової оральної патології, оцінки активності запального процесу, прогнозування характеру перебігу хвороби та ефективності лікування.
УДК 616.72:616.314.17-008]-07-092
DOI: 10.32471/rheumatology.2707-6970.82.15656
Актуальність
Нині розвивається концепція «пародонтасоційованого ревматоїдного артриту», якою намагаються пояснити причинну роль патобіонтів пародонта в ініціюванні суглобової патології (Kumar P.S. 2017; Grevich S. et al., 2019). Зазначимо, що у пацієнтів із ревматоїдним артритом (РА) частота пародонтиту (ПД) приблизно у 2–4 рази вища, ніж у популяції (Ouedraogo D.D. et al., 2017), при цьому перебіг обох захворювань більш агресивний (Hamevose-Poulsen A. et al., 2006). Чинником ризику ПД є також експериментальний артрит на моделях у тварин (Graves D.T. et al., 2019). Зазначимо і зворотний зв’язок обох захворювань, коли ПД спричиняє виникнення і прогресування РА (KonkelJ.E. et al., 2019).
Уже доведено, що ПД посилює несприятливий перебіг РА шляхом синтезу прозапальних ферментів своїми патогенами, які цитрулюють білки (Rajkarnikar J. et al., 2018; Correa J.D. et al., 2019). РА і ПД пов’язані із загальними імунозапальними реакціями дисбалансу патогенетичних побудов обох захворювань (Fuggle N.R. et al., 2016; Correa M.G. et al., 2018), мають схожість остеоклазії, алельних генів і спільний дисбаланс стану цитокінової мережі (Gamel E.B. et al. 2017; Li R. et al. 2017; Issaranggun Na Ayuthaya B. et al., 2018). Існує гіпотеза, згідно з якою механізм резорбції кістки при ПД — в основі прогресування суглобових ерозій у хворих на РА (Smolik I. et al., 2009).
Мета і завдання дослідження
Мета дослідження — вивчити особливості клініко-лабораторного та рентгено-сонографічного перебігу РА на тлі коморбідного ПД, визначити роль ясенної мікробіоти (мікробіому) в патогенетичних побудовах обох захворювань, оцінити властивості ротової рідини при патології порожнини рота й опорно-рухового апарату, значимість змін фізико-хімічних, імуноферментних та біохімічних показників.
Пацієнти і методи дослідження
Під спостереженням перебували 173 хворих на РА віком 18–76 (в середньому — 45,8±0,90) років, серед яких — 20,8% чоловіків і 79,2% жінок. Тривалість захворювання від першої його маніфестації становила 2–30 (в середньому — 10,0±0,56) років. І, ІІ і ІІІ ступені загальної активності РА (AAG) відповідно констатовані у 26,0; 43,9 і 30,1% хворих, а співвідношення I, II, III і IV стадій (ARS) патологічного процесу становило 1:6:5:3. Серопозитивність РА за ревматоїдним фактором (RF) — 74,6% хворих, а за антитілами до циклічного цитрулінового пептиду (аССР) — 72,8%. Хронічний генералізований ПД діагностовано у 79 (45,7%) хворих на РА, яких включено в основну групу спостережень, а групу порівняння становила решта (54,3%) пацієнтів із наявним РА.
Підраховували індекси Річі (RI), Лансбурі (LI), активності артриту для 28 суглобів (DAS), інтегральної тяжкості (SAI) і прогресування артриту (PAI). Показник DAS визначали за формулою: DAS=[( 0,54)+(J·0,065)+(lnQ·0,33)+0,224]·1,072+0,94, де J — кількість болючих суглобів, Q — швидкість осідання еритроцитів. Параметр SAI вираховували за формулою: SAI=
0,54)+(J·0,065)+(lnQ·0,33)+0,224]·1,072+0,94, де J — кількість болючих суглобів, Q — швидкість осідання еритроцитів. Параметр SAI вираховували за формулою: SAI=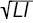 ·DAS, а PAI визначали за такою формулою: PAI=[(ARS)2+∑]:d, де ∑ — сума рентгеносонографічних ознак РА, d — тривалість клінічної маніфестації захворювання.
·DAS, а PAI визначали за такою формулою: PAI=[(ARS)2+∑]:d, де ∑ — сума рентгеносонографічних ознак РА, d — тривалість клінічної маніфестації захворювання.
З використанням комп’ютерного тензіометра «PAT2-Sinterface» (Німеччина) вивчали адсорбційно-реологічні показники змивів із порожнини рота (ротової рідини) — поверхневий натяг (ST), модуль в’язкоеластичності (VE) і час релаксації (RT). У ротовому лікворі та сироватці крові імуноферментним методом (рідер «PR2100 Sanofi diagnostic pasteur», Франція) досліджували вміст прозапальних цитокінів (інтерлейкіну (IL)-1β і фактора некрозу пухлини (TNF-α)), співвідношення їх концентрацій у цих біологічних рідинах (відповідно W і Y), а спектрофотометрично («СФ46», Росія) досліджували вміст окремих фракцій молекул середньої маси — амінопептидної (AF), пептидної (PF), нуклеотидної (NF) і хроматофорної (CF), підраховували показник усередненої фракції молекул середньої маси в оральних змивах (X) та його співвідношення з аналогічним параметром у сироватці крові (Q). Для вивчення рівнів молекул середньої маси в біологічних рідинах застосовували скринінговий метод, заснований на осадженні білків розчином трихлороцтової кислоти з подальшим визначенням спектрів поглинання світла кислоторозчинною фракцією. У сироватці крові імуноферментним методом досліджували вміст aCCP, а рівні RF, С-реактивного протеїну (CRP) і фібриногену (FG) вивчали за допомогою аналізатора «Olympus-AU-640» (Японія). Як контроль лабораторні показники досліджено у 30 практично здорових людей (11 чоловіків і 19 жінок) віком 18–62 (в середньому — 36,5±0,41) років.
Тяжкість перебігу ПД оцінювали за індексами Рамфьорда, Рассела, Сільнесса — Лое і «потреби в лікуванні пародонту», а їхній усереднений показник характеризував інтегральний індекс тяжкості ПД (SPII). Проведено дослідження мікробіома слизової оболонки ясен у контексті аеробної (факультативно-анаеробної) та анаеробної флори. Використовували тіогліколеве живильне середовище з додаванням агару «Діфко», крові та дріжджового гідролізату, застосовували набори «Мікро-Ла-Тест», «Стрептотест-16», «Анаеро-Тест-23», «Неферм-Тест-24». Мінімальний ступінь вираженості ПД констатовано у 35,4% хворих на РА, помірний — у 36,7%, високий — у 27,9%, а показник SPII становив 3,01±0,380 бала. У деяких випадках виконували мікробіопсію слизової оболонки ясен, а гістологічні препарати забарвлювали гематоксиліном й еозином.
Усім хворим виконували рентгенологічне дослідження суглобів та міжзубних альвеолярних перегородок (внутрішньоротова прицільна рентгеноортопантографія) («Multix-Compact-Siеmens», Німеччина), ультразвукове дослідження опорно-рухового апарату («Envisor-Philips», Нідерланди) і двохенергетичну рентгенівську остеоденситометрію стегна («QDR-4500-Delphi-Hologic», США). Оцінювали периферичний рентгенологічний метакарпальний індекс Барнетта — Нордина (BNI) та індекс мінеральної щільності кістки (BMD).
Статистичне оброблення результатів досліджень проведено за допомогою програм «Microsoft Excel» і «Statistica-Stat-Soft» (США). Оцінювали середні значення, їх стандартні похибки й відхилення, коефіцієнти параметричної кореляції Пірсона та непараметричної Кендалла, критерії дисперсії, однорідності дисперсії Брауна — Форсайта, багатофакторного аналізу Вілкоксона — Рао, відмінностей Стьюдента та Макнемара — Фішера, а також вірогідність статистичних показників.
Результати та їх обговорення
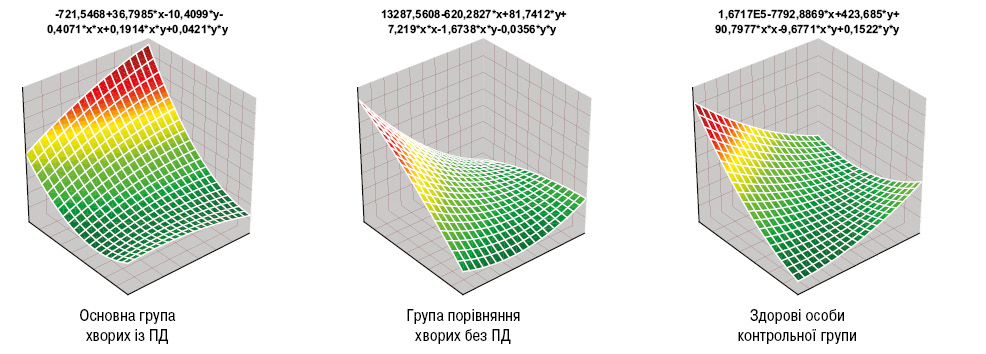
У группі РА з ПД показник AAG становив 2,6±0,06 бала, DAS — 5,2±0,12 в.о., ARS — 2,6±0,10 аLI — 157,4±7,89 бала, PAI — 1,9±0,25 в.о., SAI — 97,2±2,44 в.о., BNI — 41,4±0,56·102 в.о., BMD — 1,9±0,25 –SD, RF — 16,6±2,91 мО/мл, aCCP — 29,1±1,51 О/мл, CRP — 18,5±0,90 мг/л, FG — 9,7±0,47 г/л, IL-1β — 13,7±0,58 пг/мл, TNF-α — 54,2±3,96 пг/мл. За даними дисперсійного аналізу на розвиток ПД впливають серопозитивність РА за RF і aCCP, а також наявність системного остеопорозу, що у представників основної групи, за даними аналізу Макнемара — Фішера, виявлено вірогідно частіше, відповідно на 16,3; 19,4 та 19,7%. Формування ПД супроводжувалося (рис. 1) достовірно вищими (на 73,3%) показниками AAG, на 23,8% DAS, на 19,9% LI, на 12,9% SAI, на 35,7% BMD, на 47,0% aCCP, на 65,2% CRP, на 83,0% FG, на 98,6% IL-1β.
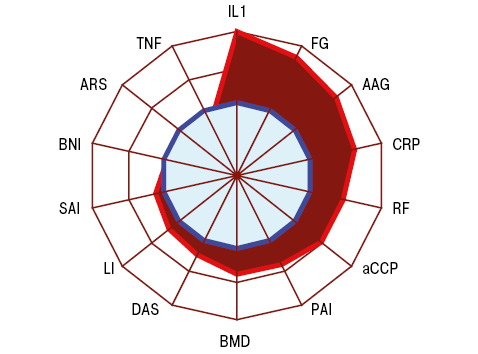
За результатами аналізу однорідності дисперсії Брауна — Форсайта, на SPII надають достовірну дію показники AAG, DAS, ARS, LI, SAI, BNI, aCCP, FG і IL-1β, а, в свою чергу, від SPII залежать параметри LI, aCCP і FG. Таким чином, при підозрі на наявність коморбідного ПД у хворих на РА з ураженням великих суглобів (колінних, плечових, кульшових) показано дослідження у крові аССР та FG, показники яких можуть мати певну прогностичну значущість одночасно щодо тяжкості перебігу основного захворювання і коморбідного ПД. Зазначимо, що SPII мав місце прямий кореляційний зв’язок Пірсона з рівнем CRP у крові.
Як свідчить однофакторний дисперсійний аналіз (рис. 2), на SPII зумовлюють вірогідний вплив вегетації на яснах стрептококів, мораксел, сарцинів, бактеріоїдів, псевдомонів, еубактерій, фузобактерій, пропіонібактерій і стафілококів. При цьому наявні прямі дисперсійно-кореляційні зв’язки відносно мікробної кількості аеробів і анаеробів. Зі SPII прямо корелюють ураження верхньощелепних, променезап’ясткових та колінних суглобів, формування в них артрокальцинатів.
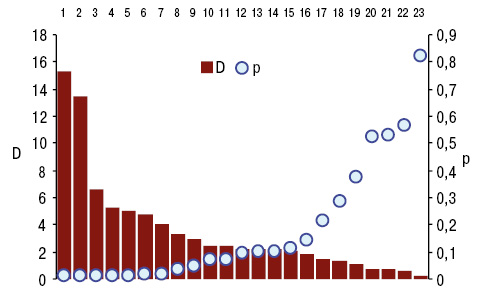
Дані літератури свідчать про те, що при РА SPII прямо корелює з рівнями СRP, RF і aCСР, відображаючи AAS та DAS (Мазур І.П., Білозецький І.І., 2014; Coburn B.W. et al., 2015). Втрата толерантності до цитрульованих антигенів із подальшим процесом утворенням aCCP може запускатися в пародонті під дією мікробної флори. Зазначимо, що наявна кореляція між тяжкістю ПД і рівнем антицитрулінових протеїнів (Molitor J.A. et al., 2009). У хворих на РА з ПД найвища активність у тканинах пародонта пептидиларгініндезаміназа-2 і -4 (Laugisch O. et al., 2016; Engström M. et al., 2018), які є факторами вірулентності патогенних видів бактерій (особливо Porphyromonas gingivalis) і генерують фрагменти білка з цитруліновими С-кінцями, які вважаються одними з ключових чинників патогенезу суглобового синдрому (Aliko A. et al., 2018; Su W. et al., 2020).
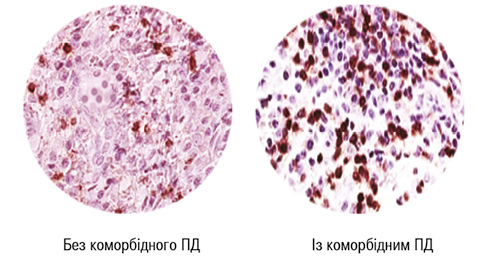
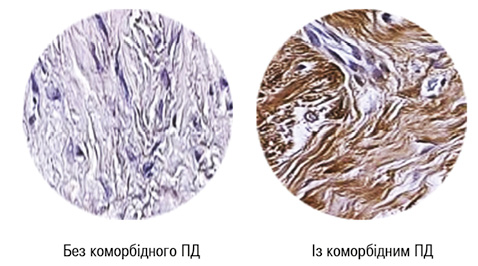
Як демонструє багатофакторний аналіз Вілкоксона — Рао, вираженість коморбідного ПД значно впливає на інтегральні лабораторні показники активності РА й тяжкість перебігу суглобового синдрому. Відзначено прямі кореляційні зв’язки Кендалла з BNI, BMD і IL-1β. Зроблено такі рекомендації: 1) тяжкий коморбідний ПД у хворих на РА є чинником ризику розвитку остеопорозу; 2) в патогенетичних побудовах ПД при РА перш за все бере участь IL-1β. Прозапальні цитокіни IL-1β, -8, -12, -17 та TNF-α, рівень аССР і активність матриксних металопротеїназ у периферичній крові позитивно співвідносяться з тяжкістю патології порожнини рота, параметрами оральної мікробіоти і AAG РА (Eriksson K. et al., 2019; Möller B. et al., 2020). Підвищена депозиція цитрульованих білків спостерігається у сполучній тканині ясен у 80% хворих на РА з коморбідним ПД і у 27% випадків здорової тканини ясен (рис. 3–4), тоді як в ясенному епітелії ніяких відмінностей не виявлено (Engström M. et al., 2018).
Поки не вдалося довести наявність зв’язку розвитку РА з тим чи іншим конкретним етіологічним бактеріальним фактором, однак накопичується все більше даних про роль мікробіома в цьому процесі, а порожнина рота розглядається як один з основних біотопів (ділянок рясного заселення мікроорганізмами) (Galushko E.A., Gordeev A.V., 2016). встановлено, що при РА достовірно збільшується кількість випадків коморбідної інфекційної патології (Gabriel S.E., 2017), а мікробіом може впливати на доклінічну фазу РА шляхом зсувів у складі мікрофлори (дисбіоз), діючи як мішень для дисрегуляції імунної системи організму (Pischon N. et al., 2018).
Тригерними чинниками щодо розвитку РА, імовірно, є інфекції, пов’язані з протеєм і мікоплазмою (Silman A.J., Pearson J.E., 2018), актиноміцетами, кампілобактерами, порфіромонами, стрептококами і фузобактеріями (Engström M. et al., 2018; Han Y.W., Wang X., 2018; Vitkov L. et al., 2018), преводелами та селеномонами (Graves D.T. et al., 2019). На найбільшу увагу заслуговує Porphyromonas gingivalis, який здатний відігравати важливу етіологічну роль у розвитку як ПД, так і РА, викликаючи дисрегуляцію місцевої імунної відповіді з подальшою стимуляцією дисбіозу (van Winkelhoff A.J. et al., 2002; Gordeev A.V. et al., 2018).
До 90% хворих на ПД в пародонтальних каналах наявні вегетації хоча б однієї з бактерій — порфіромонів, актиноміцетів, превотел, пептострептококів і кампілобактерів (Rams T.E. et al., 2016). Проведено серію робіт щодо вивчення експресії ДНК бактерій пародонта в суглобовому лікворі пацієнтів з РА (Moen K. et al., 2006; Martinez-Martinez R.E. et al., 2009). Якщо середня кількість виявлених видів ДНК бактерій у сироватці крові становила 6, то в синовії — 14, при цьому відзначено тісні зв’язки з розвитком ПД різних видів порфіромонів.
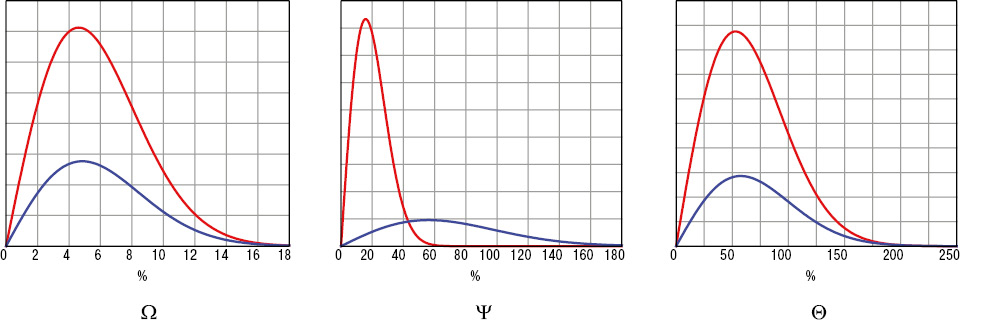
У хворих на РА показники ST ротової рідини становлять 46,9±0,28 мН/м, VE — 24,9±4,06 мН/м, RT — 127,4±7,78 с, IL-1β — 312,5±16,76 пг/мл, TNF-α — 270,8±10,98 пг/мл, W — 5,5±0,42%, Y — 33,7±3,90%, AF — 543,5±10,94 О/л, PF — 140,2±5,46 О/л, NF — 100,0±6,72 О/л, СF — 118,9±11,28 О/л, X — 225,7±8,36 О/л, Q — 60,4±4,61%. Порівняно з показниками у практично здорових людей контрольної групи встановлено вірогідне збільшення параметрів ST на 6,4%, IL-1β — у 22,0 раза, TNF-α — у 7,0 раза, AF на 12,5%, PF на 89,7%, NF у 2,5 раза, CF в 8,1 раза, X на 47,4% и Q на 43,8%, при зменшенні у 12,3 раза показника W і в 3,3 раза — Y. Наявність коморбідного ПД супроводжується достовірним підвищенням RT ротової рідини на 36,2%, при цьому констатовано зменшення на 11,5% параметра ST, на 70,2% Y, на 21,3% PF, на 31,2% NF, на 42,2% CF, на 16,0% X і на 30,2% — Q. Відмінності тривимірних інтегральних гістограм реологічних властивостей змивів порожнини рота (ST+VE+RT) у здорових людей і хворих на РА основної та контрольної груп подано на рис. 5, а гістограми Релея параметрів W, Y і Q — на рис. 6.
За даними багатофакторного дисперсійного аналізу Вілкоксона — Рао, тяжкість перебігу коморбідного ПД у хворих на РА впливає на інтегральні показники ротової рідини. Встановлено пряму кореляцію Пірсона показника SPII із вмістом у змивах порожнини рота IL-1β. Нами відібрані ті параметри ротової рідини, які одночасно мали дисперсійний зв’язок Брауна — Форсайта і кореляційний Кендалла з чинниками перебігу РА. Виявилося, що рівень ST обернено пов’язаний з наявністю у хворих системного остеопорозу, VE — з показником DAS, концентрація IL-1β прямо співвідноситься із AAG, а TNF-α — з ARS. Зазначено негативний зв’язок W і Y із BMD.
Однофакторний дисперсійний аналіз демонструє вплив вегетацій протея і псевдомонів у яснах на показники RT ротової рідини, AF, PF, NF, CF і X. Крім того, і вміст молекул середньої маси AF, PF, NF і CF у змивах порожнини рота був тісно пов’язаний з вегетацією на яснах мораксел. Міжфазна активність ротової рідини визначається наявністю сарцинів і стафілококів, а її в’язкопружні властивості — мегасфер. На показники W і Y відповідно впливають бактеріоїди і пропіонебактерії. Серед усієї вивченої ясенної мікробіоти не чинять впливу на характер ротової рідини актиноміцети, аерококи, біфідобактерії, ємели, кандиди, кишкова паличка, клостридії, коринебактерії, нейсерії, пептострептококи, стафілококи, фекальний лугоутворювач, фузобактерії, ентерококи, еубактерії. Зауважили імовірний зв’язок синтезу IL-1β зі ступенем обсіменіння порожнини рота аеробами, а TNF-α — анаеробами.
Аутоімунний «сухий синдром» Шегрена супроводжується достовірним зменшенням (на 11,0%) ST ротової рідини, що свідчить про накопичення у змивах цих хворих поверхнево-активних речовин білково-ліпідної природи (сурфактантів) та пригнічення концентрацій неорганічних інсурфактантів, що пригнічують міжфазну активність. Окрім того, у цих пацієнтів зростає синтез прозапального TNF-α на 32,7%. Зазначимо, що рівні прозапальних цитокінів IL-1β і TNF-α у крові при ПД прямо корелюють із тяжкістю патології порожнини рота, параметрами оральної мікробіоти і ступенем AAG (Eriksson K. et al., 2019; Möller B. et al., 2020). За даними однофакторного дисперсійного аналізу, наявність синдрому Шегрена у хворих на РА з коморбідним ПД впливає на ST ротової рідини, на показники в ній TNF-α і PF. У патогенетичних побудовах синдрому Шегрена при ПД у хворих на РА провідне значення має локальний синтез прозапального TNF-α. Зазначимо, що формування синдрому Шегрена у цих пацієнтів суттєво пов’язане з інфільтрацією ясен нейссеріями і фузобактеріями.
За даними літератури пацієнти з наявністю «сухого синдрому» демонструють вищий ступінь відходження ясен від поверхні зубів і більший вміст дріжджових мікроорганізмів у ротовій порожнині. Однак підвищена частота виявлення ПД при РА нібито не асоціюється з розвитком вторинного синдрому Шегрена (Gordeev A.V. et al., 2018). Відсутність відмінностей у ступені вираженості ПД у пацієнтів із цим синдромом і без нього дозволило зробити висновок про те, що патогенез резорбції кісток пародонта може мати спільні ланки з розвитком кістково-суглобової деструкції при РА (Kuru B. et al., 2002; Pers J.O. et al., 2005).
Гіпотетично розглядаються кілька механізмів негативного впливу ПД на патогенез РА: поширення інфекції порожнини рота через тимчасову бактеріємію, яка призводить до мікробної колонізації поза ротовою порожниною, системне ушкодження вільними токсинами патогенів порожнини рота і системне запалення, викликане розчинними антигенами патогенів пародонта (Han Y.W., Wang X., 2018). Ендотоксемія, викликана ПД, може підвищувати чутливість хворих на РА до аутоантигенів за рахунок активації мембранного білка, що належить до групи тол-подібного рецептора (TLR)-4, участі в розвитку і поширенні циркулюючої бактеріальної ДНК, активацією TLR9 (експресується на імуноцитах, включаючи дендритні клітини, макрофаги, природні кілери) (Vitkov L. et al., 2018). Kарбамілювання білків і утворення позаклітинних пасток нейтрофілів пов’язані з аутоімунними станами при поєднанні РА й ПД (Jashi L., Gogebashvili N., 2014; Kaneko C. et al., 2018).
Особлива етіопатогенетична значущість надається ясенним порфіромонам, які через активацію глутамілциклаз, продукцію прозапального IL-1β і моноцитарних хемоатрактантних білків-1 і -3 впливають на ланки формування як хронічного ПД, так і РА (Bender P. et al., 2019). При ПД у тканинах ясен істотно зростає рівень RANKL (сімейство цитокінів TNF) (Kawai T. et al., 2006), який прямо корелює зі ступенем активності захворювання і експресією остеопротегерину, регулюється гуанідинон-аміновалеріановою кислотою (Bostanci N. et al., 2007; Lu H.K. et al., 2016). Гіперпродукція RANKL при РА впливає на В-клітини ясен, які здатні розпізнавати порфіромони та інші бактерії, що синтезують у пародонті пептидиларгініндезаміназу (Berthelot J.M., Le Goff B., 2020), що відповідає за цитрулювання різних аутоантигенів (Rosenstein E.D. et al., 2004). Є дані про наявність загального гена HLA-DRB1-04 при РА і ПД (Stein J. et al., 2003; Marotte H. et al., 2006), причому у цих пацієнтів наявна пряма кореляція між деструкцією кісток зап’ястка і кістковим руйнуванням пародонта.
Висновки
1. Хронічний генералізований ПД діагностовано у 46% хворих на РА, розвиток якого пов’язаний з активністю та стадією суглобового синдрому, наявністю системного остеопорозу, серопозитивністю захворювання за RF і aCCP.
2. В етіопатогенезі ПД першорядне значення належить бактеріоїдам, моракселам, пропіонібактеріям, псевдомонам, сарцинам, стафілококам, стрептококам, фузобактеріям і еубактеріям.
3. Порівняно зі здоровими людьми контрольної групи при РА з ПД підвищується концентрація в ротовій рідині прозапальних цитокінів та зростає рівень молекул середньої маси всіх фракцій, при цьому параметри пов’язані з тяжкістю перебігу і суглобового синдрому, і ПД, який супроводжується більшим часом релаксації оральних змивів, але нижчою їх міжфазною активністю, співвідношенням рівнів цитокінів з їх вмістом у крові.
4. Наявні зв’язки окремих показників ротової рідини з вегетацією на яснах бактеріоїдів, біфідобактерій, кишкової палички, мегасфер, мораксел, нейсерій, пропіонібактерій, протея, псевдомонів, сарцинів і стрептококів.
5. Патологія порожнини рота бере участь у патогенезі остеопорозу, уражень верхньощелепних, променезап’ясткових і колінних суглобів, у формуванні артрокальцинатів і розвитку синдрому Шегрена.
6. Отримані дані свідчать про спільність патогенетичних побудов РА і коморбідного ПД, диктують необхідність розроблення нових підходів до медичної технології індивідуальної патогенетичної терапії РА з урахуванням етіології фонової оральної патології, виділення критеріїв, що дозволятимуть оцінювати активність запального процесу, прогнозувати характер перебігу хвороби та ефективність лікувальних заходів.
Список використаної літератури
- Мазур І.П., Білозецький І.І. (2014) Особливості перебігу генералізованого пародонтиту при ревматоїдному артриті. Укр. ревматол. журн. 57 (3): 59–63.
- Aliko A., Kamińska M., Bergum B. et al. (2018) Impact of Porphyromonas gingivalis peptidylarginine deiminase on bacterial biofilm formation, epithelial cell invasion, and epithelial cell transcriptional landscape. Sci. Rep., 8(1): 14144.
- Bender P., Egger A., Westermann M. et al. (2019) Expression of human and Porphyromonas gingivalis glutaminyl cyclases in periodontitis and rheumatoid arthritis-A pilot study. Arch. Oral Biol., 97(1): 223–230.
- Berthelot J.M., Le Goff B. (2020) Rheumatoid arthritis and periodontal disease. Joint Bone Spine, 77(6): 537–541.
- Bostanci N., Ilgenli T., Emingil G. (2007) Gingival crevicular fluid levels of RANKL and OPG in periodontal diseases: implications of their relative ratio. J. Clin. Periodontol., 345(5): 367–369.
- Coburn B.W., Sayles H.R., Payne J.B. et al. (2015) Performance of self-reported measures for periodontitis in rheumatoid arthritis and osteoarthritis. J. Periodontol., 86(1): 16–26.
- Correa J.D., Fernandes G.R., Calderaro D.C. et al. (2019) Oral microbial dysbiosis linked to worsened periodontal condition in rheumatoid arthritis patients. Sci Rep., 9(1): 8379.
- Correa M.G., Pires P.R., Ribeiro F.V. et al. (2018) Systemic treatment with resveratrol reduces the progression of experimental periodontitis and arthritis in rats. PLoS One, 13(10): 0204414.
- Engström M., Eriksson K., Lee L. et al. (2018) Increased citrullination and expression of peptidylarginine deiminases independently of P. gingivalis and A. actinomycetemcomitans in gingival tissue of patients with periodontitis. J. Transl. Med., 16(1): 214–219.
- Eriksson K., Fei G., Lundmark A. et al. (2019) Periodontal health and oral microbiota in patients with rheumatoid arthritis. J. Clin. Med., 8(5): 0630.
- Fuggle N.R., Smith T.O., Kaul A., Sofat N. (2016) Hand to mouth: a systematic review and meta-analysis of the association between rheumatoid arthritis and periodontitis. Front Immunol., 7(2): 0080.
- Gabriel S.E. (2017) The epidemiology of rheumatoid arthritis. Rheum. Dis. Clin. North Am., 27(2): 269–281.
- Galushko E.A., Gordeev A.V. (2016) The concept of barrier organ disease in the pathogenesis of spondyloarthritis. Rheumatol. Sci. Pract., 54(2): 199–205.
- Gamel E.B., Hashim N.T., Satti A., Gismalla B.G. (2017) Salivary TNFα levels in groups of subjects with rheumatoid arthritis and chronic periodontitis. BMC Res. Notes, 10(1): 34–39.
- Gordeev A.V., Galushko E.A., Savushkina N.M., Lila A.M. (2018) Is periodontitis a harbinger of rheumatoid arthritis? Rheumatol. Sci. Pract., 56(5): 613–621.
- Graves D.T., Corrêa J.D., Silva T.A. (2019) The oral microbiota is modified by systemic diseases. J. Dent Res., 98(2): 148–156.
- Grevich S., Lee P., Leroux B. et al. (2019) Oral health and plaque microbial profile in juvenile idiopathic arthritis. Pediatr. Rheumatol. Online J., 17(1): 81–89.
- Hamevose-Poulsen A., Westergaard J., Stoltze K. (2006) Periodontal and hematological characteristics associated with aggressive periodontitis, juvenile idiopathic arthritis, and rheumatoid arthritis. J. Periodontol., 77(2): 280–288.
- Han Y.W., Wang X. (2018) Mobile microbiome: oral bacteria in extra-oral infections and inflammation. J. Dent Res., 92(6): 485–491.
- Issaranggun Na Ayuthaya B., Everts V., Pavasant P. (2018) The immunopathogenic and immunomodulatory effects of interleukin-12 in periodontal disease. Eur. J. Oral Sci, 1264(2): 75–83.
- Jashi L., Gogebashvili N. (2014) Autoimmune mechanisms toward type I collagen during parodontitis. Georgian Med. News, 229: 26–28.
- Kaneko C., Kobayashi T., Ito S. et al. (2018) Circulating levels of carbamylated protein and neutrophil extracellular traps are associated with periodontitis severity in patients with rheumatoid arthritis: A pilot case-control study. PLoS One, 13(2): 0192365.
- Kawai T., Matsuyama T., Hosokawa Y. (2006) B and T lymphocytes are the primary sources of RANKL in the bone resorptive lesion of periodontal disease. Am. J. Pathol., 169(3): 987–998.
- Konkel J.E., O’Boyle C., Krishnan S. (2019) Distal consequences of oral inflammation. Front Immunol., 25(10): 01403.
- Kumar P.S. (2017) From focal sepsis to periodontal medicine: a century of exploring the role of the oral microbiome in systemic disease. J. Physiol., 595(2): 465–476.
- Kuru B., McCullough M.J., Yilmaz S., Porter S.R. (2002) Clinical and microbiological studies of periodontal disease in Sjögren syndrome patients. J. Clin. Periodontol., 29(2): 92–102.
- Laugisch O., Wong A., Sroka A. et al. (2016) Citrullination in the periodontium — a possible link between periodontitis and rheumatoid arthritis. Clin. Oral Investig., 20(4): 675–683.
- Li R., Tian C., Postlethwaite A. et al. (2017) Rheumatoid arthritis and periodontal disease: What are the similarities and differences? Int. J. Rheum. Dis., 20(12): 1887–1901.
- Lu H.K., Chen Y.L., Chang H.C. et al. (2016) Identification of the osteoprotegerin/receptor activator of nuclear factor-kappa B ligand system in gingival crevicular fluid and tissue of patients with chronic periodontitis. J. Peridontol. Res., 41(4): 354–360.
- Marotte H., Farge P., Gaudin P. et al. (2006) The association between periodontal disease and joint destraction in rheumatoid arthritis extends the link between the HLA-DR shared epitope and severity of bone destraction. Ann. Rheum. Dis., 65(7): 905–909.
- Martinez-Martinez R.E., Abud-Mendoza C., Patino-Marin N. et al. (2009) Detection of periodontal bacterial DNA in serum and synovial fluid in refractory rheumatoid arthritis patients. J. Clin. Periodontol., 36(12): 1004–1010.
- Moen K., Brun J.G., Valen M. et al. (2006) Synovial inflammation in active rheumatoid arthritis and psoriatic arthritis facilitates trapping of a variety of oral bacterial DNAs. Clin. Exp. Rheumatol., 24(6): 656–663.
- Molitor J.A., Alonso A., Wener M.H. (2009) Moderate to severe adult periodontitis increases risk of rheumatoid arthritis in non-smokers and is associated with elevated ACPA titers: the ARIC study. Arthritis Rheum., 60(10): 433–439.
- Möller B., Kollert F., Sculean A., Villiger P.M. (2020) Infectious triggers in Periodontitis and the gut in rheumatoid arthritis (RA): A complex story about association and causality. Front Immunol., 11(3): 01108.
- Ouedraogo D.D., Tiendrebeogo J., Guiguimde P.L. (2017) Periodontal disease in patients with rheumatoid arthritis in SubSaharan Africa: A case-control study. Joint Bone Spine, 84(1): 113–114.
- Pers J.O., d’Arbonneau F., Devauchelle-Pensec V. (2005) Is periodontal disease mediated by salivary BAFF in Sjögren’s syndrome? Arthritis Rheum., 52(8): 2411–2414.
- Pischon N., Pischon T., Krüger J. (2018) Association among rheumatoid arthritis, oral hygiene, and periodontitis. J. Periodontol., 79(6): 979–986.
- Rajkarnikar J., Thomas B.S., Rao S.K. (2018) Inter-relationship between rheumatoid arthritis and periodontitis. Kathmandu Univ. Med. J., 11(41): 22–26.
- Rams T.E., Listgarten M.A., Slots J. (2016) Utility of 5 major putative periodontal pathogens and selected clinical parameters to predict periodontal breakdown on maintenance care. J. Clin. Peridontol., 23(4): 346–354.
- Rosenstein E.D., Greenwald R.A., Kushner L.J., Weissmann G. (2004) Hypothesis: the humoral immune response to oral bacteria provides a stimulus for the development of rheumatoid arthritis. Inflammation, 28(6): 311–318.
- Silman A.J., Pearson J.E. (2018) Epidemiology and genetics of rheumatoid arthritis. Arthritis Res., 4(3): 265–272.
- Smolik I., Robinson D., El-Gabalawy H.S. (2009) Periodontitis and rheumatoid arthritis: epidemiologic, clinical, and immunologic associations. Compend. Contin. Educ. Dent., 30(4): 188–194.
- Stein J., Reichert S., Gautsch A., Machulla H.K. (2003) Are there HLA combinations typical supporting for or making resistant against aggressive and/or chronic periodontitis? J. Periodontal Res., 38(5): 508–517.
- Su W., Shi J., Zhao Y. et al. (2020) Porphyromonas gingivalis triggers inflammatory responses in periodontal ligament cells by succinate-succinate dehydrogenase-HIF-1α axis. Biochem. Biophys. Res. Commun., 522(1): 184–190.
- Van Winkelhoff A.J., Loos B.G., van der Reijden W.A., van der Velden U. (2002) Porphyromonas gingivalis, Bacteroides forsythus and other putative periodontal pathogens in subjects with and without periodontal destruction. J. Clin. Periodontol.,29(11): 1023–1028.
- Vitkov L., Hannig M., Minnich B., Herrmann M. (2018) Periodontal sources of citrullinated antigens and TLR agonists related to RA. Autoimmunity, 51(6): 304–309.
РЕВМАТОИДНЫЙ АРТРИТ И КОМОРБИДНЫЙ ПАРОДОНТИТ: КЛИНИКО-ПАТОГЕНЕТИЧЕСКИЕ ОСОБЕННОСТИ СВЯЗЕЙ
Донецкий национальный медицинский университет, Лиман
Резюме. Актуальность. Коморбидный пародонтит усиливает системное иммунное воспаление при ревматоидном артрите (РА), повышая чувствительность больных к аутоантигенам. РА и пародонтит имеют сходную остеоклазию, аллельные гены и общий дисбаланс состояния цитокиновой сети, но общность патогенетических механизмов требует дальнейшего изучения. Цель и задачи исследования: изучить особенности течения РА на фоне коморбидного пародонтита, определить роль десневой микробиоты в патогенетических построениях обоих заболеваний, оценить свойства ротовой жидкости при пародонтите и РА, значимость изменений физико-химических, иммуноферментных и биохимических показателей. Материалы и методы. Под наблюдением находились 173 больных РА. Для оценки количества микроорганизмов на слизистой оболочке десен использовали методику стерильных бумажных дисков. Изучали физико-химические адсорбционно-реологические свойства ротовой жидкости, уровни в ней провоспалительных цитокинов, концентраций отдельных фракций МСМ. Результаты. Пародонтит диагностирован у 46% больных РА, развитие которого тесно связано с активностью и стадией суставного синдрома, наличием системного остеопороза, серопозитивностью заболевания с ревматоидным фактором и антителами к циклическому цитрулиновому пептиду. Выявлено повышение концентрации в ротовой жидкости провоспалительных цитокинов, рост уровня МСМ всех фракций, что связано с тяжестью течения и суставного синдрома, пародонтита, особенностями десневой микробиоты. Выводы. Полученные данные свидетельствуют об общности патогенетических построений РА и коморбидного пародонтита, обосновывают возможность разработки новых подходов к индивидуальной патогенетической терапии РА с учетом этиологии фоновой оральной патологии, оценки активности воспалительного процесса, прогнозирования характера течения болезни и эффективности лечения.
Ключевые слова: ревматоидный артрит, пародонтит, течение, ротовая жидкость, этиология, патогенез.
Адреса для листування:
Синяченко Олег Володимирович
84404, Донецька обл., Лиман,
вул. Привокзальна, 27
Донецький національний медичний університет,
кафедра внутрішньої медицини № 1
E-mail: synyachenko@ukr.net

Leave a comment