КАРДІОВАСКУЛЯРНИЙ РИЗИК У ХВОРИХ НА ОСТЕОАРТРОЗ: РЕЗУЛЬТАТИ ВСЕУКРАЇНСЬКОГО ДОСЛІДЖЕННЯ «ПАРТНЕР»
Резюме. Остеоартроз (ОА) — одне з найпоширеніших хронічних захворювань у всьому світі. Серцево-судинні захворювання є дуже поширеними серед хворих на ОА у різних країнах. Однак немає даних щодо поширеності серцево-судинних захворювань у хворих на ОА в Україні. Методи. Багатоцентрове дослідження «ПАРТНЕР» (Поширеність кардіоваскулярного ризику при вперше діагностованому первинному остеоартрозі) проведено у серпні 2019 р. — березні 2020 р. Було залучено 4769 хворих із вперше діагностованим ОА. Результати. Повні дані були зібрані для 3936 пацієнтів. Пацієнти із вперше діагностованим первинним ОА в Україні значно частіше мають супутню кардіоваскулярну патологію порівняно із зарубіжними даними. Значну кількість цих хворих (2946 (75%)) навіть без розрахунку SCORE слід віднести до категорії осіб з високим і дуже високим ризиком розвитку серцево-судинних ускладнень, оскільки вони вже мають серцево-судинні захворювання атеросклеротичного генезу (55%), цукровий діабет (21%), дуже високий рівень артеріального тиску (15%) та/чи загального холестерину і хронічну хворобу нирок (5%). Згідно з результатами розрахунку SCORE, до категорії осіб з дуже високим кардіоваскулярним ризиком належать ще 127 пацієнтів, тобто загальна кількість хворих на ОА з високим і дуже високим кардіоваскулярним ризиком досягла 3073, що становить 78% загальної кількості проанкетованих осіб з первинним ОА. Ці особливості необхідно враховувати при призначенні лікування хворим на ОА. Обговорення. Основною стратегією, направленою на запобігання розвитку ускладнень, пов’язаних із застосуванням нестероїдних протизапальних препаратів (НПЗП), є застосування препаратів із кращим профілем безпеки. Одним із таких препаратів є амтолметин гуацил. Такі особливості препарату, як гастропротекторний ефект разом із протизапальним та антиагрегантним впливом, дозволяють рекомендувати амтолметин гуацил для лікування хворих на ОА з високим шлунково-кишковим та серцево-судинним ризиком, особливо за необхідності довготривалої терапії. Висновки. Результати дослідження «ПАРТНЕР» продемонстрували значну поширеність серцево-судинної патології та високий ризик розвитку серйозних серцево-судинних подій у пацієнтів із вперше діагностованим первинним ОА в Україні. Це необхідно брати до уваги при виборі НПЗП у цих хворих.
DOI: 10.32471/rheumatology.2707-6970.80.15064
Остеоартроз (ОА) — найпоширеніше захворювання опорно-рухового апарату, що характеризується хронічним запаленням і залученням до патологічного процесу всіх компонентів суглоба [1, 2]. ОА призводить до зниження якості життя, інвалідизації населення та підвищення смертності [3, 4].
За оцінками експертів на ОА у всьому світі хворіє близько 240 млн осіб, серед них приблизно 10% чоловіків та 18% жінок віком старше 60 років. В іншому епідеміологічному дослідженні американськими вченими встановлено, що симптоматичний ОА колінного суглоба відзначається приблизно у 7% дорослих віком старше 25 років [5]. Поширеність ОА вища серед жінок, ніж чоловіків, зростає з віком (тенденція наявна до досягнення 70-річного віку). Приблизно у 9% чоловіків та у 30% жінок спостерігається ураження щонайменше одного суглоба, у 11 та 23% — щонайменше двох [6].
В Україні у 2015 р. захворюваність на ОА становила 431 на 100 тис. населення на рік, поширеність — 2995 на 100 тис. (близько 3%), на обліку в ревматологів перебували близько 912 тис. пацієнтів [7].
ОА та ризик розвитку серцево-судинних захворювань
 Поширеність ОА зростає з віком так само, як і поширеність багатьох інших хронічних патологій, зокрема хвороб серцево-судинної системи. Так, у дослідженні італійських учених показано, що серед пацієнтів із серцево-судинними захворюваннями приблизно у ⅔ діагностовано ОА [8]. При цьому частота серйозних кардіоваскулярних подій протягом дослідження була вищою в осіб з ОА порівняно з пацієнтами без нього (48 та 41% відповідно, відносний ризик (ВР) 1,22, 95% довірчий інтервал (ДІ) 1,02–1,49). Така асоціація спостерігалась у хворих з ОА кульшового та колінного суглобів, але була відсутньою за наявності ОА суглобів кисті. Крім того, асоціація була вираженішою для ОА із залученням багатьох суглобів та для жінок. У масштабному метааналізі, який включав результати 15 досліджень та об’єднував дані майже 360 тис. учасників, у тому числі більше 80 тис. пацієнтів з ОА та майже 30 тис. із серцево-судинними захворюваннями, встановлено, що ризик розвитку серцево-судинної патології на 24% (ВР 1,24, 95% ДІ 1,12–1,37) вищий серед пацієнтів з ОА порівняно із загальною популяцією [9].
Поширеність ОА зростає з віком так само, як і поширеність багатьох інших хронічних патологій, зокрема хвороб серцево-судинної системи. Так, у дослідженні італійських учених показано, що серед пацієнтів із серцево-судинними захворюваннями приблизно у ⅔ діагностовано ОА [8]. При цьому частота серйозних кардіоваскулярних подій протягом дослідження була вищою в осіб з ОА порівняно з пацієнтами без нього (48 та 41% відповідно, відносний ризик (ВР) 1,22, 95% довірчий інтервал (ДІ) 1,02–1,49). Така асоціація спостерігалась у хворих з ОА кульшового та колінного суглобів, але була відсутньою за наявності ОА суглобів кисті. Крім того, асоціація була вираженішою для ОА із залученням багатьох суглобів та для жінок. У масштабному метааналізі, який включав результати 15 досліджень та об’єднував дані майже 360 тис. учасників, у тому числі більше 80 тис. пацієнтів з ОА та майже 30 тис. із серцево-судинними захворюваннями, встановлено, що ризик розвитку серцево-судинної патології на 24% (ВР 1,24, 95% ДІ 1,12–1,37) вищий серед пацієнтів з ОА порівняно із загальною популяцією [9].
Відповідно до результатів ще одного систематичного огляду та метааналізу, що включав результати 15 досліджень із більше як 32 млн учасників, виявлено, що поширеність серцево-судинних захворювань серед пацієнтів з ОА становить 38,4% (ДІ 37,2–39,6%) [10]. Пацієнти з ОА майже у 3 рази (ВР 2,80; 95% ДІ 2,25–3,49) частіше мали серцеву недостатність та майже в 2 рази (ВР 1,78; 95% ДІ 1,18–2,69) частіше у них розвивалась ішемічна хвороба серця порівняно з особами, які не мали ОА. Не виявлено статистично достовірної різниці між групами з ОА та без ОА щодо ризику розвитку інфаркту міокарда чи інсульту. Зазначимо, що у групі пацієнтів з ОА виявлено зниження ризику розвитку транзиторної ішемічної атаки у 3 рази порівняно з особами, в яких не діагностовано ОА.
В іншому дослідженні, що включало пацієнтів з ОА та велику групу контролю — без ОА, протягом 8 років спостереження кількість випадків гострих коронарних подій на 1 тис. осіб становила 5,4 у групі ОА та 4,3 — у групі без ОА (ВР 1,15 95% ДІ 1,08–1,23) [11]. Нетрадиційний підхід було застосовано в одному з недавніх досліджень, в якому вчені рандомізували пацієнтів (усі жіночої статі) на чотири групи: 1) без рентгенологічно підтвердженого OA та без болю; 2) за наявності лише больового синдрому; 3) за наявності лише рентгенологічно підтвердженого OA; 4) за наявності болю та рентгенологічно підтвердженого OA; окремо для ОА суглобів кисті (n=808) та ОА колінного суглоба (n=821) [12]. Відповідно до отриманих результатів, рентгенологічно підтверджений ОА та біль у коліні асоціюються з удвічі підвищеним ризиком смерті від усіх причин та в 4(!) рази — ризиком смерті внаслідок кардіоваскулярних подій порівняно із групою осіб без рентгенологічно підтвердженого OA та без болю. Біль у колінному суглобі без рентгенологічно підтвердженого ОА також підвищує ризик смерті внаслідок кардіоваскулярних подій у 3 рази, порівняно із групою осіб без рентгенологічно підтвердженого OA та без болю.
Отже, результати досліджень останніх років переконливо демонструють взаємозв’язок між наявністю ОА, насамперед колінних і кульшових суглобів, та підвищеним ризиком розвитку і поширеністю захворювань серцево-судинної системи, у тому числі гострих коронарних подій та смерті внаслідок кардіоваскулярних захворювань.
Інший бік проблеми — можливий негативний вплив лікарських засобів, що застосовуються в лікуванні ОА, на перебіг серцево-судинних захворювань, зокрема — розвиток гострих кардіоваскулярних подій та серцево-судинну смертність. Ця проблема вже більше двох десятиліть перебуває в центрі уваги вчених і практичних лікарів.
НПЗП — ключовий клас препаратів при лікуванні пацієнтів з ОА
Нестероїдні протизапальні препарати (НПЗП) посідають важливе місце серед лікарських засобів, що застосовуються у терапії ОА. Велика кількість рандомізованих контрольованих досліджень і відповідний метааналіз підтверджують здатність НПЗП значно зменшувати вираженість болю і пов’язані з ним функціональні порушення, які виникають при ОА [13]. Цей ефект зберігається на тлі тривалого (багатомісячного) застосування НПЗП. За даними кількох рандомізованих контрольованих досліджень, регулярний прийом НПЗП запобігає розвитку рецидивів ОА [14, 15]. Відповідно до нових рекомендацій щодо ведення пацієнтів з ОА колінного суглоба, розроблених міжнародною групою експертів ESCEO, НПЗП слід використовувати при неефективності парацетамолу і повільно діючих протизапальних засобів переривчасто або постійно тривалими курсами [16]. Однак застосування НПЗП може бути пов’язане із розвитком ряду побічних реакцій з боку шлунково-кишкового тракту (ШКТ), серцево-судинної системи і нирок, що може нести загрозу здоров’ю та життю пацієнтів, особливо людей похилого віку із серйозними супутніми патологіями, обмежуючи застосування цього класу препаратів та знижуючи їх терапевтичний потенціал [17]. Це визначає необхідність ретельного аналізу факторів ризику розвитку побічних реакцій та індивідуального підходу при виборі НПЗП з урахуванням особливостей пацієнта та клінічної ситуації [18].
Механізм дії НПЗП та кардіоваскулярна токсичність
Механізм дії НПЗП пов’язаний із блокадою ферменту циклооксигенази (ЦОГ)-2 та інгібуванням продукції синтезу простагландину (ПГ) Е2, який є одним із головних медіаторів, що викликають сенситизацію периферичних больових рецепторів і центральних структур ноцицептивної системи. Крім цього, НПЗП виявляють значний вплив на розвиток запальної реакції, знижуючи експресію гена ЦОГ‑2 і опосередковано впливаючи на експресію генів ряду інтерлейкінів (ІЛ) — ІЛ-1, ІЛ-6, фактора некрозу пухлини-α, синтез факторів росту, активацію клітин макрофагального ряду, в тому числі остеокластів. НПЗП зумовлюють локальну і системну протизапальну дію, уповільнюючи неоангіогенез, розвиток гетеротопічної осифікації та зростання остеофітів — процеси, що призводять до незворотних змін у структурі суглобів і хребта [19].
Застосування неселективних НПЗП обмежено розвитком побічних реакцій, пов’язаних із інгібуванням ЦОГ-1, а саме — ускладнень з боку ШКТ — утворенням виразок та розвитком кровотеч [18]. Однак селективні НПЗП, що суттєво не впливають на роботу ЦОГ-1 та спричиняють значно нижчий ризик ускладнень з боку ШКТ, характеризуються підвищеною, порівняно із неселективними НПЗП, кардіоваскулярною токсичністю, оскільки порушують баланс продукції простациклінів і тромбоксанів у клітинах серцево-судинної системи.
Коксиби пригнічують утворення простагландину І2 (ПГІ2) — простацикліну, який продукується ЦОГ-2 в ендотелії та інгібує агрегацію тромбоцитів, викликає розширення судин і запобігає проліферації клітин гладких м’язів судин in vitro [20, 21]. При цьому вони не впливають на синтез тромбоксану A2 (TXA2), основного продукту ЦОГ-1 у тромбоцитах, що викликає агрегацію тромбоцитів, звуження судин і проліферацію судин, таким чином порушуючи баланс цих сигнальних молекул. Тому коксиби підвищують ризик розвитку тромботичних явищ, викликаючи зокрема розвиток інсультів та інфарктів. Крім того, показано, що коксиби підвищують ризик розвитку інших захворювань серцево-судинної системи [22]. Водночас неселективні НПЗП інгібують продукцію і TXA2, і простацикліну, тому характеризуються нижчим ризиком кардіоваскулярних ускладнень.
У контексті кардіоваскулярної токсичності селективних НПЗП варто зазначити, що залишається недостатньо вивченою роль селективних інгібіторів ЦОГ-2 у розвитку ішемічної хвороби серця або загостренні наявної серцево-судинної патології. У ході клінічних досліджень виявлено, що селективні інгібітори ЦОГ-2 можуть викликати розвиток артеріальної гіпертензії або погіршувати перебіг наявної серцево-судинної патології приблизно з такою ж частотою, як і неселективні препарати [23]. Інгібітори ЦОГ-2 можуть провокувати розвиток ендотеліальної дисфункції, яка є одним із сурогатних маркерів ішемії серця [24]. Ряд авторів вважають, що такі впливи можуть призвести до абсолютного збільшення кількості побічних явищ з боку серцево-судинної системи [25]. Ці ефекти набувають особливого значення як фактори ризику у хворих на ОА, оскільки у них і без того підвищена частота розвитку ішемічної хвороби серця та серцевої недостатності [10].
Ще одним джерелом негативної дії НПЗП на серцево-судинну систему є прямий токсичний вплив деяких НПЗП на серце шляхом активації продукції реактивних форм кисню мітохондріями [26, 27]. Це може бути причиною підвищення ризику розвитку інфаркту міокарда при застосуванні ряду селективних та неселективних НПЗП, що підвищується зі зростанням дози і тривалості застосування [28].
Крім того, інгібітори ЦОГ можуть негативно впливати на продукцію простагландинів, які відіграють важливу роль у підтримці ниркового кровотоку, що може мати особливо негативне значення для пацієнтів із порушеною функцією нирок [29]. Інгібування ЦОГ-2-залежної продукції ПГЕ2 нирками може призводити до ниркової недостатності, затримки рідини та як наслідок — до розвитку артеріальної гіпертензії [27].
Вищенаведені механізми призводять до формування кардіоваскулярної токсичності як селективних, так і неселективних НПЗП. Так, відповідно до результатів метааналізу, найвищий кардіоваскулярний ризик мають еторикоксиб, етодолак, рофекоксиб, після них у порядку спадання серцево-судинної токсичності — диклофенак, індометацин, мелоксикам, ібупрофен, целекоксиб та ін. [30]. Втім, слід зазначити, що ранжування НПЗП за кардіоваскулярною токсичністю виглядає по-різному в публікаціях різних років і авторів, що, вочевидь, пов’язано з відмінностями в методології досліджень, контингенті хворих, частоті та режимі застосування різних НПЗП, коморбідності тощо. Однак найчастіше серед препаратів високого ризику фігурують коксиби, диклофенак, а найбезпечнішим у цьому сенсі виглядає напроксен.
Отже, ці взаємопов’язані проблеми — підвищена частота серцево-судинних захворювань та смертності від них у хворих на ОА і здатність багатьох НПЗП — препаратів першого ряду в лікуванні ОА — провокувати розвиток атеротромботичних та інших гострих серцево-судинних подій зумовлюють клінічну актуальність оцінки серцево-судинного ризику у хворих на ОА та вибору найбезпечніших у плані кардіоваскулярних побічних ефектів НПЗП. При цьому слід зазначити, що якщо стосовно пов’язаних із механізмом дії побічних ефектів НПЗП немає підстав очікувати на національну чи регіональну специфіку, то ступінь кардіоваскулярного ризику суттєво залежить від економічних, медичних і соціокультурних особливостей певного регіону. Нам не вдалося виявити дослідження, в яких би вивчалася поширеність кардіоваскулярного ризику в українських хворих на ОА, що й стало підставою для проведення відповідного національного дослідження.
Дослідження «ПАРТНЕР»
Із серпня 2019 р. по березень 2020 р. в Україні проведено багатоцентрове дослідження з вивчення поширеності кардіоваскулярного ризику у хворих на ОА — дослідження «ПАРТНЕР» (Поширеність кардіоваскулярного ризику при вперше діагностованому первинному остеоартрозі). Дослідниками були 54 лікарі медичних закладів із 22 областей України. Критеріями включення пацієнтів були вперше діагностований та підтверджений рентгенологічно первинний ОА будь-якої локалізації відповідно до класифікаційних критеріїв R. Altman та співавторів (1986), вік пацієнтів старше 18 років, відомий рівень загального холестерину крові, креатиніну та систолічного артеріального тиску. Під час візиту до лікаря проведено анкетування хворих за стандартизованою анкетою, яка включала запитання щодо віку, статі, локалізації ОА, вираженості пов’язаного з фізичною активністю болю в суглобах за цифровою рейтинговою шкалою (NRS), потреби у знеболювальній терапії, наявності серцево-судинних захворювань атеросклеротичного генезу, включаючи ішемічну хворобу серця (ІХС), цукрового діабету, хронічної хвороби нирок, рівня загального холестерину крові, артеріального тиску, статусу тютюнопаління (на поточний час чи в минулому). До розгляду приймалися тільки повністю заповнені анкети. У осіб віком ≥40 років, за винятком пацієнтів із наявними атеросклеротичними серцево-судинними захворюваннями, цукровим діабетом, хронічною хворобою нирок, дуже високим рівнем загального холестерину (>8,0 ммоль/л) та/чи артеріального тиску (>180/110 мм рт. ст.), було оцінено ризик смерті від серцево-судинних захворювань протягом найближчих 10 років за шкалою SCORE. Результати наведено в абсолютних числах та відсотках.
Загалом від лікарів медичних центрів 22 областей України надійшло 4769 анкет пацієнтів, з яких 3936 були заповнені повністю та коректно і включені в розробку, 833 анкети було відхилено через неповноту інформації та/чи помилки у заповненні. Найбільше хворих було включено в дослідження з Дніпропетровської, Київської, Харківської, Львівської та Полтавської областей (від 682 до 290). Серед респондентів було 2595 (65,9%) осіб жіночої і 1341 — чоловічої статі. У віковій категорії від 50 до 59 років було найбільше — 50% (1989) хворих, до 49 років — 20% (774), від 60 до 64 — 19% (758), найменше — 11% (415) було осіб віком 65 років і старше. Загалом в анкетах лікарями було зазначено 66 варіантів локалізації вперше діагностованого ОА. Найчастіше залучалися колінний (34%), кульшовий суглоби (16%) та суглоби кистей (15%), 15% хворих мали генералізований ОА із залученням ≥3 суглобових зон (табл. 1).
Таблиця 1. Частота залучення різних суглобів у респондентів, хворих на ОА
| Локалізація ураження | Кількість пацієнтів, n | Частка серед оброблених анкет, % |
|---|---|---|
| ОА колінного суглоба | 957 | 34 |
| ОА кульшового суглоба | 458 | 16 |
| ОА кисті | 433 | 15 |
| Генералізований ОА (≥3 ділянки ураження) | 422 | 15 |
| ОА плечового суглоба | 335 | 12 |
| ОА хребта | 217 | 8 |
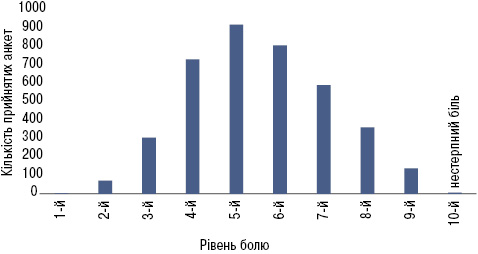
Найбільша кількість пацієнтів (≈77%) повідомляли про біль середнього ступеня вираженості, оціненого у 4–7 балів (рис. 1). При цьому майже всі хворі (97%), на узгоджену думку лікаря та пацієнта, потребували призначення знеболювальних препаратів.
Згідно з наведеними в анкетах результатами патологія серцево-судинної системи, в основі якої лежить атеросклероз судин (у тому числі ІХС), виявлена у 55% (2162) пацієнтів із вперше діагностованим ОА. Варто зазначити, що цей показник в українських реаліях може не зовсім точно відображати справжню частоту серцево-судинних захворювань атеросклеротичного генезу як внаслідок її завищення, так і заниження, наприклад внаслідок недостатньо широкого застосування методів візуалізації для виявлення аневризми аорти, атеросклеротичних бляшок, у тому числі в периферичних артеріях.
Артеріальну гіпертензію (систолічний тиск >140 мм рт. ст.) мали 50% пацієнтів із вперше діагностованим ОА (табл. 2). Ще у 40% визначалися неоптимальні величини систолічного артеріального тиску (>120 мм рт. ст.), які для певних категорій осіб (наприклад із цукровим діабетом) можуть розглядатися як патологічні, і лише у 10% пацієнтів він був у межах норми. При цьому у 15% опитаних хворих була артеріальна гіпертензія 3-го ступеня (>180/110 мм рт. ст.).
Таблиця 2. Систолічний артеріальний тиск у пацієнтів із вперше діагностованим ОА
| Систолічний артеріальний тиск, мм рт. ст. | Кількість пацієнтів, n |
|---|---|
| <120 | 412 |
| 121–140 | 1569 |
| 141–160 | 1514 |
| 161–180+ | 441 |
Цукровий діабет І чи ІІ типу з ураженням органів-мішеней мали 808 (21%) проанкетованих хворих, помірну чи тяжку хронічну хворобу нирок (швидкість клубочкової фільтрації <60 мл/хв/1,73 м2) — 178 (5%) учасників дослідження.
У ході опитування також було зібрано і іншу медичну інформацію, необхідну для розрахунку ризику розвитку серцево-судинних захворювань. Так, тютюнопаління на поточний час чи в минулому визнали 1093 (28%) опитаних. Розподіл пацієнтів за рівнем загального холестерину сироватки крові наведено в табл. 3. Як видно, рівень холестерину <5 ммоль/л мали лише 45% проанкетованих хворих. У 7% пацієнтів реєструвалися значно підвищені (>7 ммоль/л) рівні загального холестерину.
Таблиця 3. Рівень загального холестерину крові у хворих із вперше діагностованим ОА
| Загальний холестерин, ммоль/л | Кількість пацієнтів, n |
|---|---|
| <4,0 | 326 |
| 4,01–5,0 | 1471 |
| 5,01–6,0 | 1139 |
| 6,01–7,0 | 732 |
| 7,01–8,0 та вище | 268 |
Базуючись на отриманих у ході анкетування даних, було розраховано 10-річний ризик смерті від серцево-судинних захворювань за методикою SCORE у 990 пацієнтів, для яких цю діаграму може бути використано (особи без явних серцево-судинних захворювань, цукрового діабету, хронічних захворювань нирок або значного підвищення рівня одиночного фактора ризику). Виявилося, що серцево-судинний ризик становив ≥10% (дуже високий) для 13% опитаних пацієнтів цієї категорії, ≥1% <5% (помірний) — ще для 84% хворих і лише для 3% він був низьким (табл. 4).
Таблиця 4. 10-річний ризик смерті від серцево-судинних захворювань у пацієнтів із вперше діагностованим ОА (n=990)
| 10-річний ризик розвитку серцево-судинних ускладнень | Кількість пацієнтів, n |
|---|---|
| <1% | 35 |
| ≥1% <5% | 828 |
| ≥10% | 127 |
Підсумовуючи викладені вище дані, підкреслимо, що відповідно до результатів нашого дослідження пацієнти із вперше діагностованим первинним ОА в Україні значно частіше мають супутню кардіоваскулярну патологію порівняно із зарубіжними даними. Значну кількість цих хворих (2946 (75%)) навіть без розрахунку SCORE слід віднести до категорії осіб з високим і дуже високим ризиком розвитку серцево-судинних ускладнень, оскільки вони вже мають серцево-судинні захворювання атеросклеротичного генезу (55%), цукровий діабет (21%), дуже високий рівень артеріального тиску (15%) та/чи загального холестерину і хронічну хворобу нирок (5%). Згідно з результатами розрахунку SCORE, до категорії осіб з дуже високим кардіоваскулярним ризиком належать ще 127 пацієнтів, тобто загальна кількість хворих на ОА з високим і дуже високим кардіоваскулярним ризиком сягає 3073, що становить 78% загальної кількості проанкетованих осіб з первинним ОА. Ці особливості необхідно враховувати при призначенні лікування хворим на ОА.
Отже, поширеність серцево-судинних захворювань в Україні та світі в цілому значно вища серед пацієнтів з ОА порівняно із загальною популяцією, більше того — висока поширеність цієї групи патологій призводить до підвищення смертності серед хворих на ОА. І хоча патофізіологічні взаємозв’язки між ОА та розвитком серцево-судинних захворювань потребують подальшого вивчення, наявність такої асоціації має бути врахована в ході вибору схем лікування пацієнтів з ОА. Зокрема при призначенні терапії пацієнтам з ОА слід віддавати перевагу препаратам зі сприятливим кардіоваскулярним профілем безпеки.
Профілактика НПЗП-індукованих кардіоваскулярних ускладнень у пацієнтів з ОА
Основним методом профілактики НПЗП-індукованих ускладнень є застосування безпечніших представників цього терапевтичного класу. Як зазначалося вище, в контексті атеротромботичних кардіоваскулярних ускладнень безпечнішим порівняно з іншими НПЗП вважається напроксен. Однак цьому препарату притаманний один з найнижчих профілів гастроінтестинальної безпеки [2, 16, 18], що вимагає обов’язкового додаткового призначення інгібіторів протонної помпи. Це, у свою чергу, підвищує вартість лікування та знижує комплаєнтність. З урахуванням цих реалій значний клінічний інтерес становить такий НПЗП, як амтолметин гуацил.
Амтолметин гуацил (2-метоксифеніл-1-метил-5-п-метилбензоїл-пірол-2-ацетамід ацетат) впливає як на ЦОГ-1, так і на ЦОГ-2; співвідношення селективності ЦОГ-2/ЦОГ-1 становить 4,4 [22, 31]. Амтолметин гуацил зменшує проникність капілярів; стабілізує лізосомальні мембрани; гальмує синтез або інактивує медіатори запалення (простагландини, гістамін, брадикініни, цитокіни, фактори комплементу). Він блокує взаємодію брадикініну із тканинними рецепторами, відновлює порушену мікроциркуляцію і знижує больову чутливість у вогнищі запалення. Препарат впливає на таламічні центри больової чутливості; знижує концентрацію біогенних амінів, що володіють альгогенними властивостями; підвищує поріг больової чутливості рецепторного апарату. Завдяки цьому механізму дії амтолметин гуацил усуває або зменшує інтенсивність больового синдрому, зменшує ранкову скутість та набряки, збільшує амплітуду рухів в уражених суглобах вже через 4 дні лікування [32].
Амтолметин гуацил має виражену протизапальну дію подібно до ЦОГ-2-селективних НПЗП, однак він переноситься набагато краще з нижчою частотою ускладнень. Препарат створювався як гастропротекторний НПЗП, втім застосовані при його розробленні підходи дозволили створити препарат не лише із хорошою переносимістю з боку ШКТ, а й зі сприятливими властивостями щодо серцево-судинної системи та загалом із хорошим профілем безпеки. Результати фармакологічних досліджень, проведених на різних експериментальних моделях, свідчать, що амтолметин гуацил не лише не виявляє шкідливого впливу на слизову оболонку шлунка, а й проявляє захисний ефект щодо неї [33], а також слизової оболонки кишечника [34].
Завдяки особливостям молекулярної структури амтолметин гуацилу при його застосуванні підвищується рівень антиоксидантних ферментів — супероксиддисмутази, каталази, глутатіону, водночас знижується рівень супероксид-аніонів, пероксинітриту або пероксихлориду і малонового діальдегіду, рівень якого зростає в разі активації перекисного окиснення ліпідів. Так, у дослідженнях in vivo показано, що амтолметин гуацил не впливає на процеси перекисного окиснення ліпідів та на ферментні та неферментні системи антиоксидантного захисту клітин [35]. Таким чином, амтолметин гуацил, на відміну від інших НПЗП, які мають прооксидантні властивості щодо тканин серця і таким чином підвищують ризик розвитку інфаркту міокарда, виявляє виражені антиоксидантні властивості.
У ході клінічних досліджень встановлено, що протизапальну, знеболювальну та жарознижувальну дію амтолметин гуацилу можна порівняти за ефективністю із популярними препаратами — традиційними та селективними НПЗП [36, 37]. Наприклад, у метааналізі 18 рандомізованих клінічних досліджень, в яких взяли участь 780 пацієнтів і які тривали 1–6 міс, показано, що знеболювальний, протизапальний та жарознижувальний ефекти амтолметин гуацилу порівнянні з такими піроксикаму, диклофенаку, толметину, напроксену, індометацину, флурбіпрофену, ібупрофену, дифлунізалу [32, 38]. У ході цього метааналізу також проведено ґрунтовне вивчення безпеки амтолметин гуацилу порівняно з такими широко застосовуваними традиційними НПЗП, як диклофенак, толметин, піроксикам, індометацин [38]. Відповідно до отриманих результатів, ризик розвитку будь-яких побічних реакцій при прийомі амтолметин гуацилу був значно нижчим порівняно із традиційними НПЗП — ВР становив 0,2 (0,1–0,3). Аналогічні дані отримано і в пізніших дослідженнях при порівнянні з піроксикамом і селективним НПЗП целекоксибом [39, 40]. Так, результати клінічного багатоцентрового дослідження щодо порівняльної оцінки ефективності та безпеки амтолметин гуацилу з целекоксибом, в якому взяли участь 235 пацієнтів із ревматичною патологією протягом 24 тиж, продемонстрували, що зазначені препарати мають порівняльну ефективність та профіль безпеки [41].
Вивченню ефективності та профілю безпеки амтолметин гуацилу порівняно із попередньою терапією НПЗП у пацієнтів з ОА колінного суглоба було присвячено відкрите обсерваційне дослідження АГАТА. Так, встановлено, що амтолметин гуацил має сильніший анальгезивний ефект, підтверджений зменшенням вираженості болю (≥40%) у 72,5% пацієнтів [17]. Інтенсивність болю за шкалою ВАШ знизилася із 65 мм на першому візиті до 27 мм на останньому. Причому значне зменшення було відзначене вже через 14 днів після початку прийому амтолметин гуацилу. Відзначено статистично достовірне зменшення вираженості болю, скутості, функціональних обмежень і сумарного показника за індексом WOMAC. Після 14 днів прийому переносимість амтолметин гуацилу 26% пацієнтів оцінили як «відмінну», 57% — як «хорошу», 13% — як «задовільну» і тільки 3% — як «погану». При цьому після завершення дослідження оцінка переносимості лікування амтолметин гуацилом була тільки позитивною: «відмінна» — 33%, «хороша» — 56% і «задовільна» — 11% пацієнтів. Загалом хворі переносили амтолметин гуацил краще, ніж НПЗП, які вони отримували раніше. Побічні реакції відзначено у 7,7% пацієнтів. Ступінь тяжкості побічних реакцій у 18% випадків був «середній» та у 82% випадків — «легкий». Не відзначено патологічних змін рівнів гемоглобіну, трансаміназ, кількості лейкоцитів і артеріального тиску. Серйозних побічних реакцій не виявлено.
Щодо ризику розвитку тромботичних явищ то, на противагу іншим НПЗП, амтолметин гуацил володіє вираженою антитромбоцитарною активністю in vitro і ex vivo [33, 42]. Відповідно до результатів досліджень, амтолметин гуацил має високу антиагрегаційну активність, що опосередковується інгібуванням синтезу тромбоксану. Антиагрегаційна активність амтолметин гуацилу in vitro перевершує таку для ацетилсаліцилової кислоти або толметину.
У контексті кардіоваскулярного профілю безпеки амтолметин гуацилу цікавими видаються результати відкритого проспективного 12-тижневого дослідження КОРОНА, в якому досліджувалася ефективність і профіль кардіоваскулярної безпеки амтолметин гуацилу у пацієнтів із болем, викликаним ревматологічною патологією [43]. У дослідженні брали участь 48 пацієнтів (середній вік — 38,2±7,2 року), яких розподілили на дві групи: 1-ша група — пацієнти з артеріальною гіпертензією, контрольованою амлодипіном, 2-га група — пацієнти без артеріальної гіпертензії. Усі учасники отримували амтолметин гуацил в дозі 1800 мг/добу протягом 14 днів, у наступні 16 днів — у дозі 600 мг/добу (деескалаційна схема терапії). Через 2 тиж вираженість болю у нижній ділянці спини в обох групах зменшилася з 5,7±2,2 до 3,2±1,1 см за ВАШ, через 4 тиж — ступінь болю становив 3,3 ± 0, 76 см. Кардіоваскулярні події як при застосуванні амтолметин гуацилу у високих дозах, так і при підтримувальних дозах, протягом 30 діб не зафіксовані.
Водночас за період дослідження у пацієнтів (особливо у пацієнтів з артеріальною гіпертензією) спостерігалася тенденція до зниження рівня систолічного артеріального тиску. Автори дослідження припускають, що зниження артеріального тиску, очевидно, відображає вплив ефективної терапії хронічного больового синдрому і запалення. Можливо, зменшення вираженості болю в осіб з артеріальною гіпертензією має самостійний гіпотензивний ефект. Загалом застосування амтолметин гуацилу асоціювалося зі зниженням рівня систолічного артеріального тиску, більш вираженим у пацієнтів із контрольованою артеріальною гіпертензією.
Профіль безпеки амтолметин гуацилу при довготривалому застосуванні (9 міс) у пацієнтів з ОА та за наявності супутніх серцево-судинних захворювань детально вивчено у ході дослідження АВРОРА [19]. У дослідженні взяли участь 442 пацієнти з ОА, у 52,9% з яких діагностовано артеріальну гіпертензію, у 9,6% — ішемічну хворобу серця, у 8,5% — серцеву недостатність, у 3,3% — інфаркт міокарда та у 0,3% — інсульт. Відповідно до отриманих результатів, під час 9-місячного прийому амтолметин гуацилу не відзначено розвитку нових випадків або вираженої дестабілізації артеріальної гіпертензії, а також появи нових симптомів, що свідчать про патологію серцево-судинної системи, таких як задишка, епізоди серцебиття і напади стенокардії.
На противагу традиційним НПЗП і селективним інгібіторам ЦОГ-2, амтолметин гуацил не чинить негативного впливу на функцію нирок, про що свідчать результати відповідних клінічних та біохімічних досліджень [44]. Очевидно, і в цьому разі важливу роль відіграє підтримка ниркового кровотоку за рахунок NO, що виділяється при дії амтолметин гуацилу.
Слід відзначити, що амтолметин гуацил добре переноситься пацієнтами з ОА [45], а переваги амтолметин гуацилу визначають доцільність вибору цього препарату в тих випадках, коли потрібна тривала терапія НПЗП. При цьому, як свідчать дослідження після декількох місяців застосування препарату у високих дозах на фоні покращення можна перейти до підтримувальної терапії, значно знизивши дозу препарату [19].
Резюмуючи вищенаведені дані, зазначимо, що результати дослідження «ПАРТНЕР» продемонстрували високу поширеність серцево-судинної патології та високий (78%) ризик серйозних кардіоваскулярних подій у хворих із вперше діагностованим первинним ОА в Україні. Це вимагає раціонального вибору НПЗП при симптоматичному лікуванні ОА. У цьому контексті заслуговує на увагу НПЗП з оригінальним механізмом дії амтолметин гуацил, який є ефективним знеболювальним і протизапальним препаратом зі сприятливим профілем безпеки — не лише щодо ШКТ, а й стосовно серцево-судинної системи.
Команда дослідження «ПАРТНЕР»
Н.С. Агафонова, С.В. Брусенцева, Ю.Л. Бурченко, Л.П. Веденкіна, О.П. Володько, Л.О. Гавриш, О.В. Гончар, Н.М. Гречаник, Г.Д. Дорошенко, М.Г. Зябченко, О.Д. Казьмірик, Г.Р. Кальченко, В.В. Кострикіна, С.М. Минка, Є.В. Мовчан, Ю.М. Морозов, Л.В. Різничок, П.Є. Слобода, І.В. Федорук, І.В. Чіжікова.
Список використаної літератури
- 1. Woolf A.D., Erwin J., March L. (2012) The need to address the burden of musculoskeletal conditions. Best Pract. Res. Clin. Rheumatol., 26(2): 183–224.
- 2. Яременко О.Б., Федьков Д.Л. (2014) Раціональний підхід у виборі нестероїдних протизапальних препаратів для лікування хворих на остеоартроз. Укр. мед. часопис, 6(104): 61–66.
- 3. Osteoarthritis Research Society International (2016) Osteoarthritis: A Serious Disease. Osteoarthritis Research Society International, p. 1–103.
- 4. Nelson A.E. (2018) Osteoarthritis year in review 2017: clinical. Osteoarthritis and cartilage, 26(3): 319–325.
- 5. Holt H.L., Katz J.N., Reichmann W.M. et al. (2011) Forecasting the burden of advanced knee osteoarthritis over a 10-year period in a cohort of 60–64 year-old US adults. Osteoarthritis Cartilage, 19: 44–50.
- 6. Park J.H., Hong J.Y., Han K. et al. (2017) Prevalence of symptomatic hip, knee, and spine osteoarthritis nationwide health survey analysis of an elderly Korean population. Medicine (Baltimore), 96: e6372.
- 7. Яременко О.Б., Микитенко А.М. (2016). Мультимодальный подход к лечению болевого синдрома при остеоартрозе. Укр. мед. часопис, 4(114): 38–45.
- 8. Veronese N., Trevisan C., De Rui M. et al. (2016) Association of Osteoarthritis With Increased Risk of Cardiovascular Diseases in the Elderly: Findings From the Progetto Veneto Anziano Study Cohort. Arthritis Rheumatol., 68: 1136–1144.
- 9. Wang H., Bai J., He B. et al. (2016) Osteoarthritis and the risk of cardiovascular disease: a meta-analysis of observational studies. Scientific reports, 6: 39672 (https://doi.org/10.1038/srep39672).
- 10. Hall A. J., Stubbs B., Mamas M. A. et al. (2016) Association between osteoarthritis and cardiovascular disease: systematic review and meta-analysis. European journal of preventive cardiology, 23(9): 938–946.
- 11. Chung W.S., Lin H.H., Ho F.M. et al. (2016) Risks of acute coronary syndrome in patients with osteoarthritis: a nationwide population-based cohort study. Clin. Rheumatol., 35: 2807–2813.
- 12. Kluzek S., Sanchez-Santos M.T., Leyland K.M. et al. (2016) Painful knee but not hand osteoarthritis is an independent predictor of mortality over 23 years follow-up of a population-based cohort of middle-aged women. Ann. Rheum. Dis., 75: 1749–1756.
- 13. Da Costa B.R., Reichenbach S., Keller N. et al. (2016) Effectiveness of non-steroidal anti-inflammatory drugs for the treatment of pain in knee and hip osteoarthritis: a network meta-analysis. Lancet, 387 (10033): 2093–2105. doi: 10.1016/S0140-6736 (16) 30002-2.
- 14. Nakata K., Hanai T., Take Y. et al. (2018) Disease-modifying effects of COX-2 selective inhibitors and non-selective NSAIDs in osteoarthritis: a systematic review. Osteoarthritis Cartilage, 26(10): 1263–1273. doi: 10.1016/j.joca.2018.05.021.
- 15. Strand V., Simon L., Dougados M. et al. (2011) Treatment of osteoarthritis with continuous versus intermittent celecoxib. J Rheumatol., 38(12): 2625–2634. doi: 10.3899/jrheum.110636
- 16. Bruyere O., Cooper C., Pelletier J.P. et al. (2016)A consensus statement on the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO) algorithm for the management of knee osteoarthritis — From evidence-based medicine to the real-life setting. Semin. Arthritis Rheum., 45(4 Suppl.): S3–11. doi: 10.1016/j.semarthrit.2015.11.010.
- 17. Tsvetkova E. S., Denisov L. N., Otteva E. N. et al. (2016) An open label multicenter observational study of the efficacy, tolerability and safety of Amtolmetin Guacil–a non-steroidal anti-inflammatory drug, in patients with knee osteoarthritis and dyspepsia. Res. Clin. Rheumatol., 54(6): 654–659. doi: http://dx.doi.org/10.14412/1995-4484-2016-654-659.
- 18. Harirforoosh S., Asghar W., Jamali F. (2013) Adverse Effects of Nonsteroidal Antiinflammatory Drugs: An Update of Gastrointestinal, Cardiovascular and Renal Complications. J. Pharm. Pharm. Sci (http://www.cspsCanada.org)., 16(5): 821–847. doi: 10.18433/J3VW2F.
- 19. Каратеев А.Е., Насонов Е.Л., Глухова С.И. и соавт. (2019) Оценка эффективности и безопасности длительного использования амтолметин гуацила при ревматических заболеваниях: результаты 9-месячного наблюдательного исследования АВРОРА (Амтолметин гуацил: Всероссийский Регистр при Остеоартрите, Ревматоидном артрите и Анкилозирующем спондилите). Науч.-практ. ревматол., 57(1): 66–74.
- 20. Fitzgerald G.A. (2003) COX-2 and beyond: approaches to prostaglandin inhibition in human disease. Nat. Rev. Drug. Discov., 2: 879–99.
- 21. Schror K., Weber A.A. (1997) Roles of vasodi- latatory prostaglandins in mitogenesis of vascular smooth muscle cells. Agents Actions., 48: 63–91.
- 22. Лысенко Г. И., Ткаченко В. И. (2013) Амтолметин гуацил –новый нестероидный противовоспалительный препарат в лечении боли в суставах. Семейная медицина, 4: 52–56.
- 23. Aw T.J., Haas S.J., Liew D., Krum H. (2005) Metaanalysis of cyclooxygenase-2 inhibitors and their effects on blood pressure. Arch. Intern. Med., 165: 490–496.
- 24. Henry D.A. (1988) Side effects of non-steroidal antiinflammatory drugs. Balliere’s Clin. Rheumatol., 2: 425–454.
- 25. Wong D., Wang M., Cheng Y., Fitzgerald G.A. (2005) Cardiovascular hazard and nonsteroidal antiinflammatory drugs. Curr. Opin. Pharmacol., 5: 204–210.
- 26. Ghosh R., Hwang S.M., Cui Z., Gilda J.E., Gomes A.V. (2016) Diferent efects of the nonsteroidal anti-infammatory drugs meclofenamate sodium and naproxen sodium on proteasome activity in cardiac cells. J. Mol. Cell Cardiol., 94: 131–144. https://doi. org/10.1016/j.yjmcc.2016.03.016.
- 27. Gurbel P., Tantry U., Weisman S. (2019) A narrative review of the cardiovascular risks associated with concomitant aspirin and NSAID use. Journal of thrombosis and thrombolysis, 47(1): 16–30 (https://doi.org/10.1007/s11239-018-1764-5).
- 28.Bally M., Dendukuri N., Rich B. et al. (2017) Risk of acute myocardial infarction with NSAIDs in real world use: bayesian meta-analysis of individual patient data. BMJ (Clinical research ed.), 357: j1909 (https://doi.org/10.1136/bmj.j1909).
- 29. Cooper C., Chapurlat R., Al-Daghri N., et al. (2019) Safety of oral non-selective non-steroidal anti-inflammatory drugs in osteoarthritis: what does the literature say?. Drugs & aging, 36(1): 15–24.
- 30. McGettigan P., Henry D. (2011) Cardiovascular risk with non-steroidal anti-inflammatory drugs: systematic review of population-based controlled observational studies. PLoS medicine, 8(9): e1001098 (https://doi.org/10.1371/journal.pmed.1001098).
- 31. Vane J.R. (2000) The fight against rheumatism: from willow bark to COX-1 sparing drugs. J. Physiol. Pharmacol., 51: 573–586.
- 32. Трухан Д.И., Деговцов Е.Н. (2016) Выбор НПВС для пациента с хроническим послеоперационным болевым синдромом на амбулаторно-поликлиническом этапе: в фокусе — амтолметин гуацил. Стационарозамещающие технологии: Амбулаторная хирургия, (1–2): 88–93.
- 33. Tubaro E., Belogi L., Mezzadri C.M. (2000) The mechanism of action of amtolmetin guacyl, a new gastroprotective nonsteroidal antiinflammatory drug. Eur. J. Pharmacol., 387: 233–244.
- 34. Tubaro E., Belogi L., Mezzadri C.M., Bettelli E. (2003) Impact on the bowel of amtolmetin guacyl, a new gastroprotective nonsteroidal antiinflammatory drug. Eur. J. Pharmacol. Safety and efficacy of amtolmetin guacyl and celecoxib., 467: 173–183.
- 35. Kirkova M., Alexandova A., Kesiova M., Todorov S. (2007) In vivo effects of amtolmetin guacyl on lipid peroxidation and antioxidant defence systems. Comparison with non-selective and COX-2 selective NSAIDs. Autonomic & autacoid pharmacology, 27(2): 99–104 (https://doi.org/10.1111/j.1474–8673.2007.00395.x).
- 36. Ofman J.J., MacLean C.H., Straus W.L. et al. (2003) Meta-analysis of dyspepsia and non-steroidal anti-inflammatory drugs. Arthritis Rheum., 49: 508–518. doi: 10.1002/art.11192.
- 37. Singh G., Triadafilopoulos G. (1999) Epidemiology of NSAID induced gastrointestinal complications. J. Rheumatol., 15: 18–24.
- 38. Marcolongo R., Frediani B., Biasi G. et al. (1999) A meta-analysis of the tolerability of amtolmetin guacil, a novel, effective nonsteroidal anti-inflammatory drug, compared with established agents. Clin. Drug. Investigation, 17(2): 89–96.
- 39. Montrone F., Santandrea S., Caruso I. et al. (2000) Amtolmetin Guacyl versus Piroxicam in Patients with Osteoarthritis. J. Inter. Med. Res., 28: 99–100.
- 40. Koo K. Danko, Kovacs M., Scarpignato C. (2005) Gastrointestinal safety of amtolmetin guacyl in comparison with celecoxib in patients with rheumatoid arthritis. Clin. Exp. Rheumatol., 23: 809–818.
- 41. Jajic Z., Malaise M., Nekam K. et al. (2005) Gastrointestinal safety of amtolmetin guacyl in comparison with celecoxib in patients with rheumatoid arthritis. Clin. Exp. Rheumatol., 23: 809–818.
- 42. Tubaro E., Belogi L., Mezzadri C.M. (2001) Anti-inflammatory and antiplatelet effect of Amtolmetin Guacyl, a new gastroprotective nonsteroidal anti-inflammatory drug. Arzneim Forsch/Drug Res., 51: 737–742.
- 43. Гайдукова И.З., Ребров А.П., Апаркина А.В., Хондкарян Э.В. (2015) Эффективность и кардиоваскулярная безопасность амтолметин гуацила (Найзилата) у больных анкилозирующим спондилитом: промежуточные результаты исследования КОРОНА. Эффективная фармакотерапия, ревматология, травматология и ортопедия, 3: 4–10.
- 44. Niccoli L., Bellinо S., Cantini F. (2002) Renal tolerability of three commonly employed non-steroidal anti-inflammatory drugs in elderly patients with osteoarthritis. Clin. Exp. Rheumatol., 20: 201–7.
- 45. Biasi G., Marcolongo R. (2001) Efficacy and safety of amtolmetin guacyl in the treatment of acute osteoarthritis. Minerva medica, 92(5): 315–324.
Кардиоваскулярный риск у больных остеоартрозом: результаты всеукраинского исследования «ПАРТНЕР»
Резюме. Остеоартроз (ОА) — одно из самых распространенных хронических заболеваний во всем мире. Сердечно-сосудистые заболевания являются очень распространенными среди больных ОА в разных странах. Данные о распространенности сердечно-сосудистых заболеваний у больных ОА в Украине отсутствуют. Методы. Многоцентровое исследование «ПАРТНЕР» (Распространенность кардиоваскулярного риска при впервые диагностированном первичном остеоартрозе) было проведено в августе 2019 — марте 2020 гг. В исследование было включено 4769 больных с впервые диагностированным ОА. Результаты. Полные данные были собраны для 3936 пациентов. Пациенты с впервые диагностированным первичным ОА в Украине значительно чаще имеют сопутствующую кардиоваскулярную патологию по сравнению с зарубежными данными. Значительное количество этих больных (2946 (75%)) даже без расчета SCORE следует отнести к категории лиц с высоким и очень высоким риском развития сердечно-сосудистых осложнений, поскольку они уже имеют сердечно-сосудистые заболевания атеросклеротического генеза (55%), сахарный диабет (21%), очень высокий уровень артериального давления (15%) и/или общего холестерина и хроническую болезнь почек (5%). Согласно результатам расчета SCORE к категории лиц с очень высоким кардиоваскулярным риском следует отнести еще 127 пациентов, то есть общее количество больных ОА с высоким и очень высоким кардиоваскулярным риском достигло 3073, что составляет 78% общего количества проанкетированных лиц с первичным ОА. Эти особенности необходимо учитывать при назначении лечения больным ОА. Обсуждение. Основной стратегией, направленной на предупреждение развития осложнений, связанных с применением нестероидных противовоспалительных препаратов (НПВП), является применение препаратов с лучшим профилем безопасности. Одним из таких препаратов является амтолметин гуацил. Такие особенности препарата, как гастропротекторный эффект вместе с противовоспалительным и антиагрегантным влиянием, позволяют рекомендовать амтолметин гуацил для лечения больных ОА с высоким желудочно-кишечным и сердечно-сосудистым риском, особенно в случаях, когда необходима длительная терапия. Выводы. Результаты исследования «ПАРТНЕР» продемонстрировали значительную распространенность сердечно-сосудистой патологии и высокий риск развития серьезных сердечно-сосудистых событий у пациентов с впервые диагностированным первичным ОА в Украине. Это необходимо принимать во внимание при выборе НПВП у этих больных.
Ключевые слова: остеоартроз, сердечно-сосудистые заболевания, НПВП, амтолметин гуацил.
Адреса для листування:
Яременко Олег Борисович
01601, Київ, бульв. Тараса Шевченка, 13
Національний медичний університет ім. О.О. Богомольця,
кафедра внутрішньої медицини № 3

Leave a comment