АНЦА-асоційований васкуліт — оновлений погляд на ведення пацієнтів
Борткевич О.П. , Корендович В.В., Ярецька Г.В.
Резюме. Наведено сучасну номенклатуру, принципи діагностики, диференційної діагностики та лікування АНЦА-асоційованого васкуліту. Окремо виділені підходи до індукції та підтримання ремісії, моніторингу та запобігання ускладненням лікування, а також поняття рефрактерного захворювання.
Визначення, номенклатура
Антинейтрофільні цитоплазматичні антитіла (АНЦА)-асоційований васкуліт (ААВ) — гетерогенне, мультисистемне захворювання невідомої етіології, що характеризується некротизуючим запаленням кровоносних судин дрібного та середнього калібру, асоціюється з АНЦА до мієлопероксидази (МПО) чи протеїнази-3 (ПР3) та включає три підтипи: гранулематозний поліангіїт (ГПА) (в минулому — хвороба Вегенера), еозинофільний гранулематоз із поліангіїтом (ЕГПА) (синдром Черджа — Стросс) та мікроскопічний поліангіїт (МПА) [23, 32, 35].
У 2012 р. відбулася конференція в місті Чапел Хілл (Chapel Hill), США, з метою перегляду попередньої номенклатури васкулітів за 1994 р. Робоча група оновила назви та визначення захворювань, таким чином, нова номенклатура краще відображає патогенез, патологічний стан та клінічні ознаки васкулітів. Відповідно до нової номенклатури, поділ системних ААВ на підтипи проводиться залежно від клінічної картини та даних гістологічного дослідження (таблиця) [22, 23].
| ААВ | Характерні ознаки |
|---|---|
| МПА | Васкуліт без ознак гранулематозу та бронхіальної астми, часто вражаються нирки та легені |
| ГПА | Ознаки гранулематозного запалення за відсутності бронхіальної астми, часто вражаються нирки, судини очей та легень |
| ЕГПА | Наявність гранулематозного запалення, бронхіальної астми та еозинофілії, часто наявні носові поліпи |
Внаслідок гетерогенності проявів ААВ вчені розглядають питання модифікації нещодавно прийнятої номенклатури васкулітів. Так, у французькому дослідженні за участю 157 пацієнтів з ЕГПА виявили значну гетерогенність системних проявів захворювання. Використовуючи стратифікацію пацієнтів на підгрупи залежно від наявності та виду антитіл і клінічних ознак васкуліту, у хворих із наявністю АНЦА виявлено більш типову маніфестацію васкуліту, втрату маси тіла, міалгію, артралгію та захворювання нирок, на відміну від хворих без АНЦА. З іншого боку, у пацієнтів без АНЦА частіше виявляли міокардит за відсутності системних проявів. У 41% пацієнтів із діагнозом ЕГПА не спостерігали поліангіїту. Автори дослідження пропонують змінити номенклатуру васкуліту з метою розділення діагнозу ЕГПА на підгрупи:
- гіпереозинофільна астма з будь-якими системними (не за типом васкуліту) проявами та відсутністю АНЦА;
- поліангіїт (васкуліт, ураження нирок та судин за типом васкуліту, множинний мононеврит і/або АНЦА із системними проявами) [9].
Автори номенклатури 2012 р. наголошують, що вона не є класифікацією чи діагностичними критеріями. Класифікаційні критерії Американської колегії ревматологів (American College of Rheumatology — ACR) 1990 р. [52] мають певні обмеження: не проводять чіткої межі між ГПА та МПА, чи іншими захворюваннями-«масками» ГПА; немає інформації щодо проведення аналізу АНЦА. Крім того, в класифікації ЕГПА не включено залучення серця та висипки на шкірі, а МПА взагалі не розглядається ACR [40, 50]. На сьогодні триває велике міжнародне обсерваційне дослідження DCVAS (діагностичні та класифікаційні критерії васкулітів) з понад 6 тис. учасників, метою якого є розроблення та затвердження діагностичних і класифікаційних критеріїв системних васкулітів, включаючи ААВ, для застосування у клінічній практиці та клінічних дослідженнях [1, 27].
Антитіла та клінічні прояви хвороби
Відповідно до перегляду номенклатури васкулітів 2012 р., діагноз визначається здебільшого фенотипом захворювання, а не типом антитіл [23, 36]. Однак останнім часом зазначається генетична неоднорідність МПО- та ПР3-АНЦА, при цьому фенотипічні прояви схрещуються та не можуть бути чітко відмежовані [37]. Наприклад, при дослідженні біоптатів у хворих на ААВ МПО-АНЦА наявні у >80% пацієнтів з ізольованим підгострим гломерулонефритом. ПР3-АНЦА відзначають у >80% при кавернах у легенях чи деструктивному процесі ЛОР-органів, а МПО-АНЦА частіше асоціюється з легеневим фіброзом. У хворих із ПР3-АНЦА загалом відзначається вища частота позаниркових системних проявів порівняно з МПО-АНЦА [7]. Поділ пацієнтів на підгрупи дозволить у майбутньому більш індивідуалізовано підбирати терапію для підвищення ефективності та зниження їх смертності [20].
Результати спостережень свідчать, що пацієнти з ГПА без АНЦА — це переважно особи з локалізованим захворюванням (верхні чи нижні дихальні шляхи без клінічних ознак васкуліту), без тяжкого ураження органів [36]. За наявності антитіл у хворих із МПО-АНЦА спостерігається вища поширеність лімітованого захворювання та нижча частота тяжких системних проявів. Значно менше пацієнтів з МПО-АНЦА отримують циклофосфамід чи ритуксимаб, що свідчить про сприятливіший перебіг захворювання в них та на нижчу кумулятивну дозу циклофосфаміду [43]. Однак в іншому аналізі 365 хворих з ГПА не виявили релевантної клінічної гетерогенності між МПО- та ПР3-позитивними хворими з ГПА, а ризик загострення ГПА був більше пов’язаний із фенотипом захворювання, а не типом АНЦА [33].
Наявність АНЦА — головна детермінанта клінічних проявів ЕГПА. Пацієнти з ЕГПА та наявністю АНЦА (зазвичай МПО) частіше мають типові ознаки васкуліту (некротизуючий гломерулонефрит, легеневі кровотечі, пурпура, множинний мононеврит), в той час як у хворих без АНЦА відзначається еозинофільна інфільтрація органів (наприклад міокардит) [20]. Відсутність АНЦА в цьому разі не означає кращий прогноз захворювання, оскільки міокардит — тяжке ураження з високим рівнем смертності [7, 24].
Принципи діагностики та диференційної діагностики
Діагностика системного васкуліту ґрунтується на ретельному аналізі клінічної картини, результатів лабораторних/інструментальних методів обстеження та гістологічного дослідження. Клінічно ААВ може нагадувати гострий коронарний синдром [12], антифосфоліпідний синдром, атероемболічні захворювання, кальцифілаксію, гіпереозинофільний синдром, емболії (міксома серця, внутрішньосерцеві тромби, ендокардит, мікотична аневризма тощо); ідіопатичну дифузну альвеолярну кровотечу, інфекційний процес (ендокардит, синдром дисемінованого внутрішньосудинного згортання крові тощо), внутрішньосудинну лімфому, лімфоматоїдний гранулематоз, злоякісний атрофічний папульоз, тромботичну тромбоцитопенічну пурпуру тощо [34].
АНЦА-тестування необхідно проводити в акредитованих лабораторіях, які беруть участь у програмах тестування із затвердження якості [53]. Існує два основні методи виявлення АНЦА — непряма імунофлюоресценція та імуноферментний аналіз (ІФА). Методом непрямої імунофлюоресценції визначається властивість АНЦА зв’язуватись з антигенами нейтрофілів — це можуть бути перинуклеарні (p-AНЦА) чи цитоплазматичні (с-АНЦА) антитіла. Ключовими аутоантигенами для даних антитіл є відповідно MПO та ПР3, що виявляються методом ІФА. У понад 80% випадків антитіла до ПР3 асоціюються з ГПА, МПО — з МПА. При синдромі Черджа — Стросс АНЦА виявляються лише в половині випадків, найчастіше це антитіла до МПО [15, 28, 48]. Роль визначення АНЦА як предиктора майбутнього загострення захворювання є спірною та продовжує вивчатися [53].
Вважають, що метод непрямої імунофлюоресценції більш чутливий для ідентифікації антитіл, тобто його можна використовувати для скринінгу наявності патогенних антитіл у пацієнтів з відповідною клінічною картиною, а у разі позитивного результату наступний крок — це визначення специфічного аутоантигену за допомогою ІФА [15, 48].
У клінічній практиці надзвичайно важлива швидка та рання первинна діагностика пацієнтів з ААВ. Послідовне дослідження АНЦА відповідно до правил за допомогою непрямої імунофлюоресценції та ІФА зараз дещо рідше використовують у лікарнях, особливо при гострих станах. Враховуючи розвиток нових тест-систем з високою специфічністю (наприклад ІФА другого і третього покоління) та кореляцію результатів з активністю захворювання, а також необхідний час на проведення аналізів та додаткові кошти, постає питання взагалі про необхідність застосування методу непрямої імунофлюоресценції для діагностики системних васкулітів. Хемілюмінісцентний аналіз Phadia ELiA та дот-блотинг (Dotblot) — це нові лабораторні методи з високою чутливістю та специфічністю у пацієнтів з підозрою на ААВ, їх комбінація дає результати з високою чутливістю та кращою специфічністю, ніж метод непрямої імунофлюоресценції [11, 13].
Чутливість та специфічність цих антитіл не 100%. Бувають випадки наявності АНЦА за відсутності системного васкуліту, наприклад, при системному червоному вовчаку чи інших системних захворюваннях сполучної тканини, неспецифічному виразковому коліті чи аутоімунному гепатиті — при цих захворюваннях виявляється переважно перинуклеарний тип аутоантитіл [15, 48]. На відміну від пацієнтів з ААВ, у хворих з індукованим препаратами васкулітом спостерігається нетипова картина на непрямій імунофлюоресценції та дискордантність між наявністю антитіл і специфічністю до звичних антигенів методом ІФА [27].
Зазначимо, що одночасна наявність антитіл до ПР3 та МПО за методом ІФА спостерігається у 0,9% пацієнтів з позитивними АНЦА за методом непрямої імунофлюоресценції. Утворення антитіл до обох антигенів зазвичай не пов’язане із системними некротизуючими васкулітами, а з іншими аутоімунними хворобами, запальними захворюваннями кишечнику, інфекційними захворюваннями, гематологічними хворобами тощо [14]. Так, у дослідженні за участю пацієнтів із запальними захворюваннями кишечнику виявили їх схильність до розвитку різних типів васкулітів. При цьому із 32 хворих з васкулітами у 8 виявили ААВ (6 ГПА, 2 ЕГПА) [45].
Навпаки, у близько ⅓ пацієнтів з ААВ взагалі не виявляються антитіла [15], що можна зіставити з серонегативними ревматоїдним артритом чи системним червоним вовчаком [23]. Таким чином, негативний результат АНЦА не виключає васкуліту за наявності клінічних ознак активного захворювання [11].
За методами візуалізації органів грудної клітки диференційну діагностику ГПА слід проводити із субплевральними вузловими утвореннями, інфекційними хворобами, злоякісними пухлинами, в тому числі з метастазами, пневмоніями, амілоїдозом, рецидивним поліхондритом та ін. МПА необхідно диференціювати з ГПА, синдромом Гудпасчера, системним червоним вовчаком та ін. Диференційна діагностика ЕГПА включає еозинофільну пневмонію та інші типи пневмоній, підгострий гіперсенситивний пневмоніт, МПА, системний червоний вовчак, метастатичну кальцифікацію, інфекційний бронхіоліт, дихальний бронхіоліт тощо [31].
Антитіла до ендотеліальних клітин — гетерогенна група антитіл та водночас перспективний маркер ААВ. Цей тип антитіл може активувати ендотеліальні клітини, індукувати апоптоз та брати участь у патогенезі системних васкулітів. До 60% хворих на МПА, майже 100% — на ГПА та до 69% — ЕГПА мають сироваткові антитіла до ендотеліальних клітин [29].
Біопсія — найбільш достовірне дослідження для встановлення характеру та поширеності запального процесу, встановлення діагнозу та визначення активності системного васкуліту. Вибір локалізації для взяття біоптату проводять із врахуванням клінічної картини захворювання [29].
Принципи лікування пацієнтів
Виживаність пацієнтів з АНЦА-асоційованими васкулітами значно покращилась протягом останніх десятиріч. До появи імуносупресорів смертність протягом 1 року з моменту встановлення діагнозу становила 80%, в наш час виживаність становить 90% [41]. В обсерваційному дослідженні пацієнтів з ААВ та захворюваннями нирок у 1985–2009 рр. показано, що 5-річна виживаність становила 64% у 1985–1989 рр. та 83% — у 2005–2009 рр. На відміну від продовження тривалості життя пацієнтів із ААВ, частота загострень захворювань практично не змінилася з часом [42]. Так, в період 1994–2006 рр. поширеність ГПА у Північній Німеччині стала майже вдвічі вищою (зросла з 58 до 98 випадків на 1 млн населення), а МПА та ЕГПА стала втричі вищою (з 9 до 28 та з 7 до 24 на 1 млн відповідно), що значною мірою є індикатором успішного лікування. Захворюваність на ААВ залишається стабільною [19].
Далі проаналізуємо нові рекомендації EULAR (The European League Against Rheumatism — Європейська антиревматична ліга) щодо лікування ААВ 2016 р. У рекомендаціях зазначається, що пацієнтів з ААВ необхідно лікувати в закладах, які співпрацюють з експертними центрами, або безпосередньо в експертних центрах. Загальновизнані режими лікування пацієнтів із системним васкулітом поділяються на індукцію ремісії, підтримання ремісії та довготривале спостереження (схема) [35, 53].
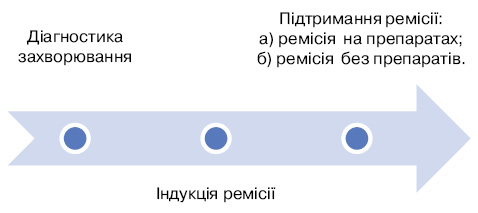
Залежно від перебігу захворювання розрізняють ремісію, рецидив захворювання та рефрактерний перебіг. Ремісія, тобто добре контрольоване захворювання, може бути у разі застосування препаратів та без прийому препаратів (протягом останніх принаймні 6 міс). Рецидив — це активація в минулому добре контрольованого захворювання. Рефрактерний (або резистентний) перебіг означає прогресивне захворювання, яке не відповідає на застосовуване лікування [35, 53].
Надзвичайно важливим принципом лікування є моніторинг потенційних ускладнень та за можливості модифікація факторів ризику при веденні пацієнтів з ААВ [3]. Наприклад, тютюнопаління пацієнтів з ААВ асоціюється з ішемією шкіри, інфарктом міокарда та більш швидким прогресуванням захворювання нирок [38].
Незважаючи на появу ефективного лікування ААВ, воно, все ж, викликає низку ускладнень. Наприклад, глюкокортикоїдна (ГК)-терапія може призводити до інфекційних ускладнень, остеопорозу та переломів, асептичного некрозу та розвитку цукрового діабету. Циклофосфамід підвищує ризик інфекційних захворювань, спричиняє безпліддя, геморагічний цистит і злоякісні новоутворення. Лікування мофетилу мікофенолатом може ускладнитися прогресивною мультифокальною лейкоенцефалопатією [51]. Нові доступні та потенційні препарати для лікування при ААВ, на відміну від традиційних імуносупресорів, мають більш специфічні мішені [16], а разом з тим «делікатніші» побічні ефекти.
Індукція ремісії
Для індукції ремісії ААВ або лікування у разі серйозного рецидиву захворювання, перебіг якого становить загрозу для життя пацієнта чи функціонування певного органа, рекомендується призначати ГК та один із препаратів на вибір: циклофосфамід (перорально чи пульс-режим) чи ритуксимаб. Якщо ж у пацієнта системний васкуліт не несе загрози для життя чи певного органа, тоді ГК дозволяється комбінувати з метотрексатом чи мофетилу мікофенолатом. Доза метотрексату в настановах EULAR — 20–25 мг/тиж. Як метод ад’ювантної терапії у хворих зі швидкопрогресуючим гломерулонефритом та креатиніном у сироватці крові >500 мкмоль/л, а також дифузними альвеолярними кровотечами, можна застосувати плазмаферез [53].
Системний васкуліт — тяжке захворювання з високою летальністю без лікування. Досвід застосування циклофосфаміду справді дозволив значно поліпшити прогноз для пацієнтів, однак побічні ефекти препарату, такі як інфекційні ураження, порушення фертильності та злоякісні новоутворення — особливо рак сечового міхура, змусили шукати нові препарати з кращим профілем безпеки.
Успішне застосування ритуксимабу у пацієнтів із системним васкулітом показало значно нижчий профіль токсичності порівняно з циклофосфамідом, разом з тим зіставну ефективність для індукції ремісії та нижчу частоту загострення захворювання, а в подальшому — зниження кумулятивної дози ГК. Залишаються не повністю вирішеним, як правильно вводити препарат, оскільки в різних клінічних дослідженнях ритуксимаб застосовували в різних дозах та інтервалах. Віддалені наслідки лікування ритуксимабом поки що невідомі [44].
В Європейських рекомендаціях максимальна добова доза ГК для індукції ремісії — 80 мг/добу за преднізолоном. Зауважимо, що в нових рекомендаціях EULAR немає згадки про призначення пульс-терапії ГК. Експерти з Великобританії допускають застосування внутрішньовенно (в/в) інфузії ГК (250–500 мг метилпреднізолону) перед або разом із першими двома пульс-терапіями циклофосфамідом [35, 53]. В літературі виявлено небагато інформації про порівняльну ефективність в/в пульс-терапії ГК та пероральною формою. Незважаючи на це, багато експертів підтримують доцільність призначення пульс-терапії ГК пацієнтам із тяжким перебігом васкуліту для індукції ремісії, це також відображається в дизайнах клінічних досліджень WGET, RAVE, RITUXVAS. Таким чином, це питання залишається відкритим, а вибір тактики терапії ГК вирішує лікар [25].
За відсутності альтернативи застосування циклофосфаміду, наприклад внаслідок побічних ефектів чи високої вартості ритуксимабу, для зменшення токсичного впливу перорально чи в/в застосовують лікарський засіб месна. Месна зв’язується з токсичним метаболітом циклофосфаміду — акролеїном, перетворюючи його в нетоксичний [53].
Підтримання ремісії
У разі успішної індукції ремісії для подальшого контролю захворювання призначаються імуносупресори, хоча менш потужні й токсичні, ніж циклофосфамід. Для підтримання ремісії застосовують комбінацію ГК в низьких дозах та один із препаратів на вибір: азатіоприн, ритуксимаб, метотрексат чи мофетилу мікофенолат, і як альтернатива — лефлуномід. Результати кількох досліджень свідчать про зіставну ефективність азатіоприну та метотрексату для підтримання ремісії ГПА та МПА. Відповідно до рекомендацій, фазу підтримання ремісії слід продовжувати принаймні протягом 24 міс, а у ПР3-позитивних пацієнтів — до 36 міс [40, 53]. Нижчий рівень креатиніну та ураження легень у пацієнтів з ААВ незалежно асоціюється з підвищеним ризиком загострення захворювання [30].
Ритуксимаб знижує титр АНЦА щодо загальних рівнів імуноглобуліну (Ig) G, однак при тривалій терапії загальний рівень IgG залишається стабільним, що є передумовою низької частоти інфекційних ускладнень [8]. Результати дослідження MAINRITSAN свідчать, що комбінація ритуксимабу з низькими дозами ГК може вважатись ефективною та безпечною альтернативою циклофосфаміду для підтримання ремісії у хворих на ААВ, особливо з недавно встановленим діагнозом ГПА [2].
Ретроспективне дослідження пацієнтів з ГПА показало значно кращу ефективність ритуксимабу для підтримання ремісії у разі введення при підвищенні рівнів В-лімфоцитів чи ПР3-АНЦА, ніж лікування у разі клінічного загострення захворювання (превентивне введення) [6]. Рандомізоване клінічне дослідження MAINRITSAN 2 якраз спрямоване на порівняння двох режимів введення ритуксимабу: 500 мг з фіксованими інтервалами та 500 мг — при підвищенні рівнів CD19-лімфоцитів чи титру АНЦА [2].
Також показано, що ризик загострення захворювання при підвищенні рівнів ПР3-антитіл вищий при терапії ритуксимабом, ніж циклофосфамідом та азатіоприном: ймовірно, клінічна значимість підвищення титру антитіл вища у хворих, які не отримують синтетичних хворобо-модифікуючих засобів. Періодичне вимірювання рівнів ПР3-АНЦА насамперед доцільно використовувати за наявності капіляритів (ураження нирок чи альвеолярна кровотеча) та у хворих, які лікуються ритуксимабом [17].
Поки що доцільність призначення ритуксимабу для лікування ЕГПА залишається неясною. Попередні дані свідчать про перспективність цього препарату для індукції та підтримання ремісії. Безумовно, потенційна ефективність препарату буде в майбутньому оцінена у рандомізованих клінічних дослідженнях [39].
Ризик загострення ГПА може знизитися за рахунок поєднаного застосування антибіотика триметоприму/сульфаметоксазолу чи використання локальних антибактеріальних мазей [18, 35, 53]. Зауважимо, що близько 65% пацієнтів із ГПА — хронічні носії S. aureus в носовій порожнині, на відміну від 25% здорових осіб. Це, в свою чергу, несе підвищений ризик ураження ЛОР-органів, загострення та високої активності захворювання. Метааналізи демонструють позитивний ефект від антибактеріальної терапії, нижчу частоту загострень після елімінації стафілокока [18, 49].
Рефрактерне захворювання
Рефрактерне захворювання — прогресивне захворювання, що не відповідає на призначену терапію, тобто ремісії не досягнуто [53]. У разі резистентності до лікування в фазі індукції ремісії необхідно змінити циклофосфамід на ритуксимаб чи навпаки. Слід визначити можливі причини рефрактерності до терапії, за необхідності переглянути діагноз та провести диференційну діагностику. У рекомендаціях наголошується на важливості лікування таких пацієнтів у тісній співпраці або безпосередньо в експертних центрах [53].
При веденні пацієнтів з ААВ необхідно звертати особливу увагу на системність ураження. Від того, які системи органів залучені в патологічний процес, залежить вибір стратегії лікування та подальший прогноз. Завжди необхідно проводити ретельну диференційну діагностику для виключення інших можливих причин системного захворювання, включаючи злоякісний процес, системну інфекцію, реакцію на препарати, вторинні васкуліти тощо — іноді з проведенням повторних біопсій [24, 35].
Так, близько 10–20% пацієнтів резистентні до лікування комбінацією циклофосфаміду та ГК. У дослідженні пацієнтів з ААВ встановлено, що предиктором резистентності до лікування є підвищений рівень креатиніну в сироватці крові. Можливим поясненням цієї асоціації є те, що лікарі при зниженому кліренсі креатиніну пацієнтів намагаються належним чином знизити дозу циклофосфаміду, оскільки препарат виділяється переважно нирками. Корекція дозування у пацієнтів із порушенням функції нирок призводить до отримання препарату в нижчих дозах та зниження шансів ремісії [30].
Ретроспективне дослідження 92 пацієнтів з ААВ показало ефективність в/в введення IgG, тому це також може бути додатковою терапією, особливо у пацієнтів із протипоказаннями чи неадекватною відповіддю на лікування іншими препаратами [10].
У пацієнтів з рефрактерним захворюванням чи частими загостреннями можливим є призначення комбінації ритуксимабу з синтетичними хворобо-модифікуючими засобами — азатіоприном, метотрексатом, лефлуномідом чи мофетилу мікофенолатом. Одночасне призначення ритуксимабу з синтетичними препаратами сприяє меншій кількості загострень порівняно з монотерапією. Однак є дані про підвищений ризик виникнення інфекційних захворювань при комбінації ритуксимабу з циклофосфамідом та мофетилу мікофенолатом, особливо у вищих дозах [2, 4].
Описані випадки призначення при рефрактерному ЕГПА моноклонального антитіла до IgE — омалізумабу. Препарат зменшує прояви бронхіальної астми і потребу в застосуванні ГК, однак не зумовлює впливу на кількість еозинофілів, рівні С-реактивного білка та IgE в сироватці крові, тому його використання обмежується лише окремими випадками [39].
Інтерлейкін (ІЛ)-6 — цитокін, що сприяє диференціації В-лімфоцитів та активації макрофагів, диференціації Т-лімфоцитів і синтезу інших прозапальних цитокінів, відіграє центральну роль у патогенезі ААВ. Рівні ІЛ-6 у сироватці крові та експресія в біоптатах підвищені при активації ГПА та МПА. Таким чином, тоцилізумаб — потенційна опція лікування пацієнтів з ААВ, які мають рефрактерне захворювання чи протипоказання до стандартної терапії [5].
Моніторинг та запобігання ускладненням
(захворювання та лікування)
Згідно з рекомендаціями, моніторинг рівнів АНЦА в крові не може бути підґрунтям для зміни терапії ААВ, краще в цьому разі проводити комплексну клінічну оцінку стану пацієнта. Для цього можна використати затверджені методи оцінки активності захворювання. У лікарській практиці та клінічних дослідженнях для визначення активності ААВ найчастіше використовують індекс BVAS. Хоча цей індекс розрізняє стан активного захворювання та ремісії, однак результат певною мірою залежить від рішення особи, яка проводить оцінку [47, 53].
У пацієнтів, які приймають імуносупресори, насамперед циклофосфамід, необхідно виявляти можливі побічні ефекти та звертати на них увагу (наприклад гематурія з незрозумілої причини як ознака геморагічного циститу чи злоякісного процесу сечового міхура). При застосуванні ритуксимабу в Європейських рекомендаціях зазначається про доцільність вимірювання рівнів IgG в сироватці крові перед кожним курсом терапії ритуксимабом у пацієнтів з рецидивними інфекціями [53].
Рання смертність пацієнтів пов’язана переважно із власне захворюванням чи інфекційними ускладненнями, а віддалена смертність — із серцево-судинними ускладненнями, злоякісними процесами та інфекцією [20, 46]. Невідкладними станами у пацієнтів з ААВ найчастіше є загострення власне захворювання та інфекційні ускладнення [51].
При лікуванні ААВ необхідно звертати увагу на можливі коморбідності, пов’язані з васкулітами. Лікар має регулярно проводити оцінку серцево-судинного та інших ризиків у пацієнтів з ААВ. Пацієнти, у свою чергу, мають отримувати належну інформацію про своє захворювання, опції лікування та залучатися до самомоніторингу — це може поліпшити прихильність хворого до терапії та прогноз ААВ [53].
У хворих також спостерігається швидший атерогенез та серцево-судинна коморбідність, особливо розвиток інфаркту міокарда та інсульту. Причиною смерті протягом першого року хвороби у 25% випадків є серцево-судинні події. У 10% хворих із часом розвивається цукровий діабет [26, 27].
Хворі на ААВ мають у 20 разів вищий ризик тромбоемболічних ускладнень порівняно із загальною популяцією. Це, вірогідно, не пов’язано з виробленням антифосфоліпідних антитіл, оскільки у пацієнтів із розвитком тромбоемболії та без неї не спостерігається різниці в поширеності антифосфоліпідних антитіл. Лише 3,8% пацієнтів з ААВ — позитивні за антитілами до кардіоліпіну, що є зіставним із загальною популяцією [28]. Вірогідно, активація фактора комплементу С5а — головна причина підвищеного ризику тромбозу у хворих на ААВ. АНЦА-позитивні IgG здатні активувати С5а-праймовані нейтрофіли, які, у свою чергу, виділяють значно більше тканинного фактора й активують систему коагуляції [21].
Результати проведеного два роки тому дослідження свідчать, що у хворих на ААВ у 2,21 раза вищий ризик розвитку раку шкіри порівняно з контрольною групою здорових осіб, що асоціюється із тривалістю застосування циклофосфаміду понад 1 рік. На відміну від попередніх досліджень, не відзначено підвищеної схильності до розвитку раку сечового міхура, лейкемії чи злоякісних лімфом. Ці дані відображають зміну режимів лікування ААВ внаслідок появи нових препаратів та зменшення застосування циклофосфаміду. Відомо, що азатіоприн має властивість підвищувати чутливість геному клітин шкіри до ультрафіолетового випромінювання типу А, що також може пришвидшувати розвиток раку шкіри [41].
Висновки
Таким чином, ААВ — тяжке захворювання, що може вражати практично всі органи і тканини. Системний васкуліт потребує швидкої діагностики та невідкладного лікування внаслідок потенційних ускладнень. Доступні до застосування препарати є достатньо ефективними, значно подовжують тривалість життя пацієнтів та покращують довгостроковий прогноз, однак тривалий прийом імуносупресорів та ГК після індукції ремісії спричиняє численні побічні ефекти.
Список використаної літератури
- 1. ACR/EULAR study to develop classification and diagnostic criteria for primary systemic vasculitis (https://research.ndorms.ox.ac.uk/public/dcvas/).
- 2. Alba M.A., Flores-Suárez L.F. (2016) Rituximab as maintenance therapy for ANCA associated vasculitis: how, when and why? Reumatol. Clínica (English Edition), 12(1): 39–46.
- 3. Aviña‐Zubieta J.A., Mai A., Amiri N. et al. (2016) Risk of myocardial infarction and stroke in patients with granulomatosis with polyangiitis (Wegener’s): A Population‐Based Study. Arthritis Rheum., 68(11): 2752–2759.
- 4. Azar L., Springer J., Langford C. A., Hoffman G.S. (2014) Rituximab with or without a conventional maintenance agent in the treatment of relapsing granulomatosis with polyangiitis (Wegener’s): A Retrospective Single‐Center Study. Arthritis Rheum., 66(10): 2862–2870.
- 5. Berti A., Cavalli G., Campochiaro C. et al. (2015) Interleukin-6 in ANCA-associated vasculitis: rationale for successful treatment with tocilizumab. Semin. Arthritis Rheum., 45(1): 48–54.
- 6. Cartin-Ceba R., Golbin J.M., Keogh K.A. et al. (2012) Rituximab for remission induction and maintenance in refractorygranulomatosis with polyangiitis (Wegener’s): ten-year experience at a singlecenter. Arthritis Rheum., 64: 3770–3778.
- 7. Cornec D., Cornec-Le Gall E., Fervenza F.C., Specks U. (2016) ANCA-associated vasculitis [mdash] clinical utility of using ANCA specificity to classify patients. Nat. Rev. Rheumatol., 35: 953–960.
- 8. Cortazar F.B., Pendergraft W.F., Wenger J. et al. (2016) The effect of continuous B cell depletion with rituximab on pathogenic autoantibodies and total IgG levels in ANCA vasculitis. Arthritis Rheum., 69 (5): 1045–1053.
- 9. Cottin V., Bel E., Bottero P. et al. (2017) Revisiting the systemic vasculitis in eosinophilic granulomatosis with polyangiitis (Churg-Strauss): A study of 157 patients by the Groupe d’Etudes et de Recherche sur les Maladies Orphelines Pulmonaires and the European Respiratory Society Taskforce on eosinophilic granulomatosis with polyangiitis (Churg-Strauss). Autoim. Rev., 16(1): 1–9.
- 10. Crickx E., Machelart I., Lazaro E. et al. (2016) Intravenous immunoglobulin as an immunomodulating agent in antineutrophil cytoplasmic antibody-associated vasculitides: A French Nationwide Study of Ninety‐Two Patients. Arthritis Rheum., 68(3): 702–712.
- 11. Csernok E., Moosig F. (2014) Current and emerging techniques for ANCA detection in vasculitis. Nat. Rev. Rheumatol., 10(8): 494–501.
- 12. Cuminetti G., Regazzoni V., Vizzardi E. et al. (2016). Cardiac ANCA-associated vasculitis mimicking an acute coronary syndrome. Int. J. Сardiol., 214: 200–201.
- 13. de Joode A.A., Roozendaal C., van der Leij M.J. et al. (2014) Performance of two strategies for urgent ANCA and anti-GBM analysis in vasculitis. Eur. J. Іnt. Мed., 25(2): 182–186.
- 14. Denommé A.-S., Lakomy D., Olsson N. et al. (2015) Patients with dual MPO-and PR3-ANCA do not present primary systemic necrotizing vasculitis. Joint Bone Spine, 82(4): 292–294.
- 15. Flint S.M., McKinney E.F., Smith K.G. (2015) Emerging concepts in the pathogenesis of antineutrophil cytoplasmic antibody-associated vasculitis. Curr. Оpin. Rheumatol., 27(2): 197–203.
- 16. Furuta S., Jayne D. (2014) Emerging therapies in antineutrophil cytoplasm antibody-associated vasculitis. Curr. Оpin. Rheumatol., 26(1): 1–6.
- 17. Fussner L.A., Hummel A.M., Schroeder D.R. et al. (2016) Factors determining the clinical utility of serial measurements of antineutrophil cytoplasmic antibodies targeting proteinase 3. Arthritis Rheum., 68(7): 1700–1710.
- 18. Graninger W. (2015) Durch Infektionen ausgelöste Vaskulitiden. Aktuel. Rheumatol., 54(3): 223–226.
- 19. Herlyn K., Buckert F., Gross W.L., Reinhold-Keller E. (2014) Doubled prevalence rates of ANCA-associated vasculitides and giant cell arteritis between 1994 and 2006 in northern Germany. Rheumatology (Oxford, England) 53(5): ket440.
- 20. Holle J.U. (2013) L43. Seropositive and negative ANCA-associated vasculitis, anti-MPO and PR3-vasculitis: Different outcomes? La Presse Médicale, 42(4P2): 616–619.
- 21. Huang Y.M., Wang H., Wang C. et al. (2015) Promotion of hypercoagulability in antineutrophil cytoplasmic antibody-associated vasculitis by C5a‐induced tissue factor — expressing microparticles and neutrophil extracellular traps. Arthritis Rheum., 67(10): 2780–2790.
- 22. Jennette J.C., Falk R.J. (2014) Pathogenesis of antineutrophil cytoplasmic autoantibody-mediated disease. Nat. Rev. Rheumatol., 10(8): 463–473.
- 23. Jennette J.C., Falk R.J., Bacon P.A. et al. (2013) 2012 revised international chapel hill consensus conference nomenclature of vasculitides. Arthritis Rheum., 65(1): 1–11.
- 24. Kallenberg C.G.M. (2014) Key advances in the clinical approach to ANCA-associated vasculitis. Nat. Rev. Rheumatol., 10: 484–493.
- 25. Keller S.F., Miloslavsky E.M. (2016) Corticosteroids in antineutrophil cytoplasmic antibody-associated vasculitis. Rheumatic Dis. Clin. North America, 42(1): 91–101.
- 26. Lally L., Sammaritano L.R. (2015) Vasculitis in antiphospholipid syndrome. Rheumatic Dis. Clin. North America, 41(1): 109–123.
- 27. Lally L., Spiera R. (2015) Current landscape of antineutrophil cytoplasmic antibody-associated vasculitis: classification, diagnosis, and treatment. Rheumatic Dis. Clin. North America, 41(1): 1–19.
- 28. Lally L., Spiera R.F. (2015) Pulmonary vasculitis. Rheumatic Dis. Clin. North America, 41(2): 315–331.
- 29. Legendre P., Régent A., Thiebault M., Mouthon L. (2016) Anti-Endothelial Cell Antibodies in Vasculitis: A Systematic Review. Autoimmun. Rev., 16(2): 146–153.
- 30. Li Z.Y., Chang D.Y., Zhao M.H., Chen M. (2014) Predictors of treatment resistance and relapse in ANCA-associated vasculitis: a study of 439 cases in a single Chinese center. Arthritis Rheum., 66: 1920–1926.
- 31. Mahmoud Shamseldeen et al. (2016) Pulmonary vasculitis: Spectrum of imaging appearances. Radiol. Clin. North America, 54(6): 1097–1118.
- 32. Millet A., Pederzoli-Ribeil M., Guillevin L. et al. (2013) Antineutrophil cytoplasmic antibody-associated vasculitides: is it time to split up the group? Ann. Rheum. Dis., 72(8): 1273–1279.
- 33. Miloslavsky E.M., Lu N., Unizony S. et al. (2016) Myeloperoxidase-antineutrophil cytoplasmic antibody (ANCA)-positive and ANCA-negative patients with granulomatosis with polyangiitis (Wegener’s): Distinct patient subsets. Arthritis Rheum., 68(12): 2945–2952.
- 34. Miloslavsky E.M., Stone J.H., Unizony S.H. (2015) Challenging mimickers of primary systemic vasculitis. Rheum. Dis. Clin. North America, 41(1): 141–160.
- 35. Ntatsaki E., Carruthers D., Chakravarty K. et al. (2014) BSR and BHPR guideline for the management of adults with ANCA-associated vasculitis. Rheumatology, ket445.
- 36. Pagnoux C., Springer J. (2016) Editorial: Classifying antineutrophil cytoplasmic antibody (ANCA)-associated vasculitides according to ANCA type or phenotypic diagnosis: Salt or Pepper? Arthritis Rheum., 68(12): 2837–2840.
- 37. Pendergraft W.F., Nachman P.H. (2015) Recent pathogenetic advances in ANCA-associated vasculitis. La Presse Médicale, 44(6): e223–e229.
- 38. Perricone C., Versini M., Ben-Ami D. et al. (2016) Smoke and autoimmunity: the fire behind the disease. Autoim. Rev., 15(4): 354–374.
- 39. Puéchal X. (2016) Therapeutic immunomodulation in eosinophilic granulomatosis with polyangiitis (Churg-Strauss). Joint Bone Spine, 83(1): 7–10.
- 40. Puéchal X., Pagnoux C., Perrodeau É. et al. (2016) Long‐term outcomes among participants in the WEGENT Trial of remission‐maintenance therapy for granulomatosis with polyangiitis (Wegener’s) or microscopic polyangiitis. Arthritis Rheum., 68(3): 690–701.
- 41. Rahmattulla Chinar et al. (2015) Incidence of malignancies in patients with antineutrophil cytoplasmic antibody-associated vasculitis diagnosed between 1991 and 2013. Arthritis Rheum., 67(12): 3270–3278.
- 42. Rhee R.L., Hogan S.L., Poulton C.J. et al. (2016) Trends in long‐term outcomes among patients with antineutrophil cytoplasmic antibody-associated vasculitis with renal disease. Arthritis Rheum., 68(7): 1711–1720.
- 43. Schirmer J.H., Wright M.N., Herrmann K. et al. (2016) Myeloperoxidase-antineutrophil cytoplasmic antibody (ANCA)-positive granulomatosis with polyangiitis (Wegener‘s) is a clinically distinct subset of ANCA-associated vasculitis: A retrospective analysis of 315 patients from a German Vasculitis Referral Center. Arthritis Rheum., 68(12): 2953–2963.
- 44. Silva-Fernández L., Loza E., Martínez-Taboada V.M. et al. (2014) Biological therapy for systemic vasculitis: a systematic review. Seminars Arthritis Rheum., 43(4): 542–557.
- 45. Sy A., Khalidi N., Dehghan N. et al. (2016) Vasculitis in patients with inflammatory bowel diseases: A study of 32 patients and systematic review of the literature. Sem. Arthr. Rheum., 45(4): 475–482.
- 46. Tervaert J.W.C. (2013) Cardiovascular disease due to accelerated atherosclerosis in systemic vasculitides. Best Practice Res. Clin. Rheumatol., 27(1): 33–44.
- 47. Tomasson G. (2015) Outcome measures for antineutrophil cytoplasmic antibody-associated vasculitis. Curr. Оpin. Rheumatol., 27(1): 38–44.
- 48. UpToDate: http://www.uptodate.com
- 49. van Timmeren M.M., Heeringa P., Kallenberg C.G. (2014) Infectious triggers for vasculitis. Curr. Оpin. Rheumatol., 26(4): 416–423.
- 50. Waller R., Ahmed A., Patel I., Luqmani R. (2013) Update on the classification of vasculitis. Best Pract. Res. Clin. Rheumatol., 27(1): 3–17.
- 51. Wilfong E.M., Seo P. (2013) Vasculitis in the intensive care unit. Best Practice Res. Clin. Rheumatol., 27(1): 95–106.
- 52. Wolfe Frederick et al. (1990) The American College of Rheumatology 1990 criteria for the classification of fibromyalgia. Arthritis Rheum., 33(2): 160–172.
- 53. Yates M., Watts R.A., Bajema I.M. et al. (2016) EULAR/ERA-EDTA recommendations for the management of ANCA-associated vasculitis. Ann. Rheum. Dis., 75: 1583–1594.
АНЦА-ассоциированный васкулит — обновленный подход к ведению пациентов
Резюме. Даны современные номенклатура, принципы диагностики, дифференциальной диагностики и лечения АНЦА-ассоциированных васкулитов. Отдельно выделены подходы к индукции и поддержанию ремиссии, мониторингу и предупреждению осложнений лечения, а также понятие рефрактерного заболевания.
васкулит, антинейтрофильные цитоплазматические антитела (АНЦА), рекомендации, диагностика, лечение.
Адреса для листування:
Борткевич Олег Петрович
03680, Київ, вул. Народного ополчення, 5
ДУ «Національний науковий центр
«Інститут кардіології ім. М.Д. Стражеска»
НАМН України»

Leave a comment