ЕФЕКТИВНІСТЬ ПРЕПАРАТУ ПІАСКЛЕДИН® 300 У ХВОРИХ НА ПЕРВИННИЙ ОСТЕОАРТРОЗ КОЛІННИХ ТА КУЛЬШОВИХ СУГЛОБІВ*
Борткевич О.П. , Корендович В.В., Білявська Ю.В.
Резюме. В описаному проспективному дослідженні проведено оцінку ефективності та переносимості препарату Піаскледин® 300 у пацієнтів із первинним остеоартрозом колінних та кульшових суглобів І–ІІІ рентгенологічної стадії, які мали клінічно значимі прояви захворювання. До показників, за якими оцінювали ефективність, належали інтенсивність болю у спокої та при рухах, тривалість та інтенсивність ранкової скутості, індекс Лекена, індекс WOMAC, добова потреба у нестероїдних протизапальних препаратах та індивідуальна оцінка ефективності лікування. Також проаналізовано побічні ефекти препарату. Згідно з результатами отриманих даних, у більшості пацієнтів виявлено достовірне зниження індексу болю у спокої та при рухах, тривалості та інтенсивності ранкової скутості, а також показників сумарних індексів Лекена та WOMAC. Отже, Піаскледин® 300 — ефективний та безпечний препарат, що виявляє симптом-модифікуючий ефект, має хорошу переносимість, мінімальну кількість протипоказань, що є запорукою позитивного комплаєнсу.
ВСТУП
Остеоартроз (ОА) — прогресуюче захворювання синовіальних суглобів, що проявляється у порушенні відновлення ушкоджених суглобів, що є наслідком стресових чинників та може маніфестувати в результаті порушення будь-якої структури синовіальних суглобів, включаючи суглобовий хрящ, субхондральну кістку, зв’язки, меніски, періартикулярні м’язи, периферичні нерви та синовіальну оболонку [7]. Також ця нозологія розглядається як гетерогенна група захворювань різної етіології зі схожими біологічними, морфологічними, клінічними проявами і наслідком, в основі яких — ураження всіх компонентів суглоба, перш за все хряща, а також субхондральної кістки, синовіальної оболонки, зв’язок, капсули, навколосуглобових м’язів [1]. ОА — найпоширеніше захворювання суглобів, частота якого зростає з віком. Окрім цього, ОА — найчастіше діагностоване захворювання в загальній практиці; у майбутньому очікується збільшення кількості випадків за рахунок зростання тривалості життя пацієнтів [2]. При ОА погіршується якість життя, нерідко ускладнення цього захворювання призводить до інвалідизації пацієнта. Діагностика цієї нозологічної одиниці базується переважно на клінічних та рентгенологічних даних [1].
Мета лікування при ОА — зниження вираженості больового синдрому та запалення, зменшення прогресування захворювання і поліпшення функціональної здатності пацієнта. Лікарські засоби, які застосовують при лікуванні ОА, поділяються на симптом-модифікуючі препарати — анальгетики, нестероїдні протизапальні препарати (НПЗП), внутрішньосуглобові ін’єкції глюкокортикоїдів та структурно-модифікуючі препарати, які здатні модифікувати структуру хряща, які також називають SYSADOA (symptomatic slow actingdrugs for osteoarthritis) [12]. Вони не лише деякою мірою сповільнюють прогресування артрозу, але й активно впливають на основні клінічні прояви — запалення та больовий синдром, тобто виявляють і симптом-модифікуючий ефект [4, 9].
Піаскледин — оригінальний французький препарат класу SYSADOA. До складу Піаскледину входять фітостероли та насичені жирні кислоти, які отримують внаслідок гідролізу олій авокадо та соєвих бобів методом молекулярної дистиляції в пропорції 1:2 (Піаскледин**, A1S2, «Laboratories Expanscience», Франція). Як інгібітор інтерлейкіну-1 Піаскледин проявляє опосередкований колагенолітичний вплив на хондроцити і синовіоцити та сприяє зниженню синтезу колагенази, стромелізину, інтерлейкіну-6 та -8, а також простагландину Е2, тобто тих біологічних речовин, що беруть активну участь у розвитку запалення. До того ж цей хондропротектор характеризується доведеною клінічною ефективністю і потенційними хондропротекторними властивостями. Тому мета проведеного нами дослідження — оцінити ефективність і переносимість препарату Піаскледин 300 у пацієнтів з ОА колінних та кульшових суглобів.
Об’єкти І МЕТОДИ ДОСЛІДЖЕННЯ
У проведеному проспективному мультицентровому дослідженні брали участь амбулаторні чи стаціонарні пацієнти віком 40–70 років із первинним коксартрозом чи гонартрозом І–ІІІ рентгенологічної стадії, які мали клінічно значимі прояви захворювання, що відповідали оцінці інтенсивності болю в суглобах за 100 мм візуальною аналоговою шкалою (ВАШ) ≥30 мм та індексом Лекена ≥5 балів, та які потребували постійного застосування НПЗП протягом останніх 5 міс перед дослідженням.
До критеріїв виключення належали: застосування будь-яких препаратів із хондропротекторною активністю протягом останніх 3 міс; вторинний ОА; клінічно латентний перебіг захворювання; наявність виразки шлунка чи дванадцятипалої кишки; тяжка гепатоцелюлярна, ниркова недостатність; тяжкий перебіг інших гострих чи хронічних захворювань; індивідуальна непереносимість препарату, алергія на препарат; тяжкі соматичні захворювання (некомпенсована ішемічна хвороба серця, онкологічні захворювання, хронічна легенева недостатність, ВІЛ). Усім пацієнтам, включеним у дослідження, призначали Піаскледин 300 1 раз на добу, в один і той самий час під час прийому їжі, незалежно від періоду доби протягом 5 міс. За необхідності пацієнтам дозволялося приймати НПЗП в ефективній дозі.
З метою об’єктивізації оцінки клінічних проявів ОА та ефективності запропонованого препарату в ході дослідження використано та проаналізовано такі показники: інтенсивність болю у спокої та при рухах, тривалість та інтенсивність ранкової скутості, індекс Лекена, індекс WOMAC, добова потреба в НПЗП та індивідуальна оцінка ефективності лікарем і пацієнтом, а також кількість та вираженість побічних ефектів. Контроль ефективності лікування проводили через 1; 3 та 5 міс.
Інтенсивність больового синдрому в спокої та при рухах, а також інтенсивність ранкової скутості оцінювали за допомогою ВАШ. Тривалість ранкової скутості визначали в хвилинах.
При оцінюванні індекса Лекена враховують 5 показників, які пацієнт оцінює в балах: ступінь вираженості болю протягом ночі, вираженість болю при ходьбі, ступінь вираженості болю в положенні сидячи протягом >2 год, тривалість ранкової скутності та посилення болю в положенні стоячи протягом 30 хв, обмеження дистанції ходьби [8].
Індекс WOMAC використовують для оцінки болю, скутості та обмеження фізичних функцій у пацієнтів із коксартрозом та гонартрозом. Пацієнти оцінювали свій стан, відповідаючи на запитання в балах (від 0 до 100). При аналізі враховували сумарний індекс WOMAC [6].
Індивідуальну оцінку ефективності лікування лікарем та пацієнтом визначали так: значне покращення — 2; покращення — 1; без змін — 0; погіршення — (–1).
Статистичний аналіз проводили з використанням методів описової статистики, наведених у відсотках, методів варіаційної статистики з розрахунком частотних характеристик досліджуваних показників, середніх величин (середньої арифметичної — Х), оцінки їх варіабельності та середньої похибки відповідного показника. Для оцінки статистичної значимості різниці використовували t-критерій для порівняння частотних характеристик і середніх величин на рівні не нижче 95% та критерій достовірності (р) при заданому граничному рівні похибки першого роду (α) не вище 5% (p<0,05) та рівня похибки другого роду (β) — не вище 20%. Статистичну обробку даних проводили з використанням програмного забезпечення «Statistiсa 6.0».
РЕЗУЛЬТАТИ ТА ЇХ ОБГОВОРЕННЯ
Дослідження проводили на базі 7 дослідних центрів різних областей України. Загалом було включено 141 пацієнта (102 жінки (72,3%)), з яких 140 завершили дослідження: одна пацієнтка вибула у зв’язку з виникненням побічної реакції на лікарський засіб (описано нижче) та відмови від подальшої участі у дослідженні. Середній вік пацієнтів становив 60,2±8,44 року. Діагноз первинного гонартрозу встановлено у 114/141 (80,8%) хворих, а первинного коксартрозу — у 45/141 (31,9%) осіб.
Серед основних коморбідностей переважали гіпертонічна хвороба — 33/141 (23,4%), ішемічна хвороба серця — 20/141 (14,2%) та дегенеративно-дистрофічні процеси хребта — 19/141 (13,5%).
Найчастішим препаратом, застосовуваним пацієнтами з метою знеболення, був неселективний НПЗП — диклофенак натрію (42/141 (29,8%)) в ефективній дозі. Серед інших НПЗП також були німесулід (31/141 (21,9%)), мелоксикам (25/141 (17,7%)), еторикоксиб (10/141 (7,1%)) та целекоксиб (9/141 (6,4%)).
Клініко-демографічна характеристика пацієнтів з ОА, які увійшли в дослідження, наведена у табл. 1.
| Показник | Пацієнти з ОА |
|---|---|
| Середній вік, років (М±σ) | 60,2±8,44 |
| Кількість жінок/чоловіків, n (%) | 102 (72,3)/39 (27,7) |
| Рентгенологічна стадія II/III, n (%) | 98 (69,5)/43 (30,5) |
| Стаціонарні/амбулаторні пацієнти, n (%) | 94 (66,7)/47 (33,3) |
| Розподіл за ураженням суглобів — гонартроз/коксартроз, n (%) | 114 (80,8)/45 (31,9) |
| Основні коморбідності, n (%) | Гіпертонічна хвороба 33 (23,4); ішемічна хвороба серця 20 (14,2); дегенеративно-дистрофічний процес хребта 19 (13,5) |
| НПЗП, які переважно застосовували пацієнти, n (%) | Диклофенак 42 (29,8); німесулід 31 (21,9); мелоксикам 25 (17,7); еторикоксиб 10 (7,1); целекоксиб 9 (6,4) |
При аналізі за шкалами клінічних проявів ОА у 1-й день дослідження виявлено такі показники: середній індекс болю в спокої — 37,86±7,6, середній індекс болю при рухах — 44,63±8,1, тривалість ранкової скутості — 16,41±5,4 хв, інтенсивність ранкової скутості — 32,48±5,9, сумарний індекс Лекена — 9,70±2,6, сумарний індекс WOMAC — 265,00±42,4.
На момент включення у дослідження більшість пацієнтів (131/141 (92,9%)) мали потребу в застосуванні НПЗП протягом щонайменше останніх 7 днів у зв’язку з больовим суглобовим синдромом. Внаслідок того, що учасники дослідження застосовували різні НПЗП, добову дозу неможливо порівняти в абсолютних числах, тому вона представлена та порівнюється у відсотковому значенні, залежно від початкової дози у кожного окремого пацієнта. Так, визначено, що всі хворі, які застосовували НПЗП, використовували максимальну добову дозу препарату. Через 5 міс спостереження у переважної більшості хворих виявлено статистично достовірне зниження індексу болю у спокої (20,43±6,3) та при рухах (27,50±6,6), тривалості (8,04±4,3 хв) та інтенсивності (19,15±4,8) ранкової скутості, а також показників сумарних індексів Лекена (6,70±2,0) та WOMAC (157,06±31,9) (р<0,001 у всіх випадках).
Також, відзначено зменшення потреби у НПЗП на 64% (р<0,001). Вищеописані дані наочно продемонстровані в табл. 2.
| Показник | До лікування | 1 міс | 3 міс | 5 міс | p,95% довірчий інтервал | Різниця між 1 та 5 міс |
|---|---|---|---|---|---|---|
| Індекс болю в спокої | 37,86±7,6 | 31,54±7,3 | 26,15±6,8 | 20,43±6,3 | <0,001 | –17,43 |
| Індекс болю при рухах | 44,63±8,1 | 40,51±7,8 | 33,54±7,2 | 27,50±6,6 | <0,001 | –17,13 |
| Тривалість ранкової скутості, хв | 16,41±5,4 | 14,35±5,2 | 11,66±4,8 | 8,04±4,3 | <0,001 | –8,37 |
| Інтенсивність ранкової скутості | 32,48±5,9 | 29,59±5,4 | 23,76±5,1 | 19,15±4,8 | <0,001 | –13,33 |
| Сумарний індекс Лекена | 9,70±2,6 | 9,00±2,3 | 8,00±2,2 | 6,70±2,0 | <0,001 | –3,0 |
| Сумарний індекс WOMAC | 265,00±42,4 | 248,00±40,3 | 207,61±36,7 | 157,06±31,9 | <0,001 | –107,94 |
| Кількість пацієнтів без НПЗП за останні 7 днів, n (%) | 10 (7,1) | 23 (16,4) | 37 (26,4) | 67 (47,8) | <0,001 | +57 (40,7) |
| Добова доза НПЗП (% початкової дози) | 100% | 89% | 68% | 36% | <0,001 | –64% |
Аналіз кількості пацієнтів, що відзначили покращення від лікування Піаскледином 300, показав достовірне збільшення позитивної відповіді через 5 міс спостереження порівняно з 1 міс (p<0,001) за всіма шкалами, що використовували при проведенні дослідження. Дані наведені в табл. 3.
Суб’єктивне покращення стану та зменшення вираженості больового синдрому відзначено вже через 1 міс лікування у невеликої кількості пацієнтів. Об’єктива оцінка лікарем динаміки больового синдрому у пацієнтів достовірно не відрізнялася від оцінки пацієнтами свого стану. Так, через 5 міс спостереження у 37,1% (52/140) (за даними пацієнтів) та у 41,4% (58/140) (за даними лікаря) відзначали суттєве покращення самопочуття; 50,7% (71/140) (за даними пацієнтів) та 51,4% (72/140) (за даними лікаря) відзначили покращення самопочуття. Однак у 10,7% (15/140) (за даними пацієнтів) та у 7,1% (10/140) (за даними лікаря) учасників дослідження не відзначено покращення. Згідно з оцінкою пацієнтів, погіршення відзначили 1,4% (2/140) хворих. Дані наочно продемонстровані на рисунку.
| Показник | 1 міс | 3 міс | 5 міс | р |
|---|---|---|---|---|
| Індекс болю в спокої | 31 (21,9) | 99 (70,7) | 119 (85,0) | <0,001 |
| Індекс болю при рухах | 36 (25,5) | 88 (62,8) | 125 (89,3) | <0,001 |
| Тривалість ранкової скутості | 39 (27,6) | 87 (62,1) | 102 (72,8) | <0,001 |
| Інтенсивність ранкової скутості | 43 (30,5) | 90 (64,3) | 110 (78,6) | <0,001 |
| Сумарний індекс Лекена | 32 (22,7) | 78 (55,7) | 105 (75,0) | <0,001 |
| Сумарний індекс WOMAC | 28 (19,8) | 66 (47,1) | 95 (67,8) | <0,001 |
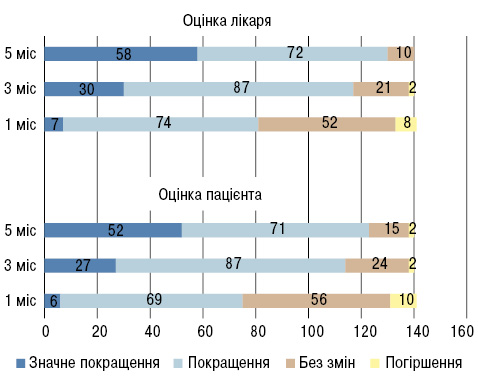 <
<Аналіз безпеки препарату продемонстрував, що за 5 міс лікування у 141 пацієнта з ОА виникли три побічні ефекти: один випадок болю в животі (на фоні застосування НПЗП), що самостійно минув, однак хвора відмовилася продовжувати участь в дослідженні після 1 міс. Також спостерігалися два випадки кропивниці — висипання світло-рожевого кольору на верхніх кінцівках, грудях, що минули на фоні прийому протиалергічних препаратів коротким курсом протягом 5–7 днів та не потребували відміни прийому Піаскледину 300.
ДИСКУСІЯ
Місце повільно діючих хворобо-модифікуючих препаратів у лікуванні пацієнтів із ОА дискутується вже протягом тривалого часу. Згідно з останніми рекомендаціями Європейської антиревматичної ліги з ведення пацієнтів з ОА, рекомендується застосовувати симптоматичну терапію, яка поділяється на нефармакологічну, фармакологічну та оперативну. Нефармакологічні засоби лікування включають загальні міри (зменшення маси тіла, модифікація способу життя, плавання), фізіотерапію (спеціальна гімнастика, навчання пацієнта, тренування м’язів, фізіотерапевтичні засоби), а також носіння устілок та амортизуючого взуття, що поєднуються із застосуванням парацетамолу чи препаратів групи SYSADOA (хондроїтин сульфат, глюкозамін сульфат, гіалуронати, діацереїн та неомилюваних з’єднань сої/авокадо).
Доказові дані клінічних досліджень продемонстрували не лише симптом-модифікуючий ефект Піаскледину 300 [2, 3, 12], але й деякий структурно-модифікуючий потенціал, що виражається у сповільненні прогресування звуження суглобової щілини [9, 10].
Хоча проведене нами дослідження не є ані рандомізованим, ані плацебо-контрольованим, воно продемонструвало достовірний симптоматичний ефект Піаскледину 300 у пацієнтів з ОА. Результати подібного дослідження з вивчення ефективності та безпеки неомилюваних з’єднань сої/авокадо у хворих на ОА вперше опубліковані у 1997 р. У 3-місячне подвійне сліпе плацебо-контрольоване рандомізоване клінічне дослідження F. Blotman та співавторів (1997), метою якого була оцінка ефективності неомилюваних з’єднань сої/авокадо на прикладі зниження дози НПЗП, було включено 164 пацієнти з коксартрозом та гонартрозом, наявністю больового синдрому протягом 3 міс до початку дослідження, з рівнем болю за ВАШ ≥25 мм, індексом Лекена ≥4. Однак пацієнтам було заборонено застосовувати анальгетики та інші препарати SYSADOA. Це дослідження продемонструвало, що кількість пацієнтів, які застосовували НПЗП між 60-м и 90-м днями терапії, була меншою, а кумулятивна доза НПЗП була достовірно нижчою у групі неомилюваних з’єднань сої/авокадо, ніж у групі плацебо (р<0,001). Також в обох групах виявлено зниження бала болю за ВАШ, однак різниця на користь препарату була статистично незначимою порівняно з плацебо [3].
Згодом, у 1998 р., опубліковано результати ще одного дослідження Е. Maheu та співавторів [11]. У це проспективне рандомізоване плацебо-контрольоване дослідження тривалістю 8 міс (6 міс — терапія, 2 міс — оцінка післядії препарату) було включено 164 хворих на ОА. Вираженість болю за ВАШ до кінця лікування в основній групі знизилася з 56,1±1,6 до 35,3±2,3 мм (р=0,003), а в групі плацебо — з 56,1±1,8 до 45,7±2,6 мм. Окрім цього, різниця індексу Лекена становила –2,1 (р<0,001) на користь препарату. Потреба застосування НПЗП у групі, в якій приймали олії сої/авокадо, була нижчою порівняно із групою плацебо — як протягом 6-місячного лікування (48% проти 63%; р=0,054), так і через 2 міс після припинення терапії (40,5 і 56,4%; р<0,05). Автори дійшли висновку, що лікування препаратами сої/авокадо показало достовірну симптоматичну ефективність, починаючи з 2-го місяця терапії, з ефектом післядії навіть після закінчення курсу терапії.
У 3-місячному багатоцентровому подвійному сліпому плацебо-контрольованому рандомізованому клінічному дослідженні, проведеному Т. Аppelboom та співавторами [2], оцінювали ефективність та безпеку застосування неомилюваних олій сої/авокадо у різних дозуваннях (300 і 600 мг/добу) у 260 пацієнтів із гонартрозом. Первинною кінцевою точкою була потреба застосування НПЗП на 30-му та 90-му дні. Результати дослідження свідчать, що ефективність препарату в дозуваннях 300 і 600 мг/добу була значно вищою, ніж плацебо, у всіх контрольних точках, а різниці в ефективності між двома дозуваннями не спостерігалося. Зниження дози НПЗП у >2 рази в групі препарату відзначали у 71% хворих, тоді як в групі плацебо — лише у 36%.
У метааналіз 4 рандомізованих клінічних досліджень неомилюваних з’єднань сої/авокадо було включено 664 пацієнти із коксартрозом (41,4%) і гонартрозом (58,6%), з яких 336 хворих отримували препарат Піаскледин по 300 мг/добу і 328 — плацебо. Середня тривалість прийому препарату становила 6 міс. Піаскледин перевершував плацебо щодо впливу на больовий синдром (середнє зменшення вираженості болю за ВАШ становило 10,7% при гонартрозі і 11,3% — при коксартрозі; р=0,04) і функціональний індекс Лекена (р=0,0003) [5].
М. Lequesne та співавтори [9] у публікації за 2002 р. описали результати дворічного рандомізованого клінічного дослідження, де проводили оцінку ефективності неомилюваних олій сої/авокадо щодо прогресування звуження суглобової щілини у пацієнтів із коксартрозом. Звуження суглобової щілини визначали в обох групах, і автори дослідження не продемонстрували структурно-модифікуючого ефекту препарату порівняно з плацебо через 2 роки. Однак у post-hoc-аналізі встановлено, що застосування неомилюваних олій сої/авокадо достовірно сповільнювало прогресування звуження суглобової щілини порівняно з плацебо у підгрупі пацієнтів із вираженим звуженням суглобової щілини, що дозволяє говорити про ймовірний структурно-модифікуючий ефект Піаскледину. У 3-річному дослідженні Е. Maheu та співавтори [10] отримали підтвердження про зниження прогресування звуження суглобової щілини у хворих на коксартроз, які застосовували Піаскледин.
ВИСНОВКИ
Таким чином, проведене дослідження продемонструвало достовірний симптом-модифікуючий ефект препарату Піаскледин. Зручне застосування препарату (1 раз на добу), специфічний механізм дії, хороша переносимість та наявність мінімальної кількості протипоказань дозволяють широко застосовувати цей препарат у практиці лікаря як хондропротектор та зумовлюють високу комплаєнтність.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
- 1. Коваленко В.М., Шуба Н.М. (ред.) (2013) Національний підручник з ревматології. МОРІОН, Київ, 672 с.
- 2. Appelboom T., Schuermans J., Verbruggen G. et al. (2001) Symptoms modifying effect of avocado/soybean unsaponifiables (ASU) in knee osteoarthritis. A double blind, prospective, placebo controlled study. Scand. J. Rheumatol., 30: 242–247.
- 3. Blotman F., Maheu E., Wulwik A. et al. (1997) Efficacy and safety of avocado/soybean unsaponifiables in the treatment of symptomatic osteoarthritis of the knee and hip. A prospective, multicenter, three-month, randomized, double-blind, placebo-controlled trial. Rev. Rhum. Engl. Ed., 64(12): 825–834.
- 4. Cameron M., Chrubasik S. (2013) Oral herbal therapies for treating osteoarthritis (Review). Cochrane Database Syst. Rev., 31(5): CD010538.
- 5. Christensen R., Bartels E.M., Astrup A. (2008) Symptomatic efficacy of avocado-soybean unsaponifiables (ASU) in osteoarthritis (OA) patients: a meta-analysis of randomized controlled trials. Osteoarthritis Cartilage, 16(4): 399–408.
- 6. Health Status Measurement Systems for Ostheoarthritis. URL: http://www.womac.org/womac/index.htm
- 7. Lane N.E., Brandt K., Hawker G. et al. (2011) OARSI-FDA initiative: defining the disease state of osteoarthritis. Osteoarthritis Cartilage, 19: 478–482.
- 8. Lequesne M. (1991) Indices of severity and disease activity for osteoarthritis. Semin. Arthritis Rheum., 20(Suppl. 2): 48–54.
- 9. Lequesne M., Maheu E., Cadet C. et al. (2002) Structural effect of avocado/soybean unsaponifiables on joint space loss in osteoarthritis of the hip. Arthritis Rheum. 47: 50–58.
- 10. Maheu E., Cadet C., Marty M. et al. (2014) Randomised, controlled trial of avocado–soybean unsaponifiable (Piascledine) effect on structure modification in hip osteoarthritis: the ERADIAS study. Ann. Rheum. Dis., 73(2): 376–384.
- 11. Maheu E., Mazières B., Valat J.P. et al. (1998) Symptomatic efficacy of avocado/soybean unsaponifiables in the treatment of osteoarthritis of the knee and hip: a prospective, randomized, double-blind, placebo-controlled, multicenter clinical trial with a six-month treatment period and a two-month followup demonstrating a persistent effect. Arthritis Rheum., 41(1): 81–91.
- 12. McAlindon T.E., Bannuru R.R., Sullivan M.C. et al. (2014) OARSI guidelines for the non-surgical management of knee osteoarthritis. Osteoarthritis Cartilage, 22: 363–388.
- 13. Pavelka K., Coste P., Géher P. (2010) Efficacy and safety of piascledine 300 versus chondroitin sulfate in a 6 months treatment plus 2 months observation in patients with osteoarthritis of the knee. Clin. Rheumatol., 29(6): 659–670.
ЭФФЕКТИВНОСТЬ ПРЕПАРАТА ПИАСКЛЕДИН 300 У БОЛЬНЫХ ПЕРВИЧНЫМ ОСТЕОАРТРОЗОМ коленных И тазобедренных СУСТАВОВ
Резюме. В описанном проспективном исследовании проведена оценка эффективности и переносимости препарата Пиаскледин 300 у пациентов с первичным остеоартрозом коленных и тазобедренных суставов I–III рентгенологической стадии, имевших клинически значимые проявления заболевания. К показателям, по которым оценивали эффективность, относились интенсивность боли в покое и при движениях, длительность и интенсивность утренней скованности, индекс Лекена, индекс WOMAC, суточная потребность в нестероидных противовоспалительных препаратах и индивидуальная оценка эффективности лечения. Также проанализированы побочные эффекты препарата. По результатам полученных данных, у большинства пациентов выявлено достоверное снижение индекса боли в покое и при движениях, продолжительности и интенсивности утренней скованности, а также показателей суммарных индексов Лекена и WOMAC. Итак, Пиаскледин 300 — эффективный и безопасный препарат, оказывающий симптом-модифицирующий эффект, имеющий хорошую переносимость, минимальное количество противопоказаний, что является залогом положительного комплаенса.
остеоартроз, коксартроз, гонартроз, болевой синдром, WOMAC, Пиаскледин 300.
Адреса для листування:
Борткевич Олег Петрович
03680, Київ, вул. Народного ополчення, 5
ДУ «Національний науковий центр
«Інститут кардіології ім. М.Д. Стражеска»
НАМН України»
*Висловлюється вдячність за активну участь у дослідженні групі українських фахівців під керівництвом О.П. Борткевича, проф., докт. мед. наук, ДУ «ННЦ «Інститут кардіології ім. М.Д. Стражеска» НАМН України», Київ, у складі: Є.Ф. Колпакова, А.О. Жерновенков, Клінічна лікарня на залізничному транспорті № 2, Харків; Н.В. Єрахторіна, Обласна клінічна лікарня, Харків; Р.Є. Бендецька, П.Є. Слобода, Т.А. Стажевська, Клінічна лікарня № 6, Дніпро; Т.Г. Малосилко, Поліклініка Лікарні на залізничному транспорті Клінічного центру охорони здоров’я УКРЗАЛІЗНИЦЯ, Дніпро; Т.С. Чорна, Клінічна лікарня № 11, Дніпро; Д.Г. Рекалов, докт. мед. наук, Клінічна обласна лікарня, Запоріжжя; М.Ю. Синенька, О.В. Синенький, канд. мед. наук, Обласна клінічна лікарня, Львів; М.А. Станіславчук, проф., докт. мед. наук, В.О. Романова, аспірант, Клінічна обласна лікарня, Вінниця; Р.І. Яцишин, проф., докт. мед. наук, Обласна клінічна лікарня, Івано-Франківськ; Н.М. Шуба, проф., докт. мед. наук, Міська клінічна лікарня № 6, Київ; О.І. Івашковський, Олександрівська клінічна лікарня, Київ. **В Україні зареєстровано під торговою назвою Піаскледин 300.

Leave a comment