ПЕРЕВАГИ АЛЬФАКАЛЬЦИДОЛУ ПЕРЕД ВІТАМІНОМ D ПРИ ЛІКУВАННІ ОСТЕОПОРОЗУ
Shiraishi A., Higashi S., Ohkawa H., Kubodera N., Hirasawa T., Ezawa I., Ikeda K., Ogata E.
Резюме. Незважаючи на те що альфакальцидол широко використовується в лікуванні остеопоро-зу, механізм його дії на кісткову тканину не зовсім зрозумілий. Альфакальцидол стимулює абсорбцію кальцію (Са) у кишечнику, збільшує його екскрецію із сечею та вміст у плазмі крові, пригнічує секрецію паратиреодного гормону(П^). Необхідно з'ясувати (особливо для ситуацій з надлишком вітамінуD), чи буде альфакальцидол виявляти протекторний вплив на кістки за допомогою лише кальцієвих механізмів, чи є супресія ПTГ необхідною умовою для прояву кісткових ефектів альфакальцидолу й чи буде альфакальцидол мати переваги перед вітаміном D при лікуванні остеопорозу. Щоб відповісти на ці питання, ми: 1) порівняли вплив альфакальцидолу (перораль-но 0,025-0,1 мкг/кг маси тіла) і вітаміну D3 (50400 мкг/кг маси тіла) на остеопороз у В місячних пацюків, які перенесли оваріектомію (OBE), залежно від кальцієвих ефектів обох препаратів; 2) оцінили, чи будуть кісткові ефекти альфакаль-цидолурозвиватися незалежно від супресії^Г, для чого використовували пацюків, які перенесли паратиреоїдектомію (^Е) і яким безперервно вводили людський (1-34). Oтpимaні результати свідчать про те, що: 1) в OBE-пацюків альфакальцидол підвищує мінеральну щільність кісткової тканини (MЩKT) і міцність кісток більш ефективно, ніж вітамін D3, при заданому рівні кальцію в сечі/плазмі крові: для досягнення такого ж приросту MЩKT потрібні високі дози вітаміну D3, що загрожує гіперкальціємією і порушенням якості кістки; 2) у дозах, які підтримують вміст Са в плазмі крові 3; 3) альфакальцидол здатний збільшувати кісткову масу в ПTЕ-пaцюків, які одержують безперервну ін-фузію П^, і, отже, діє незалежно від рівня П^. Oтpимaні дані свідчать про те, що альфакальци-дол робить протекторний вплив на кістки незалежно від його кальцієвих ефектів і щодо цього перевершує вітамін D3; кісткові ефекти альфа-кальцидолу реалізуються, принаймні частково, незалежно від супресії П^. Taким чином, отримані результати обґрунтовують клінічну придатність альфакальцидолу і його перевагу перед вітаміном D3 при лікуванні остеопорозу.
1а,25-дигидроксивитамин D3 (1а,25(ОН)2D3, или кальцитриол), активная и гормональная форма витамина D и его предшественник 1а,25-гидроксивитамин D3 (1а,25(ОН)йD или альфакальцидол) широко используются для лечения различных метаболических болезней костей, включая почечную остеодистрофию, рахит/остеомаляцию и остеопороз [1]. Несмотря на то что был достигнут значительный прогресс в понимании молекулярных механизмов генной регуляции, осуществляемой активными формами витамина D [2], механизмы действия на тканевом уровне, особенно в костях, продолжают оставаться невыясненными.
1а,25(ОН)2D3 играет главную роль в поддержании кальциевого (Са) и костного гемостаза путем связывания с ядерным рецептором витамина D (VDR) в классических органах-мишенях, включая кишечник, кости, почки и паращитовидные железы [1]. Было выяснено, что 1а,25(ОН)2D3 стимулирует абсорбцию Са в кишечнике, резорбцию, равно как и образование, костей, реабсорбцию Са в дистальных почечных канальцах, подавляет генную транскрипцию паратиреоидного гормона (ПТГ) и кальцитонина в паращитовидных железах и щитовидной железе соответственно [1].
Хорошо известно, что 1a,25(OH)2D3 проявляет анаболическое действие в отношении костной ткани у животных с дефицитом витамина D [3, 4]. При этом 1a,25(OH)2D3 делает следующее: 1) увеличивает абсорбцию Са в кишечнике, повышая его уровень в плазме крови и экскрецию с мочой; 2) снижает содержание ПТГ в плазме крови путем прямого ингиби-рования секреции/синтеза ПТГ за счет связывания с VDR паращитовидных желез, а также путем непрямого ингибирования секреции ПТГ за счет повышения концентрации Са в плазме крови; 3) уменьшает резорбцию костей вследствие снижения содержания ПТГ и 4) увеличивает образование костной ткани путем влияния на Са и фосфатный гомеостаз [5].
Напротив, влияние активного метаболита витамина D на кости в условиях избытка витамина D остается неясным. Если говорить более конкретно, то нужно выяснить, будут ли наблюдаемые костные эффекты только лишь следствием повышения содержания Са в плазме крови и моче (отражение стимулированной абсорбции Са), и если так, то является ли снижение содержания эндогенного ПТГ необходимым условием для анаболического действия активного метаболита витамина D в костях. Ответ на эти вопросы поможет обосновать использование активного метаболита витамина D, такого как аль-факальцидол, для лечения остеопороза, и верифицировать его преимущество перед более дешевым витамином D, который также может нормализовы-вать баланс Са. Настоящее исследование проведено для того, чтобы: 1) сравнить предупреждающее влияние альфакальцидола, применяемого пер-орально, и витамина D3, применяемого перорально, на развитие остеопороза и ломкость костей у перенесших овариэктомию (ОВЭ) крыс среднего возраста в зависимости от кальциевых эффектов обоих препаратов; 2) выяснить, является ли супрессия ПТГ необходимой для проявления костных эффектов препаратов, для чего использовали перенесших паратиреоидэктомию (ПТЭ) крыс, которым непрерывно вводили ПТГ.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Лекарственные средства
Человеческий ПТГ (1-34) [чПТГ(1-34)] был выделен в «Peptide institute inc.» (Осака, Япония). 1a(OH)D3 (альфакальцидол) был синтезирован в «Chugai Pharmaceuticai Co. Ltd», витамин D3 (хо-лекальциферол) был выделен в «WAKO Chemicai industries Ltd.» (Осака, Япония). Оба вещества растворили в среднецепочечном триглицериде (СЦТ).
Дизайн эксперимента
Исследования на крысах, перенесших ОВЭ. Крысы-самки линии Wistar-imamichi в возрасте 8 мес были приобретены в imamuchi institute For Animai Reproduction (Ибараки, Япония) и акклиматизированы к стандартным лабораторным условиям при температуре 23±2 °С и влажности 40-70%. Крыс содержали в простерилизованных клетках, кормили стандартной пищей для грызунов, содержащей 1,25% Са и 1,06% фосфатов (СЕ-2, Clea Japan Inc.), и не ограничивали в доступе к водопроводной воде. 90 крыс были разделены на 9 групп. В 1-ю группу включали неоперированных крыс. Всем остальным крысам выполнили билатеральную ОВЭ и разделили на восемь групп: 2-я группа — контрольная группа крыс с ОВЭ, 3-5-я группы — крысы, получающие лечение альфакальцидо-лом, 6-9-я группы — крысы, получающие лечение витамином D3. Животным 1-й и 2-й групп давали СЦТ (плацебо) перорально в дозе 1 мл/кг массы тела (МТ). В 3-5-й группах получали альфакальцидол перорально в дозах 0,025; 0,05 и 0,1 мкг/кг МТ соответственно 5 раз в неделю. В 6-9-й группах получали витамин D3 перорально в дозах 50; 100; 200 и 400 мкг/кг МТ соответственно 5 раз в неделю. Длительность эксперимента составила 12 нед.
Исследования на крысах, перенесших ПТЭ. Крысы-самцы линии Spraque-Dawley в возрасте 7 нед были приобретены в «Clea Japan Inc.» (Токио, Япония) и содержались так, как описано выше. 36 крыс были случайно разделены на 5 групп. В 1-ю группу включали неоперированных крыс, во 2-5-ю группы — крыс, которым выполнили ПТЭ (операции выполняли в 0-й день). ПТЭ считали успешной, если по состоянию на 1-й день уровень ионизированного кальция (Са+) в крови был 2+ в крови; животных умерщвляли на 14-й день эксперимента.
Исследования на животных были выполнены в соответствии с руководством по этике работы с животными Chugai Pharmaceutical. Протоколы эксперимента были одобрены Комитетом по биоэтике.
Биохимический анализ
После последнего приема пищи животные голодали в течение 24 ч. В этот период собирали мочу. Кровь забирали из абдоминальной аорты в условиях эфирного наркоза. Образцы крови и мочи центрифугировали, для того чтобы получить суперна-тант плазмы крови или мочи, которые сохраняли при температуре -20 °С до момента проведения замеров. Содержание Са и фосфатов в плазме крови и моче определяли с помощью аутоанали-затора («Hitachi 71700», Токио, Япония). Содержание Са в крови определяли электродным методом с помощью аутоанализатора («Cairon Co. Ltd.», Токио, Япония). Содержание в моче дезок-сипиридинолина измеряли с помощью наборов PYRILINKS-D (Metra Biosystems Inc., США).
Исследование костей
Для исследования костей взяты поясничные позвонки, бедро и большеберцовая кость. Позвонок LV был отделен и сохранялся при температуре -20°С для измерения механической прочности. Другие позвонки (L,|-L|V) сохранялись в 70% этаноле при температуре 4 °С для определения минеральной плотности костной ткани (МПКТ). Левое бедро сохраняли при -20 °С, правое бедро фиксировали в 70% этаноле при 4 °С для измерения механической прочности и МПКТ соответственно.
Измерение МПКТ(мг/см) поясничных позвонков и правого бедра осуществляли с помощью двухэнергетической рентгеновской абсорбцио-метрии (ДРА) («DCS-600 Aloka», Япония). Во время проведения анализа бедро поделили на 10 равных областей вдоль его основной оси, и средние значения МПКТ для трех наиболее проксимальныхобластей (1-3-я), следующих четырех сканируемых областей (4-7-я) и трех наиболее дистальных сканируемых областей (8-10-я) отражали плотность проксимальной, средней и дистальной частей бедра соответственно.
Гистология костей. Были приготовлены срезы, окрашенные гематоксилином и эозином, для ги-стопатологического исследования проксимальных отделов большеберцовых костей. С этой целью после некропсии большеберцовые кости фиксировали в 10% нейтральном забуференном формалине, декальцифицировали в 10% этилендиаминтетра-уксусной кислоте и заливали парафином. Парафиновые срезы (3 мкм) окрашивали с помощью гематоксилина и эозина для исследования под световым микроскопом.
Тесты на прочность. Левое бедро использовали для измерения механической прочности с помощью теста на трехточечный изгиб. Изгибающую силу прикладывали со скоростью 6 мм/мин до тех пор, пока не происходил перелом. Для измерения механической прочности тела позвонка LV использовали компрессионный тест. После удаления краниального и каудального концов от каждого тела позвонка получен центральный цилиндр с плоскопараллельными концами высотой примерно 5 мм. Для проведения замеров цилиндры помещали в прибор для нагрузочного теста (TK-252C «MUROMACHI KIKAI Co. Ltd.», Япония). Для того чтобы приложить компрессионную силу к образцу, использовали стальной диск, перемещавшийся с деформационной скоростью 10 мм/мин. Предел прочности на разрыв (максимальная нагрузка: N) получали прямо из кривой «нагрузка — деформация» [6].
Статистический анализ
Результаты выражали в виде средних значений ± стандартная ошибка. Статистический анализ выполняли с помощью программы SAS (Statistic Analysis System). Достоверность различий определяли с помощью ANOVA и множественных сравнений Даннетта (рис. 6 и 7 — см. далее) или t-критерия Стьюдента (рис. 3 и 5 — см. далее). Различия считали статистически значимыми при p<0,05
РЕЗУЛЬТАТЫ
Протекторное влияние альфакальцидола и витамина й3 на кости как функция концентрации Са в плазме крови
У 8-месячных ОВЭ-крыс изучили влияние альфакальцидола и витамина D3 на остеопороз, вызванный дефицитом эстрогенов. Повышающиеся дозы альфакальцидола и витамина й3 назначали 5 раз в неделю в течение 3 мес, начиная со 2-й недели после ОВЭ. В результате оказалось, что и альфакальцидол, и витамин D3 повышали МПКТ в до-зозависимой манере, что согласовывалось с небольшим (в пределах нормального диапазона) увеличением содержания Са в плазме крови. Для того чтобы более детально оценить взаимосвязь между способностью обоих препаратов повышать содержание кальция и оказывать протекторное влияние на кости, значения МПКТ были отмечены на оси координат против соответствующих им значений концентрации Са (рис. 1). Видно, что в исходных условиях МПКТ средней части бедра значительно снижалась у ОВЭ-крыс по сравнению с не-оперированными животными. После применения животным повышающихся доз альфакальцидола и витамина D3 была выявлена положительная корреляция между ростом МПКТ и повышением концентрации Са. Однако необходимо отметить, что кривая альфакальцидола поднимается более круто, чем кривая витамина D3, и проходит через значения для неоперированных животных. Аналогичные данные получены и для МПКТ в проксимальных и дистальных участках бедра (данные не представлены). Таким образом, полученные данные свидетельствуют о том, что при фиксированной концентрации Са в плазме крови альфакальцидол более эффективно увеличивает MПКT по сравнению с витамином D3, и что более высокие дозы витамина D3 требуются для того, чтобы достичь такого же уровня MПКT.
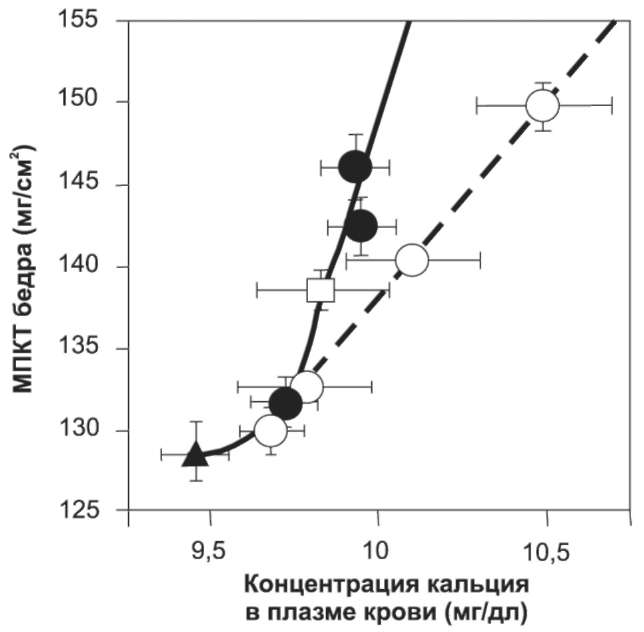
Рис. 1. Взаимосвязь между влиянием альфакальцидола и витамина D3 на МПКТ и концентрацию Са в плазме крови у перенесших ОВЭ крыс. У ОВЭ-крыс (возраст 8 мес) перорально применяли альфакальцидол (0,025; 0,05; 0,1 мкг/кг МТ (•)) или витамин D3 (50; 100; 200; 400 мкг/кг МТ (О)) 5 раз в неделю в течение 3 мес., после чего измеряли МПКТ в среднем участке бедра и концентрацию Са в плазме крови. Неоперированные крысы обозначены □, ОВЭ-крысы до лечения обозначены ▲. На рис. 1-5: значения представлены в виде средних ± стандартное отклонение (n=10)
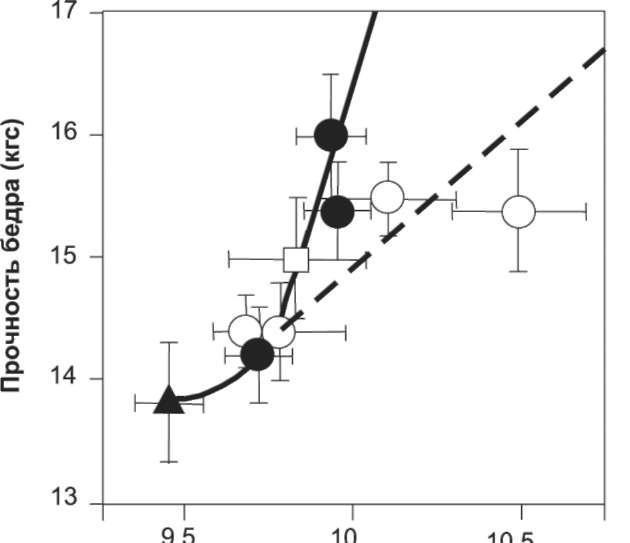
Было изучено также влияние обоих препаратов на прочность костей (рис. 2). И хотя прочность костей увеличивалась по мере роста концентрации Са на фоне приема обоих препаратов, кривая для альфакальцидола была более крутой, чем для витамина D3. Необходимо отметить, что влияние витамина D3 на прочность достигало плато при дозе 200 мкг/кг MT, и что доза 400 мкг/кг не приводила к соответствующему повышению плотности костей. Такие же результаты были получены и в том случае, когда значения MПКT и прочности костей были отмечены против экскреции Са с мочой (данные не представлены). Следовательно, полученные данные свидетельствуют о том, что при одном и том же уровне кальция в плазме крови/моче аль-факальцидол более эффективен, чем витамин D3, в отношении увеличения костной массы и прочности костей, сниженных при дефиците эстрогенов.
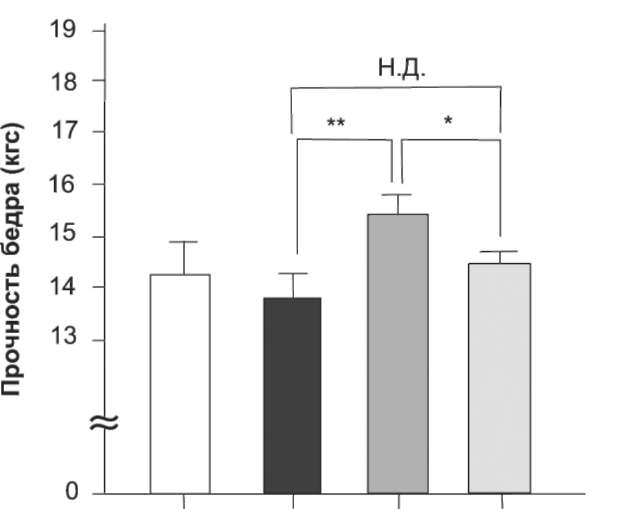
Для того чтобы еще лучше прояснить полученные данные, костные эффекты альфакальцидола и витамина D3 оценили при заданной концентрации Са в плазме крови 3 не делает этого. Таким образом, альфакальцидол оказывает протекторное влияние на кости в дозах, которые не вызывают гиперкальциемии. В то же время могут потребоваться более высокие дозы витамина D3, чтобы вызвать такие же увеличивающие массу эффекты в костях; при этом будут наблюдаться гиперкальциемия и нарушение прочности костей.
Концентрация кальция в плазме крови (мг/дл)
Рис. 2. Взаимосвязь между влиянием альфакальцидола и витамина на прочность бедренной кости и концентрацию Са в плазме крови у ОВЭ-крыс. У В-месячных ОВЭ-крыс перораль-но применяли альфакальцидол (•) или витамин D3 (О) в течение З мес. так же, как это описано для рис. 1, после чего измеряли прочность бедренной кости и концентрацию Са в плазме крови. Неоперированные крысы обозначены □, ОВЭ-крысы до лечения обозначены ▲
Альфакальцидол ингибируетрезорбцию костей более эффективно, чем витамин D3. Чтобы заглянуть в механизмы, с помощью которых альфакальцидол проявляет протекторное действие в костях, оценили экскрецию с мочой дезоксипиридиноли-на (маркер костной резорбции) как показатель содержания Са в плазме крови. Как следует из рис. 4, и альфакальцидол, и витамин й3 дозозависимо снижали содержание дезоксипиридинолина в моче, однако кривая для альфакальцидола была более крутой, чем для витамина D3. Когда данные проанализировали для животных с содержанием Са в плазме крови 3 в дозах, поддерживающих концентрацию Са
Протекторное влияние альфакальцидола на кости без супрессии ПТГ
Для того чтобы определить, является ли супрессия эндогенного ПТГ необходимым условием для костных эффектов альфакальцидола, изучили влияние этого препарата на кости и кальциевый метаболизм у перенесших ПТЭ крыс, у которых относительная нормокальциемия поддерживалась путем непрерывной инфузии чПТГ(1-34) с помощью осмотических мини-насосов. Этим животным с фиксированным уровнем ПТГ назначали пер-орально альфакальцидол в повышающихся дозах 9 раз в течение 14-дневного экспериментального периода. После этого животных умерщвляли, а кости забирали на анализ. Как следует из рис. 6, после успешной ПТЭ наблюдались гипокальци-емия («5 мг/дл) и гиперфосфатемия («12 мг/ дл); непрерывная инфузия чПТГ(1-34) приводила к повышению содержания Са в плазме крови до 8 мг/дл вместе со снижением содержания фосфатов в плазме крови до 9 мг/дл. Применение аль-факальцидола не приводило к достоверным изменениям содержания Са в плазме крови.
Неопериро- ОВЭ Альфа- Витамин D; ванные кальцидол
Рис. 3. Альфакальцидол повышает прочность бедренной кости более эффективно, чем витамин D3, при заданном содержании Са в плазме крови. Альфакальцидол (0,025; 0,05; 0,1 мкг/кг МТ) или витамин D3 (50; 100; 200; 400 мкг/кг МТ) вводили ОВЭ-крысам тем же способом, что и на рис. 1. Влияние альфакальцидола и витамина D3 на прочность бедренной кости сравнили у крыс с содержанием Са
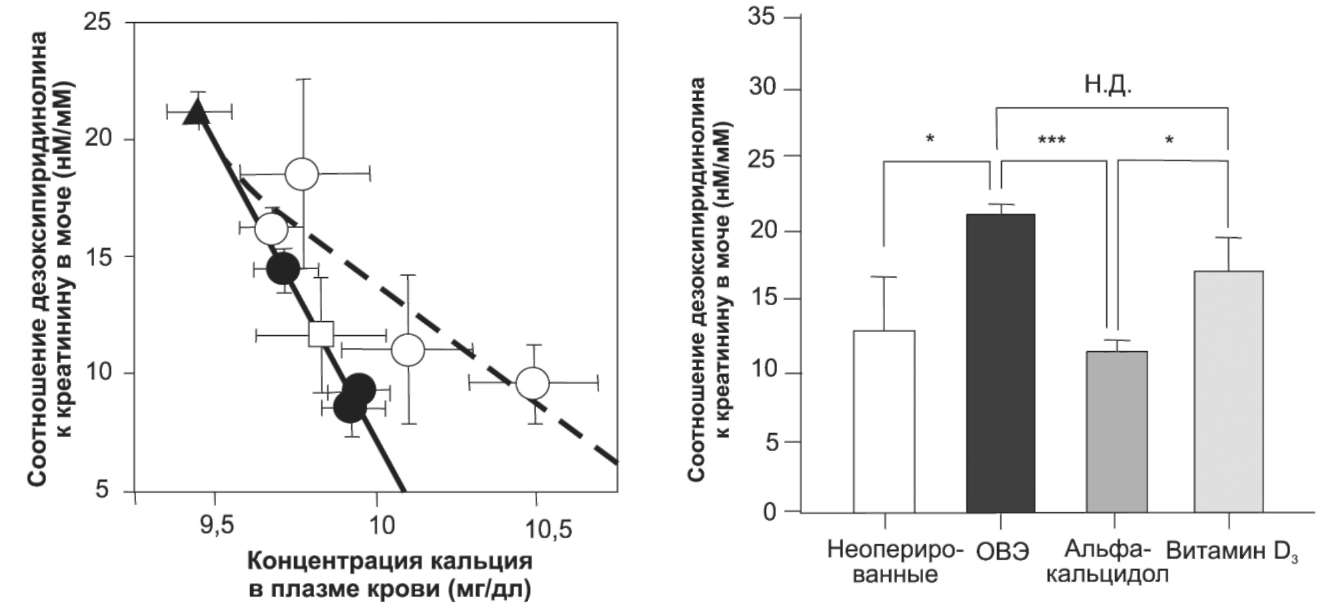
Рис. 4. Взаимосвязь между влиянием альфакальцидола и витамина D3 на экскрецию дезоксипиридинолина с мочой и концентрацию Са в плазме крови у ОВЭ-крыс. У ОВЭ-крыс назначали альфакаль-цидол (•) или витамин D3 (О) так же, как это описано для рис. 1, после чего измеряли экскрецию дезоксипиридинолина с мочой и концентрацию Са в плазме крови. Неоперированные крысы обозначены □, ОВЭ-крысы до лечения обозначены ▲
Рис. 5. Альфакальцидол снижает экскрецию дезоксипиридинолина с мочой более эффективно, чем витамин D3. Альфакальцидол (0,025; 0,05; 0,1 мкг/кг МТ) или витамин D3 (50; 100; 200; 400 мкг/кг МТ) вводили ОВЭ-крысам тем же способом, что и на рис. 1. Влияние аль-факальцидола и витамина D3 на экскрецию дезоксипиридинолина с мочой сравнили у крыс с содержанием Са
Влияние альфакальцидола на MПКT у ПТЭ-крыс, которым вводили чПТГ(1-34), представлено на рис. 7. Во время 2-недельного периода альфакальцидол дозозависимо повышал MПКT. Анаболический эффект альфакальцидола был также подтвержден гистологическим анализом прокси
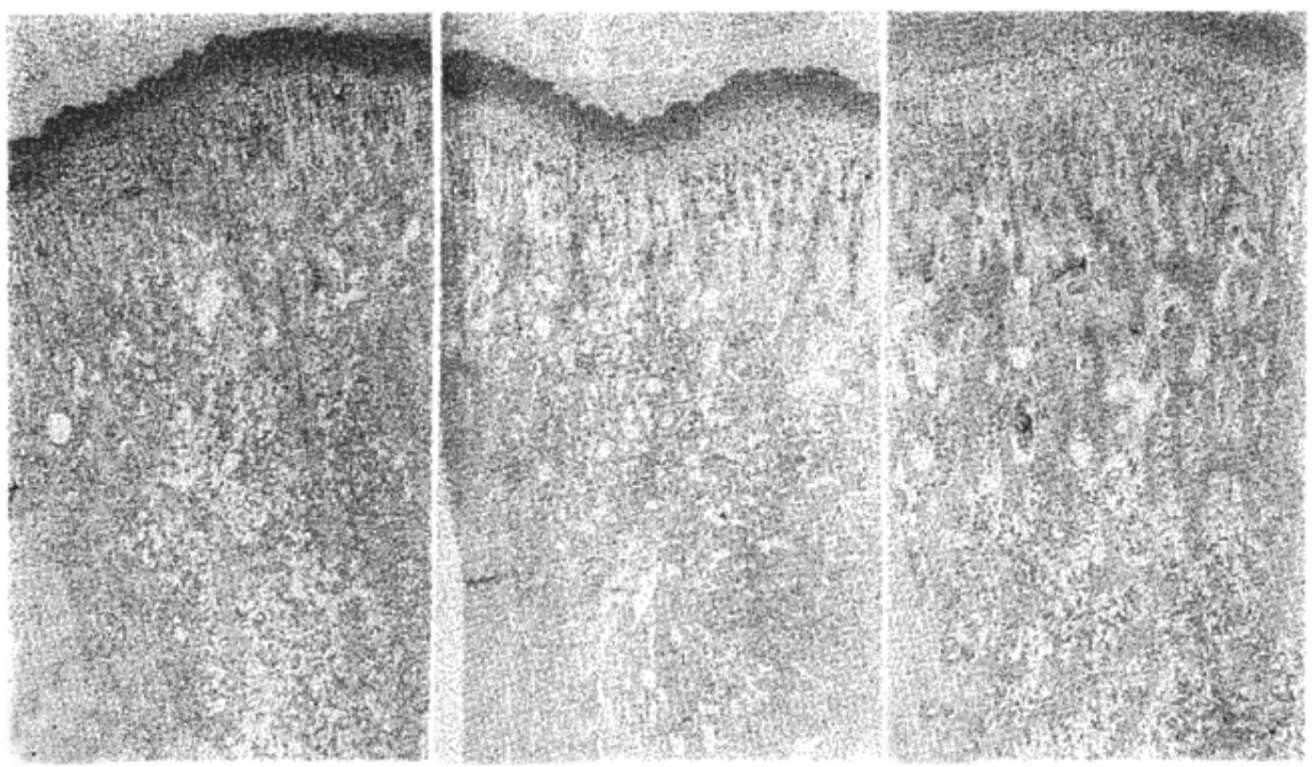
мальных отделов большеберцовой кости (рис. 8). Применение альфакальцидола у ПТЭ-крыс, которым вводили ПТГ, приводило к увеличению объема трабекулярной кости. Поверхность кости у животных, получавших альфакальцидол, была выстлана большими кубовидными клетками, напоминающими активные остеобласты (данные не представлены). Таким образом, полученные результаты свидетельствуют о том. что протекторное влияние альфакальцидола на кости не зависит от уровня ПТГ. Это согласуется с нашей концепцией о том. что влияние альфакальцидола на кости. по крайней мере отчасти. осуществляется независимо от его влияния на абсорбцию Са и результирующей супрессии секреции ПТГ.
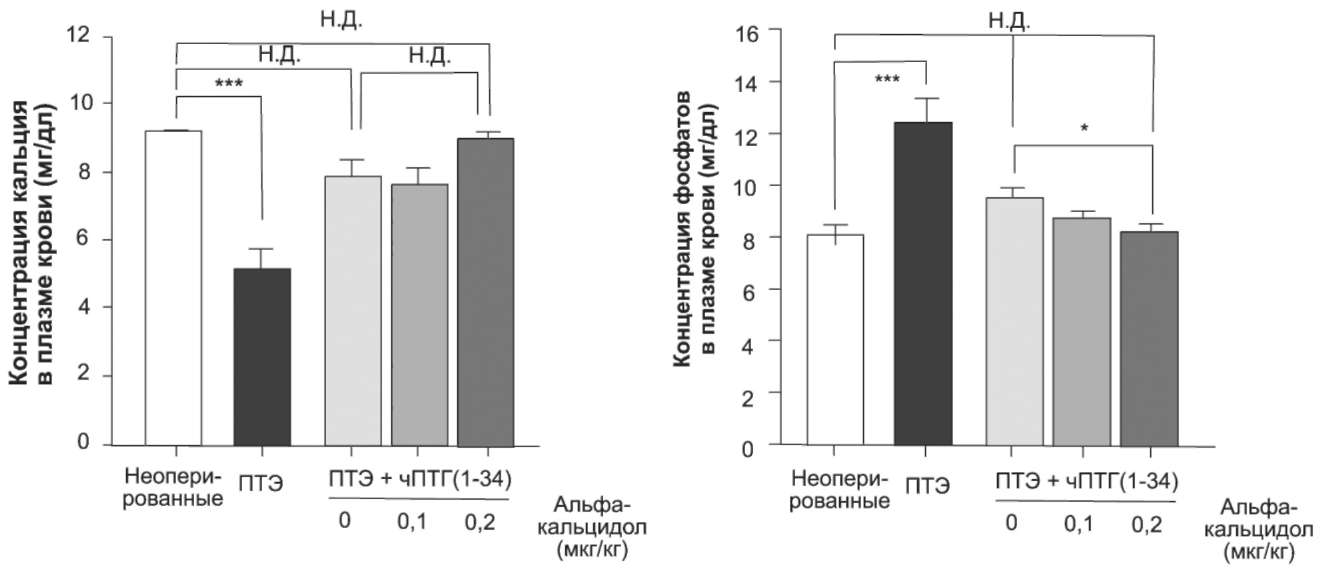
Рис. 6. Влияние альфакальцидола на содержание Са и фосфатов в плазме крови у перенесших ПТЭ крыс, которым вводили ПТГ. ПТЭ-крысам (возраст 7 нед) непрерывно подкожно вводили чПТГ(1-34) со скоростью 2,4 мкг/сут. Альфакальцидол (0,1; 0,2 мкг/кг МТ) давали перорально 9 раз в течение 14-дневного периода, после чего измеряли содержание Са и фосфатов в плазме крови. Значения представлены в виде средних ± стандартное отклонение (n=5 для неоперированных крыс, n=7 – для ПТЭ-крыс, n=8 – для других групп). Н.Д. – различия недостоверны
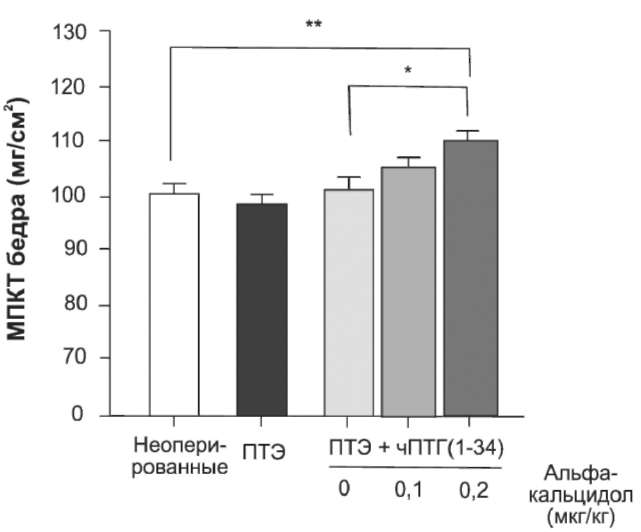
Рис. 7. Влияние альфакальцидола на МПКТ бедра у ПТЭ-крыс, которым вводили ПТГ. ПТЭ-крысам (возраст 7 нед), которым непрерывно вводили чПТГ(1-34), был назначен альфакальцидол так же, как и на рис. 6. После умерщвления животных измеряли МПКТ бедра. Значения представлены в виде средних ± стандартное отклонение (п=5 для неопери-рованных крыс, п=7 — для ПТЭ-крыс, п=8 — для других групп). *р
ОБСУЖДЕНИЕ
Остеопороз является системным заболеванием костей, которое характеризуется снижением костной массы и повышением риска переломов костей [7]. Для лечения при постменопаузальном остеопорозе, развивающемся вследствие дефицита эстрогенов, широко применяют гормонозаме-стительную терапию [8]. Однако при этом развивается ряд неблагоприятных побочных эффектов, таких как вагинальные кровотечения и риск развития гормональнозависимого рака.
Препараты витамина D в целом хорошо переносятся, накоплено достаточно данных в пользу их применения при лечении остеопороза [9]. Дефицит витамина D и низкое потребление Са в пожилом возрасте приводят к повышению уровня ПТГ, что также вносит вклад в высокую распространенность остеопороза. Показано, что прием витамина D и Са снижает выраженность остеопороза и частоту невертебральных переломов [10. 11]. У лиц пожилого возраста зафиксировано нарушение образования 1а,25(ОН)2D3 в почках [12, 13] и снижение чувствительности кишечника к 1а,25(ОН)2D3 [14], что также нарушает абсорбцию Са и приводит к от-
а б в
Рис. 8. Альфакальцидол увеличивает объем трабекулярной кости у ПТЭ-крыс. ПТЭ-крысам (возраст 7 нед), которым непрерывно вводили чПТГ(1-34), был назначен альфакальцидол (0,2 мкг/кг МТ) так же, как и на рис. 6. Представлены микрофотографии гистологических срезов проксимальных отделов большеберцовых костей неоперированных крыс (а),
ПТЭ-крыс, которым вводили чПТГ(1-З4) (б)
и ПТЭ-крыс, которым вводили чПТГ(1-34) и назначали альфакальцидол (в) (х 100). Срезы были окрашены гематоксилином и эозином
рицательному балансу Са. Во всех этих случаях 1a,25(OН)2D3 предпочтительно применять в дозах, превышающих фармакологические дозы витамина D, что может привести к интоксикации витамином D вследствие его длительной задержки в мягких тканях [9]. В одних рандомизированных проспективных клинических исследованиях, изучавших MПКT при постменопаузальном остеопо-розе, было показано, что 1a,25(OН)2D3 эффективно снижает выраженность остеопороза [15, 16], в то время как в других подобные эффекты получены не были [17], возможно, вследствие применения препарата в более низких дозах. В 3-летнем проспективном многоцентровом одиночном слепом исследовании, включавшем 622 женщины с компрессионными переломами позвонков, показано, что лечение 1a,25(OН)2D3 приводит к снижению частоты новых вертебральных переломов [18]. В клиническом исследовании из Японии также установлено, что альфакальцидол – предшественник D-гормона, который в организме превращается в кальцитриол (D-гормон), повышает плотность костей и уменьшает частоту переломов позвонков [19].
В дополнение к стимуляции абсорбции Са в кишечнике 1a,25(OН)2D3 усиливает реабсорбцию Са в почках, работая в содружестве с ПТГ. Общепризнано, что эти механизмы поддержания позитивного баланса Са лежат в основе протекторного действия 1a,25(OН)2D3 на кости. В самом деле, наши данные свидетельствуют о том, что и альфакальцидол, и витамин D3 увеличивают MПКT и прочность костей, одновременно повышая содержание Са в плазме крови и моче. Это предполагает, что костные эффекты этих препаратов зависят от их кальциевых эффектов. Важным, однако, является тот факт, что наши данные, соотнесенные с кальциевыми эффектами, свидетельствуют о том, что альфакальцидол увеличивает костную массу и улучшает качество костей более эффективно, чем витамин D3, при заданном уровне Са. Это указывает на то, что протекторное влияние альфакальцидола на кости, по крайней мере отчасти, реализуется независимо от его влияния на нормализацию Са-баланса. Несмотря на то что механизмы, с помощью которых активная форма витамина D оказывает положительное влияние на кости, остаются неизвестными, наши результаты указывают на то, что альфакальцидол подавляет резорбцию костей после повышения костного ре-моделирования вследствие дефицита эстрогенов.
Хорошо известно, что высокие дозы 1a,25(OН)2D3 приводят к стимуляции остеокласт-ной резорбции костей вследствие индукции образования остеокластогенезподдерживающих молекул в стромальных клетках костного мозга, недавно идентифицированных как RANKL/TRANCE [20, 21]. Этот феномен, наблюдаемый in vitro, противоречит нашим данным и данным других исследователей [22-25] in vivo, поскольку показано, что в дозах, не приводящих к развитию гиперкальциемии, активный метаболит витамина D3 повышает костную массу, по крайней мере отчасти, за счет подавления костной резорбции. Исходя из данных о том, что костные протекторные эффекты альфа-кальцидола наблюдаются при постоянных уровнях ПТГ (см. рис. 7), разумно допустить, что активный метаболит витамина D3 ингибирует костную резорбцию независимо от супрессии ПТГ. Необходимо проводить дальнейшие исследования, чтобы уточнить механизмы, с помощью которых активный метаболит витамина D3 тормозит резорбцию костей, особенно при состояниях со значительной костной резорбцией, таких как дефицит эстрогенов (настоящее исследование) или поражение костей, индуцированное раком [26].
Несмотря на многообещающие эффекты альфа-кальцидола, выявленные в опытах на животных, и терапевтическую эффективность, подтвержденную во многих, хотя и не во всех клинических исследованиях, 1a,25(OH)2D3 не одобрен для лечения остео-пороза в США. По-видимому, это связано в значительной степени с умеренной эффективностью препаратов активных метаболитов витамина D и риском развития гиперкальциурии/гиперкальциемии, что и является причиной их довольно ограниченного терапевтического применения. В связи с этим необходимо проводить дальнейшие исследования влияний на кости и механизмов действия других аналогов активного метаболита витамина D, таких как ОСТ [26], который обладает меньшей кальцемической активностью и, следовательно, может вводиться в высоких дозах без риска развития побочных эффектов, и ED-71 [25], оказывающий, по-видимому, более выраженный анаболический эффект на кости. Эти препараты являются многообещающими для применения по всему миру в качестве недорогих средств лечения метаболических заболеваний костей.
Список литературы находится в редакции
ПРОФИЛАКТИКА И ЛЕЧЕНИЕ КОРТИКОСТЕРОИД-ИНДУЦИРОВАННОГО ОСТЕОПОРОЗА АКТИВНЫМИ АНАЛОГАМИ ВИТАМИНА D3 (АЛЬФАКАЛЬЦИДОЛОМ – АЛЬФА Д3-ТЕВА)
Целью данного обзора и метаанализа было обосновать применение активных форм витамина й3 (например альфакальцидола—Альфа Д3-Тева) в лечении и профилактике кортикостероид (КС)-индуцированного остеопороза (ОП) и сравнить их по эффективности с другими методами терапии ОП. Поиск исследований проводили в базе данных МЕйШЕ/ РиЬМеС с 1966 по 2003 г. Экспериментальные исследования на животных и фундаментальные исследования активных форм витамина й3 (альфакальцидола — Альфа Д3-Тева) были
включены в обзор; клинические исследования, в том числе с участием пациентов, перенесших трансплантацию органов, — в метаанализ. В качестве первичной конечной точки использовали изменение (в процентном отношении) минеральной плотности костной ткани (МПКТ) поясничных позвонков, вторичной — частоту вертебральных переломов.
Всего было найдено 44 соответствующие публикации. Экспериментальные исследования на животных и фундаментальные исследования показали, что активные аналоги витамина D3 (альфакальцидол —
Альфа Д3-Тева) могут предупреждать потерю массы костной ткани. вызванную терапией КС. Что касается влияния на МПКТ, суммарная величина эффекта (ВЭ) активных аналогов витамина D3 по сравнению с отсутствием лечения, плацебо, природным витамином D3 и/или препаратами кальция составила 0,35 (95% ДИ 0,18-0,52); по сравнению с бисфос-фонатами -1,03 (95% ДИ -1,71…-0,36). Суммарный относительный риск переломов позвонков при использовании активных аналогов витамина D3 в сравнении с отсутствием лечения, плацебо, природным витамином D3 и/или препаратами кальция составил 0,56 (95% ДИ 0,34-0,92); по сравнению с бисфосфо-натами — 1,2 (95% ДИ 0,32-4,55).
Таким образом, активные аналоги витамина D3 (альфакальцидол – Альфа Д3-Тева) не только эффективнее, чем отсутствие лечения, плацебо, природный витамин D3 и/или препараты кальция, сохраняют костную ткань при лечении КС, но и более эффективны в отношении снижения риска вер-тебральных переломов. Только бисфосфонаты превосходят их по эффективности.
Возможно, в дальнейшем стоит изучить эффективность комбинированной терапии альфакальци-дол + бисфосфонаты, где альфакальцидол выступает в качестве базисной терапии вместо витамина D.
Подготовлено по материалам: De Nijs R.N. et al. (2004) Osteoporos Int., 15(B): 5B9-602.
АНАЛОГИ ВИТАМИНА D (АЛЬФАКАЛЬЦИДОЛ (АЛЬФА Д3-ТЕВА) И КАЛЬЦИТРИОЛ) ПО СРАВНЕНИЮ С ПРИРОДНЫМ ВИТАМИНОМ D В ПРОФИЛАКТИКЕ ПОТЕРИ МАССЫ КОСТНОЙ ТКАНИ И СВЯЗАННЫХ С ОСТЕОПОРОЗОМ ПЕРЕЛОМОВ: РЕЗУЛЬТАТЫ СРАВНИТЕЛЬНОГО МЕТААНАЛИЗА
Для сохранения минеральной плотности костной ткани (МПКТ) и предупреждения остеопоро-тических переломов женщинам в период ранней постменопаузы и пациентам, получающим корти-костероиды (КС), рекомендуется назначать профилактическую терапию (препараты кальция, витамин D, аналоги витамина D, эстрогены, бисфос-фонаты). Сравнению эффективности природного витамина D и его аналогов (альфакальцидола (Альфа Д3-Тева) и кальцитриола) в профилактике указанных нарушений был посвящен метаанализ, проведенный бельгийскими учеными. В анализ включили 14 исследований по изучению эффективности природного витамина D. 9 — по альфакальцидолу (Альфа Д3-Тева) и 10 — по кальцитриолу. Его результаты показали, что аналоги витамина D (Альфа Д3-Тева и кальцитриол) обладают более выраженным профилактическим эффектом в отношении потери массы костной ткани и остеопоротических переломов у пациентов, не получающих КС. Так, в отношении предотвращения потери МПКТ в исследованиях по сравнению аналогов витамина D (Альфа Д3-Тева и кальцитриола) с плацебо была показана величина эффекта (ВЭ), равная 0,36 (р3-Тева и кальцитриол) также обладали более выраженным эффектом в отношении снижения риска переломов по сравнению с природным витамином D: разность рисков (РР), то есть снижение абсолютного риска по сравнению с плацебо, составила 10% (95% ДИ 2-17) и 2% (95% ДИ 1-3) соответственно
(р<0,0001). Частота вертебральных и невертебральных переломов была достоверно ниже
при применении аналогов витамина D по сравнению с природным витамином D — на 13,4% (95% ДИ 7,7-19,8) и 6% (95% ДИ 1-12) соответственно. В отношении показателя МПКТ у пациентов, получающих КС, оба режима терапии продемонстрировали сопоставимую ВЭ — 0,38 для аналогов и 0,41 — для природного витамина D (р=0,88). Однако относительно МПКТ только позвонков аналоги обладали выраженным и статистически достоверным профилактическим эффектом (ВЭ 0,43; р3-Тева и кальцитриола) и природного витамина D у пациентов, получавших КС, было отмечено достоверное преимущество аналогов в отношении профилактики снижения МПКТ шейки бедренной кости (ВЭ 0,31; р=0,02) и переломов позвонков (РР 15%; 95% ДИ 6,5-25). Таким образом, аналоги витамина D (Альфа Д3
Тева и каль-цитриол) превосходят по эффективности природный витамин D в отношении профилактики потери массы костной ткани как минимум в 2 раза и переломов позвонков при первичном, в том числе постменопаузальном, остеопорозе (ОП). При КС-индуцированном ОП наличие или отсутствие превосходства аналогов над природным витамином D зависело от метода сравнения: при непрямом сравнении различия в эффективности были статистически недостоверны, в то время как при прямом сравнении аналоги продемонстрировали достоверные преимущества. При КС-индуцированном ОП аналоги представляются более эффективными в отношении профилактики вертебральных переломов, однако это предположение должно быть подтверждено в сравнительных плацебо-контролируемых исследованиях.
Подготовлено по материалам: Richy F. et al. (2005) Calcif. Tissue Int., 76(3): 176-186.
АЛЬФАКАЛЬЦИДОЛ (АЛЬФА Д3-ТЕВА) ПО СРАВНЕНИЮ С ОБЫЧНЫМ ВИТАМИНОМ О ПРИ ОСТЕОПОРОЗЕ, ИНДУЦИРОВАННОМ ВОСПАЛЕНИЕМ
Воспалительные заболевания могут вызывать системный остеопороз вследствие таких факторов, как повышенные циркулирующие концентрации воспалительных цитокинов (интерлейкина-6 — ИЛ-6, фактора некроза опухоли альфа — ФНО-а), лечение глюкокортикоидами, снижение двигательной активности пациента. Кроме того, в патогенезе остеопороза, связанного с воспалением, важную роль играют нарушения метаболизма витамина D. D-гормон обладает плейотропными свойствами не только в отношении гомеостаза кальция, но и мышечной ткани (повышает силу мышц), нервной и иммунной систем, D-гормон подавлял высвобождение цитокинов (ИЛ-1, ИЛ-6, ФНО-a) из макрофагов и стимулировал секрецию остеопротегерина in vitro, а на моделях артрита у животных уменьшал выраженность симптомов. В рандомизированных контролированных исследованиях было обосновано назначение альфакальцидола вместо обычного витамина D в профилактике и
лечении вторичного остеопороза. В отличие от витамина D3, альфакальцидол (Альфа Д3-Тева) улучшал метаболизм костной и мышечной ткани и облегчал симптомы заболевания у пациен тов с ревматоидным артритом.

Leave a comment