КЛІНІКО-ПАТОГЕНЕТИЧНЕ ЗНАЧЕННЯ КРЕМНІЮ ПРИ РЕВМАТОЇДНОМУ АРТРИТІ
Синяченко О.В.1, Егудина Е.Д.2, Гейко И.А.1, Ермолаева М.В.1, Такташов Г.С.1
- 1Донецкий национальный медицинский университет им. Максима Горького (Лиман)
- 2ГУ «Днепровская медицинская академия» (Днепр)
Резюме. До чинників ризику розвитку та подальшого несприятливого перебігу ревматоїдного артриту (РА) належать високі концентрації в атмосфері сполук кремнію (Si). Мета і завдання роботи — оцінка клініко-патогенетичної значущості кремнієвого мікроелементозу при РА, роль його в розвитку вторинного остеопорозу та у впливі на стан маркерів кісткового метаболізму, вивчення впливу рівня забруднення атмосфери регіонів проживання людей кремнійвмісними полютантами на поширеність і характер перебігу захворювання, а також на баланс в організмі хворих Si. Матеріали і методи. Обстежено 83 хворих на РА (22% чоловіків і 78% жінок віком від 22 до 75 років; в середньому — 45 років). Тривалість захворювання від перших ознак його маніфестації становила 9 років. Системну форму хвороби діагностовано в 19% випадків, серопозитивний РА за ревматоїдним фактором встановлений у 68% спостережень, за антицитруліновими антитілами — у 80%. Результати. РА супроводжується зменшенням накопичення Si у волоссі, яке спостерігається у ¾ хворих, за відсутності достовірних змін рівня кремніємії, що пов’язано із клінічними, рентгенологічними та сонографічними ознаками перебігу захворювання, ступенем активності й тяжкістю артриту, а кремнієвий дисбаланс бере участь у патогенетичних побудовах суглобового синдрому, ураження скелетних м’язів, периферичної нервової системи і внутрішніх органів (легень, серця, нирок), причому, показники Si у крові й волоссі можуть мати прогностичну значущість. Системний остеопороз супроводжується зменшенням на 43% параметра кремніємії, що щільно пов’язане з показниками компактності кістки, а ті, у свою чергу, з концентрацією в крові остеокальцину, при цьому існує дисперсійний вплив і кореляційні зв’язки кремнієвого балансу із вмістом у крові остеоасоційованого стронцію, що має певну прогностичну значущість відносно порушень параметрів в організмі Si. Високий рівень в атмосфері регіонів проживання хворих на РА кремнійвмісних сполук впливає на накопичення в організмі Si, що є додатковим патогенетичним чинником уражень верхньощелепних суглобів та великих кісткових зчленувань (плечових, колінних, кульшових), на виникнення системних ознак захворювання (ентезопатії, дигітального артеріїту), асептичного остеонекрозу, інтраартикулярних тіл Гоффа і Штайді, а забруднення повітря, що вдихається, кремнеземом може змінювати щільність кістки, впливаючи на рівень у крові остеоасоційованих макроелементів (Ca, Mg).
Введение
Ревматоидный артрит (РА) относится к наиболее частым воспалительным заболеваниям опорно-двигательного аппарата (Kingsbury S.R. et al., 2016). Распространенность его среди всего населения в некоторых регионах земного шара достигает 3%, причем абсолютная и относительная численность этих пациентов постоянно увеличивается, нанося огромный медико-социальный ущерб больным и оказывая неподъемное экономическое бремя на общество в целом (Machado M.A. et al., 2016; Minichiello E. et al., 2016; Smolen J.S. et al., 2016).
К факторам риска развития РА относятся высокие концентраций в атмосфере соединений кремния (Si) (Anic B., Mayer M., 2014; Murphy D. et al., 2015; Too C.L. et al., 2016). Токсическое воздействие на организм вдыхаемого кварца (диоксида Si) рассматривается как один из мощных патогенетических факторов данного заболевания (Gomez-Puerta J.A. et al., 2013). Сейчас четко установлено неблагоприятное воздействие на организм больных с уже развившимся РА экологического загрязнения окружающей атмосферы поллютантами заводов по производству кремнийсодержащих строительных материалов (Makol A. et al., 2011). В таких случаях высокие концентрации во вдыхаемом воздухе кремниевой пыли способствуют дальнейшему увеличению продукции ревматоидного фактора (RF) и антицитруллиновых антител (аСА) (Turk S.A. et al., 2014; Essouma M., Noubiap J.J., 2015; Conigliaro P. et al., 2016).
Необходимо отметить, что распространенность РА значительно выше у лиц, связанных с производством строительных материалов, содержащих Si (Blanc P.D. et al., 2015). По данным К. Steenland и соавторов (2010), среди 4,6 тыс. рабочих, подвергающихся по роду своей профессиональной деятельности влиянию кварцевой пыли, частота развития РА оказалась достоверно выше, чем в популяции, а продолжительность жизни больных меньше. S. Turner и N. Cherry (2009) диагностировали РА у 1% из 8,3 тыс. таких обследованных рабочих в соотношении мужчин к женщинам как 3:1. В результате длительного вдыхания кварцевой пыли на производстве может развиваться так называемый ревматоидный силикоартрит Колине — Каплана (Rozenberg D., Shapera S., 2014; Jungraithmayеr W. et al., 2016; Pollard K.M., 2016).
Значимость Si в клинико-патогенетических построениях РА изучена недостаточно. Гипотетически выяснение роли Si в формировании особенностей течения РА будет способствовать улучшению качества диагностики отдельных проявлений заболеваний, разработке прогностических критериев, повышению уровня реабилитационных мероприятий. Цель и задачи данной работы — оценка клинико-патогенетической значимости кремниевого микроэлементоза при РА, роль его в развитии вторичного остеопороза (ОП) и воздействии на состояние маркеров костного метаболизма (МКМ), изучение влияния уровня загрязнения атмосферы регионов проживания людей кремнийсодержащими поллютантами на распространенность и характер течения заболевания, а также на баланс в организме больных Si.
Материалы и методы
Обследованы 83 больных РА (21,7% мужчин и 78,3% женщин в возрасте от 22 до 75 лет; в среднем — 45±1,2 года). Длительность заболевания от первых признаков его манифестации составила 9±0,7 года. Системная (суставно-висцеральная) форма болезни диагностирована в 19,3% случаев, серопозитивный РА по RF установлен в 67,5% наблюдений, по аСА — в 79,5%. Параметры общей активности заболевания (AAG) составили 2,0±0,08 балла, активности артрита для 28 суставов (DAS) — 4,7±0,10 о.е., рентгенологической стадии (ARS) — 2,4±0,09 балла, распространенности суставного синдрома (AA) — 20,8±0,90 абс., индекса Лансбури (LI) — 175,9±8,91 балла, индекса прогрессирования болезни (PAI) — 2,1±0,28 о.е., показателей в крови RF — 10,9±0,99 МЕ/мл, aCA — 27,2±1,29 Е/мл, С-реактивного протеина (CRP) — 13,3±0,82 мг/л, фибриногена (FG) — 7,4±0,34 г/л.
Остеокистоз выявлен у 84,3% больных РА, субхондральный склероз — у 72,3%, изменения рогов менисков коленных сочленений — у 44,6%, остеоузуры — у 36,2%, подвывихи суставов — у 20,5%, лигаментоз и кисты Бейкера — соответственно у 19,3%, интраартикулярные хондромные тела — у 16,9%, кальцинаты Штайди — у 7,2%, асептический остеонекроз — у 6,0%, липидные тела Гоффа — у 3,6%. Системный ОП отмечен в 63,9% случаев, эпифизарный (околосуставной) — в 81,9%. Тендовагинит диагностирован в 45,8% наблюдений, энтезопатия — в 21,7%, изменения миокарда и клапанов сердца — в 15,7%, периферической нервной системы (полинейропатия) — в 12,1%, скелетных мышц (миозит, миалгия) — в 10,8%, легких (интерстициальный пневмонит, фиброзирующий альвеолит, ревматоидные узлы) — в 8,4%, почек (мезангиопролиферативный или мезангиокапиллярный гломерулонефрит, тубулоинтерстициальный нефрит, амилоидоз) и серозных оболочек (плеврит, перикардит) — в 6,0%, лимфоузлов — в 4,8%, дигитальный артериит — в 2,4%, синдром Шегрена — в 1,2%.
Всем больным выполняли рентгенологическое исследование периферических суставов, крестцово-подвздошных и позвонковых сочленений, а также органов грудной клетки (аппарат «Multix-Compact-Siеmens», Германия), ультразвуковое — суставов, внутренних органов, щитовидной железы и лимфатических узлов («Envisor-Philips», Нидерланды), двухэнергетическую рентгеновскую остеоденситометрию проксимального отдела бедренной кости («QDR-4500-Delphi-Hologic», США). Оценивали периферический метакарпальный индекс Барнетта — Нордина (BNI) и индекс минеральной плотности костной ткани (BMD), подсчитывали индекс интегральной тяжести артрита (SAI) по формуле:
SAI = ´DAS,
а PAI определяли по формуле:
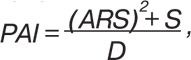
где S — сумма рентгеносонографических признаков РА, D — продолжительность клинической манифестации заболевания.
Иммуноферментным методом (ридер «PR2100-Sanofi diagnostic pasteur», Франция) исследовали содержание в сыворотке крови aCА и остеокальцина (ОС), уровни RF, СRP, FG и активность щелочной фосфатазы (АР) — с помощью анализатора «Olympus-AU-640» (Япония). В сыворотке крови также определяли содержание тех химических макро- и микроэлементов (МЭ), которые участвуют в метаболизме костной ткани (кальций — Ca, магний — Mg, фосфор — P, свинец — Pb, стронций — Sr), использовав атомно-эмиссионный спектрометр с индуктивно связанной аргоновой плазмой «IRIS-Intepid-II-XDL» и атомно-абсорбционный спектрометр «SolAAr-Mk2-MOZe» с электрографитовым атомизатором (Великобритания). С помощью последнего изучали уровни Si в крови (SiК) и волосах (SiВ), подсчитывали интегральную степень в организме кремниевого микроэлементоза (SDD). В случаях показателя, равного [(M±SD)¸(M±2SD)] здоровых людей, авторы расценивали как изменение содержания SiК или SiВ в 1 балл, при [(M±2SD)¸(M±3SD)] — в 2 балла, при [(M±3SD¸M±4SD] — в 3 балла, при >M±4SD — в 4 балла. SDD получали как среднее значение отклонений от нормы концентрации Si в крови и волосах. В качестве контроля обследованы 30 практически здоровых людей в возрасте от 18 до 62 лет, среди которых — 10 мужчин и 20 женщин.
Гигиеническую оценку интегрального экологического индекса (EI) антропогенного загрязнения окружающей среды проводили на основе определения ксенобиотиков в атмосферном воздухе. Данные получены региональными отделениями Государственного комитета по гидрометеорологии, контролю природной среды и экологической безопасности. Оценивали: 1) распределение доли выбросов в атмосферу 17 городских и 17 сельских регионов Донецкой области производства кремнийсодержащих строительных материалов по отношению к другим отраслям промышленности; 2) уровень выбросов в атмосферу и накопление в ней промышленных отходов за год из расчета на площадь территории и человека; 3) степень загрязнения атмосферы кремнеземом.
Статистическая обработка полученных результатов исследований проведена с помощью компьютерного вариационного, непараметрического, корреляционного, регрессионного, одно- (ANOVA) и многофакторного (ANOVA/MANOVA) дисперсионного анализа (программы «Microsoft Excel» и «Statistica-Stat-Soft», США). Оценивали средние значения (M), их стандартные ошибки и отклонения (SD), коэффициенты параметрической корреляции Пирсона и непараметрической Кендалла, критерии дисперсии Брауна — Форсайта, множественной регрессии, Стьюдента, Уилкоксона — Рао, Макнемара — Фишера и достоверность статистических показателей.
Результаты исследования
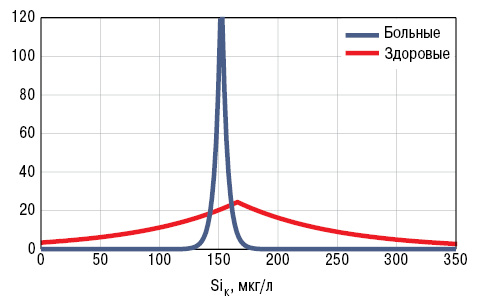
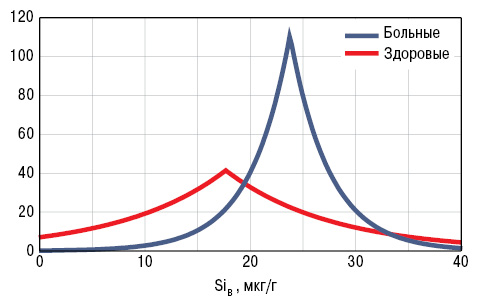
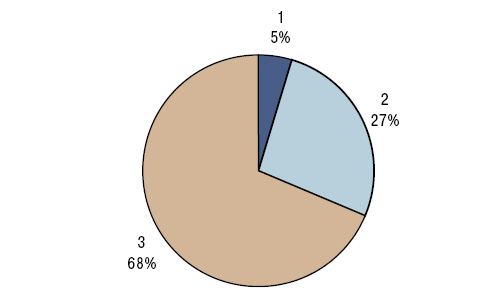
У больных РА уровень SiК составил 164,4±13,17 мкг/л, а SiВ — 17,6±1,55 мкг/г. Концентрация кремниемии мало отличалась от показателей у здоровых людей, а содержание этого МЭ в волосах было достоверно сниженным на 27% (рис. 1, 2). Кремниевый дисбаланс в организме, по данным критерия SDD, составил 3,0±0,10 о.е., причем отсутствовала корреляционная связь между параметрами SiК и SiВ. Нормальные значения SiК (M±SD здоровых) установлены в 4,8% случаев РА, повышенные (>M+SD) — в 26,5%, пониженные (<M–SD) — в 68,7%, а уровни SiВ — соответственно в 12,1; 13,3 и 74,7% (рис. 3, 4).
Как показывает однофакторный дисперсионный анализ Брауна — Форсайта, на содержание SiК оказывают влияние пол пациентов и продолжительность клинической манифестации заболевания, на показатель SiВ — возраст обследованных и наличие асептических остеонекрозов, на значение SDD — наличие интраартикулярных тел Гоффа. В свою очередь, с параметром SiК тесно связано вовлечение в патологический процесс межфаланговых суставов стоп, с SiВ — степень выраженности субхондрального склероза, а с SDD — поражение скелетных мышц, легких и периферической нервной системы. Как показал регрессионный анализ, содежание этого МЭ в крови обратно зависит от возраста пациентов с РА, а в волосах — от степени лигаментоза коленных суставов.
Показатели SiК и SiВ тесно дисперсионно связаны с параметром DAS, а уровень МЭ в волосах, кроме того, зависел от тяжести поражения крупных суставов, на что указывала связь с LI. Определенный интерес представляет факт об отсутствии влияния изменений кремниемии в сторону повышения и снижения показателя на интегральные клинические, рентгенологические, сонографические признаки патологии суставов и экстраартикулярные проявления РА. По данным многофакторного дисперсионного анализа Уилкоксона — Рао, на клинико-лабораторные критерии течения РА оказывает существенное воздействие содержание SiВ, от которого также зависит характер суставного синдрома.
Непараметрический корреляционный анализ Кембалла продемонстрировал прямую связь поражения межфаланговых суставов стоп с уровнем SiК, плечевых — обратную с SiВ, а межфаланговых суставов кистей — позитивное соотношение с SDD. Наличие и тяжесть у больных лигаментоза разнонаправленно (позитивно и негативно) коррелирует с показателями SiВ и SDD, асептического остеонекроза (прямое и обратное соотношение) — с SiК и SiВ. Кроме того, интраартикулярные тела Штайди имеют отрицательную связь с уровнем кремниемии. Если содержание Si в крови обратно коррелирует с наличием нефропатии, то концентрация МЭ в волосах прямо соотносится с выраженностью поражения скелетных мышц. Отмечена отрицательная связь интегрального кремниевого дисбаланса в организме больных РА (показатель SDD) с диастолической дисфункцией левого желудочка сердца.
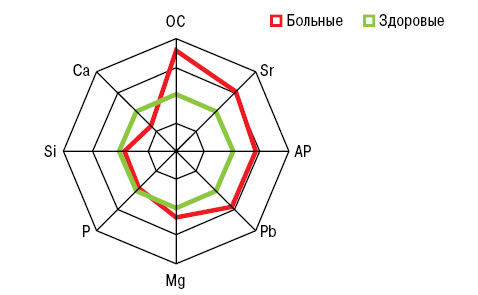
У больных РА показатели в крови OC составили 15,4±0,43 нг/мл, активности AP — 126,0±5,50 Е/л, Mg — 31,8±0,33 мг/л, Pb — 61,7±3,46 мкг/л, Sr — 48,7±1,84 мкг/л, Ca — 62,7±1,58 мг/л, P — 380,2±4,73 мг/л, что по сравнению со здоровыми людьми соответствующего пола и возраста оказались достоверно большими соответственно на 79; 42; 17; 42 и 49%, меньшими — на 37 и 6%.
Обсуждение
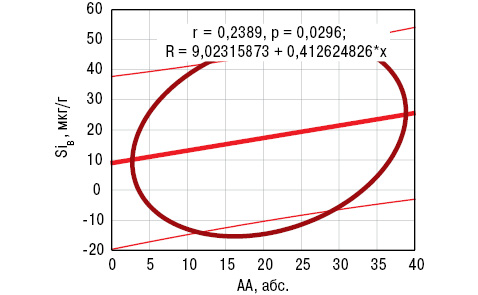
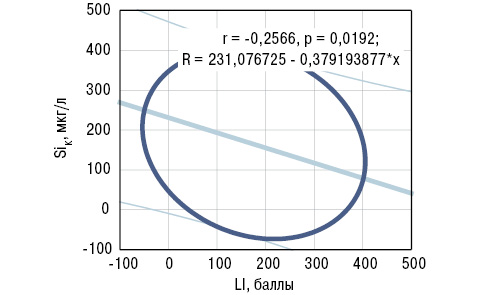
Дисперсионный анализ Брауна — Форсайта показал влияние содержания SiК на параметры AA, LI и PAI, SiВ — только на AA, SDD — на РAI, концентрации в сыворотке крови aCA и FG. Корреляционный анализ Пирсона выявил прямую связь SiВ с АА, a SiК — обратную с LI. Эти результаты отражены на рис. 5, 6. С учетом полученных данных статистического анализа сделаны следующие заключения, имеющие практическую направленность: 1) уровень SiК<45 мкг/л (<M-SD больных РА) является прогнознегативным признаком в отношении поражения крупных сочленений (тазобедренных, коленных, плечевых); 2) содержание SiВ>35 мкг/г (>M+SD больных) относится к прогностически неблагоприятным критериям распространенности суставного синдрома.
Si участвует в метаболизме костной ткани при РА (Horecka A. et al., 2016) и способен формировать нормальную BMD (Shadjou N., Hasanzadeh M., 2015; Tatara M.R. et al., 2015), ослаблять апоптоз остеобластов, восстанавливать дифференцировку остеокластов и процессы резорбции кости (Casarrubios L. et al., 2016). У животных с постоянным дефицитом в пищевом рационе Si установлено развитие ОП, что связывают с появлением измененной продукции в организме ОС и коллагена типа 1 (Dong M., 2016). В свою очередь, употребление животными с моделью артрита пищи, богатой Si, способствует восстановлению BMD (Rodella L.F. et al., 2014). M.N. Weitzmann и соавторами (2015) установлено, что у мышей с экспериментальным ОП внутрибрюшинные введения наночастиц сферического Si увеличивают BMD. Этот факт является хорошим подспорьем для дальнейших испытаний такого метода лечения в клинической практике у больных с ОП.
Значения BNI у обследованных больных составили 0,43±0,005 о.е., а BMD — 1,59±0,082 –SD. По данным дисперсионного анализа, уровни SiK и SiB влияют на показатель BNI, и, как свидетельствует корреляционный анализ, существует прямая связь параметра кремниемии с BNI и обратная с BMD. Имеет место четкая зависимость формирования ОП от уровней в организме SiK и SiB. Такой остеодефицит сопровождается достоверным снижением кремниемии на 43%, тогда как параметры SiB и SDD в этих группах больных отличаются несущественно.
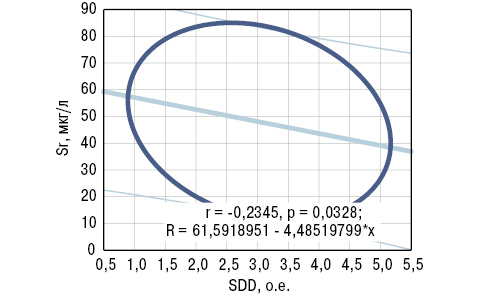
На рис. 7 представлены отличия МКМ и Si в крови больных от аналогичных показателей в группе условно здоровых лиц. ОП при РА (рис. 8) сопровождается достоверным повышением (на 35%) показателя ОС. При этом концентрация кремниемии у больных без ОП превышает аналогичные значения у здоровых людей на 27%, а в случаях ОП становится меньшей на 14%. Как свидетельствует многофакторный дисперсионный анализ Уилкоксона — Рао, на интегральные МКМ оказывает влияние повышенный уровень (>M+SD больных) SiK и пониженное содержание (<M–SD) SiB. Однофакторный анализ Брауна — Форсайта продемонстрировал зависимость содержания стронциемии от значений SiB и SDD.
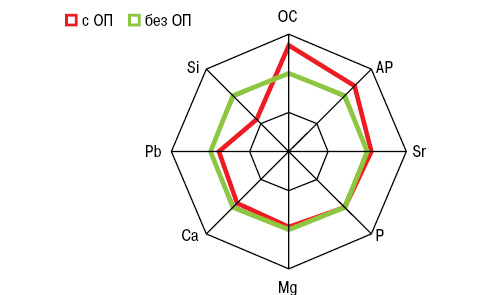
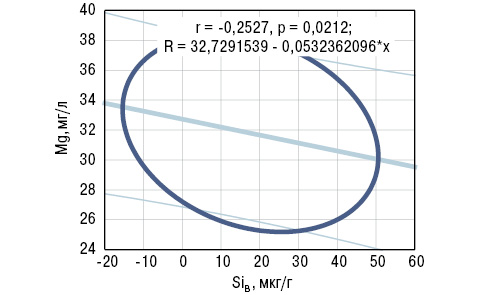
Корреляционный анализ выявил обратные связи показателей SiK и SDD c концентрацией в крови Sr, а SiB — c содержанием Mg (рис. 9, 10). С учетом выполненной статистической обработки полученных результатов исследования сделано следующее заключение: показатель в крови больных РА Sr<30 мкг/л (<M-SD больных РА) является прогнознегативным в отношении дисбаланса в организме Si. В этой связи необходимо отметить, что Sr входит в состав неорганического матрикса и способен вытеснять из кости Са, встраиваясь вместо него в костную решетку.
Средняя распространенность РА в регионах проживания обследованных больных составила 17,1±0,61 на 10 тыс. населения. Среди этих пациентов 63,9% составляли городские и 36,2% — сельские жители. ЕІ был равен 3,2±0,36 о.е., выбросы в атмосферу ксенобиотиков отраслями промышленности, транспортом и сельским хозяйством — 1,2±0,15 т на одного человека за год, накопление этих отходов в атмосфере — 566,1±69,30 т/км/год. Структура производства кремнийсодержащих строительных материалов в экологическом загрязнении атмосферы зон проживания больных составила 14,7±2,28%, кратность доли стройматериалов — 773,4±243,14 о.е., уровень во вдыхаемом воздухе поллютантов кремнезема — 2,5±0,12 балла, загрязнение атмосферы кремнеземом на 100 тыс. населения — 3,9±0,36 о.е.
По данным дисперсионного анализа, на распространенность РА влияет фактор проживания больных в городах, общее накопление в атмосфере промышленных отходов и степень загрязнения воздуха кремнеземом, причем, с последними двумя экологическими показателями существует прямая корреляционная связь. Многофакторный анализ ANOVA/MANOVA продемонстрировал влияние факторов внешней среды на интегральное состояние в организме кремниевого баланса. Прямую связь показателя SDD со степенью загрязнения атмосферы кремнийсодержащими соединениями показал анализ множественной регрессии. Необходимо отметить, что экологические параметры атмосферы не оказывают достоверного воздействия на содержание у больных РА кремниемии, тогда как концентрация SiB оказалась тесно связанной с суммарным накоплением в воздухе промотходов в целом и кремнезема в частности. Обращала на себя внимание прямая корреляционная связь показателя SiB с параметром загрязнения кремнеземом. Значение SDD также определяется уровнем в атмосфере кремнезема.
Мощность производства кремнийсодержащих строительных материалов в регионах проживания больных РА воздействует на поражение плечевых, коленных и тазобедренных суставов, а также формирование асептических остеонекрозов, о чем свидетельствует выполненный дисперсионный анализ Брауна — Форсайта. Степень загрязнения атмосферы кремнеземом влияет на развитие внесуставной (экстраартикулярной, системной) формы РА, вовлечение в процесс верхнечелюстных сочленений и развитие дигитального артериита. Как продемонстрировал непараметрический корреляционный анализ Кембалла, с уровнем выбросов в атмосферу кремнийсодержащих соединений прямо соотносится поражение при РА верхнечелюстных и плечевых суставов, развитие энтезопатий, асептических остеонекрозов и кист Бейкера, а со степенью загрязнения вдыхаемого воздуха кремнеземом — артрит верхнечелюстных сочленений, энтезопатии, интраартикулярные тела Гоффа и Штайди.
Необходимо отметить, что параметры экологической нагрузки на атмосферу кремнийсодержащими соединениями в регионах проживания больных РА никак не отражаются на развитии ОП. Вместе с тем, как показал корреляционный анализ, уровень в атмосфере кремнезема обратно соотносится со значениями BNI и концентрацией магниемии, а позитивная связь установлена в отношении содержания кальцемии.
Выводы
1. РА сопровождается уменьшением накопления SiВ, что наблюдается у ¾ больных, при отсутствии достоверных изменений уровня кремниемии, хотя соответственно в 13 и 27% случаев констатируется высокое содержание данного МЭ в этих объектах исследования, что связано с полом и возрастом пациентов, клиническими, рентгенологическими и сонографическими признаками течения заболевания, степенью активности и тяжестью артрита, а кремниевый дисбаланс участвует в патогенетических построениях суставного синдрома, поражения скелетных мышц, периферической нервной системы и внутренних органов (легких, сердца, почек), причем показатели SiК и SiВ могут обладать прогностической значимостью.
2. Системный ОП развивается у 64% больных РА, который сопровождается уменьшением на 43% параметра кремниемии, что тесно связано с показателями плотности кости, а те, в свою очередь, с концентрацией в крови ОС, при этом существует дисперсионное влияние и корреляционные связи кремниевого баланса с содержанием в крови остеоассоциированного Sr, обладающего определенной прогностической значимостью в отношении нарушений параметров в организме Si.
3. Высокий уровень в атмосфере регионов проживания больных РА кремнийсодержащих соединений оказывает влияние на накопление в организме Si, что является дополнительным патогенетическим фактором поражений верхнечелюстных суставов и крупных костных сочленений (плечевых, коленных тазобедренных), на возникновение системных признаков заболевания (энтезопатий, дигитального артериита), асептического остеонекроза, интраартикулярных тел Гоффа и Штайди, а загрязнение вдыхаемого воздуха кремнеземом может изменять плотность кости, влияя на уровень в крови остеоассоциированных макроэлементов (Ca, Mg).
Список использованной литературі
- 1. Anic B., Mayer M. (2014) Pathogenesis of rheumatoid arthritis. Reumatizam, 61(2): 19–23.
- 2. Blanc P.D., Järvholm B., Torén K. (2015) Prospective risk of rheumatologic disease associated with occupational exposure in a cohort of male construction workers. Am. J. Med., 128(10): 1094–1101.
- 3. Casarrubios L., Matesanz M.C., Sánchez-Salcedo S. et al. (2016) Nanocrystallinity effects on osteoblast and osteoclast response to silicon substituted hydroxyapatite. J. Colloid. Interface Sci., 15(482): 112–120.
- 4. Conigliaro P., Chimenti M.S., Triggianese P. et al. (2016) Autoantibodies in inflammatory arthritis. Autoimmun. Rev., 15(7): 673–683.
- 5. Dong M., Jiao G., Liu H. et al. (2016) Biological silicon stimulates collagen type 1 and osteocalcin synthesis in human osteoblast-like cells through the BMP-2/Smad/RUNX2 signaling pathway. Biol. Trace. Elem. Res., 173 (2): 306–315.
- 6. Essouma M., Noubiap J.J. (2015) Is air pollution a risk factor for rheumatoid arthritis? J. Inflamm., 30(12): 48–59.
- 7. Gomez-Puerta J.A., Gedmintas L., Costenbader K.H. (2013) The association between silica exposure and development of ANCA-associated vasculitis: systematic review and meta-analysis. Autoimmun. Rev., 12(12): 1129–1135.
- 8. Horecka A., Hordyjewska A., Blicharski T. et al. (2016) Simvastatin effect on calcium and silicon plasma levels in postmenopausal women with osteoarthritis. Biol. Trace. Elem. Res., 171(1): 1–5.
- 9. Jungraithmayеr W., Tzafos S., Distler O. et al. (2016) Rapid growth of lung nodules due to combined pulmonary vasculitis, silicoanthracosis, and chondrocalcinosis. Can. Respir. J., 20(16): 9254374.
- 10. Kingsbury S.R., Corp N., Watt F.E. et al. (2016) Recommendations on core data collection from an arthritis research UK clinical studies group. Rheumatology, 55(8): 1394–1402.
- 11. Machado M.A., Bernatsky S., Bessette L. et al. (2016) Hospitalization for musculoskeletal disorders in rheumatoid arthritis patients: a population-based study. BMC Musculoskelet. Disord., 19(17): 298–308.
- 12. Makol A., Reilly M.J., Rosenman K.D. (2011) Prevalence of connective tissue disease in silicosis report from the state of Michigan surveillance system for silicosis. Am. J. Ind. Med., 54(4): 255–262.
- 13. Minichiello E., Semerano L., Boissier M.C. (2016) Time trends in the incidence, prevalence, and severity of rheumatoid arthritis: A systematic literature review. Joint Bone Spine, 16(9): 129–134.
- 14. Murphy D., Sinha A., Hutchinson D. (2015) A trigger for rheumatoid arthritis? Am. J. Med., 128(12): 35–45.
- 15. Pollard K.M. (2016) Silica, silicosis, and autoimmunity. Front. Immunol., 11(7): 97–102.
- 16. Rodella L.F., Bonazza V., Labanca M. et al. (2014) A review of the effects of dietary silicon intake on bone homeostasis and regeneration. J. Nutr. Health Aging., 18(9): 820–826.
- 17. Rozenberg D., Shapera S. (2014) What to do with all of these lung nodules? Can. Respir. J., 21(3): 52–54.
- 18. Shadjou N., Hasanzadeh M. (2015) Silica-based mesoporous nanobiomaterials as promoter of bone regeneration process. J. Biomed. Mater. Res. A., 103(11): 3703–3716.
- 19. Smolen J.S., Collaud Basset S., Boers M. et al. (2016) Clinical trials of new drugs for the treatment of rheumatoid arthritis: focus on early disease. Ann. Rheum. Dis., 75(7): 1268–1271.
- 20. Steenland K., Sanderson W., Calvert G.M. (2010) Kidney disease and arthritis in a cohort study of workers exposed to silica. Epidemiology, 12(4): 405–412.
- 21. Tatara M.R., Krupski W., Szpetnar M. et al. (2015) Effects of total gastrectomy on plasma silicon and amino acid concentrations in men. Exp. Biol. Med., 240(12): 1557–1563.
- 22. Too C.L., Muhamad N.A., Ilar A. et al. (2016) Occupational exposure to textile dust increases the risk of rheumatoid arthritis: results from a Malaysian population-based case-control study. Ann. Rheum. Dis., 75(6): 997–1002.
- 23. Turk S.A., van Beers-Tas M.H., van Schaardenburg D. (2014) Prediction of future rheumatoid arthritis. Rheum. Dis. Clin. North Am., 40(4): 753–770.
- 24. Turner S., Cherry N. (2009) Rheumatoid arthritis in workers exposed to silica in the pottery industry. Occup. Environ Med., 57(7): 443–447.
- 25. Weitzmann M.N., Ha S.W., Vikulina T. et al. (2015) Bioactive silica nanoparticles reverse age-associated bone loss in mice. Nanomedicine, 11(4): 959–967.
Адрес для переписки:
Синяченко Олег Владимирович
84404, Донецкая обл.,
Красный Лиман, ул. Кирова, 27
Донецкий национальный медицинский
университет им. Максима Горького,
кафедра внутренней медицины № 1
Е-mail: synyachenko@ukr.net

Leave a comment