Ефективність німесуліду та його вплив на окремі катаболічні й анаболічні фактори у хворих на остеоартроз
Шуба Н.М.1, Воронова Т.Д.2, Пилипенко А.В.3, Литвиненко С.В.2
- 1ДУ «Національний науковий центр «Інститут кардіології ім. М.Д. Стражеска» НАМН України», Київ
- 2
- 3Національна медична академія післядипломної освіти ім. П.Л. Шупика, Київ
Резюме. Остеоартроз (ОА) є найпоширенішою формою захворювання опорно-рухового апарату й основною причиною болю й інвалідності в літньому віці, що значною мірою погіршує якість життя хворих. При лікуванні пацієнтів з ОА важливе значення належить як симптом-модифікуючим препаратам швидкої дії, так і повільнодіючим препаратам зі структурно-модифікуючим ефектом. Терапевтичний ефект структурно-модифікуючих препаратів найчастіше настає через 2–4 тиж застосування, тому для швидкого купірування больового синдрому спочатку призначають нестероїдні протизапальні препарати. Дуже важливо при їх виборі керуватися не тільки вираженою протизапальною активністю, хондропротекторною дією препарату, а й його максимальною безпекою щодо кардіоваскулярних і гастроінтестинальних ускладнень. З урахуванням вищевикладеного препаратом вибору при ОА є німесулід.
Введение
Остеоартроз (ОА) — хроническое дегенеративное заболевание, которое характеризуется потерей суставного хряща из-за возникновения дисбаланса между анаболическими и катаболическими процессами в хрящевой ткани. Ключевую роль в прогрессирующей деструкции хряща и альгофункциональной дисфункции играют провоспалительные цитокины, в частности фактор некроза опухоли-альфа (TNF-α) (Шуба Н.М. и соавт., 2012). TNF-α тесно коррелирует с тяжестью повреждения хряща и выраженностью болевого синдрома (Orita S. et al., 2011).
На сегодня рассматривается важность роли в патогенезе ОА: 1) супероксидных радикалов; 2) iNOS; 3) NF-κβ.
Чрезмерная продукция оксид азота (NO) в суставе подавляет матриксный синтез и вызывает его разрушение (Малышев И.Ю., 1997; Scher J.U. et al., 2007). NO инициирует также повреждение клеток через образование пероксинитрита (ОNOO) и апоптоз хондроцитов (Abramson S.B. et al., 2001). В хондроцитах iNOS индуцируется цитокинами, в частности ІL-1β и TNF-α, стимулируя их собственную продукцию, что приводит к прогрессирующей деструкции суставного хряща (Andrew P.J., Mayer B., 1999; Laporte J.R. et al., 2004; Манухина Е.Б. и соавт., 2007; McAlindony Т.E. et al., 2014). Установлено, что активность NF-κβ также влияет на индукцию iNOS и синтез NO (Pelletier J.P. et al., 2000; Jovanovic D.V. et al., 2002).
Высокий сывороточный уровень C-реактивного белка (СРБ) в значительной степени связан с наличием и прогрессированием ОА коленных суставов (Sokolove J., Lepus C.M., 2013).
Нестероидные противовоспалительные препараты (НПВП) широко применяют для уменьшения болевого синдрома при ОА. Нимесулид является препаратом с мультифакториальным механизмом действия, которое не ограничивается только ингибирующим влиянием на синтез циклооксигеназы (ЦОГ)-2. ЦОГ-независимые эффекты нимесулида в первую очередь заключаются в ингибировании активности NO-синтазы и, соответственно, образовании окиси азота и пероксинитрита (ОNOO), которые являются ключевыми медиаторами в процессе разрушения клеток организма и элементами воспалительного ответа. По последним данным установлено, что нимесулид угнетает in vivo высвобождение TNF и продукцию активного кислорода — два эффекта, которые вносят существенный вклад в противовоспалительное и анальгетическое действие препарата (Bennet A., Villa G., 2000). Поскольку ОА возникает у лиц с сопутствующей кардиоваскулярной патологией, то такие особенности нимесулида, как активация синтеза ингибитора тканевого активатора плазминогена, блокирование синтеза тромбоцитактивирующего фактора, являются чрезвычайно важными в предупреждении тромбоэмболических осложнений (Bloodsworth A. et al., 2000; Lane N.E. et al., 2011). Нимесулид подавляет активность 5-липоксигеназы, таким образом снижает риск возникновения воспаления и язвообразования в желудочно-кишечном тракте, что делает данный препарат более безопасным в отношении гастроинтестинальных осложнений (Laporte J.R. et al., 2004).
Для определения оптимальной терапевтической
тактики ведения больного ОА необходимо руководствоваться наличием у препарата высокой клинической эффективности, выраженной противовоспалительной активности, отличного профиля безопасности и метаболической нейтральности со стороны внутренних органов, что очень важно для пациентов с наличием коморбидных состояний. Данным требованиям отвечает препарат нимесулид.
Цель исследования — изучение эффективности и безопасности нимесулида у пациентов с ОА.
Объект и методы исследования
На базе 1-го терапевтического отделения Центральной городской клинической больницы № 7 обследовано 30 больных ОА в возрасте от 31 года до 77 лет (в среднем — 60,9±1,9 года). Диагноз ОА верифицирован на основании критериев Американского колледжа ревматологов (American College of Rheumatology — ACR). Средняя продолжительность заболевания составила 10,6±0,9 года. Общая характеристика респондентов отображена в табл. 1.
| Показатель | M±m |
|---|---|
| Женщины,n | 26 |
| Мужчины, n | 4 |
| Возраст, лет | 60,9±1,9 |
| Длительность заболевания, лет | 10,6±0,9 |
| Индекс массы тела | 32,57±1,16 |
| Рентгенологическая стадия по Келлгрену — Лоуренсу, n (%) | |
| I | 3 (10) |
| II | 24 (80) |
| III | 3 (10) |
Для оценки выраженности болевого синдрома использовали визуальную аналоговую шкалу (ВАШ), оценивали альгофункциональный индекс Лекена, индекс Western Ontario and McMaster Universiti osteoarthritis (WOMAC). Лабораторное обследование пациентов включало: общеклинический анализ крови и мочи, биохимические исследования (глюкоза в крови, билирубин, трансаминазы (аланинаминотрансфераза, аспартатаминотрансфераза), креатинин, мочевая кислота, СРБ). Иммунологические исследования крови: апоптоз (индекс индукции), TNF-α (Orgenium Laboratories, Финляндия), трансформирующий фактор роста-бета (TGF-β; DRG, Германия), инсулиноподобный фактор роста (IGF-1; DRG, Германия), оксид азота (NO) иммуноферментным методом. Учет реакции проводили на иммуноферментном анализаторе Lab-line-100 (WestMedica, Австрия). Рентгенографию коленных суставов проводили по стандартной методике в переднезадней и боковой проекциях. Рентгенологическая I–III стадия была установлена согласно классификации по Келлгрену — Лоуренсу. Статистический анализ полученных результатов проводили с помощью пакетов программ Microsoft Exel. При анализе применяли методы описательной статистики (вычисляли показатели: среднее арифметическое значение (M), ошибку среднего (m), стандартное отклонение (SD), минимум, максимум), определяли достоверность различий по t-критерию Стьюдента.
Результаты и их обсуждение
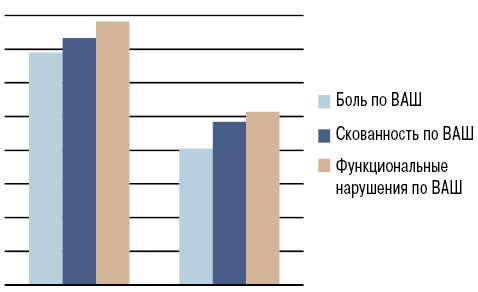
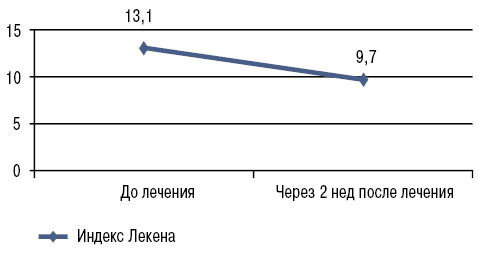
На фоне применения нимесулида в течение 2 нед мы отметили достоверное снижение интенсивности болевого синдрома, скованности, степени функциональных нарушений, оцениваемых по ВАШ (р<0,001) и альгофункциональному индексу Лекена (p<0,05) (табл. 2; рис. 1, 2).
| Показатель | До лечения | Через 2 нед после лечения |
|---|---|---|
| Выраженность боли по ВАШ, мм | 69±2,78 | 40,53±2,42** |
| Скованность по ВАШ, мм | 73,33±4,57 | 48,4±3,99** |
| Функциональные нарушения по ВАШ, мм | 78,23±4,09 | 51,37±3,93** |
| Индекс Лекена, баллов | 13,1±0,84 | 9,7±0,68* |
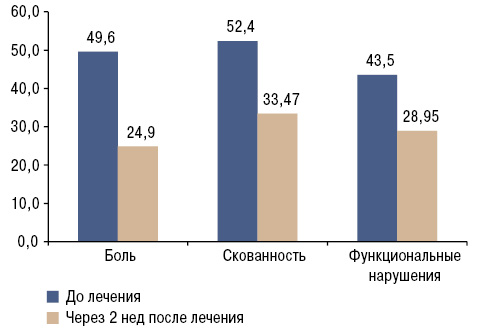
Боль, скованность, функциональные нарушения оценены также с помощью анкеты WOMAC. Полученные данные представлены в табл. 3. На фоне проводимой терапии пациенты отметили повышение физической активности и значительное улучшение двигательного режима, что находит отражение в достоверном снижении интенсивности боли (р<0,001) на 50,1%, скованности (р<0,001) — на 63,9% и функциональных нарушений (р<0,05) — на 66,5% (рис. 3).
| Показатели | До лечения | Через 2 нед после лечения |
|---|---|---|
| Боль | 49,65±4,91 | 24,87±2,67** |
| Скованность | 52,4±3,49 | 33,47±3,11** |
| Функциональные нарушения | 43,52±4,78 | 28,95±3,53* |
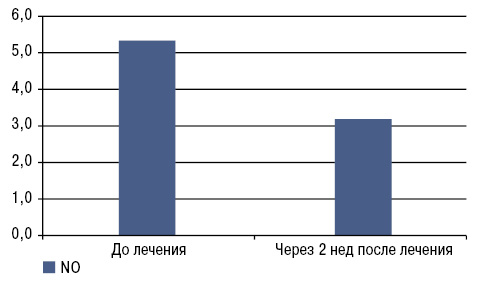
Примечательным было наблюдение динамики уровня NO с 5,33±0,72 до 3,19±0,34 через 2 нед после приема нимесулида, что приводит к значительному уменьшению болевого синдрома, выраженности воспалительного процесса и степени функциональных нарушений (рис. 4).
Учитывая непосредственное влияние TNF-α на развитие воспалительного ответа, деградации суставного хряща и субхондральной кости, нами отмечено статистически достоверное снижение TNF-α (р<0,05) с начального уровня до лечения с 45,6±14,08 до 16,26±1,6 через 14 дней применения препарата.
Также нами выявлена тенденция к повышению плазменных уровней TGF-β с 25,28±4,75 до 31,96±4,72 через 2 нед приема препарата (однако она является статистически не достоверной), что диктует необходимость включения в симптоматическую терапию структурно-модифицирующих препаратов для достижения синергетического и стойкого клинического эффекта (рис. 5).
При анализе полученных результатов выявлено статистически достоверное снижение плазменных уровней СРБ с 11,9±3,33 до 4,23±0,95 после 2 нед приема нимесулида.
Нами отмечена способность препарата нимесулид оказывать влияние на апоптоз хондроцитов. Выявлено, хотя и статистически не достоверную, тенденцию к уменьшению апоптоза с 0,805±0,063 до 0,774±0,058 через 2 нед лечения (табл. 4).
| Показатель | До лечения | Через 2 нед после лечения |
|---|---|---|
| Мочевая кислота, мкмоль/л | 375,33±24,6 | 321,57±19,6 |
| NO, мкмоль/л | 5,33±0,72 | 3,19±0,34* |
| TNF-α, пг/мл | 45,6±14,08 | 16,3±1,6* |
| TGF-β, пг/мл | 25,28±4,75 | 32,0±4,72 |
| IGF-1, нг/мл | 24,88±5,06 | 26,36±5,3 |
| Апоптоз (индекс индукции), у.е. | 0,805±0,063 | 0,774±0,058 |
| СРБ, мг/л | 11,9±3,33 | 4,23±0,95* |
При анализе результатов не отмечено достоверных различий в динамике показателей липидного, углеводного и пуринового обмена.
При применении нимесулида у больных ОА, после тщательного обследования, гастроинтестинальных и кардиоваскулярных осложнений не выявлено.
ВЫВОДЫ
Нимесулид оказал быстрый клинический эффект при применении его в течение 2 нед, что проявилось в значительном уменьшении болевого синдрома, скованности и улучшении функциональной активности.
Установлена безопасность нимесулида в отношении гастроинтестинальных осложнений, в частности язвообразования.
Применение нимесулида у больных гонартрозом способствовало снижению провоспалительных факторов, в частности СРБ и TNF-α , что может указывать на высокую противовоспалительную активность препарата.
Особого внимания заслуживает тот факт, что при применении нимесулида происходит снижение уровня NO, что может оказывать благоприятное влияние как на уменьшение воспалительного процесса, так и на замедление прогрессирования деструкции хрящевой ткани.
При применении нимесулида, несмотря на относительно короткий период назначения, отмечена тенденция к повышению уровня TGF-β, который обладает анаболическим эффектом, что, возможно, связано с его хондропротекторным действием.
Учитывая вышеизложенное, можно считать, что нимесулид при применении его в течение 2 нед является препаратом выбора для лечения ОА до наступления эффекта структурно-модифицирующих препаратов.
Список использованной литературы
-
- Малышев И.Ю. (1997) Введение в биохимию оксида азота. Роль оксида азота в регуляции основных систем организма. Рос. журн. гастроэнтерол. гепатол. колопроктол., 1: 49–55.
- Манухина Е.Б., Дауни Х.Ф., Маллет Р.Т., Малышев И.Ю. (2007) Защитные и повреждающие эффекты периодической гипоксии: роль оксида азота. Вестн. Рос. АМН, 2: 25–33.
- Шуба Н.М., Воронова Т.Д., Тарасенко Т.М., Крилова А.С. (2012) Нові аспекти патогенезу остеоартрозу та шляхи корекції. Укр. ревматол. журн., 47(1): 51–73.
- Abramson S.B., Attur M., Amin A.R., Clancy R. (2001) Nitric oxide and inflammatory mediators in the perpetuation of osteoarthritis. Curr. Rheumatol. Rep., 3(6): 535–41.
- Andrew P.J., Mayer B. (1999) Enzymatic function of nitric oxide synthases. Cardiovasc. Res., 43: 521–531.
- Bennet A., Villa G. (2000) Nimesulid: an NSAID that preferentially inhibits COX-2, and has various unique pharmacological activities. Exp. Opin. Pharmacotherapy, 1: 277–286.
- Bloodsworth A., O’Donnell V.B., Freeman B.A. (2000) Nitric oxide regulation of free radical and enzyme mediated lipid and lipoprotein oxidation. Aterioscler. Thromb. Vasc. Biol., 20(7): 1707–1715.
- Jovanovic D.V., Mineau F., Notoya K. et al. (2002) Nitric oxide induced cell death in human osteoarthritic synoviocytes is mediated by tyrosine kinase activation and hydrogen peroxide and/or superoxide formation. J. Rheumatol., 29(10): 2165–2175.
- Lane N.E., Brandt K., Hawker G. et al. (2011) OARSI-FDA initiative: defining the disease state of osteoarthritis. Osteoarthritis Cartilage, 19(5): 478–482.
- Laporte J.R., Ibanez L., Vidal X. et al. (2004) Upper gastrointestinal bleedings, associated with the use of NSAIDs: newer versus older agents. Drug Saf., 27(6): 411–420.
- McAlindony Т.E., Bannuruy R.R., Sullivany M.C. et al. (2014) OARSI guidelines for the non-surgical management of knee osteoarthritis. Osteoarthritis Cartilage, 22: 363–388.
- Orita S., Koshi T., Mitsuka T. et al. (2011) Associations between proinflammatory cytokines in the synovial fluid and radiographic grading and pain-related scores in 47 consecutive patients with osteoarthritis of the knee. BMC Musculoskelet Disord., 12: 144.
- Pelletier J.P., Yaron M., Haraoui B. et al. (2000) Efficacy and safety of diacerein in osteoarthritis of the knee: a double-blind, placebo-controlled trial. The Diacerein Study Group. Arthritis Rheum., 43(10): 2339–2348.
- Scher J.U., Pillinger M.H., Abramson S.B. (2007) Nitric oxide synthases and osteoarthritis. Curr. Rheumatol. Rep., 9(1): 9–15.
- Sokolove J., Lepus C.M. (2013) Role of inflammation in the pathogenesis of osteoarthritis: latest findings and interpretations. Ther. Adv. Musculoskelet. Dis., 5(2): 77–94. doi: 10.1177/1759720X12467868.
Адрес для переписки:
Шуба Неонила Михайловна
04112, Киев, ул. Дорогожицкая, 9
Национальная медицинская академия
последипломного образования
имени П.Л. Шупика

Leave a comment