Субклінічний атеросклероз та кардіоваскулярний ризик, інсулінорезистентність, рівень адипонектину при поєднанні ревматоїдного артриту з артеріальною гіпертензією
- 1ДЗ «Дніпропетровська медична академія» МОЗ України
- 2ДУ «ННЦ «Інститут кардіології ім. М.Д. Стражеска НАМН України»
Резюме. Обстежено 42 хворих (38 жінок, 4 чоловіки) віком 45–65 років (медіана — 54 [51; 60] років) з ревматоїдним артритом (РА) в поєднанні з артеріальною гіпертензією (АГ). Усім пацієнтам проводили загальноклінічне обстеження, ультразвукове дослідження каротидних судин із визначенням товщини комплексу інтима-медіа, пружно-еластичних властивостей, визначення ендотеліальної дисфункції, ліпідного спектра крові, рівня інсуліну, адипонектину, розрахунок індексів інсулінорезистентності, також проводили добове моніторування артеріального тиску. Визначено атеросклеротичні зміни у 33 (78,6%) пацієнтів із РА в поєднанні з АГ, що достовірно частіше, ніж у групах порівняння. У хворих основної групи встановлено достовірно вищу частоту виявлення атеросклеротичних бляшок — у 23 (54,8%), зокрема нестабільних за структурою — у 5 (21,7%) порівняно із групами порівняння. Наявність атеросклеротичних бляшок у хворих на АГ в поєднанні з РА асоціювалася із ендотеліальною дисфункцією, порушенням пружно-еластичних властивостей каротидних артерій, віком, гіперінсулінемією, гіперадипонектинемією, тривалістю застосування глюкокортикоїдів. Для адипонектину та індексу НОМА2 AUROC становила 0,787 (95% CI 0,642–0,932; р<0,05) та 0,700 (95% CI 0,536–0,864; р<0,05) відповідно, що свідчить про високу якість діагностичних моделей. Отже, у хворих із поєднанням РА та АГ достовірно частіше виявляють ознаки атеросклеротичних змін каротидних артерій порівняно зі групами порівняння, що потребує більш жорсткого контролю факторів кардіоваскулярного ризику. Визначення рівня адипонектину та інсулінорезистентності може бути додатковими маркерами атеросклеротичного ураження у цих хворих.
Вступ
Як відомо, ревматоїдний артрит (РА) — захворювання, що характеризується прискореним розвитком атеросклеротичного ураження судин та вищим рівнем кардіоваскулярного ризику порівняно із загальною популяцією [1, 2], що співвідноситься із серцево-судинним ризиком при цукровому діабеті (ЦД) ІІ типу [3]. Найчастішими чинниками ризику при РА є артеріальна гіпертензія (АГ), гіперліпідемія і тютюнопаління [4]. Водночас підвищення частоти судинних ускладнень неможливо пояснити лише нагромадженням традиційних факторів ризику [5, 6].
Згідно з рекомендаціями Європейської антиревматичної ліги (EULAR), оцінка ризику серцево-судинних захворювань (ССЗ) при РА — обов’язкова з метою визначення заходів щодо первинної профілактики кардіоваскулярних ускладнень [7]. Проте результати останніх досліджень свідчать про те, що рівень кардіоваскулярного ризику у пацієнтів із РА не цілком відображається при використанні шкали SCORE навіть з урахуванням коефіцієнта 1,5 [8], що зумовлює пошук додаткових маркерів серцево-судинного ризику у цих хворих. Так, у рамках щорічного конгресу EULAR у 2015 р. анонсовано оновлення рекомендацій 2009 р. з оцінки та управління серцево-судинного ризику у пацієнтів з РА, зазначено необхідність використання ультразвукового дослідження (УЗД) сонних артерій як доповнення оцінки традиційних факторів ризику [9]. Адже, як відомо, визначення товщини комплексу інтима-медіа (КІМ) каротидних артерій є важливим інструментом визначення субклінічного атеросклерозу та предиктором розвитку ішемічної хвороби серця [10]. Цілий ряд досліджень продемонстрував, що РА є самостійним, незалежним фактором збільшення товщини КІМ та наявності атеросклеротичних бляшок (АБ) у каротидних артеріях [11–13], що є предиктором кардіоваскулярних подій серед пацієнтів із РА з відсутніми традиційними факторами ризику [14].
В умовах високого рівня коморбідності при РА у розвитку атеросклерозу у цих хворих також відіграють роль чинники, пов’язані із супутньою патологією. Так, у 2015 р. EULAR розробила нові рекомендації з оцінки та управління коморбідними станами у осіб із ревматологічними захворюваннями, підкреслюючи необхідність урахування всіх факторів, що призводять до атеросклеротичного ураження судин [15]. Останнім часом привертає увагу поєднання РА з АГ у зв’язку з високою частотою виявлення субклінічного атеросклерозу та підвищеним кардіоваскулярним ризиком [16].
Встановлено, що у хворих на АГ в поєднанні з РА частіше виявляють такі додаткові фактори ризику, як інсулінорезистентність (ІР), порушення обміну адипоцитокінів, ендотеліальна дисфункція, зміна пружно-еластичних властивостей судин та добового ритму артеріального тиску (АТ) [16–18]. Проте залишається маловідомим, які саме з наведених факторів мають переважний вплив на формування атеросклеротичного ураження судин в умовах поєднання РА з АГ, зокрема на розвиток АБ, та їх прогностичне значення. Тому мета проведеного нами дослідження — визначити взаємозв’язок між наявністю атеросклеротичного ураження каротидних судин та кардіоваскулярним ризиком, ІР, рівнем адипонектину у хворих на РА в поєднанні з АГ.
Об’єкт і методи дослідження
Обстежено 42 хворих (38 жінок, 4 чоловіки) віком 45–65 років (медіана — 54 [51; 60] років) з РА в поєднанні з АГ. До 1-ї групи порівняння увійшли 20 осіб з РА, до 2-ї групи порівняння — 20 пацієнтів із АГ, які були зіставними з основною групою за віком, тривалістю захворювання, гендерним складом.
Середня тривалість захворювання на АГ становила 8 [5; 10] років, РА — 7 [3; 10] років. Більшість хворих були серопозитивними за ревматоїдним фактором (РФ) — 35 (83,3%), позасуглобові прояви РА встановлені у 29 (69%) пацієнтів. Діагноз АГ встановлювали згідно з рекомендаціями Української асоціації кардіологів (2012). Діагноз РА встановлювали за класифікацією Асоціації ревматологів України (2002) та діагностичними критеріями ACR/EULAR (2010). Критерії включення: наявність веріфікованого діагнозу АГ I–II стадії 1-го і 2-го ступеня; наявність верифікованого діагнозу РА, DAS28 <3,2 бала, стабільно підібрана терапія РА (незмінна базисна терапія не менше 6 міс), вік 45–65 років, добровільна інформована згода на участь у дослідженні. Критерії виключення: активність РА DAS28 >3,2 бала, встановлений та верифікований діагноз ішемічної хвороби серця, АГ ІІІ стадії 3-го ступеня, хронічна серцева недостатність III–IV функціонального класу, ЦД, гіпотиреоз, швидкість клубочкової фільтрації (ШКФ) <60 мл/хв/1,73м, ожиріння 3–4-го ступеня.
Усім пацієнтам вимірювали зріст та масу тіла, окружність талії, розраховували індекс маси тіла (ІМТ) за стандартною формулою, ШКФ — за формулою CKD-EPI. Кардіоваскулярний ризик оцінювали відповідно до рекомендацій EULAR з управління серцево-судинним ризиком у пацієнтів з РА і запальним артритом за модифікованою шкалою mSCORE з використанням співвідношення загального холестерину (ЗХС) до холестерину ліпопротеїдів високої щільності (ХС ЛПВЩ) та врахуванням коефіцієнта 1,5 [7]. Вміст С-реактивного протеїну (СРП), ЗХС, тригліцеридів (ТГ), ХС ЛПВЩ в сироватці крові визначали імуноферментним методом. Кількісний вміст рівня адипонектину, інсуліну визначали в сироватці венозної крові методом імуноферментного аналізу за допомогою наборів реактивів AssayMax Human Adiponectin (ASSAYPRO, USA) і Insulin ELISA («DRG», Німеччина) відповідно. Нормою концентрації адипонектину в сироватці крові вважали 3–14 мкг/мл, інсуліну — 2–25 мкЕД/мл. Рівень ІР, функцію В-клітин підшлункової залози, чутливість периферичних тканин до інсуліну розраховували з використанням індексів HOMA1 за стандартною формулою (Bonora E., 1998), HOMA2 (Wallace T., 2004) за допомогою програми НОМА2 Calculator версії 2.2.2. Значення HOMA1-IR >2,77 і HOMA2-IR >1,00 свідчили про ІР. Застосування індексів HOMA1, НОМА2 зумовлено відсутністю чітких рекомендацій щодо використання конкретної моделі оцінки ІР у хворих на АГ в поєднанні з РА, а також можливими відмінностями результативності цих методик у зазначеній категорії пацієнтів.
Усім хворим визначали за допомогою еходопплера в 2D-, CFM-режимі імпульсним датчиком 12L (5–12 Мгц) функціональний стан ендотелію судин шляхом вимірювання ендотелійзалежної вазодилатації (ЕЗВД) за результатам проби з реактивною гіперемією за методикою, яку описав D. Celermajer. Нормою вважався приріст діаметра артерії на ≥10%. Визначення гомілково-плечового індексу тиску (ГПІ) проводили за стандартною методикою, показник <0,9 розцінювали як наявність гемодинамічно значущої патології артерій нижніх кінцівок.
Дуплексне дослідження екстракраніального відділу сонних артерій виконували згідно з рекомендаціями Американського товариства ехокардіографії (2005). Сканування проводили на апараті «Philips Envisor C» за наявності імпульсного кольорового допплера і тканинного допплера, використовували лінійні датчики 5; 7,5 мГц та конвексний датчик 3,5 мГц. Дослідження проводили в режимах: В-сканування, імпульсно-хвильової допплерографії та кольорового картування струму крові. Визначали звивистість судин, лінійну швидкість кровотоку, з аналізом структури стінок судин, товщини КІМ, наявності АБ, визначення ступеня стенозу. Наявність проявів субклінічного атеросклерозу встановлювали при потовщенні КІМ (>0,9 мм), візуалізації АБ — локальному чи пролонгованому потовщенні стінки артерії з боку її просвіту >1,3 мм або стенозу >20% від діаметра артерії. Також визначали пружно-еластичні властивості сонних артерій на підставі визначення діаметра загальної сонної артерії в систолу та діастолу, усередненої максимальної швидкості кровотоку по загальній сонній артерії: індекс жорсткості, коефіцієнт розтяжності, коефіцієнт піддатливості, модуль еластичності Петерсона, модуль пружності Юнга згідно з рекомендаціями Європейського товариства кардіологів (2006).
Добовий моніторинг АТ проводили у стаціонарних умовах за допомогою монітора АВРЕ-02 («Solvaig», Україна), вимірювання проводили кожні 15 хв у денний період та кожні 30 хв у нічний період. Аналіз отриманих результатів добового моніторингу АТ проводили за допомогою оригінальної комп’ютерної програми. Аналізували такі параметри: середньодобові, середньоденні, середньонічні значення систолічного (САТ), діастолічного АТ (ДАТ), ступінь нічного зниження АТ (СНЗ АТ), денна та нічна варіабельність САТ (ВСАТ) і ДАТ (ВДАТ). При проведенні дослідження користувалися нормативними значеннями АТ, рекомендованими Європейським товариством кардіологів (2013) та Асоціацією кардіологів України (2012).
І стадію АГ встановлено у 7 (16,7%) хворих, II стадію — у 35 (83,3%), 1-й ступінь АГ — у 13 (31%) пацієнтів, 2-й ступінь — у 29 (69,1%). Медіана САТ становила 136,5 [131,5; 142,9] мм рт. ст., ДАТ — 77,98 [74,1; 83,4] мм рт. ст, показник активності РА за шкалою DAS28 — 2,6 [2,1; 2,9] бала, медіана рівня СРП у сироватці крові — 6,6 [4,9; 9,7].
Лікування антигіпертензивними препаратами отримував 31 (73,81%) хворий на РА із супутньою АГ, з них 17 (54,84%) отримували лікування постійно, 14 (45,16%) хворих — епізодично (за результатами аналізу амбулаторних карт). Більшість хворих отримували інгібітори ангіотензинперетворювального ферменту — 22 (70,97%), сартани застосовували 6 (19,35%) хворих, блокатори бета-адренорецепторів — 4 (12,9%), діуретики — 8 (25,81%). Як базисну терапію при РА метотрексат отримував 21 (50%) хворий, лефлуномід — 6 (14,29%), сульфасалазин — 2 (4,76%), середня доза метотрексату становила 15 [10; 15] мг/тиж, середня тривалість лікування метотрексатом — 5,5 [4; 7,5] року. Глюкокортикостероїди (ГКС) отримували 28 (66,7%) хворих, середня добова доза за метилпреднізолоном на момент дослідження становила 6 [4; 6] мг, середня тривалість глюкокортикоїдної терапії — 5 [2,5; 7,75] років.
Залежно від наявності атеросклеротичного ураження каротидних судин пацієнти з РА із супутньою АГ були розподілені на три групи. До 1-ї групи увійшли 23 (54,8%) хворих з наявністю АБ і товщиною КІМ >0,9 мм, до 2-ї — 8 (19%) зі збільшенням КІМ та відсутніми АБ. До 3-ї групи увійшли 11 (26,2%) хворих із відсутністю атеросклеротичних змін каротидних судин за даними УЗД.
Статистичне оброблення отриманих даних проводили з використанням ліцензійної програми STATISTICA 6.1, SPSS версії 22.0 та Microsoft Excel 2013. Враховуючи характер розподілу даних, використовували непараметричні методи статистики — кількісні ознаки представлено у вигляді медіани (Ме) та меж інтерквартильного інтервалу [25%; 75%]. Для порівняння показників у двох незалежних групах використовували U-критерій Манна — Уїтні та χ Пірсона — для порівняння відносних показників. Для порівняння показників у всіх трьох групах використовували множинне порівняння за однофакторним дисперсійним аналізом Крускала — Уолліса (Kruskal — Wallis ANOVA). Оцінку ступеня взаємозв’язку між парами незалежних ознак, виражених у кількісній величині, проводили за допомогою коефіцієнта рангової кореляції P. Spearman — R. Окрім того, для визначення незалежності показників проводили уні- та мультиваріантний (binary logistic) регресійний аналіз. Для визначення діагностичної ефективності адипонектину та індексів ІР використовували ROC-аналіз, розраховуючи площу під ROC-кривою (AUROC). Статистично значущі відмінності результатів досліджень визначали при рівні p<0,05.
Результати та їх обговорення
За результатами проведеного УЗД каротидних судин визначено атеросклеротичні зміни у 33 (78,6%) пацієнтів із РА в поєднанні з АГ, у 10 (50%) та 12 (60%) хворих груп порівняння — групи РА та групи АГ відповідно. Серед пацієнтів основної групи наявність АБ встановлено у 23 (54,8%), потовщення КІМ за відсутності АБ — у 8 (19%), не виявлено атеросклеротичних змін каротидних судин у 11 (26,2%) осіб із АГ в поєднанні з РА. Двобічне атеросклеротичне ураження сонних артерій виявлено у 8 (34,8%) пацієнтів, множинне однобічне — у 1 (4,3%) хворого. Більшість пацієнтів із РА в поєднанні з АГ мали ущільнені АБ — 18 (78,3%), АБ з нерівним краєм — у 5 (21,7%), кальциновані АБ виявлено у 3 (13%) хворих. Серед пацієнтів 1-ї та 2-ї груп порівняння встановлено АБ серед 5 (25%) та 8 (40%) хворих відповідно (p<0,05), при цьому переважали ущільнені АБ — у 4 (80%) та 8 (100%) хворих відповідно. Більш висока частота виявлення АБ у хворих на РА в поєднанні з АГ також залишалася статистично достовірною з урахуванням кількості традиційних факторів кардіоваскулярного ризику.
Атеросклеротичні зміни артерій нижніх кінцівок (ГПІ <0,9) встановлено серед 18 (42,9%) хворих основної групи, 6 (30%) та 7 (35%) пацієнтів 1-ї та 2-ї груп порівняння відповідно. Поєднання ознак атеросклерозу магістральних та периферичних артерій відзначали у 16 (38,1%) хворих із поєднанням РА та АГ, серед пацієнтів груп порівняння — лише у 3 (15%) та 5 (25%) відповідно. Таким чином, у хворих на РА в поєднанні з АГ частіше спостерігались ознаки атеросклеротичних змін басейнів каротидних судин та артерій нижніх кінцівок та їх поєднання порівняно з пацієнтами контрольних груп. При цьому більшість хворих на РА в поєднанні з АГ мали атеросклеротичні зміни саме каротидних артерій, що на 30,9% частіше порівняно з атеросклеротичними змінами периферичних артерій (p<0,05). Водночас медіана показника кардіоваскулярного ризику за шкалою SCORE у хворих на РА в поєднанні з АГ становила 4 [1,0; 5,5]%, кількість хворих із низьким рівнем ризику — 12 (28,6%), із середнім — 17 (40,4%), з високим і дуже високим — 13 (31%). Отримані результати, можливо, свідчать про важливість додаткових факторів у формуванні загального кардіоваскулярного ризику, а також зумовлюють детальний аналіз традиційних факторів та пошук нових маркерів атеросклеротичного ураження судин у цих хворих.
Серед основних факторів кардіоваскулярного ризику, окрім АГ, одним із найбільш розповсюджених було ожиріння та збільшена маса тіла — у 17 (40,5%) та 17 (40,5%) хворих відповідно, лише у 8 (19,0%) пацієнтів був нормальний ІМТ (медіана становила 28,1 [26; 33,1] кг/м). При цьому групи хворих за показником ІМТ достовірно не відрізнялись (при всіх порівняннях р>0,05). Абдомінальна форма ожиріння встановлена у більшості хворих — 37 (88,1%), медіана окружності талії була достовірно вище у хворих із виявленими АБ порівняно з пацієнтами, в котрих не було атеросклеротичних змін (табл. 1). Встановлений прямий кореляційний зв’язок між показником окружності талії та активністю РА за DAS28 — r=0,31; р<0,05.
| Показник | Група | р* | ||
|---|---|---|---|---|
| 1-ша (n=23) | 2-га (n=8) | 3-тя (n=11) | ||
| Середній вік, років | 55 [51,5; 62] рІІІ |
53,5 [47,5; 57,8] | 51 [47,5; 54,5] рІ | 0,116 |
| Тривалість захворювання АГ, років | 10 [8; 14,3] рІІ, рІІІ |
5 [5; 6,3] рІ | 5 [4,5; 5] рІ | 0,003 |
| ІМТ, кг/м | 28,3 [26,2; 33,3] | 30,0 [24,9; 35,2] | 27,9 [26,1; 30,5] | 0,715 |
| Окружність талії, см* | 100 [94; 109] рІІІ |
101 [93; 107,8] | 91 [85,5; 93] рІ | 0,071 |
| ЗХС, ммоль/л | 6,0 [5,2; 6,5] рІІІ |
5,0 [4,4; 5,5] | 4,7 [4,4; 5,2] рІ | 0,032 |
| ТГ, ммоль/л | 1,8 [1,4; 2,0] рІІІ |
1,7 [1,3; 2,1] | 1,1 [1,0; 1,6] рІ | 0,022 |
| ХС ЛПНЩ**, ммоль/л | 4,0 [3,2; 4,6] рІІІ | 2,9 [2,2; 3,7] | 2,9 [2,1; 3,0] рІ | 0,014 |
| ХС ЛПВЩ, ммоль/л | 1,0 [0,9; 1,5] рІІІ | 1,2 [0,9; 1,6] | 1,6 [1,4; 1,7] рІ | 0,064 |
| ХС ЛПДНЩ***, ммоль/л | 0,8 [0,6; 0,9] рІІІ | 0,8 [0,6; 1,0] | 0,5 [0,4; 0,7] рІ | 0,023 |
| Ризик фатальних ССЗ за шкалою SCORE з урахуванням коефіцієнта 1,5 | 4,5 [4; 6] рІІІ | 3,8 [3,0; 6,4] рІІІ | 0,9 [0,6; 2,2] рІ, рІІ | 0,0001 |
| Тривалість РА | 10 [5; 12] | 6 [2,8; 8,8] | 3 [1,5; 5,5] | 0,072 |
| ШКФ | 92 [79; 102] | 99 [90,3; 104] | 96,5 [91,8; 106,5] | 0,383 |
| РФ | 74,2 [35,9; 93,4] | 68,1 [51,5; 75,8] | 47,2 [19,5; 67,7] | 0,289 |
| Сечова кислота | 294,5 [249,8; 345] рІІІ | 243,5 [233,8; 288,3] | 255 [219; 284] рІ | 0,091 |
| Метотрексат | 11 (47,8%) | 4 (50%) | 6 (54,5%) | – |
| Метотрексат, середня доза | 15 [15; 15] рІІІ | 10 [7,5; 12,5] | 10 [9,4; 15] рІ | 0,092 |
| Середня тривалість, міс | 7,5 [4,3; 8,0] рІІІ | 5 [4,5; 6,5] | 4 [2; 5] рІ | 0,094 |
| ГКС | 18 (78,3%) | 5 (62,5%) | 5 (45,5%) | – |
| Доза метилпреднізолону, мг | 6 [4; 6] рІІІ | 6 [4; 10] | 4 [2; 4,5] рІ | 0,083 |
| Середня тривалість, міс | 6 [4,0; 8,0] рІІІ | 5 [4; 6] | 3 [2; 4] рІ | 0,075 |
У табл. 1–3: *достовірність відмінностей за критерієм Крускала — Уолліса, в інших випадках — за критерієм Манна — Уїтні (р<0,05). Тут і далі: **ліпопротеїди низької щільності; ***ліпопротеїди дуже низької щільності.
Пацієнти з наявними АБ мали достовірно вищі показники медіани віку, тривалості захворювання, ризику фатальних ССЗ за шкалою SCORE, рівня сечової кислоти (див. табл. 1). Аналізуючи взаємозв’язок між отримуваним лікуванням стосовно РА та наявністю атеросклеротичного ураження каротидних артерій, встановлено, що хворі 1-ї групи мали достовірно вищі показники середньої дози та тривалості застосування метотрексату, ГКС, що імовірно пов’язано не лише з безпосереднім медикаментозним впливом, але й зі зв’язком із тривалістю захворювання РА та його перебігом, що потребувало призначення вищих доз зазначених препаратів (див. табл. 1).
Частота виявлення тютюнопаління була низькою — 7 (16,67%) хворих та достовірно не відрізнялася в обстежених хворих — 4 (17,4%), 1 (12,5%), 2 (18,2%) для 1-, 2- та 3-ї груп відповідно (р>0,05). Підвищені рівні ТГ, ХС ЛПНЩ та ЗХС відзначали у 17 (40,48%), 24 (57,14%) та у 21 (50%) хворих відповідно, знижений рівень ХС ЛПВЩ встановлено у 18 (42,86%) хворих на РА в поєднанні з АГ. Пацієнти 1-ї групи мали достовірно вищі показники рівня ЗХС, ТГ, ЛПНЩ, ЛПДНЩ та нижчий рівень ЛПВЩ (див. табл. 1). Серед хворих із виявленими АБ також встановлено достовірно більшу частоту виявлення гіперхолестеринемії (17 хворих (73,9%)), гіпертригліцеридемії (14 хворих (60,9%)) порівняно з 2-ю групою (2 (25%) та 4 (50%) хворих відповідно; р<0,05) та 3-ю групою (3 (27,3%) та 1 (9%) хворих відповідно; р<0,05). Також слід відзначити, що при проведенні дисперсійного аналізу виявлено достовірні відмінності майже за всіма показниками ліпідного спектра у пацієнтів з РА в поєднанні з АГ (див. табл. 1).
Пацієнти зі встановленими атеросклеротичними змінами каротидних артерій мали достовірно вищі показники активності захворювання за шкалою DAS28 (р=0,0007), рівня концентрації СРП у сироватці крові (р=0,008) (рис. 1). Встановлено позитивні кореляційні зв’язки між рівнем СРП, активністю запалення за шкалою DAS28 та показником товщини КІМ (рис. 2). Це відповідає даним літератури щодо ключової ролі запалення в прогресуванні атеросклеротичного ураження судин при РА [5].
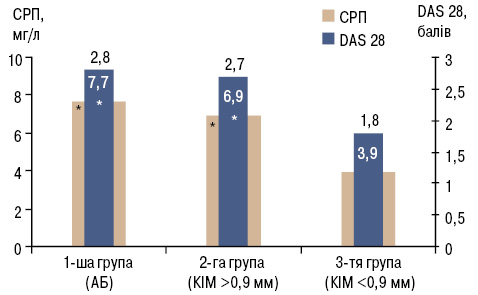
*р<0,05 порівняно з 3-ю групою (за критерієм Манна —Уїтні).
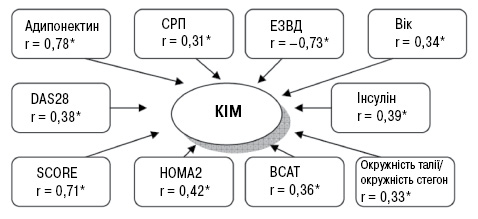
ІР виявлено у 21 (50%) та 36 (85,7%) обстежених хворих за індексами НОМА1-IR та НОМА2-IR, медіана становила 3,3 [2,6; 5,5] та 1,8 [1,5; 2,8] відповідно. Наявність атеросклеротичних змін у хворих на РА в поєднанні з АГ асоціювалася з підвищеними рівнями інсуліну крові, індексів ІР (табл. 2). Групи дослідження достовірно відрізнялися саме за показником HOMA2-%S, що свідчить про переважну роль зниження чутливості до інсуліну у формуванні ІР у хворих на РА в поєднанні з АГ. Встановлені прямі кореляційні зв’язки між індексом НОМА2 і товщиною КІМ (r=0,42; р<0,05), ІМТ (r=0,44; р<0,05), показником окружності талії (r=0,57, р<0,05), тривалістю застосування ГКС (r=0,41; р<0,05), індексом жорсткості (r=0,39; р<0,05), модулем Петерсона (r=0,50; р<0,05), модулем Юнга (r=0,45; р<0,05) та зворотний кореляційний зв’язок з показником ЕЗВД (r=–0,37; р<0,05), коефіцієнтом розтяжності (r=0,41; р<0,05).
атеросклеротичного ураження сонних артерій
| Показник | Група | р* | ||
|---|---|---|---|---|
| 1-ша (n=23) | 2-га (n=8) | 3-тя (n=11) | ||
| Рівень інсуліну, мкод/мл | 20,3 [12,8; 24,7] рІІІ | 18,6 [14,5; 22,8] рІІІ | 11,8 [11,4; 12,5] рІ, рІІ | 0,014 |
| НОМА1-IR | 4,4 [2,7; 5,6] рІІІ | 5,1 [3,8; 6,5] | 2,7 [2,5; 2,8] рІ | 0,051 |
| НОМА2-IR | 2,6 [1,6; 3,2] рІІІ | 2,5 [1,9; 3,0] рІІІ | 1,5 [1,4; 1,6] рІ, рІІ | 0,011 |
| HOMA2-%B | 168,8 [122,2; 221,7] | 135,1 [88,4; 185,1] рІІІ | 135,8 [111,4; 155,8] рІІ | 0,230 |
| HOMA2-%S | 38,7 [32,0; 57,3] рІІІ | 39,9 [34,6; 51,5] рІІІ | 66 [63,2; 67,2] рІ, рІІ | 0,014 |
При аналізі пружно-еластичних властивостей каротидних артерій встановлено, що всі виділені групи достовірно відрізнялися за визначеними показниками (табл. 3). Так, хворі з ознаками субклінічного атеросклерозу мали достовірно вищі значення індексу жорсткості, модулів Петерсона, Юнга та водночас нижчий показник коефіцієнту розтяжності. При цьому встановлено прямі кореляційні зв’язки між індексом жорсткості та рівнем активності запалення за індексом DAS28 (r=0,38; р<0,05), рівнем кардіоваскулярного ризику за SCORE (r=0,33; р<0,05), віком (r=0,33; р<0,05), тривалістю захворювання АГ (r=0,36; р<0,05), рівнем СРП (r=0,39; р<0,05), співвідношенням окружності талії до окружності стегон (r=0,31; р<0,05), товщиною КІМ (r=0,58; р<0,05). Коефіцієнт розтяжності у хворих на РА в поєднанні з АГ зворотно корелював із товщиною КІМ (r=–0,53; р<0,05), рівнем кардіоваскулярного ризику за SCORE (r=–0,60; р<0,05), тривалістю захворювання АГ (r=–0,35; р<0,05), рівнем СРП (r=–0,32; р<0,05), тривалістю терапії ГКС (r=–0,33; р<0,05).
| Показник | Група | р* | ||
|---|---|---|---|---|
| 1-ша(n=23) | 2-га(n=8) | 3-тя(n=11) | ||
| Індекс жорсткості зліва, ум. од. | 5,1 [4,7; 5,4] рІІІ * | 4,7 [4,6; 4,8] рІІІ * | 4,1 [3,8; 4,3] рІ *, рІІ * | р<0,001 |
| Індекс жорсткості справа, ум.о д. | 4,9 [4,4; 5,3] рІІІ * | 4,5 [4,4; 4,6] рІІІ * | 4,1 [3,9; 4,2] рІ *, рІІ * | р<0,001 |
| Коефіцієнт розтяжності зліва, 10 мм рт. ст. | 4,5 [4,1; 5,4] рІІІ * | 4,3 [4,2; 4,4] рІІІ * | 5,9 [5,7; 6,2] рІ *, рІІ * | р<0,001 |
| Коефіцієнт розтяжності справа, 10 мм рт. ст. |
4,7 [4,3; 5,2] рІІІ * | 4,5 [4,4; 4,6] рІІІ * | 5,8 [5,8; 6,2] рІ *, рІІ * | р=0,007 |
| Модуль Петерсона зліва, мм рт. ст. | 487 [476; 503] рІІІ *, рІІ | 453,5 [450,5; 458] рІ, рІІІ * | 399 [387,5; 414] рІ *, рІІ * | р<0,001 |
| Модуль Петерсона справа, мм рт. ст. | 483 [459; 491] рІІІ *, рІІ | 449,5 [441,8; 451] рІ, рІІІ * | 395 [385,5; 415] рІ *, рІІ * | р=0,002 |
| Модуль Юнга зліва, мм рт. ст. | 1578 [1567,5; 1590] рІІІ *, рІІ * | 1504,5 [1503,3; 458] рІ *, рІІІ * | 1156 [1112,5; 1223] рІ *, рІІ * | р<0,001 |
| Модуль Юнга справа, мм рт. ст. | 1568 [1541,5; 1581] рІІІ *, рІІ | 449,5 [441,8; 1507,8] рІ, рІІІ * | 1168 [1120,5; 1227] рІ *, рІІ * | р=0,005 |
У більшості хворих на РА в поєднанні з АГ виявлено ендотеліальну дисфункцію — 31 (73,8%), медіана ЕЗВД становила 4,9 [3,3; 10,0]%. Усі групи дослідження достовірно відрізнялися за показником ЕЗВД як при дисперсійному аналізі (р=0,0002), так і при попарному зіставленні (рис. 3). Показник ЕЗВД мав кореляційні зв’язки з рівнем кардіоваскулярного ризику за SCORE (r=–0,68; р<0,05), тривалістю захворювання АГ (r=–0,39; р<0,05), показником співвідношення окружності талії до окружності стегон (r=–0,48; р<0,05), рівнем ШКФ (r=0,36; р<0,05), товщиною КІМ (r=–0,73; р<0,05), індексом жорсткості (r=–0,59; р<0,05), коефіцієнтом розтяжності (r=–0,56; р<0,05), модулем Петерсона (r=–0,76; р<0,05), модулем Юнга (r=–0,70; р<0,05).
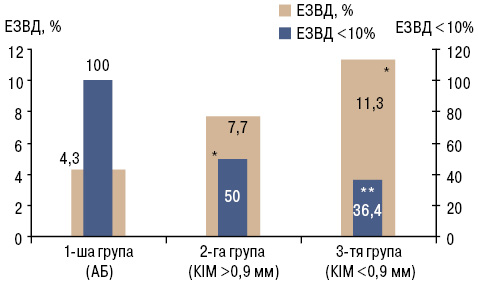
*р<0,05 порівняно з 1-ю групою (за критерієм Манна — Уїтні);
**р<0,05 порівняно з 1-ю групою (за критерієм χ Пірсона).
Медіана концентрації адипонектину в сироватці крові серед обстежених хворих становила 13,8 [12,5; 14,8] мкг/мл, при цьому цей показник достовірно був вищим у пацієнтів із субклінічним атеросклерозом порівняно з тими, у кого атеросклеротичних змін не виявлено (p<0,05, рис. 4), при проведенні дисперсійного аналізу достовірність відмінностей між групами становила р=0,001. Підвищений рівень адипонектину в сироватці крові встановлено у 18 (42,9%) пацієнтів з РА в поєднанні з АГ, переважно серед хворих 1-ї групи (див. рис. 4), зниження рівня адипонектину нижче норми не відзначено у жодного пацієнта. Рівень адипонектину в сироватці крові корелював із товщиною КІМ (r=0,78; р<0,05), індексом DAS28 (r=0,41; р<0,05), рівнем кардіоваскулярного ризику за SCORE (r=0,44; р<0,05), рівнем РФ (r=0,40; р<0,05), інсуліну (r=0,33; р<0,05), показником співвідношення окружності талії до окружності стегон (r=0,33; р<0,05), індексом НОМА2 (r=0,33; р<0,05), показником ЕЗВД (r=–0,47; р<0,05), індексом жорсткості (r=0,45; р<0,05), коефіцієнтом розтяжності (r=–0,35; р<0,05), модулем Петерсона (r=0,45; р<0,05), модулем Юнга (r=0,35; р<0,05), показником ГПІ (r=–0,52; р<0,05). За результатами регресійного аналізу серед факторів, що асоціювались із гіперадипонектинемією, були ІР (відношення ризиків (OR) =1,354; р=0,04; 95% довірчий інтервал (CI) 0,70–2,6), активність РА за DAS28 (OR=2,037; р=0,049; 95% CI 0,50–8,3), тривалість застосування ГКС (OR=0,888; р=0,048; 95% CI 0,76–1,05).
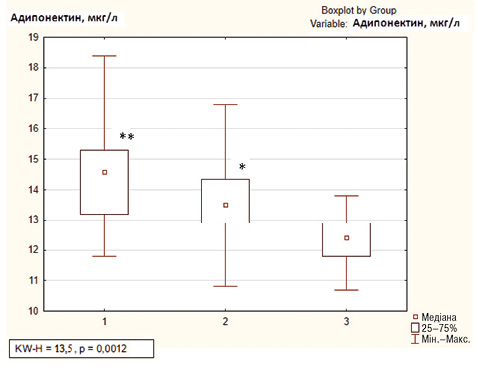
*р<0,05 порівняно з 3-ю групою (за критерієм Манна — Уїтні); **р<0,001 порівняно з 3-ю групою (за критерієм Манна — Уїтні).
Серед обстежених хворих підвищення ВСАТ та ВДАТ спостерігалось у 32 (76,19%) та 29 (69,05%) відповідно, профіль АТ «нон-дипер» діагностовано у 21 (50%) пацієнта, «дипер» — у 16 (38,1%), «найтпікер» — у 3 (7,14%), «овер-дипер» — у 2 (4,76%). При цьому хворі 1-ї групи мали достовірно вищий показник ВСАТ порівняно із 3-ю групою — 15,6 [12,5; 17,3] мм рт. ст. та 8,8 [7,7; 10,3] мм рт. ст. відповідно (p<0,05). Медіана ступеня зниження систолічного тиску у пацієнтів із виявленими АБ становила 9,5 [8,6; 11,0]% та була достовірно нижчою порівняно з показником у групі хворих без субклінічного атеросклерозу — 14 [12; 15]%; p<0,05. Аналізуючи структуру типів добового профілю АТ у хворих на РА в поєднанні з АГ встановлено, що пацієнти зі встановленими атеросклеротичними змінами переважно мали добовий профіль АТ «нон-дипер» — у 16 (69,7%), в той час серед хворих із відсутніми проявами субклінічного атеросклерозу нон-дипером був лише 1 (9,1%) пацієнт (p<0,05).
При проведенні регресійного аналізу встановлено, що ендотеліальна дисфункція була фактором, що асоціюється з наявністю АБ у хворих на АГ в поєднанні з РА: OR=1,467; р=0,004; 95% CI 1,14–1,90. Фактори ризику, що також асоціювалися з наявністю АБ в обстежених пацієнтів, наведено в табл. 4. Порушення пружно-еластичних властивостей каротидних артерій, вік, ІР, гіперадипонектинемія, тривалість застосування ГКС мали найбільший достовірний зв’язок із наявністю АБ у хворих на АГ у поєднанні з РА. Водночас у пацієнтів із РА найбільш значущими факторами, що асоціювалися із субклінічними проявами атеросклерозу, були рівень адипонектину (OR=1,250; р=0,049; 95% CI 0,94–1,65), ІМТ (OR=0,734; р=0,048; 95% CI 0,50–1,08) і тривалість захворювання РА (OR=0,831; р=0,04; 95% CI 0,67–1,04). При ізольованій АГ встановлено достовірний зв’язок між наявністю атеросклеротичного ураження каротидних артерій та віком (OR=0,781; р=0,023; 95% CI 0,59–1,03), рівнем ХС ЛПНЩ (OR=0,677; р=0,011; 95% CI 0,59–1,01), коефіцієнтом розтяжності (OR=0,789; р=0,011; 95% CI 0,76–1,0). Зазначені результати створили передумови для оцінки діагностичної ефективності адипонектину та ІР у хворих на РА в поєднанні з АГ. Для цього нами використано ROC-аналіз (рис. 5), за результатами якого констатовано хорошу якість діагностичної моделі, оскільки AUROC для адипонектину становила 0,787 (95% ДІ 0,642–0,932; р<0,05) та 0,700 (95% CI 0,536–0,864; р<0,05) для індексу ІР НОМА2.
при РА в поєднанні з АГ
(за результатами логістичної регресії)
| Фактор | OR (95% CI) |
р |
|---|---|---|
| Вік, років | 0,891 (0,89–0,99) | 0,046 |
| Кардіоваскулярний ризик за шкалою mSCORE, % | 0,722 (0,55–0,94) | 0,017 |
| Активність РА за шкалою DAS28, бали | 0,597 (0,15–2,31) | 0,036 |
| ІР за індексом НОМА2 | 0,910 (0,82–1,00) | 0,034 |
| Рівень адипонектину, мкг/мл | 0,472 (0,27–0,83) | 0,001 |
| ВСАТ, мм рт.ст. | 0,816 (0,69–0,97) | 0,019 |
| Тривалість захворювання на АГ, роки | 0,724 (0,57–0,91) | 0,007 |
| Тривалість застосування ГКС, роки | 0,825 (0,68–1,00) | 0,027 |
| Коефіцієнт розтяжності, 10 мм рт. ст. |
2,566 (1,10–6,00) | 0,025 |
| ЗХС, ммоль/л | 0,462 (0,23–0,91) | 0,027 |
| ЛПНЩ, ммоль/л | 0,413 (0,21–0,83) | 0,010 |
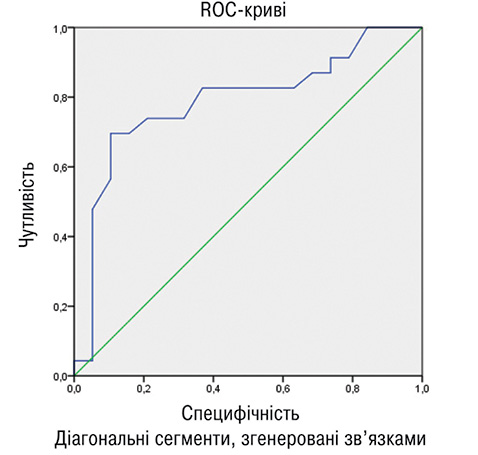
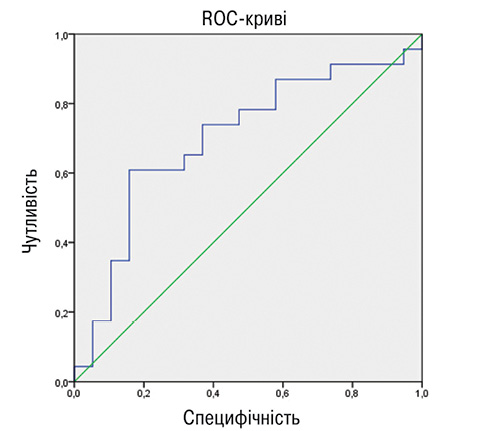
Таким чином, на відміну від хворих з ізольованими АГ та РА, при поєднанні зазначених нозологій спостерігається підвищення частоти субклінічних ознак атеросклерозу, зокрема найбільш агресивних його проявів — АБ з ознаками нестабільності. Ймовірно, це пов’язано, з одного боку, із нагромадженням факторів ризику в умовах коморбідного перебігу, але з іншого — простежується вплив специфічних чинників при поєднанні РА та АГ, зокрема підвищеного рівня адипонектину, ІР. Асоціативний зв’язок між наявністю атеросклеротичного ураження судин із підвищенням рівня адипонектину у хворих на АГ в поєднанні з РА не співвідноситься з даними, отриманими для загальної популяції [19]. Слід зазначити, що схожі дані отримані Patrick H. Dessein та співавторами у пацієнтів з ізольованим РА [20]. Можливо, це свідчить про нелінійний характер взаємозв’язку між атеросклеротичним ураженням судин та рівнем циркулюючого адипонектину в умовах поєднаного перебігу РА та АГ, що потребує подальшого детального вивчення. Також відзначали вплив ІР на підвищення рівня адипонектину, що свідчить про складні та, можливо, специфічні для поєднання РА і АГ взаємозв’язки між обміном м’язової та жирової тканини, що також потребує подальшого дослідження.
Висновки
1. В умовах коморбідного поєднання РА та АГ достовірно частіше відзначають ознаки атеросклеротичних змін каротидних артерій порівняно із групами порівняння, водночас при оцінці кардіоваскулярного ризику за модифікованою шкалою SCORE лише у 13 (31%) хворих встановлено високий та дуже високий ризик. У хворих на РА в поєднанні з АГ виявлено вищу частоту наявності АБ, переважно в басейні каротидних артерій, в тому числі нестабільних за структурою.
2. Наявність АБ у хворих на РА в поєднанні з АГ асоціюється з добовим профілем АТ «нон-дипер», ендотеліальною дисфункцією, активністю РА.
3. Встановлено, що визначення рівня адипонектину може бути додатковим маркером атеросклеротичного ураження у хворих на РА в поєднанні з АГ, збільшення якого поряд із ІР асоціювалося з наявністю АБ у цієї категорії хворих.
Список використаної літератури
- 1. Kitas G.D., Gabriel S.E. (2011) Cardiovascular disease in rheumatoid arthritis: state of the art and future perspectives. Ann. Rheum. Dis., 70: 8–14.
- 2. Gabriel S.E. (2010) Heart disease and rheumatoid arthritis: understanding the risks. Ann. Rheum. Dis., 69: 61–64.
- 3. Peters M.J. (2009) Does rheumatoid arthritis equal diabetes mellitus as an independent risk factor for cardiovascular disease? A prospective study. Arthritis Rheum., 61(11): 1571–1579.
- 4. Solomon D.H., Curhan G.C., Rimm E.B. et al. (2004) Cardiovascular risk factors in women with and without rheumatoid arthritis. Arthritis Rheum., 50: 3444–3449.
- 5. del Rincon I., Williams K., Stern M.P. et al. (2003) Association between carotid atherosclerosis and markers of inflammation in rheumatoid arthritis patients and healthy subjects. Arthritis Rheum., 48: 1833–1840.
- 6. Kitas G.D., Gabriel S.E. (2011) Cardiovascular disease in rheumatoid arthritis: state of the art and future perspectives. Ann. Rheum. Dis., 70: 8–14.
- 7. Peters M.J., Symmons D.P., McCarey D. (2010) EULAR evidence-based recommendations for cardiovascular risk management in patients with rheumatoid arthritis and other forms of inflammatory arthritis. Ann. Rheum. Dis., 69: 325–331.
- 8. Semb Anne Grete et al. (2014) Cardiovascular disease assessment in rheumatoid arthritis: a guide to translating knowledge of cardiovascular risk into clinical practice. Ann. Rheum. Dis., 73: 1284–1288.
- 9. Mitchel L. Zoler (2015) EULAR updates cardiovascular-disease risk recommendations. Expert analysis from the EULAR 2015 Annual Congress on June 19, 2015.
- 10. Chambless L. et al. (1997) Association of coronary heart disease incidence with carotid arterial wall thickness and major risk factors: the Atherosclerosis Risk in Communities (ARIC) Study, 1987–1993. Am. J. Epidemiol., 146(6): 483–494.
- 11. Jonsson S.W. et al. (2001) Increased prevalence of atherosclerosis in patients with medium term rheumatoid arthritis. J. Rheumatol., 28(12): 2597–2602.
- 12. Kumeda Y. et al. (2002) Increased thickness of the arterial intima-media detected by ultrasonography in patients with rheumatoid arthritis. Arthritis Rheum., 46(6): 1489–1497.
- 13. Park Y.B. et al. (2002) Atherosclerosis in rheumatoid arthritis: morphologic evidence obtained by carotid ultrasound. Arthritis Rheum., 46(7): 1714–1719.
- 14. Evans M.R. et al. (2011) Carotid atherosclerosis predicts incident acute coronary syndromes in rheumatoid arthritis. Arthritis Rheum., 63(5): 1211–1220.
- 15. Mitchel L. Zoler (2015) Reccomendation focus on comorbidity management. Expert analysis from the EULAR 2015 Annual Congress on June 19, 2015.
- 16. Курята О.В., Сіренко О.Ю. (2014) Субклінічні прояви атеросклерозу, функціональний стан ендотелію та жорсткість судин у хворих на артеріальну гіпертензію в поєднанні з ревматоїдним артритом. Актуальні проблеми сучасної медицини: Вісн. Укр. мед. стоматол. акад., Т. 14, № 3 (47): 89–96.
- 17. Курята О.В., Сіренко О.Ю. (2015) Добовий профіль артеріального тиску, ліпідний спектр крові у хворих на артеріальну гіпертензію в поєднанні з ревматоїдним артритом та ефективність застосування аторвастатину. Сімейна медицина, 3(59): 155–159.
- 18. Курята А.В., Сиренко О.Ю. (2014) Уровень инсулинорезистентности, адипонектина у больных с артериальной гипертензией в сочетании с ревматоидным артритом, их динамика в условиях коррекции эндотелиальной дисфункции. Медицина, 2(152): 28–33.
- 19. Dalibor Novotný, Helena Vaverková and David Karásek (2012) Adiponectin: a perspective adipose tissue marker with antiinflammatory and antiaterogenic potencial, lipoproteins — role in health and diseases. Gerhard Kostner (Ed.), InTech, DOI: 10.5772/47754.
- 20. Dessein H. Patrick, Woodiwiss J. Angela, Norton R. Gavin et al. (2013) Independent associations of total and high molecular weight adiponectin with cardiometabolic risk and surrogate markers of enhanced early atherogenesis in black and white patients with rheumatoid arthritis: a cross-sectional study. Arthritis Research & Therapy, 15: 128.
Субклинический атеросклероз и кардиоваскулярный риск, инсулинорезистентность, уровень адипонектина при сочетании ревматоидного артрита с артериальной гипертензией
Резюме. Обследовано 42 больных (38 женщин, 4 мужчины) в возрасте 45–65 лет (медиана — 54 [51, 60] лет) с ревматоидным артритом (РА) в сочетании с артериальной гипертензией (АГ). Всем пациентам проводили общеклиническое обследование, ультразвуковое исследование каротидных сосудов с определением толщины комплекса интима-медиа, упруго-эластичных свойств, определение эндотелиальной дисфункции, липидного спектра крови, уровня инсулина, адипонектина, расчет индексов инсулинорезистентности, также проводили суточное мониторирование артериального давления. Определены атеросклеротические изменения у 33 (78,6%) пациентов с РА в сочетании с АГ, что достоверно чаще, чем в группах сравнения. У больных основной группы установлено достоверно более высокую частоту выявления атеросклеротических бляшек — у 23 (54,8%), в том числе нестабильных по структуре — у 5 (21,7%) по сравнению с группами сравнения. Наличие атеросклеротических бляшек у больных АГ в сочетании с РА ассоциировалось с эндотелиальной дисфункцией, нарушением упруго-эластичных свойств каротидных артерий, возрасту, гиперинсулинемией, гиперадипонектинемией, продолжительностью применения глюкокортикоидов. Для адипонектина и индекса НОМА2 AUROC составила 0,787 (95% CI 0,642–0,932; р<0,05) и 0,700 (95% CI 0,536–0,864; р<0,05) соответственно, что свидетельствует о высоком качестве диагностических моделей. Следовательно, у больных РА в сочетании с АГ достоверно чаще определяют признаки атеросклеротических изменений каротидных артерий по сравнению с группами сравнения, что требует более жесткого контроля факторов кардиоваскулярного риска. Определение уровня адипонектина и инсулинорезистентности может быть дополнительными маркерами атеросклеротического поражения у этих больных.
артериальная гипертензия, ревматоидный артрит, кардиоваскулярный риск, субклинический атеросклероз, адипонектин, инсулинорезистентность.
Адреса для листування:
Курята Олександр Вікторович
49000, Дніпропетровськ,
вул. Володимира Вернадського, 9
ДЗ «Дніпропетровська медична
академія МОЗ України»
Сіренко Оксана
E-mail: oksanasirenko@i.ua
Слияние «Pfizer» и «Allergan» — путь к созданию крупнейшей фармацевтической компании мира
По материалам http://www.allergan.com
Компании «Pfizer Inc.» и «Allergan plc» заключили окончательное соглашение о слиянии, в результате которого будет создана крупнейшая в мире фармацевтическая и биотехнологическая компания. Стоимость сделки по слиянию и поглощению (mergers and acquisitions — M&A) оценивают в 160 млрд дол. США; стоимость ценных бумаг «Allergan» — в 363,63 дол. за акцию. Акционеры «Pfizer» получат по 1 акции новой компании за каждую имеющуюся у них акцию, при этом акционеры «Allergan» получат 11,3 акции. Планируют завершить сделку во второй половине 2016 г. Технически M&A-сделка будет структурирована как обратное слияние, в рамках которого «Allergan» покупает более крупную по размеру «Pfizer» — это рекордная корпоративная инверсия, позволяющая «Pfizer» сменить налоговую юрисдикцию и в результате — существенно снизить налоговую нагрузку. Ожидается, что слияние компаний «Pfizer» и «Allergan» приведет к созданию крупнейшей мировой фармацевтической компании с совокупным объемом продаж в размере >60 млрд дол. в год. M&A-сделка не повлияет на скорригированную прибыль на акцию в 2017 г., но рост прибыли произойдет в 2018 г. Слияние обеспечит дополнительно 10% прибыли в 2019 г. В течение 3 лет после завершения сделки ожидается синергетический эффект в размере >2 млрд дол. Предыдущий рекорд в сфере стоимости M&A-сделок также установлен «Pfizer» — в 2000 г. компания приобрела «Warner-Lambert Co.» за 116 млрд дол.

Leave a comment