ГЛОМЕРУЛОНЕФРИТ ПРИ ГЕМОРАГІЧНОМУ ВАСКУЛІТІ
Синяченко О.В.1, Бевзенко Т. Б.1, Ермолаева М.В.1, Дядык А.И. 2
- 1Донецкий национальный медицинский университет им. Максима Горького, Красный Лиман
- 2Національний медичний університет ім. А.А. Богомольця, Київ
Резюме. Мета роботи. Провести порівняння характеру ниркової патології з клінічним перебігом геморагічного васкуліту (ГВ), оцінити взаємозв’язки екстраренальних проявів захворювання з морфологічними ознаками гломерулонефриту (ГН). Об’єкт і методи. Під наглядом перебували 144 хворих на ГВ (56% чоловіків і 44% жінок). У 21 пацієнта (12 чоловіків і 9 жінок) зі збереженою функцією нирок та сечовим синдромом виконано прижиттєве морфологічне вивчення ниркових тканин. Загалом ГН діагностовано у 65% обстежених осіб, хронічну ниркову недостатність I–IV ступеня — у 17%, нефротичний синдром — у 8%. Морфологічний клас ГН виявився більш високим у чоловіків. Результати. За результатами дисперсійного й кореляційного аналізу на частоту розвитку ГН виявляють вплив загальний ступінь активності ГВ, інтегральна тяжкість екстраренальних проявів захворювання, вираженість кардіальної патології, причому швидкість клубочкової фільтрації залежить від параметрів антинейтрофільних цитоплазматичних антитіл, ефективний нирковий плазмотік — від рівня імуноглобуліну (Ig) М і циркулюючих імунних комплексів, нирковий судинний опір — від вмісту IgG, а від змін з боку нирок залежать показники у крові фібриногену, фібронектину, С-реактивного протеїну та IgА. Висновки. При ГВ клініко-морфологічний характер ураження нирок у вигляді ГН взаємопов’язаний з екстраренальними проявами захворювання, ступенем активності хвороби і концентрацією у крові імунних запальних білків.
Введение
Геморрагический васкулит (ГВ), или пурпура Шенляйна — Геноха — первичное поражение мелких сосудов преимущественно иммуноглобулин (Ig) A-иммунными комплексами (Moore S. et al., 2011). ГВ относится к самым частым вариантам микрососудистого системного ангиита у взрослых и детей (Byun J.W. et al., 2012; Li L. et al., 2013; Trnka P., 2013). Ежегодная заболеваемость ГВ достигает в некоторых регионах 30 случаев на 100 тыс. детского и 2 случая на 100 тыс. взрослого населения (Penny K. et al., 2010; Piram M., Mahr A., 2013).
У больных ГВ поражение почек развивается примерно в 70% случаев, а гломерулонефрит (ГН) может проявляться весьма разнообразно — от изолированной микрогематурии (¼ наблюдений) до нефротического синдрома (30%) (Naija O. et al., 2012). По данным A.A. Lardhi (2012), ГН возникает у каждого четвертого пациента с ГВ уже в дебюте заболевания. Именно от характера поражений почек и темпов прогрессирования почечной недостаточности зависит прогноз у больных пурпурой Шенляйна — Геноха (Dudley J. et al., 2013; Kawasaki Y. et al., 2013).
За последние два десятилетия повысилась частота ГН у пациентов с пурпурой Шенляйна — Геноха среди лиц с хронической болезнью почек, а взаимосвязь клинических признаков такого ГН с внепочечными остается малоизученной (Yin X.L. et al., 2013). ГН у пациентов с пурпурой Шенляйна — Геноха часто рассматривают как вариант IgA-нефропатии («системная форма IgA-нефропатии» (Oh H.J. et al., 2012)), но прогноз патологии почек при ГВ значительно хуже (Mohey H. et al., 2013). Цель и задачи данной работы — сопоставления характера ренальной патологии с клинико-лабораторным течением ГВ, изучение клинико-патогенетической значимости уровня IgА в крови и тканях почек больных, оценка влияния экстраренальных проявлений заболевания на морфологию почек.
Объект и методы исследования
Под наблюдением находились 144 больных ГВ в возрасте от 14 до 65 лет (в среднем — 26±0,8 года). Среди этих пациентов были 56% мужчин в возрасте 22±0,7 года и 44% женщин в возрасте 30±1,5 года. Длительность заболевания составила 9±0,79 года, причем, у женщин на 4 года больше. Острое течение заболевания отмечали в 24% наблюдений, 1-ю степень активности патологического процесса констатировали у 33% больных, 2-ю — у 38%, 3-ю — у 30%.
На предыдущих этапах поражение кожи в виде геморрагической пурпуры имело место у всех без исключения больных. На момент обследования поражение кожи диагностировано в 58%, суставов — в 40%, сердца — в 24%, печени — в 23%, нервной системы — в 22%, пищеварительного тракта — в 17%, скелетных мышц — в 15%, поджелудочной железы — в 9%, селезенки — в 7%. Длительность ГВ составила 11±1,9 года, а период от первых проявлений болезни — от 2 до 39 лет (в среднем — 18±2,2 года).
ГН диагностирован у 93 (65%) больных ГВ в возрасте от 17 до 63 лет (в среднем — 25±0,9 года). У 21 пациента с сохраненной функцией почек и без нефротического синдрома выполнена нефробиопсия (использована методика «True-Cut» с применением высокоскоростного пистолета «Biopty-Bard»). Гистологические срезы окрашивали гематоксилином-эозином, по ван Гизону, ставилась PAS-реакция, окраска методом РТАН, импрегнация серебром по Джонсу-Моури. Выполняли иммуногистохимическое исследование при помощи поликлональных антител к IgA, IgG, IgM, фракций комплемента С1q, С3 (все фирмы «DAKO», Дания). Микроскопическое исследование проводили на микроскопах «Olуmpus BX 40» (Япония) с цифровой камерой «Olуmpus C3030-ADU», программным обеспечением «Olympus DP-Soft». Морфометрическое исследование с подсчетом клеток осуществляли в морфологической программе AnalySIS Pro 3.2 (фирма «SoftImaging», Германия) на микроскопе «Olympus AX70» (Япония) с цифровой видеокамерой «Olympus DP50». Интегральный критерий тяжести поражения (E) почек и экстраренальных признаков болезни высчитывали по формуле:
| E = | A + 2B + 3C | , |
| A + B + C + D |
где А — число случаев в 1 балл, B — число случаев в 2 балла, C — число случаев в 3 балла, D — число случаев с отсутствием признака. Подсчитывали степень пролиферации эндотелия артериол и выраженность депозиции в эндотелиоцитах клубочков почек IgA, IgG, IgM, C3, C1q фракций компонента. 2-й морфологический класс ГН установлен в 48% наблюдений, 3-й, 4-й и 6-й — по 14%, 5-й — в 10%.
Статистическая обработка полученных результатов исследований проведена с помощью компьютерного вариационного непараметрического, корреляционного, регрессионного, одно- (ANOVA) и многофакторного (ANOVA/MANOVA) дисперсионного анализа (программы «Microsoft Excel» и «Statistica-Stat-Soft», США). Оценивали средние значения (M), стандартные отклонения (SD), стандартные ошибки (m), коэффициенты корреляции (r), критерии дисперсии (D), регрессии, Стьюдента, Уилкоксона — Рао, Макнемара — Фишера и достоверность статистических показателей (р).
Результаты и их обсуждение
Артериальная гипертензия имела место у 23% обследованных с ГН, нефротический синдром — у 8%, хроническая почечная недостаточность — у 17% общего числа больных и 26% пациентов с ГН, в том числе 1-й стадии — у 6%, 2-й — у 8%, 3-й и 4-й — соответственно у 1%. Антитела к протеиназе-3 выявлены в 67% наблюдений, а к миелопероксидазе — у 2%, гипер-IgA-анемия (>M±SD показателей здоровых) установлена в 85% случаев. Усредненные параметры артериального давления у обследованных пациентов составили 106±1,7 мм рт. ст., общего периферического сосудистого сопротивления — 2589±77,7 дин ⋅ с ⋅ см, скорости клубочковой фильтрации (по формуле Кокрофта — Голта) — 114±2,5 мл/мин, эффективного почечного плазмотока — 466±17,8 мл/мин, соотношения почечного к периферическому сосудистому сопротивлению — 25±1,1%.
Как демонстрируют дисперсионный и корреляционный анализы, интегральная тяжесть поражения почек прямо соотносится со степенью активности заболевания. На развитие и выраженность ГН мало воздействуют пол и возраст больных, а также возраст в начале патологического процесса, о чем свидетельствует выполненный ANOVA. У мужчин параметры периферического сосудистого сопротивления достоверно (на 14%) выше, чем у женщин, тогда как показатели среднего артериального давления, скорости клубочковой фильтрации, эффективного почечного плазмотока и соотношения почечного к периферическому сосудистому сопротивлению гендерных особенностей не имеют.
Развитие ГН у пациентов с пурпурой Шенляйна — Геноха прямо связано с интегральной тяжестью экстраренальных проявлений ГВ, а также с выраженностью изменений поджелудочной железы и сердца (рис. 1). Характер поражения почек при ГВ прямо зависит от уровней в крови фибронектина и С-реактивного протеина (рис. 2). Параметры С-реактивного протеина у больных с ГН (8,4±0,79 мг/л) и без нефропатии (6,5±0,84 мг/л) отличаются между собой несущественно, тогда как поражение почек сопровождается большими на 19% значениями фибронектина (857,4±13,65 мг/л; p<0,001).
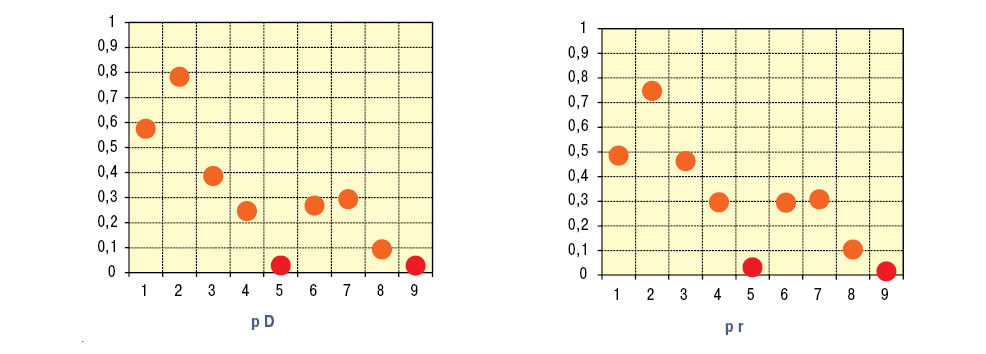
По данным ANOVA, на величину скорости клубочковой фильтрации оказывают воздействие концентрации в сыворотке крови IgA и содержание антител к протеиназе-3. Корреляционный анализ демонстрирует связи эффективного почечного плазмотока с уровнями общего белка в крови, фибриногена, IgM, циркулирующих иммунных комплексов и антител к нативной дезоксирибонуклеиновой кислоте, а соотношение почечного к периферическому сосудистому сопротивлению — с показателями IgG и антител к кардиолипину.
Тубулярный компонент выявлен в 91% наблюдений ГН, интерстициальный — в 86%. Как свидетельствуют результаты дисперсионного анализа, на тяжесть первого из этих компонентов достоверно влияют возраст больных и общая степень активности ГВ. От возраста пациентов высокодостоверно зависят интегральные признаки изменений мезангиума, эндотелиоцитов и подоцитов клубочков, стромы и канальцев. ANOVA/MANOVA показывает влияние пола больных на интегральные изменения канальцев почек, а ANOVA — на степень отложения депозитов IgA в мезангиуме и строме. Частота депозиции IgA в интерстиции, мезангиуме, эндотелиоцитах и в эпителии канальцев соответственно составляет 100; 95; 95 и 62%, IgG — 95; 91; 86 и 57%, IgM — 95; 81; 67 и 48%, C3-фракции комплемента — 67; 38; 29 и 43%, C1q-фракции комплемента — 71; 43; 24 и 38%. Лимфогистиоцитарная инфильтрация в сосудах почек имела место у 62% больных ГН, пролиферация эндотелия — у 57%, фибриноидные изменения и фибриноидный некроз сосудов и периваскулярный склероз — соответственно у 48%, гиалиноз сосудов — у 43%, эластрофиброз — у 33%, плазматическое пропитывание — у 14%.
Как свидетельствует однофакторный дисперсионный анализ, на интегральный критерий тяжести поражения клубочков почек влияют развитие у больных ГВ артрита и кардиопатии, а выраженность тубулярных изменений прямо зависит от распространенности кожного синдрома. Высокие параметры интегрального критерия поражения сердца (с учетом нарушений возбудимости миокарда, электрической проводимости, клапанного аппарата, камер сердца и диастолической дисфункции левого желудочка) влияют на степень депозиции IgA и IgG в мезангиуме клубочков и в эндотелиоцитах капилляров. Кроме того, от суставного синдрома зависят отложения в мезангиуме C1q-фракции комплемента, а в интерстиции — С3-фракции комплемента. Наличие и выраженность кардиальной патологии влияют на формирование фибриноидных изменений в стенке сосудов, пролиферации эндотелия, гиалиноза, эластофиброза, лимфогистиоцитарной инфильтрации стенки артериол и периваскулярного склероза в интраренальных сосудах. С поражением печени при ГВ связано развитие плазматического пропитывания почечных сосудов.
Как видно из таблицы, уровень отложений IgA в эндотелиоцитах и подоцитах прямо ассоциируется с параметрами IgA/∑Ig, на что указывают дисперсионный и корреляционный анализ. Морфологический класс ГН на характер депозиций IgA в структурах почек не влияет, а последний зависит от наличия у больных экстракапиллярного компонента. С выраженностью тубулярного и интерстициального компонентов тесно связана степень отложений IgA в эндотелиоцитах клубочков.
в структурах почек больных ГН при ГВ
| Локализация IgAв почках | Уровень показателей крови | Тяжесть поражения структур почек | ||||||
|---|---|---|---|---|---|---|---|---|
| IgA | IgA/∑Ig | |||||||
| Влияние | Корреляция | Влияние | Корреляция | Клубочки | Строма | Канальцы | Сосуды | |
| Мезангиум клубочков
Эндотелий капилляров Интерстиций Канальцы |
0,826
0,249 0,632 0,676 |
0,982
0,189 0,868 0,370 |
0,219
0,026 0,525 0,564 |
0,112
0,022 0,449 0,694 |
0,009
<0,001 0,394 0,795 |
0,233
0,502 0,152 0,388 |
0,771
0,319 0,902 0,028 |
0,589
0,868 0,187 0,646 |
Существуют дисперсионные связи уровней депозиции IgA в мезангиуме со степенью отложений в этой структуре почек IgG и IgM. Кроме того, выраженность IgA-депозитов в гломерулярном эндотелии и подоцитах зависит от степени отложений IgG и IgM, а также от параметров IgM в мезангиуме и тяжести плазматического пропитывания сосудов почек. С мезангиальными IgM связаны отложения IgA в интерстиции и канальцах. От IgA-депозиции в строме зависит выраженность пролиферации эндотелиальных клеток артериол, гиалиноз и эластофиброз сосудов. Степень отложений IgA в мезангиуме и эндотелии капилляров клубочков почек прямо коррелирует с тяжестью гломерулярных повреждений, а уровень таких депозитов в канальцах — с выраженностью других тубулярных изменений.
Согласно результатам выполненного ANOVA/MANOVA, на интегральные физико-химические адсорбционно-реологические свойства мочи влияют наличие тубулярного и интерстициального компонентов поражений почек, тяжесть вовлечения в патологический процесс клубочков, канальцев, стромы и сосудов. Кроме того, поверхностные вязкость, упругость, напряжение и релаксация мочи зависят от степеней отложений в мезангиуме IgA-, IgG- и C3-компонента комплемента, в гломерулярном эндотелии и подоцитах — IgA-, IgG- и C1q-компонента, тяжести плазматического пропитывания сосудов и пролиферации эндотелиоцитов артериол, что демонстрирует многофакторный анализ Уилкоксона— Рао. Тяжесть поражений канальцев и стромы почек прямо коррелирует с показателями поверхностной вязкости и упругости мочи, межфазной активности мочи при среднем времени существования поверхности, а также с модулем вязкоэластичности и углом наклона тензиореограмм. Выраженность гломерулярных и сосудистых изменений при ГН позитивно связана лишь с уровнем статического (равновесного) поверхностного натяжения. С учетом дисперсионного анализа и выполненных сопоставлений с морфологическими признаками ГН, можно утверждать, что параметры поверхностного натяжения мочи >55 мН/м (>M+SD больных ГВ с поражением почек) отражают тяжелые повреждения клубочков, канальцев, стромы и сосудов, что имеет немаловажную практическую (прогностическую) значимость.
Выводы
ГН диагностируют у примерно ⅔ обследованных больных ГВ, хроническую почечную недостаточность — у 17%, нефротический синдром — у 8%. Клинический характер поражения почек взаимосвязан с экстраренальными проявлениями заболевания, степенью активности болезни и концентрацией в крови иммунных воспалительных белков. По результатам дисперсионного и корреляционного анализа на частоту развития ГН оказывают влияние общая степень активности ГВ, интегральная тяжесть внепочечных признаков болезни, выраженность кардиальной патологии, причем скорость клубочковой фильтрации зависит от параметров антител к протеиназе-3, эффективный почечный плазмоток — от уровня IgМ и циркулирующих иммунных комплексов, почечное сосудистое сопротивление — от содержания IgG, а от изменений со стороны почек зависят показатели в крови фибриногена, фибронектина, С-реактивного протеина и IgА. Параметры IgA-анемии взаимосвязаны с уровнем IgA в эндотелии и подоцитах клубочков почек, а тот, в свою очередь, прямо соотносится с выраженностью депозиций других иммунных комплексов, со степенью плазматического пропитывания, пролиферации эндотелия, гиалиноза и эластофиброза почечных артериол. На интегральные физико-химические адсорбционно-реологические свойства мочи оказывают воздействие тяжесть поражения отдельных структур почек, уровень иммунных депозитов в мезангиуме, эндотелии гломерулярных капилляров и подоцитах, степень плазматического пропитывания артериол и пролиферации эндотелия сосудов.
Список использованной литературы
- Byun J.W., Song J., Kim L. (2012) Predictive factors of relapse in adult with Henoch-Schönlein purpura. Am. J. Dermatopathol., 34(2): 139–144.
- Dudley J., Smith G., Llewelyn-Edwards A. (2013) Randomised, double-blind, placebo-controlled trial to determine whether steroids reduce the incidence and severity of nephropathy in Henoch-Schonlein purpura (HSP). Arch. Dis. Child., 98(10): 756–763.
- Kawasaki Y., Ono A., Ohara S. (2013) Henoch-Schönlein purpura nephritis in childhood: pathogenesis, prognostic factors and treatment. Fukushima J. Med. Sci., 59(1): 15–26.
- Lardhi A.A. (2012) Henoch-Schonlein purpura in children from the eastern province of Saudi Arabia. Saudi Med. J., 33(9): 973–978.
- Li L., Zhang J., Zhang Y. et al. (2013) Thrombosis warning in children suffering from henoch-schonlein purpura. Indian J. Dermatol., 58(5): 409–410.
- Mohey H., Laurent B., Mariat C. et al. (2013) Validation of the absolute renal risk of dialysis/death in adults with IgA nephropathy secondary to Henoch-Schönlein purpura: a monocentric cohort study. BMC Nephrol., 14(1): 169–170.
- Moore S., Bowden A., Afify S. (2011) Henoch-Schonlein purpura. BMJ Case Rep., 23: 2011–2012.
- Naija O., Bouzaraa J., Goucha-Louzir R. et al. (2012) Predictive factors of severe Henoch-Schonlein nephritis in children: report of 34 cases. Tunis Med., 90(12): 878–881.
- Oh H.J., Ahn S.V., Yoo D.E. (2012) Clinical outcomes, when matched at presentation, do not vary between adult-onset Henöch-Schönlein purpura nephritis and IgA nephropathy. Kidney Int., 82(12): 1304–1312.
- Penny K., Fleming M., Kazmierczak D. et al. (2010) An epidemiological study of Henoch-Schönlein purpura. Paediatr. Nurs, 22(10): 30–35.
- Piram M., Mahr A. (2013) Epidemiology of immunoglobulin A vasculitis (Henoch-Schönlein): current state of knowledge. Curr. Opin. Rheumatol., 25(2): 171–178.
- Trnka P. (2013) Henoch-Schönlein purpura in children. J. Paediatr. Child. Health, 49(12): 995–1003.
- Yin X.L., Zou M.S., Zhang Y. (2013) Twenty-three-year review of disease patterns from renal biopsies: an experience from a pediatric renal center. J. Nephrol., 26(4): 699–707.
Адрес для переписки:
Синяченко Олег Владимирович
84404, Донецкая область,
Красный Лиман, ул. Кирова, 27
Донецкий национальный медицинский
университет им. Максима Горького,
кафедра внутренней медицины № 1
Е-mail: synyachenko@ukr.net

Leave a comment