Випадок глюкокортикоїд-індукованого остеопорозу на тлі ювенільного ревматоїдного артриту
Кондратюк В.Є.1, Івашківський О.І.1, Джус М.Б.2, Коржук В.О.1
- 1Національний медичний університет ім. О.О. Богомольця, Київ
- 2Национальный медицинский университет, Киев
Резюме. У лекції наведено дані щодо етіології, патогенезу, клініки, діагностики та лікування глюкокортикоїд-індукованого остеопорозу (ГКІ-ОП) на тлі ювенільного ревматоїдного артриту (ЮРА). Описано випадок із власної практики. Особливістю представленого випадку є складнощі щодо діагностики та лікування ГКІ-ОП на тлі ЮРА, що детермінувалися особливостями його дебюту, своєчасністю та адекватністю терапії пацієнта на різних етапах розвитку патології. Хронічне запалення, системне та необґрунтоване тривале застосування глюкокортикоїдів — основні чинники погіршення стану кісткової тканини у хворого.
Остеопороз (ОП) — системне захворювання скелета, яке характеризується зменшенням кісткової маси, мікроструктурними пошкодженнями кісткової тканини, що призводять до підвищення крихкості кісток та підвищення ризику переломів [1, 13]. Переломи у пацієнтів з ОП посідають важливе місце серед станів, що призводять до погіршення якості життя, інвалідизації та смертності. Основним завданням профілактики є зниження ризику їх виникнення, насамперед у жінок при настанні менопаузи, у чоловіків працездатного віку, за допомогою застосування різних лікарських препаратів. Особливе значення має створення Всесвітньою організацією охорони здоров’я шкали ризику FRAX, що дозволяє лікарю визначити 10-річний ризик остеопоротичних переломів, вибираючи контингент пацієнтів, яким необхідна специфічна терапія. Останнім часом в арсеналі лікаря з’явилася велика кількість антирезорбтивних і анаболічних препаратів для лікування при ОП, що дало можливість запобігти до 70% переломів [14].
В арсеналі сучасного лікаря існують препарати, які при тривалому застосуванні можуть призвести до зниження мінеральної щільності кісткової тканини (МЩКТ). Серед них особливе місце займають глюкокортикоїди (ГК) (зниження кісткоутворення та підвищення кісткової резорбції з формуванням вторинного ОП), інгібітори протонної помпи (можливим механізмом є зниження всмоктування кальцію в кишечнику), протиепілептичні препарати (вірогідно внаслідок інактивації вітаміну D), медрогідроксипрогестерону ацетат та інгібітори ароматази (знижують рівень естрогенів, що призводить до підвищення кісткової резорбції), антагоністи гонадотропін-рилізинг фактора (інгібіція вироблення тестостерону та естрадіолу, що призводить до підвищення кісткової резорбції), селективні інгібітори серотоніну, механізм дії яких невідомий, тіазолідиндіони (зменшення кісткоутворення), інгібітори кальциневрину (активація остеокластів та кісткова резорбція), гепарин (інгібіція остеобластів зі зниженням кісткоутворення та підвищенням кісткової резорбції), варфарин (зниження мінералізації кістки). Найбільш розповсюдженими серед них є ГК, що застосовують для лікування пацієнтів із широким спектром захворювань, у тому числі ревматологічних. За даними різних досліджень у 30–50% пацієнтів, які отримують їх навіть у низьких дозах (3–10 мг/добу за преднізолоном), розвиваються переломи [9]. Ці побічні дії розвиваються внаслідок поєднання як прямого, так і непрямого негативного впливу ГК на структуру та якість кістки [3, 13]. Прямими ефектами є вплив на остеоцити, що призводять до надмірної резорбції кістки, перш за все у хребті. Одночасно з цим відбувається індукція апоптозу остеоцитів, що детермінує втрату можливості остеобластів до диференціації, що зумовлює зниження кісткоутворення. Непрямі ефекти ГК включають: зниження всмоктування кальцію, інгібіцію гормону росту, зниження синтезу статевих гормонів, підвищення синтезу паратиреоїдних гормонів [9, 11, 24]. При цьому ризик переломів більшою мірою залежить від добової дози ГК, ніж від сумарної [3, 20]. Доведено, що доза >7,5 мг/добу за преднізолоном у 5 разів підвищує ризик переломів, а 10 мг/добу протягом >90 днів — до 17 разів. Найбільш небезпечне перевищення дози 20 мг/добу в людей похилого віку. Додатковими чинниками, які незалежно один від одного підвищують ризик розвитку ОП є недостатня маса тіла, тютюнопаління, спадковість, переломи стегна в анамнезі, вживання алкоголю та внутрішньовенне застосування ГК [16].
Розвиток ОП характерний також і для дитячого та підліткового віку, де простежується тенденція до зростання його поширеності. Чинниками цього феномену є формування, прогресування ревматичних захворювань (наявність хронічного запалення), з одного боку, та широке застосування ГК (системний вплив) у педіатричній практиці — з іншого. Так, ГК є найчастішою причиною виникнення вторинного ОП та його ускладнень: низькоенергетичних переломів кісток скелета (насамперед, деформації тіл хребців, переломів проксимальної ділянки стегна, дистального відділу передпліччя, ребер, плеча кісток таза тощо) [5, 6, 10]. Превалюючі при ОП вертебральні деформації, які є причиною погіршення якості життя, часто залишаються не діагностованими, а біль розцінюється як фіброміалгія чи радикулярний синдром. Тривала відсутність адекватного лікування пацієнтів підвищує ризик виникнення остеопоротичних переломів. Ризик виникнення переломів за наявності глюкокортикоїд-індукованого остеопорозу (ГКІ-ОП) не залежить від показника МЩКТ [2, 9, 11].
Особлива увага приділяється змінам кісткової тканини у пацієнтів з ювенільним ревматоїдним артритом (ЮРА), що пов’язаний із локальною (навколосуглобова остеопенія) і системною втратою кісткової маси (системний ОП). Патофізіологія ОП при ЮРА — багатофакторна і включає низку механізмів, зокрема дію прозапальних цитокінів (фактор некрозу пухлини-α, інтерлейкіни-1, -6, -7 та -17), активацію апоптозу, зниження активності антиоксидантної системи, специфічні ефекти ГК, які призначають у комплексній терапії при ЮРА [8, 12, 13]. Клінічні дослідження у пацієнтів з ЮРА свідчать про одночасне існування надмірної активації остеокластогенезу і пригнічення процесу формування кісток, що поряд зі зниженням фізичної активності, розвитком м’язової атрофії, викликані високою активністю захворювання і обмеженням рухів, спричиняють втрату кісткової маси з подальшою системною або локальною затримкою росту. За умови відсутності профілактичних заходів щодо розвитку остеопенічного синдрому при ЮРА, переломи кісток можуть розвиватися навіть у ранньому віці [10, 17, 18, 24]. Зростання частоти переломів хребта у цій групі пацієнтів пояснюється не лише високою активністю захворювання, прийомом ГК, а і збільшенням маси тіла, що є наслідком прийому останніх [8, 21]. Небезпека застосування ГК у дитячій ревматології полягає в тому, що при неможливості досягнути нормального піку кісткової маси в дитинстві, і тим самим забезпечити нормальний ріст кісток, підвищується ризик переломів протягом усього життя [22, 25]. Більше того, в дитячому віці патологічні переломи можуть відбутися навіть після відносно короткого періоду застосування ГК [20].
У патогенезі ГКІ-ОП виділяють прямий та опосередкований вплив ГК на кісткову тканину. ГК одночасно пришвидшують апоптоз остеоцитів, пригнічують функцію та диференціацію остеобластів, активують остеокласти. Цей вплив ГК поєднується зі зниженням абсорбції кальцію в кишечнику, підвищенням реабсорбції кальцію в нирках, зниженням рівня статевих гормонів, що призводить до порушення формування кісткової тканини (зменшення кісткової маси) та підвищення ризику переломів [3, 9, 11]. У дітей і підлітків відзначено негативну кореляцію між кістковою масою і кумулятивною дозою ГК. За даними світової літератури, у пацієнтів з ЮРА гірша якість кісткової тканини порівняно зі здоровими однолітками [15, 24].
Отже, основними факторами ризику, що призводять до погіршення стану кісткової тканини при ЮРА, є ранній вік початку захворювання, низький пік кісткової маси, особливості форми та перебігу (висока активність захворювання, частота рецидивів і кількість залучених суглобів; наявність системних проявів), порушення рухової активності, відсутність адекватного лікування і тривале (>3 міс) застосування ГК у дозі >5 мг/добу за преднізолоном [23].
Зазначимо, що клінічна картина ОП найчастіше малосимптомна. У разі підозри на ОП та з метою своєчасної діагностики рекомендується проводити рентгенівську денситометрію за наявності таких клінічних ознак: тривалий, постійний біль у спині, через який є потреба у відпочинку протягом дня, зменшення зросту на >3 см; у дітей та підлітків — відставання у зрості від однолітків. Проте дебютує ОП, на жаль, частіше ускладненнями, а саме низькоенергетичними переломами.
Для діагностики ОП використовують ряд інструментальних та лабораторних досліджень. Рентгенографію давно і досить активно застосовують для діагностики ОП і його ускладнень. Проте її не можна віднести до методів ранньої діагностики, що особливо важливо в педіатричній практиці, оскільки рентгенологічні ознаки ОП з’являються тоді, коли близько 30% кісткової маси вже втрачено. Більше того, цей метод за точністю і відтворюваністю результатів значно поступається сучасним методам остеоденситометрії.
З 1994 р. згідно з рекомендаціями експертів Всесвітньої організації охорони здоров’я, золотим стандартом у діагностиці ОП є метод двохенергетичної рентгенівської денситометрії. Останніми роками поліпшилася діагностика та моніторинг порушень стану кісткової тканини у дітей в Україні внаслідок розробки та наявності денситометрів із педіатричними програмами. Метод рентгенівської двохенергетичної абсорбціометрії є високочутливим і специфічним, точним, дозволяє вимірювати МЩКТ, Т- і Z-показники як осьового, так і периферичного скелета, характеризується мінімальною дозою опромінювання, високою швидкістю отримання результатів. Для жінок у постменопаузальний період та чоловіків віком старше 50 років діагноз ОП встановлюють за Т-критерієм ≤2,5 стандартних відхилень (SD). Існує подібна програма і для педіатричної практики, яка дає можливість визначати МЩКТ у дитячому віці, починаючи з народження. Одержана при цьому величина МЩКТ автоматично зіставляється із середньою нормою, з урахуванням відхилення індивідуальних значень від середньовікової норми дітей відповідного віку та статі (Z-критерій). Важливим також є впровадження у клінічну практику маркерів кісткового формування та резорбції, визначення рівня вітаміну D, які слід використовувати для підбору відповідних антиостеопоротичних засобів, моніторингу їх ефективності та безпеки. На відміну від осіб віком старше 40 років, модель FRAX щодо визначення 10-річного ризику виникнення остеопоротичних переломів не може бути застосована в педіатрії [1].
На сьогодні запропоновані різні варіанти лікування при ГКІ-ОП. Важливе значення має корекція способу життя, дієта, збалансована за вмістом кальцію, фосфору, магнію, білка, дозовані фізичні навантаження, лікувальна фізкультура, що є основними немедикаментозними засобами впливу на стан кісткової тканини. Профілактика втрати кісткової тканини має проводитися при застосуванні ГК незалежно від віку. Її основним завданням є, перш за все, забезпечення досягнення максимального піку кісткової маси в період активного росту та розвитку дитини. Обов’язковим є призначення препаратів кальцію в адекватних дозах (1200–1500 мг), вітаміну D (400–800 МО) та його активних метаболітів [4, 7, 18]. З метою зниження ризику розвитку ОП обов’язковими є своєчасна діагностика основного захворювання, призначення базисної терапії протягом 1-го року захворювання, корекція терапії протягом 3 міс у разі її неефективності, виключення тривалого застосування ГК, використання мінімально можливої ефективної дози ГК протягом мінімально можливого часу, використання імунобіологічної терапії основного захворювання та контроль за станом кісткової тканини не рідше 1 разу на рік [2, 19, 23]. Препаратами першої лінії для лікування ГКІ-ОП у дорослих хворих є бісфосфонати (БФ) [8, 9]. Сьогодні в Україні широко застосовують БФ як для перорального (алендронат, ризендронат та ібандронат), так і для парентерального введення (памідронат, ібандронат, золедронова кислота). Здатність БФ впливати на остеокласти та пригнічувати тим самим резорбцію кісткової тканини визначає їх лікувальну дію. Досвід застосування БФ при ОП у дітей та підлітків із ревматичними захворюваннями висвітлений у невеликій кількості публікацій [26]. Проте, незважаючи на проведені дослідження, дотепер чіткі показання для призначення БФ у дітей та підлітків відсутні, що потребує проведення подальших клінічних досліджень. У зв’язку з великою кількістю побічних ефектів та відсутністю даних щодо впливу БФ на кісткову тканину в молодому віці, БФ слід застосовувати у разі неефективності терапії препаратами кальцію, вітаміну D та/чи за наявності компресійних переломів тіл хребців і стійкого вираженого больового синдрому. Обов’язковою умовою призначення БФ є інформована згода батьків пацієнтів та вік старше 14 років.
Хоча ГКІ-ОП має високий рівень поширеності серед ревматичних захворювань, відносно невеликій кількості пацієнтів, які перебувають на постійному лікуванні ГК, проводять адекватну діагностику ОП та адекватну профілактичну терапію. Причиною цього може бути відсутність чіткого розуміння проблеми ОП та його наслідків у дитячому віці, неповна оцінка ризиків ускладнень лікарем, складність основних принципів лікування та контролю за ним, недотримання режиму лікування пацієнтом.
У звʼязку з цим пропонуємо вашій увазі клінічний випадок розвитку ГКІ-ОП у пацієнта з ЮРА.
Хворий Л., 16 років, мешканець Києва, поступив до І ревматологічного відділення Олександрівської клінічної лікарні 12.02.2013 р. у плановому порядку за направленням військового комісаріату з діагнозом: «Ювенільний ревматоїдний артрит».
При госпіталізації турбували загальна слабкість, періодичний біль у поперековому та грудному відділах хребта, скутість у хребті, швидка втомлюваність через біль у спині, погіршення зору за останні півроку, відставання у зрості. Скарг на біль у периферичних суглобах не висловлював.
Із анамнезу захворювання відомо, що пацієнт хворіє близько 10 років, коли почали турбувати біль та припухлість у проксимальних міжфалангових, п’ястково-фалангових, ліктьових, плечових, колінних, гомілковостопних суглобах. Батьки звернулися до лікаря-педіатра за місцем проживання, який встановив діагноз: «Поліартрит нез’ясованої етіології» та призначив преднізолон 35 мг/добу, який згодом замінив на метилпреднізолон. На тлі прийому ГК стан покращився: зменшилася інтенсивність болю та зникла припухлість вищезазначених суглобів. Для уточнення діагнозу був направлений до ДУ «Інститут педіатрії акушерства та гінекології», де після проведення лабораторних та інструментальних обстежень суглобовий синдром розцінили, як реактивний артрит на тлі гострої респіраторної вірусної інфекції та рекомендували зниження дози ГК протягом 10–12 діб з 28 до 12 мг/добу метилпреднізолону. Однак на тлі швидкого зниження дози виникло загострення суглобового синдрому у вигляді посилення вираженості болю у суглобах кистей та колінних. Було призначено ібупрофен (200 мг 3 рази на добу), після чого прояви суглобового синдрому регресували. Протягом наступних років періодично турбував біль у колінних та п’ястково-фалангових суглобах, почав відставати у зрості від однолітків. З осені 2009 р. поступове загострення суглобового синдрому — посилення болю та припухання п’ястково-фалангових суглобів. На початку 2010 р. звернувся в «Охматдит», де встановлено діагноз ЮРА та знову призначено метилпреднізолон без базисної терапії з поступовим зниженням дози з 28 до 16 мг/добу. При досягненні дози ГК 16 мг/добу з’явилися біль у грудному відділі хребта, втомлюваність у спині. Восени 2011 р. призначено метотрексат у початковій дозі 7,5 мг/тиж із поступовим підвищенням до 15 мг/тиж. У травні 2012 р. у зв’язку із загостренням суглобового синдрому дозу метотрексату було підвищено до 20 мг/тиж, яку приймав до моменту надходження у стаціонар. На тлі прийому ГК у 2012 р. діагностовано стероїдну катаракту.
Спадковий анамнез обтяжений по лінії батька — у прадіда були біль та припухання суглобів, а згодом — деформація кистей та стоп.
При об’єктивному обстеженні: маса тіла — 52 кг, зріст — 154 см, індекс маси тіла — 21,9 кг/м. При обстеженні кістково-м’язової системи визначали біль при пальпації паравертебральних точок та остистих відростків у грудному та поперековому відділах хребта. Клінічних ознак сакроілеїту не виявлено. При обстеженні периферичних суглобів кінцівок деформацій, набряку, болю чи обмеження рухів не виявлено.
Шкірні покриви та видима слизова оболонка не змінені, лімфатичні вузли не збільшені. З боку серцево-судинної, дихальної системи та шлунково-кишкового тракту патологічних змін не виявлено. При проведенні загального та біохімічного аналізу крові, загального аналізу сечі, електро- та ехокардіографії клінічно значущих змін не виявлено. Відповідно до лабораторних показників, ступінь активності захворювання розцінено як мінімальний (С-реактивний білок <6 г/л, швидкість осідання еритроцитів 5 мм/год).
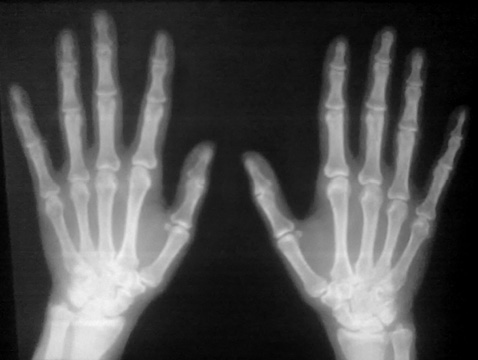
З метою диференційної діагностики трансформації ЮРА в серонегативний спондилоартрит або ревматоїдний артрит проведено аналіз крові на HLA-B27 й антитіла до циклічного цитрулінованого пептиду (anti-CCP) та магнітно-резонансну томографію (МРТ) крижово-здухвинних з’єднань. Отримано негативні результати лабораторних досліджень (HLA-B27 — негативний та anti-CCP <0,5 ОД/мл); ознаки сакроілеїту при МРТ-дослідженні відсутні. За даними рентгенографії кистей і стоп, виявлено ОП суглобових кінців та кісток, окремі кістоподібні утворення кісток зап’ястків, усі зони зросту простежуються, ерозивні зміни відсутні (рис. 1).
З метою верифікації болю в спині проведено МРТ попереково-крижового відділу хребта, на якій виявлено ознаки розповсюдженого остеохондрозу та множинні двояковгнуті деформації тіл хребців (рис. 2).
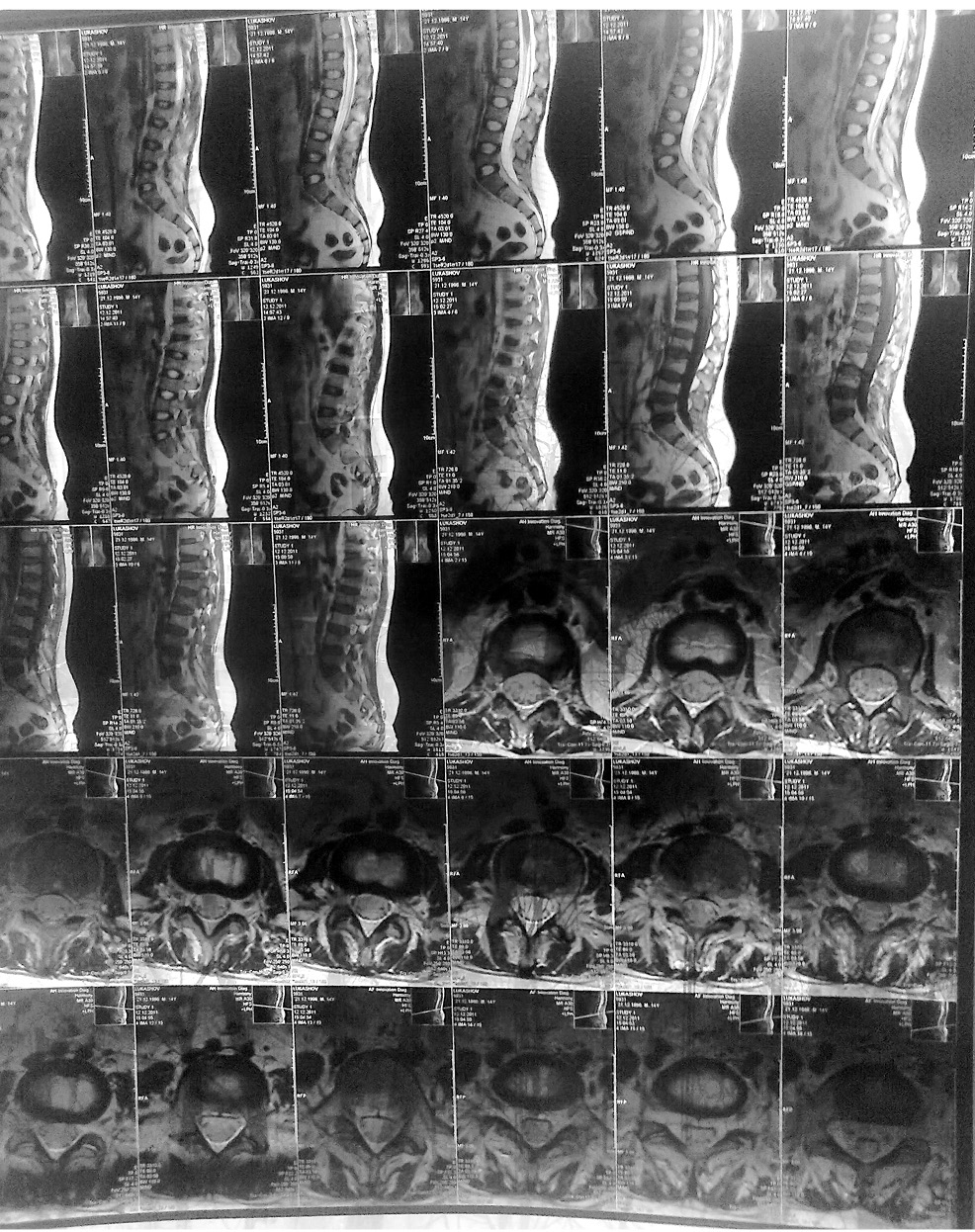
Враховуючи тривале застосування ГК, ознаки ОП за даними рентгенографії, зміни на МРТ у вигляді двояковгнутих деформацій тіл хребців, хворому проведено двофотонну рентгенівську абсорбціометрію. При обстеженні виявлено ОП: зниження МЩКТ на рівні поперекового відділу хребта до 0,562 г/см (Z-показник –3,9 SD) та на рівні шийки стегнової кістки до 0,609 г/см (Z-показник –3,1 SD).
Враховуючи скарги пацієнта, анамнез захворювання, результати клінічних, лабораторних та інструментальних методів досліджень, встановлено заключний клінічний діагноз: «Ювенільний ревматоїдний артрит, серонегативний варіант, anti-CCP-негативний, стадія клініко-лабораторної ремісії, рентген-стадія І, ФНС 0 ст. Глюкокортикоїд-індукований системний остеопороз. Початкова стероїдна катаракта обох очей».
Надалі лікування проводили за двома стратегічними напрямками: терапія ЮРА та системного ОП. Перша спрямована на збереження досягнутої клініко-лабораторної ремісії, а також зниження дози ГК та за можливості — їх коректну відміну. У стаціонарі розпочато поступове зниження дози метилпреднізолону з 8 мг/добу по 1 мг 1 раз на 2 тиж з подальшою повною його відміною та зниження дози метотрексату з 20 до 15 мг/тиж (внаслідок відсутності клініко-лабораторної активності, з одного боку, підвищення частоти гострих респіраторних інфекцій — з іншого боку), що поєднувалося зі зниженням дози фолієвої кислоти (з 15 до 10 мг/тиж). Лікування при системному ОП мало на меті підвищення МЩКТ та зменшення вираженості болю у хребті. Для цього рекомендовані дієта, збагачена кальцієм, вітаміном D та мікроелементами; дозована фізична активність, лікувальна фізкультура, препарати кальцію 1000 мг/добу та вітамін D 800 МО/добу.
Після виписки зі стаціонару хворому рекомендована консультація в Українському науково-медичному центрі проблем остеопорозу. Пацієнту призначено додаткове обстеження: двохенергетична рентгенівська абсорбціометрія з рентгеноморфометричним аналізом, визначення рівня вітаміну D у сироватці крові (виявлено значний дефіцит вітаміну D — 5,76 нмоль/л, норма — 75–200 нмоль/л) та маркерів резорбції/формування кісткової тканини: P1NP — пропептиди колагену І типу — 623,7 нг/мл (норма — 15,1–58,6 нг/мл), остеокальцин — 136,1 нг/мл (норма — 24–70 нг/мл), β-термінальний телопептид — 1,68 пг/мл (норма <0,584 пг/мл), паратгормон — 51,17 пг/мл (норма — 15–65 пг/мл). Встановлено заключний діагноз: «Ювенільний ревматоїдний артрит, серонегативний варіант, anti-CCP-негативний, стадія клініко-лабораторної ремісії, рентген-стадія І, ФНС 0 ст. Вторинний системний ГКІ-ОП із деформацією тіл хребців ThVIII–Х, LI. Дефіцит вітаміну D. Спондилодисплазія. Початкова стероїдна катаракта обох очей». За результатами обстежень лікування було скориговане — додано активні метаболіти вітаміну D — альфакальцидол 0,50 мкг/добу, а також після отримання письмової згоди від батьків — БФ, а саме памідронова кислота — 30 мг внутрішньовенно кожні 3 міс протягом року. В березні, липні та листопаді 2013 р. проведено відповідне лікування. За результатами контрольної денситометрії у листопаді 2013 р. МЩКТ на рівні поперекового відділу хребта підвищилася до 0,845 г/см (на 11,9%), на рівні всього скелета — до 0,807 г/см (на 2,0%), а порівняно з показниками за лютий 2013 р. — на 50,3 і 32,1% відповідно. Рівень вітаміну D підвищився до 18,56 нмоль/л, хоча не досягнув норми. Результатом проведеного лікування є значне зменшення вираженості болю у хребті, пацієнт майже не потребував відпочинку протягом дня через дискомфорт у спині, його зріст збільшився на 4 см за 8 міс.
Наведений клінічний випадок продемонстрував складнощі щодо діагностики та лікування при ГКІ-ОП на тлі ЮРА, що детермінувалися особливостями його дебюту, своєчасністю, адекватністю терапії пацієнта на різних етапах розвитку патології. Була наявна недооцінка лікарів щодо розвитку патології кісткової тканини на тлі ЮРА. Наявність хронічного запалення, яке визначає інтенсивність, характер больового синдрому, призводить до обмеження рухової активності, з одного боку, та системного необґрунтовано тривалого прийому ГК у середніх і високих дозах (навіть при досягненні стійкої клініко-лабораторної ремісії ЮРА), з іншого — є основними взаємообтяжуючими чинниками погіршення стану кісткової тканини у хворого.
У педіатра завжди має бути насторога щодо таких клінічних ознак, як ниючий біль у спині, в кінцівках, який виникає при рухах, фізичному навантаженні; швидка втомлюваність у положенні стоячи та сидячи; виникнення переломів при мінімальній травмі, що може бути проявом дебюту ОП в дитячому та підлітковому віці. Надалі відзначається відставання в зрості від однолітків, збільшення кіфозу (кіфосколіоз, лордоз) та обмеження рухливості в хребті.
У разі наявності у хворого з ЮРА остеопенічного синдрому або ОП необхідно проводити ретельний моніторинг клініко-лабораторної активності захворювання та у разі неефективності або недоцільності базисної терапії — її корекцію. Одночасно з цим потрібно оптимізувати застосування ГК: знизити до максимально можливих доз та зменшити тривалість прийому. Обов’язковими є визначення рівня маркерів кісткового метаболізму, кальцію та вітаміну D у крові, їх адекватна медикаментозна корекція. Важливою складовою лікування хворого з ОП є зміна способу життя з акцентом на розумне підвищення фізичної активності, дієту, збагачену кальцієм, фосфором, магнієм, білком. Рутинним має стати проведення цим пацієнтам денситометрії для своєчасної діагностики, корекції та аналізу в динаміці стану кісткової тканини з метою запобігання розвитку ОП.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Поворознюк В.В., Григорьева Н.В. (2013) Информативность различных моделей FRAX в оценке риска остеопоротических переломов у женщин Украины. Боль. Суставы. Позвоночник, 2(10): 32–39.
2. Поворознюк В.В., Карасевська Т.А., Дзерович Н.І. (2011) Мінеральна щільність кісткової тканини та рентгеноморфометричні індекси аксіального скелета у хворих на глюкокортикоїд-індукований остеопороз. Боль. Суставы. Позвоночник, 1(1): 41–46.
3. Поворознюк В.В., Нейко Є.М., Голова І.Ю. (2000) Глюкокортикоїд-індукований остеопороз. ТМК, Київ, 208 с.
4. Baroncelli G.I., Bertelloni S., Sodini F. et al. (2005) Osteoporosis in children and adolescents: etiology and management. Paediatr. Drugs., 7(5): 295–323.
5. Bianchi M.L. (2002) Glucorticoids and bone: some general remarks and some special observations in pediatric patients. Calcified Tissue International., 70(5): 384–390.
6. Brabnikova-Maresova K. (2011) Secondary osteoporosis in patients with juvenile idiopathic arthritis. J. Osteoporos. 20: 569417.
7. Brown J.J., Zacharin M.R. (2005) Proposals for prevention and management of steroid-induced osteoporosis in children and adolescents. J. Paediatr. Child. Health., 41(11): 553–557.
8. Burnham J.M. (2012) Inflammatory diseases and bone health in children. Curr. Opin. Rheumatol., 24(5): 548–553.
9. Canalis E., Mazziotti G., Giustina A. et al. (2007) Glucocorticoid-induced osteoporosis: pathophysiology and therapy. Review. Osteoporos. Int., 18: 1319–1328.
10. Cohran V.C., Griffiths M., Heubi J.E. (2008) Bone mineral density in children exposed to chronic glucocorticoid therapy. Clin. Pediatr. (Phila)., 47(5): 469–475.
11. Grossman J.M., Gordon R. еt al. (2010) American College of Rheumatology 2010. Recommendations for the Prevention and Treatment of Glucocorticoid-Induced Osteoporosis. Arthritis Care & Research., 62(11): 1515–1526.
12. Hämäläinen H., Arkela-Kautiainen M., Kautiainen H. et al. (2010) Bone mineral content in young adults with active or inactive juvenile idiopathic arthritis and in controls. Scand. J. Rheumatol., 39(3): 219–222.
13. Maruotti N., Corrado A., Cantatore F.P. (2014) Osteoporosis and rheumatic diseases. Reumatismo., 66(2): 125–135.
14. Nanes M.S., Kallen C.B. (2014) Osteoporosis. Semin. Nucl. Med., 44(6): 439–450.
15. Okumus O., Erguven M., Deveci M. et al. (2008) Growth and bone mineralization in patients with juvenile idiopathic arthritis. Indian. J. Pediatr., 75(3): 239–243.
16. Panday K., Gona A., Humphrey M.B. (2014) Medication-induced osteoporosis: screening and treatment strategies. Ther. Adv. Musculoskel. Dis., 6(5): 185–202.
17. Roth J., Linge M., Tzaribachev N. et al. (2007) Musculoskeletal abnormalities in juvenile idiopathic arthritis — a 4-year longitudinal study. Rheumatology, 46: 1180–1184.
18. Saggese G., Baroncelli G.I., Bertelloni S. (2001) Osteoporosis in children and adolescents: diagnosis, risk factors, and prevention. J. Pediatr. Endocrinol. Metab., 14(7): 833–859.
19. Shaw N.J. (2008) Management of osteoporosis in children. European Journal of Endocrinology, 159: 33–39.
20. Soybilgic A., Tesher M., Wagner-Weiner L. et al. (2014) A survey of steroid-related osteoporosis diagnosis, prevention and treatment practices of pediatric rheumatologists in North America. Pediatr. Rheumatol. Online J., 12: 24.
21. Stagi S., Bertini F., Cavalli L. et al. (2014) Determinants of vitamin D levels in children, adolescents, and young adults with juvenile idiopathic arthritis. J. Rheumatol., 41(9): 1884–1892.
22. Stagi S., Cavalli L., Bertini F. et al. (2014) Comparison of bone mass and quality determinants in adolescents and young adults with juvenile systemic lupus erythematosus (JSLE) and juvenile idiopathic arthritis (JIA). Lupus, 23(13): 1392–1406.
23. Sušić G., Pilipović N., Stojanović R. (2009) Bone mineral density in patients with juvenile idiopathic arthritis. Srp. Arh. Celok. Lek., 137(7–8): 396–401.
24. Valta H., Lahdenne P., Jalanko H. et al. (2007) Bone health and growth in glucocorticoid-treated patients with juvenile idiopathic arthritis. J. Rheumatol., 34(4): 831–836.
25. von Scheven E., Corbin K.J., Stefano S. et al. (2014) Glucocorticoid-associated osteoporosis in chronic inflammatory diseases: epidemiology, mechanisms, diagnosis, and treatment. Curr. Osteoporos. Rep., 12(3): 289–299.
26. Ward L., Tricco A.C., Phuong P. et al. (2007) Bisphosphonate therapy for children and adolescents with secondary osteoporosis. Cochrane Database of Systematic Reviews., 4 CD005324 (Review).
СЛУЧАЙ ГЛЮКОКОРТИКОИД-ИНДУЦИРОВАННОГО ОСТЕОПОРОЗА НА ФОНЕ ЮВЕНИЛЬНОГО РЕВМАТОИДНОГО АРТРИТА
Резюме. В лекции представлены данные об этиологии, патогенезе, клинике, диагностике и лечении глюкокортикоид-индуцированного остеопороза (ГКИ-ОП) на фоне ювенильного ревматоидного артрита (ЮРА). Описан случай из собственной практики. Особенностью представленного случая являются трудности диагностики и лечения ГКИ-ОП на фоне ЮРА, что обусловлено особенностями его дебюта, своевременностью, адекватностью терапии пациента на разных этапах развития патологии. Хроническое воспаление, системное и необоснованно длительное применение глюкокортикоидов — основные причины ухудшения состояния костной ткани у больного.
ювенильный ревматоидный артрит, остеопороз, диагностика, глюкокортикоиды.
Адреса для листування:
Кондратюк Віталій Євгенович
01601, Київ, бульв. Тараса Шевченка, 13
Національний медичний університет
імені О.О. Богомольця,
кафедра внутрішньої медицини № 2

Leave a comment