БІОЛОГІЧНІ ПРЕПАРАТИ В ЛІКУВАННІ при ПСОРІАТИЧНОму АРТРИТі
Тарадин Г.Г., Ватутин Н.Т. , Смирнова А.С.
Резюме. Резюме. У наведеному огляді обґрунтована актуальність вивчення нових підходів до лікування пацієнтів із псоріатичним артритом біологічними препаратами. Зазначено загальні уявлення про імунопатогенез захворювання із підкресленням важливості розробки таргетингової терапії, спрямованої на провідні ланки патогенезу псоріатичного ураження суглобів. Зокрема, наводяться відомості щодо складного механізму псоріатичного процесу за участю плазмацитоїдної та активованих дендритних клітин, підтипів Т-лімфоцитів (Th1 і Th17) та численних медіаторів запалення. Висвітлено основні критерії об’єктивної оцінки терапевтичного впливу на псоріатичний суглобовий процес, найбільш поширеними з яких є критерії досягнення індексу Американської колегії ревматологів (ACR), PASI і PSARC. Представлені як окремі результати досліджень застосування інгібіторів фактора некрозу пухлини (етанерцепт, адалімумаб, інфліксимаб, голімумаб, цертолізумабу пегол), так і сумарна оцінка їх клінічної ефективності. Особливу увагу приділено інгібіторам інтерлейкінів, які відіграють важливу роль у патогенезі захворювання, а саме устекінумабу, бродалумабу, а також інгібітора фосфодіестерази-4 апреміласту. Окрім оцінки клінічної ефективності біологічних препаратів та їх безпеки, підкреслюється перспективність вивчення цих засобів у лікуванні при псоріатичному артриті на основі даних, отриманих при проведенні контрольованих досліджень. Відзначається перспективність вивчення інших біологічних засобів для лікування при псоріатичному ураженні шкіри та суглобів, зокрема інгібіторів інтерлейкіну-17 (секукінумабу, іксекізумабу), інгібітора Янус-кіназ (тофацитинібу) й інгібітора протеїнкінази С (сотрастаурину).
Введение
Псориатический артрит (ПсА) — хроническое серонегативное воспалительное заболевание суставов, ассоциирующееся с кожным псориазом [1, 12, 36, 46]. Диагностика ПсА нередко затруднена вследствие того, что у части больных превалируют не классические признаки «истинного артрита», а проявления вертебрального поражения, тендинита, энтезита или дактилита. При этом, если псориатическая природа суставного процесса не диагностируется своевременно, то соответственно не предпринимаются адекватные мероприятия по лечению больного, что приводит к прогрессирующему поражению суставов и ранней инвалидизации.
Считают, что псориазом болеют ≈1–3% населения [11, 42]. Среди больных псориазом распространенность ПcА по сообщениям большинства авторов варьирует от 20 до 30% [18, 26, 52]. D. Gladman и соавторы (2005) полагают, что диапазон псориатического поражения суставов гораздо шире и составляет 6–42% [12].
До настоящего времени вопрос эффективного и безопасного лечения ПсА остается открытым. Определенную роль в этом играет неясность этиопатогенетических механизмов. В лечении при ПсА препаратом первой линии длительное время считали метотрексат, однако в свете недавних исследований его эффективность стала оспариваться [2, 25, 35, 53]. К тому же появляется все больше сведений о его серьезных побочных эффектах. В клинической практике также широко применяют и другие болезнь-модифицирующие антиревматические препараты (БМАРП), такие как циклоспорин, лефлуномид, сульфасалазин и др. Однако, по данным многочисленных исследований, не получено убедительных доказательств об их эффективности при лечении дактилита, энтезита, поражений позвоночника и радиографических признаков улучшения суставного поражения [4, 6, 36, 39, 50]. В связи с этим проводятся исследования, направленные на изучение особенностей патогенеза ПсА, позволяющие выяснить возможности разработки таргетинговой терапии. На основании полученных результатов можно с оптимизмом смотреть на возможность внедрения в широкую клиническую практику так называемых биологических препаратов, занимающих уже сейчас важное место в лечении при ПсА [49].
Настоящий обзор посвящен современным представлениям о роли биологических препаратов в фармакотерапии при ПсА на основе анализа последних данных литературы.
Иммунопатогенез заболевания
При псориазе в коже и суставах наблюдаются преимущественно лимфоцитарные инфильтраты, локализованные около дермальных сосочков кожи и выстилающего слоя поверхности суставов. Среди лимфоцитов наиболее часто отмечают Т-клетки, особенно CD4+ с соотношением CD4+/CD8+ 2:1 в синовиальной жидкости. Синовиальная ткань при ПсА характеризуется инфильтрацией Т-клетками и усиленной васкуляризацией, а также уменьшением количества макрофагов, по сравнению с морфологической картиной при ревматоидном артрите. Важная роль интерлейкинов (ИЛ)-12/-23 в патогенезе ПсА подчеркивается выявлением повышенных уровней р40-протеина (имеющего общую субъединицу, представленную на ИЛ-12 и -23) в сыворотке крови по сравнению со здоровыми лицами [49]. Более того, отмечены повышенные уровни активности эпидермального фактора роста, интерферона-α, сосудистого эндотелиального фактора роста и макрофагального ингибирующего протеина-α по сравнению со здоровыми лицами. В свою очередь, у больных с более выраженным ПсА отмечали и более высокие уровни р40-протеина наряду с ИЛ-2, -5, интерфероном-α и макрофагальным ингибирующим протеином-α [15].
Высокие уровни фактора некроза опухоли (TNF)-α; ИЛ-8, -6, -1, -10 и матриксных металлопротеиназ отмечают в суставной жидкости больных с ранним ПсА. Расщепление коллагеназ хрящевого коллагена начинается в дебюте заболевания и может происходить в результате продукции протеаз под воздействием цитокинов. Некоторые данные дают возможность полагать, что клетки-предшественники остеокластов играют важную роль в патогенезе ПсА. С одной стороны, их уровни повышены в периферической крови больных артритом, с другой — отмечается резкое уменьшение количества клеток уже после 2 нед начальной терапии препаратами, ингибирующими TNF-α [15].
Провоспалительные медиаторы, которые участвуют в патогенезе псориаза и ПсА, секретируются разнообразными клетками, включая естественные, адаптивные и тканевые иммунные клетки [40, 54]. Плазмацитоидные дендритные клетки действуют как регуляторы врожденного и активированного иммунного ответа и играют важнейшую роль в Т-клеточном иммунитете [56]. Большое количество плазмацитоидных дендритных клеток определяется в участках кожи и синовии, пораженных псориатическим процессом [9]. Активированные дендритные клетки презентируют антигены и продуцируют интерферон-α и провоспалительные медиаторы, такие как ИЛ-12 и -23 [40]. Т-клетки отвечают на презентацию антигенов миелоидными дендритными клетками путем пролиферации и дифференциации в подтипы хелперных клеток Тh1 и Тh17, которые, в свою очередь, повышают секрецию провоспалительных цитокинов (рисунок) [40]. Дендритные клетки CD11+ экпрессируют синтазу оксида азота и TNF-α, а CD4+/CD8+ Т-клетки продуцируют, кроме TNF-α, также интерферон-α и ИЛ-2 [36].
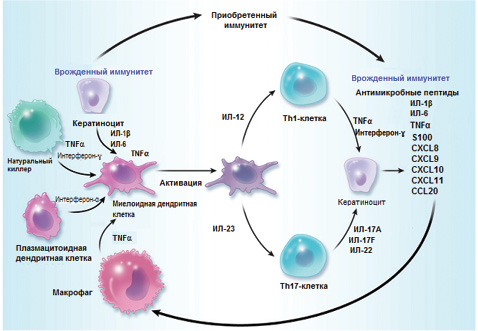
(https://s100.copyright.com/CustomerAdmin/PLF.jsp?ref=b20e1aea-1fe5–40f8–893e-c456cb833bcc)
Описание: ведущие цитокины, вырабатываемые иммунной системой, такие как TNF-α, интерферон-α, интерферон-γ, ИЛ-6, активируют миелоидные дендритные клетки. Активированные дендритные клетки презентируют антигены и секретируют медиаторы — ИЛ-12 и -23, — которые обусловливают дифференцировку Т-хелперов 1 и 17 типа (Th1 и Th17). Т-клетки, в свою очередь, секретируют медиаторы (ИЛ-17А, -17F и -22), активирующие кератиноциты и индуцирующие продукцию антимикробных пептидов, провоспалительных цитокинов (TNF-α; ИЛ-1β и -6), а также хемокинов (CXCL8-CXCL11 и CCL20) и протеинов семейства S100. Эти растворимые медиаторы усугубляют патологический процесс по принципу обратной связи и формируют воспалительные инфильтраты.
Активированные дендритные клетки и ассоциированные сигнальные молекулы также проявляют эффекты на других типах клеток, включая кератиноциты, лейкоциты, нейтрофилы, эндотелиальные клетки и гладкомышечные клетки сосудов, характеризующиеся хемотаксисом, пролиферацией и продукцией дополнительных воспалительных медиаторов [56]. Хроническое нарушение в путях передачи воспалительных сигналов, вероятно, приводят к длительным изменениям со стороны тканевых иммунных клеток кожи и суставов, которые обусловливают выраженность характерных клинических проявлений псориатического процесса [17, 40].
Важная роль отводится вторичному внутриклеточному посреднику циклическому аденозинмонофосфату (цАМФ), поддерживающему иммунный гомеостаз благодаря модулированию сети про- и противовоспалительных медиаторов [47]. Уровни цАМФ регулируются с помощью фосфодиэстераз (ФДЭ), внутриклеточных ферментов, которые конвертируют цАМФ в аденозинмонофосфат (АМФ). В клетках иммунной системы наиболее активным ферментом семейства ФДЭ является ФДЭ-4 [5]. Образование АМФ из цАМФ приводит к увеличению образования провоспалительных медиаторов и снижению продукции противовоспалительных веществ [47]. В кожных участках псориатического процесса и синовии больных ПсА обнаруживаются повышенные уровни провоспалительных медиаторов [19, 28, 43, 44, 55].
Критерии оценки эффективности режимов лечения
Подходы к оценке воздействия на суставной процесс при псориазе сформировались, главным образом, в течение последнего десятилетия, продиктованные необходимостью разработки достоверных критериев мониторинга заболевания при проведении серьезных клинических исследований. Этот подход обоснован растущим интересом к принципу целевого лечения при ведении пациентов с ревматическими заболеваниями. Иными словами, целью лечения при любом хроническом воспалительном заболевании становится достижение минимальной активности или полной его ремиссии и минимизации повреждения органа или системы, что, в свою очередь, требует количественной оценки степени тяжести патологического процесса с помощью достоверных показателей [34].
Традиционно активность псориатического процесса оценивается по системе PASI (Psoriasis Area and Severity Index), а для объективизации эффективности терапии ПсА наиболее приемлемыми являются — «Критерии ответа псориатического артрита» (The Psoriatic Arthritis Response Criteria — PSARC) и критерии «Американской коллегии ревматологов» (ACR 20/50/70) [34]. В соответствии с критериями оценки PSARC, улучшение определяется в случае положительных изменений хотя бы двух показателей из четырех по результатам: 1) субъективной оценки пациентом самочувствия; 2) врачебной оценки состояния пациента; 3) оценки боли в суставах; 4) изменения отечности суставов (обязательно должно наблюдаться уменьшение выраженности боли или отечности).
Критерии ACR 20/50/70 изначально разработаны для оценки динамики ревматоидного артрита. Обозначения «ACR 20, ACR 50 и ACR 70» подразумевают снижение на 20; 50 и 70% соответственно индекса болезненности и отечности в суставах, а также снижение на соответствующий уровень, по крайней мере, 3 из 5 признаков:
- суставной боли (по субъективной оценке пациента);
- активности заболевания (по мнению пациента);
- активности заболевания (по мнению врача);
- индекса инвалидизации (по данным анкеты оценки состояния здоровья);
- величины острофазовых показателей (по лабораторным тестам).
Для анализа динамики радиографической прогрессии поражения суставов широко применяется модифицированный индекс Шарпа. При субъективной или врачебной оценке состояния больного используется градуированная шкала Лайкерта, а также определение индекса активности заболевания — DAS28, рассчитываемого при заполнении анкеты в письменном или онлайн-режиме с учетом типа, количества пораженных суставов, наличия их припухлости и болезненности. Удобным для пациентов и информативным для врачей является и Вопросник оценки здоровья по индексу инвалидности (HAQ-DI) [34].
Биологические препараты
В последние годы биологические препараты заняли ведущее место в лечении при многочисленных аутоиммунных заболеваниях и, в частности, ПсА. Появились рекомендации по их применению у пациентов, которым терапия синтетическими БМАРП не принесла положительных результатов или вызвала серьезные побочные эффекты. Сейчас считается, что терапию биологическими препаратами следует обсуждать, если предварительное базисное лечение неэффективно в течение планируемого периода применения лекарственного средства (обычно 3–6 мес) и не была достигнута расчетная минимальная активность заболевания [14, 49]. Эксперты EULAR в 2012 г. предложили алгоритм ведения больных ПсА. Рекомендуется начинать лечение пациентов с активным суставным процессом с традиционных БМАРП. При отсутствии или неадекватном ответе на традиционную терапию следует обсуждать назначение биологических препаратов, в частности ингибиторов TNF-α [14]. Также указывается, что требуется с осторожностью применять в качестве препаратов первой линии ингибиторы TNF-α, особенно у лиц с обширным поражением кожи и суставов.
Этанерцепт
Этанерцепт — первый препарат среди ингибиторов TNF-α, одобренный для лечения пациентов с псориазом и ПсА [26]. Он обладает способностью связываться и нейтрализовать растворимые и трансмембранные молекулы TNF-α. Кроме того, препарат нарушает миграцию нейтрофилов, созревание и миграцию дендритных клеток и Т-лимфоцитов, уменьшая тем самым системную продукцию провоспалительных цитокинов и последующие их эффекты.
Эффективность этанерцепта доказана при лечении ПсА в нескольких краткосрочных исследованиях (до 24 нед) при умеренном и тяжелом течении заболевания [26, 46]. По результатам продленного двойного слепого плацебо-контролируемого исследования при применении препарата у 169 пациентов в дозе 25 мг 2 раза в неделю сроком до 48 нед критерий АСR 20 был достигнут у 64% пациентов [32]. По критериям PSARC и PASI уровень клинического улучшения составил 84 и 62% соответственно. Кроме того, по сравнению с группой больных, получавших плацебо, отмечено замедление радиографической прогрессии суставного поражения. Длительное лечение этанерцептом больных ПсА приводило к уменьшению выраженности радиографических признаков прогрессирования суставного поражения.
Этанерцепт хорошо переносится больными даже в течение длительного периода лечения. Из побочных эффектов изредка отмечают появление реакции в месте инъекции препарата, инфекционные осложнения, инфаркт миокарда, базальноклеточную карциному и депрессию [26].
Инфликсимаб
Инфликсимаб — химерические моноклональные антитела, блокирующие растворимые и связанные с цитоплазматической мембраной молекулы TNF-α [11]. При лечении больных ПсА препарат можно комбинировать с метотрексатом и применять обычно в дозировке 5 мг/кг массы тела внутривенно в начале лечения, на 2-ю, 6-ю неделю, а затем через каждые 8 нед.
Эффективность инфликсимаба оценивали в двойном слепом плацебо-контролируемом исследовании у 200 пациентов с ПсА по критериям ACR 20, PSARC, PASI, а также выраженности дактилита и энтезопатии. На 14-й неделе терапии 58% пациентов, получавших инфликсимаб, и 11% — плацебо достигли критерия ACR 20, а по оценке критериев PSARC улучшение отмечено у 77% больных группы инфликсимаба и 27% — группы плацебо. К тому же в этом исследовании выявлено положительное влияние инфликсимаба на качество жизни пациентов и их физическую активность [2].
В исследовании N. Woolacott и соавторов [53] после 16 нед терапии инфликсимабом отмечена существенная разница в достижении индексов оценки заболевания по сравнению с плацебо-группой. Так, уровень больных, достигших ACR 20, составил 65% (9,6% — в группе плацебо), ACR 50 — 46,2% (0%) и ACR 70 — 28,8% (0%). Индекс PSARC к концу лечения составил 75%.
Тем не менее, FDA полагает, что применение препарата может усугублять сердечную недостаточность у пациентов с нарушением функции сердца, а также способствовать возникновению туберкулеза, гистоплазмоза, листериоза и пневмоцистоза. Также установлено, что инфликсимаб вызывает повышение уровня трансаминаз по сравнению с плацебо. Вместе с тем в исследовании C. Antoni и соавторов [2] после 24 нед лечения больных ПсА инфликсимабом не отмечено возникновения оппортунистических инфекций, нарушений функции сердца, демиелинизации, аутоиммунных реакций или анафилаксии.
Голимумаб
Препарат представлен человеческими моноклональными антителами, направленными на TNF-α. В исследовании A. Kavanaugh и соавторов [21] отмечена эффективность и в целом хорошая переносимость голимумаба, вводимого подкожно каждые 4 нед в течение полугода. К 14-й недели лечения терапевтический эффект ACR 20 был достигнут у 51% больных, получавших препарат в дозе 50 мг, и у 41% — в дозе 100 мг в сравнении с 9% в группе плацебо. Значительное улучшение отмечено также по индексам ACR 50 и ACR 70 у пациентов, принимавших голимумаб, по сравнению с группой плацебо. Различия в изменении самочувствия и клинического статуса в группах больных, принимавших 50 и 100 мг препарата, были незначительными вне зависимости от того, проводилось ли ранее лечение метотрексатом. На фоне терапии голимумабом у пациентов отмечалось существенное улучшение физической активности, качества жизни, связанного со здоровьем, и уменьшение выраженности энтезита [21].
При изучении профиля безопасности побочные эффекты отмечены у 65% больных, получавших голимумаб (59% в группе плацебо). Из наиболее частых регистрировали назофарингит и инфекцию верхних дыхательных путей (у 9% больных). Серьезные осложнения выявлены у 2% пациентов (по сравнению с 6% в группе плацебо) и включали злокачественные новообразования, в 2 случаях — базальноклеточная карцинома и в одном — рак предстательной железы.
Цертолизумаба пэгол
Цертолизумаба пэгол (ЦЗП) является пегилированным Fab-9 фрагментом гуманизированного антитела к TNF-α [51]. Если адалимумаб, этанерцепт и инфликсимаб содержат Fc-регион на IgG1, что может приводить к антителозависимой, клеточно-опосредованной и комплементзависимой цитотоксичности, у ЦЗП, не содержащего Fc-регион, эти виды цитотоксичности отсутствуют.
К настоящему времени опубликованы данные исследования, посвященного изучению эффективности и безопасности ЦЗП на большом массиве больных ПсА [37]. Участники исследования (n=409) были распределены на три группы: получающие плацебо, ЦЗП — в дозе 200 мг 1 раз в 2 нед и ЦЗП — в дозе 400 мг 1 раз в 4 нед. Спустя 12 нед лечения ACR 20 ответ был существенно выше в группах, получавших препарат в режимах 200 мг/2 нед и 400 мг/4 нед, чем среди пациентов плацебо-группы (58,0 и 51,9% в сравнении с 24,3% соответственно; p<0,001), причем улучшение наблюдалось уже на 1-й неделе терапии. Отмечен также более выраженный положительный эффект по критериям PSARC на 24-й неделе лечения в группах больных, получавших препарат 200 мг/2 нед и 400 мг/4 нед, чем среди пациентов плацебо-группы (78,3; 77,0 и 33,1% соответственно; p<0,001). Кроме этих результатов, отмечалось улучшение со стороны кожных проявлений, энтезита, дактилита и поражений ногтей.
Наиболее частыми побочными эффектами зафиксированы диарея (3,6% больных, получавших ЦЗП, в сравнении с 2,9% плацебо-группы) и головная боль (3,6 и 1,5% соответственно). Из распространенных инфекционных осложнений отмечали назофарингит (8,7 и 7,4% соответственно) и инфекцию верхних дыхательных путей (7,8 и 5,1% соответственно). В целом большинство побочных эффектов расценивались как легкие или умеренные. Среди 273 больных, принимавших ЦЗП в течение 24 нед, констатированы 2 летальных исхода: в одном случае — внезапная смерть неизвестной причины, в другом — вследствие инфаркта миокарда [37].
Адалимумаб
Препарат является полностью человеческими моноклональными антителами, направленными против TNF-α, и применяется при иммуно-опосредованных заболеваниях [7].
Имеются сообщения об эффективности адалимумаба и при ПсА. Так, в частности, к концу 48-й недели терапии препаратом у 151 больного улучшение, оцениваемое по индексам ACR 20, ACR 50 и ACR 70, было отмечено в 56; 44 и 30% случаев соответственно [13]. Кроме того, выявлена положительная динамика показателей радиографического поражения суставов по сравнению с группой плацебо.
Аналогичные результаты получены и в другом исследовании — ADEPT, выполненном P.J. Mease и соавторами [33]. Сообщается, что максимальные показатели ACR 20, ACR 50 и ACR 70 были отмечены к 60–72-й неделе терапии адалимумабом, вводимом подкожно в дозировке 40 мг 1 раз в 2 нед. Исследователи отмечают, что адалимумаб обладает клинической и радиографической эффективностью вне зависимости от того, получал ли больной ранее метотрексат [13]. Подчеркивается хорошая переносимость препарата и низкая частота побочных эффектов, типичных для всей группы ингибиторов TNF-α. Отметим, что не выявлено клинически значимых отличий в частоте и характере побочных эффектов в первые 48 нед лечения и к концу 104-й недели. Среди наиболее частых побочных эффектов за 2-летний период наблюдения отмечались инфекция верхних дыхательных путей (в 21,5% случаев), назофарингит (17,4%) и синусит (10,7%) [7, 33].
Данные об эффективности ингибиторов TNF-α, оцениваемые по достижению улучшения на 20% индекса ACR и на 75% — PASI на основании ряда исследований, представлены в таблице [18].
Устекинумаб
Относительно недавно в клинических исследованиях продемонстрирована эффективность препаратов, ингибирующих р40 субъединицу двух цитокинов ИЛ-12 и -23 — устекинумаба, бриакинумаба и бродалумаба. Результаты 12-недельной терапии свидетельствуют, что у больных псориазом, получавших устекинумаб или бриакинумаб, отмечали лучший клинический ответ, чем при лечении этанерцептом [42]. Вполне вероятно, что эти препараты могут составить конкуренцию ингибиторам TNF-α, если будет доказана их эффективность и хорошая переносимость в долгосрочный период.
Таблица. Результаты клинических исследований ингибиторов TNF-α при ПсА
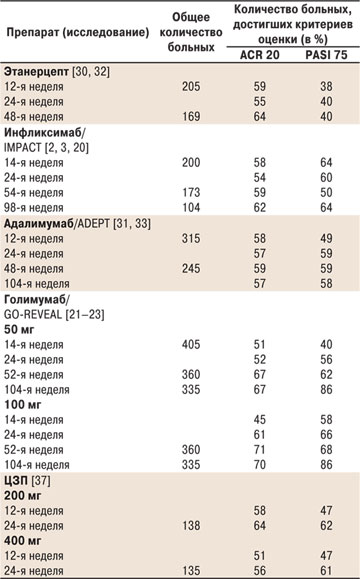
Адаптировано по: D.Q.Huynh и A.Kavanaugh (2014) [18]
Как отмечалось выше, ИЛ-12, -17 и -23 как ключевые цитокины играют важную роль в иммунопатогенезе ПсА, вызывая, в свою очередь, продукцию провоспалительных цитокинов и ускоряя остеокластогенез и деградацию хряща [48].
Устекинумаб — полностью человеческие моноклональные антитела (IgG1κ), направленные против субъединицы р40 ИЛ-12 и одновременно ИЛ-23 [27]. В 2009 г. были опубликованы результаты второй фазы двойного слепого рандомизированного плацебо-контролируемого перекрестного исследования устекинумаба, которые выявили существенное улучшение со стороны кожных и суставных проявлений у больных псориазом [16]. Пациенты с активным ПсА были распределены на две группы — 76 из них (1-я группа) 1–4-ю неделю получали устекинумаб (в среднем — в дозе 63 мг), а затем на 12-й и 16-й неделе — плацебо. Во 2-ю группу вошли 70 человек, получавшие плацебо в 1–4-ю неделю и далее — устекинумаб (63 мг) на 12-й и 16-й неделе.
К 12-й неделе 42,1% больных, получавших устекинумаб, достигли уровня ответа ACR 20 по сравнению с 14,3% в плацебо-группе. Более того, у 50% больных группы устекинумаба отмечено улучшение выраженности утренней скованности по сравнению с отсутствием эффекта в группе плацебо. В ходе исследования сделан вывод, что устекинумаб способствует уменьшению выраженности клинических проявлений ПсА [16].
В 2013 г. на ежегодном Собрании ACR были представлены данные третьей фазы двойного слепого плацебо-контролируемого исследования эффективности устекинумаба для лечения при ПсА. В исследовании участвовали пациенты с активным ПсА (≥5 болезненных, ≥5 отечных суставов, уровень СРБ ≥3,0 мг/л), которые были распределены на три группы: 1-я — получавшие устекинумаб в дозе 45 мг (n=205), 2-я — в дозе — 90 мг (n=204) и плацебо-группа (n=206) [29].
На 24-й неделе лечения критерия ACR 20 достигли 87 (42,4%) участников 1-й группы, 101 (49,5%) — 2-й группы по сравнению с 47 (22,8%) больными в плацебо-группе. Положительная динамика сохранялась и на 52-й неделе. На 16-й неделе терапии количество пациентов с побочными эффектами в группах устекинумаба и плацебо было одинаково — 171 из 409 (41,8%) в двух группах устекинумаба против 86 из 206 (40,0%) плацебо-группы. Таким образом, в ходе исследования доказана эффективность устекинумаба по сравнению с плацебо по различным критериям: ACR 20/50/70, DAS28, PASI, HAQ-DI и т.д. [29].
На основании ряда исследований продемонстрировано, что устекинумаб в целом хорошо переносится больными псориазом и ПсА. Наиболее частыми его побочными эффектами являются инфекции верхних дыхательных путей, назофарингит, фаринголарингеальная боль, повышение уровня креатинфосфокиназы и лимфопения. Со стороны нервной системы — головная боль и головокружение. Достаточно редко отмечали такие осложнения, как диарея, боль в спине, миалгия и эритема в местах инъекций.
Бродалумаб
Препарат представляет человеческие моноклональные антитела против рецептора-А ИЛ-17. Сообщается о результатах проведенной второй фазы исследования бродалумаба у больных ПсА. 168 пациентов были распределены на три подгруппы: 57 получали препарат подкожно в дозе 140 мг, 56 — 280 мг и 55 — плацебо в 1-й день, спустя 1 нед, на 2; 4; 6; 8 и 10-й неделе курса терапии [38]. Спустя 12 нед лечения пациенты, получавшие 140 и 280 мг бродалумаба, имели выше индекс ACR 20, чем в плацебо-группе (37 и 39% по сравнению с 18% соответственно). Индекс достижения ACR 50 был идентичен для обеих групп (14%), находившихся на лечении бродалумабом, по сравнению с 4% в группе плацебо. К 12-й неделе серьезные побочные эффекты отмечены у 3% больных в группах бродалумаба и у 2% — группы плацебо. Авторы полагают, что рецепторы-А ИЛ-17 являются потенциально важными мишенями при лечении ПсА, блокируя которые удается подавить патогенетические звенья псориатического процесса, что приводит к клиническому улучшению со стороны кожных и суставных проявлений [38].
Апремиласт
В настоящее время находятся в разработке низкомолекулярные препараты, направленные на коррекцию альтернативных патогенетических механизмов псориатического процесса, в частности ингибиторы ФДЭ-4. Как отмечалось, ФДЭ-4 регулирует иммунные и воспалительные процессы с помощью контроля внутриклеточного уровня цАМФ и дальнейших процессов пути протеинкиназы-А [10, 41]. В свою очередь, при изменении продукции ряда ключевых воспалительных цитокинов миелоидными и лимфоидными клетками происходит изменение иммунного ответа ФДЭ-4, что предполагает перспективность изучения роли специфических ингибиторов фермента в генезе различных заболеваний.
Ингибитор ФДЭ-4 апремиласт представляет собой низкомолекулярный препарат, повышающий уровень внутриклеточного цАМФ, что в результате подавляет секрецию TNF-α [42]. Кроме того, апремиласт ингибирует экспрессию провоспалительных цитокинов и повышает экспрессию противовоспалительных медиаторов, таких как ИЛ-10 [24, 45].
К настоящему времени уже опубликованы данные второй и третьей стадии клинического исследования апремиласта с участием внушительного контингента больных ПсА. В исследовании PALACE (Psoriatic Arthritis Long-Term Assessment Of Clinical Efficacy) изучали клиническую эффективность и безопасность апремиласта у больных ПсА [24]. Исследование проводили с участием 500 больных, рандомизированных на три группы: 1-я — получавшие препарат по 30 мг 2 раза в сутки, 2-я —по 20 мг 2 раза в сутки и плацебо. Первичным критерием эффективности являлось достижение ACR 20, вторичными — оценка индексов ACR 50/70, качества жизни, обусловленного здоровьем. К 16-й неделе терапии выявлена существенная эффективность в достижении ACR 20 в подгруппах больных, получавших апремиласт по 20 мг 2 раза в сутки (31%) и по 30 мг 2 раза в сутки (40%) по сравнению с плацебо (19%, p<0,001). Значительный прогресс отмечен и по повышению физической активности больных и уменьшению кожных проявлений псориаза. Препарат хорошо переносился больными, а из наиболее частых побочных эффектов отмечали желудочно-кишечные расстройства, редко явившиеся причиной прерывания терапии. Примечательно, что в PALACE-4 не отмечено оппортунистических инфекций, включая туберкулез, злокачественные новообразования; а также сердечно-сосудистых заболеваний. Из наиболее частых побочных эффектов, помимо тошноты и диареи, регистрировали инфекцию верхних дыхательных путей и головную боль [8, 24, 42].
В перспективе позиция такого препарата, как апремиласт, выглядит убедительной в качестве эффективного выбора для лечения больных ПсА, особенно у лиц с умеренной активностью заболевания и у которых возникает вопрос выбора препарата по профилю его побочных эффектов. В настоящее время принципы подхода к лечению ПсА выглядят оптимистичными, благодаря полученным результатам и проходящим многочисленным исследованиям. Несомненно, эти исследования позволят внедрить в клиническую практику дополнительные препараты и новые терапевтические стратегии для оптимизации помощи больным с таким распространенным и серьезным заболеванием, как ПсА.
Следует отметить, что ПсА является хроническим воспалительным заболеванием с выраженной гетерогенностью клинических проявлений, включая поражения кожи и ногтей, энтезит, дактилит, поражения позвоночника и периферических суставов [18]. Перспективными выглядят предварительные данные применения других биологических препаратов, в частности: ингибиторов ИЛ-17 (секукинумаба, иксекизумаба), ингибитора Янус-киназ (тофацитиниба) и ингибитора протеинкиназы С (сотрастаурина) [36]. В настоящее время большинство исследований, изучающих новые биологические средства, проходят различные фазы клинических испытаний, по окончанию которых интересно узнать их результаты в лечении как псориаза, так и ПсА.
Список использованной литературы
- 1. Мельниченко А.Б., Кочергин Н.Г., Белоусова Т.А. (2010) Псориатический артрит: клиническая картина, диагностика и терапия. Клин. дерматол. и венерол., 5: 17–24.
- 2. Antoni C., Krueger G.G., de Vlam K. et al. (2005) Infliximab improves signs and symptoms of psoriatic arthritis: results of the IMPACT 2 trial. Ann. Rheum. Dis., 64: 1150–1157 (doi:10.1136/ard.2004.032268).
- 3. Antoni C., Kavanaugh A., van der Heijde D. et al. (2008) Two-year efficacy and safety of infliximab treatment in patients with active psoriatic arthritis: findings of the Infliximab multinational psoriatic arthritis controlled trial (IMPACT). J. Rheumatol., 35: 869–876.
- 4. Ash Z., Gaujoux-Viala C., Gossec L. et al. (2012) A systemic literature review of drug therapies for the treatment of psoriatic arthritis: current evidence and meta-analysis informing the EULAR recommendations for the management of psoriatic arthritis. Ann. Rheum. Dis., 71: 319–326 (doi:10.1136/ard.2011.150995).
- 5. Baumer W., Hoppmann J., Rundfeldt C. et al. (2007) Highly selective phosphodiesterase 4 inhibitors for the treatment of allergic skin diseases and psoriasis. Inflamm. Allergy Drug Targets., 6(1): 17–26.
- 6. Behrens F., Finkenwirth C., Pavelka K. et al. (2013) Leflunomide in psoriatic arthritis: results from a large European prospective observational study. Arthritis Care Res., 65 (3): 464—470.
- 7. Burmester G.R., Panaccione R., Gordon K.B. et al. (2013) Adalimumab: long-term safety in 23 458 patients from global clinical trials in rheumatoid arthritis, juvenile idiopathic arthritis, ankylosing spondylitis, psoriatic arthritis, psoriasis and Crohn’s disease. Ann. Rheum. Dis., 72: 517–524 (doi:10.1136/annrheumdis-2011–201244).
- 8. Cauli A., Porru G., Piga M. et al. (2014) Clinical potential of apremilast in the treatment of psoriatic arthritis. Immunotargets Ther., 3: 91–96.
- 9. Ciocon D.H., Kimball A.B. (2007) Psoriasis and psoriatic arthritis: separate or one and the same? Br. J. Dermatol., 157(5): 850–860.
- 10. Conti M., Beavo J. (2007) Biochemistry and physiology of cyclic nucleotide phosphodiesterases: essential components in cyclic nucleotide signaling. Annu. Rev. Biochem., 76: 481–511.
- 11. Day M.S., Nam D., Goodman S. et al. (2012) Psoriatic Arthritis. J. Am. Acad. Orthop. Sur., 20: 28–37.
- 12. Gladman D.D., Antoni C., Mease P. et al. (2005) Psoriatic arthritis: epidemiology, clinical features, course, and outcome. Ann. Rheum. Dis., 64 (Suppl. II): ii14–ii17 (doi:10.1136/ard.2004.032482).
- 13. Gladman D.D., Mease P.J., Ritchlin C.T. et al. (2007) Adalimumab for long-term treatment of psoriatic arthritis: forty-eight week data from the adalimumab effectiveness in psoriatic arthritis trial. Arthritis Rheum., 56(2): 476–488.
- 14. Gossec L., Smolen J.S., Gaujoux-Viala C. et al. (2012) European League Against Rheumatism recommendations for the management of psoriatic arthritis with pharmacological therapies. Ann. Rheum. Dis., 71: 4–12 (doi:10.1136/annrheumdis-2011–200350).
- 15. Gottlieb A., Korman N.J., Gordon K.B. et al. (2008) Guidelines of care for the management of psoriasis and psoriatic arthritis. Section 2. Psoriatic arthritis: Overview and guidelines of care for treatment with an emphasis on the biologics. J. Am. Acad. Dermatol., 58: 851–864.
- 16. Gottlieb A., Menter A., Mendelsohn A. et al. (2009) Ustekinumab, a human interleukin 12/23 monoclonal antibody, for psoriatic arthritis: randomised, double-blind, placebo-controlled, crossover trial. Lancet, 373(9664): 633–640 (doi: 10.1016/S0140–6736(09)60140–9).
- 17. Henno A., Blacher S., Lambert C.A. et al. (2010) Histological and transcriptional study of angiogenesis and lymphangiogenesis in uninvolved skin, acute pinpoint lesions and established psoriasis plaques: an approach of vascular development chronology in psoriasis. J. Dermatol. Sci., 57(3): 162–169.
- 18. Huynh D.Q., Kavanaugh A. (2014) Psoriatic arthritis: current therapy and future approaches. Rheumatology, 263: 1–9 (doi: 10.1093/rheumatology/keu237).
- 19. Johansen C., Usher P.A., Kjellerup R.B. et al. (2009) Characterization of the interleukin-17 isoforms and receptors in lesional psoriatic skin. Br. J. Dermatol., 160(2): 319–324.
- 20. Kavanaugh A., Krueger G.G., Beutler A. et al. (2007) Infliximab maintains a high degree of clinical response in patients with active psoriatic arthritis through 1 year of treatment: results from the IMPACT2 trial. Ann. Rheum. Dis., 66: 498–505.
- 21. Kavanaugh A., McInnes I., Mease P. et al. (2009) Golimumab, a new human tumor necrosis factor alpha antibody, administered every four weeks as a subcutaneous injection in psoriatic arthritis. Arthritis Rheum., 60(4): 976–986.
- 22. Kavanaugh A., van der Heijde D., McInnes I. et al. (2012) Golimumab in psoriatic arthritis: one-year clinical efficacy, radiographic, and safety results from a randomized, placebo-controlled trial. Arthritis Rheum., 64: 2504–2517.
- 23. Kavanaugh A., McInnes I., Mease P. et al. (2013) Clinical efficacy, radiographic and safety findings through 2 years of golimumab treatment in patients with active psoriatic arthritis: results from a long-term extension of the randomized placebo-controlled GO-REVEAL study. Ann. Rheum. Dis., 72: 1777–1785.
- 24. Kavanaugh A., Mease P.J., Gomez-Reino J.J. et al. (2014) Treatment of psoriatic arthritis in a phase 3 randomised, placebo-controlled trial with apremilast, an oral phosphodiesterase 4 inhibitor. Ann. Rheum. Dis., 0: 1–7 (doi:10.1136/annrheumdis-2013–205056).
- 25. Kingsley G.H., Kowalczyk A., Taylor H. et al. (2012) A randomized placebo-controlled trial of methotrexate in psoriatic arthritis. Rheumatology, 51(8): 1368–1377.
- 26. Kivelevitch D., Mansouri B., Menter A. (2014) Long term efficacy and safety of etanercept in the treatment of psoriasis and psoriatic arthritis. Biologics, 8: 169–182.
- 27. Krueger G., Langley R., Leonardi C. et al. (2007) A human interleukin-12/23 monoclonal antibody for the treatment of psoriasis. N. Engl. J. Med., 356: 580–592.
- 28. Lowes M.A., Chamian F., Abello M.V. et al. (2005) Increase in TNF-a and inducible nitric oxide synthase-expressing dendritic cells in psoriasis and reduction with efalizumab (anti-CD11a). Proc. Natl. Acad. Sci. USA., 102(52): 19057–1962.
- 29. McInnes I.B., Kavanaugh A., Gottlieb A.B. et al. (2013) Efficacy and safety of ustekinumab in patients with active psoriatic arthritis: 1 year results of the phase 3, multicentre, double-blind, placebo-controlled PSUMMIT 1 trial. Lancet, 382(9894): 780–789 (doi:10.1016/S0140–6736(13)60594–2).
- 30. Mease P.J., Goffe B.S., Metz J. et al. (2000) Etanercept treatment of psoriatic arthritis and psoriasis: a randomized trial. Lancet, 356: 385–390.
- 31. Mease P.J., Gladman D.D., Ritchlin C.T. et al. (2005) Adalimumab for the treatment of patients with moderately to severely active psoriatic arthritis: results of a double-blind, randomized, placebo-controlled trial. Arthritis Rheum., 52: 3279–3289.
- 32. Mease P.J., Kivitz A.J., Burch F.X. et al. (2006) Continued inhibition of radiographic progression in patients with psoriatic arthritis following 2 years of treatment with etanercept. J. Rheumatol., 33(4): 712–721.
- 33. Mease P.J., Ory P., Sharp J.T. et al. (2009) Adalimumab for long-term treatment of psoriatic arthritis: 2-year data from the Adalimumab Effectiveness in Psoriatic Arthritis Trial (ADEPT). Ann. Rheum. Dis., 68: 702–709 (doi:10.1136/ard.2008.092767).
- 34. Mease P.J. (2011) Measures of psoriatic arthritis. Arthritis Care Res., 63(S11): S64–S85 (doi: 10.1002/acr.20577).
- 35. Mease P.J. (2013) Methotrexate in psoriatic arthritis. Bull. Hosp. Jt. Dis., 71(Suppl. 1): S41–45.
- 36. Mease P.J., Armstrong A.W. (2014) Managing patients with psoriatic disease: the diagnosis and pharmacologic treatment of psoriatic arthritis in patients with psoriasis. Drugs, 74: 423–441 (doi:10.1007/s40265–014–0191-y).
- 37. Mease P.J., Fleischmann R., Deodhar А.А. (2014) Effect of certolizumab pegol on signs and symptoms in patients with psoriatic arthritis: 24-week results of a Phase 3 double-blind randomized placebo-controlled study (RAPID-PsA). Ann. Rheum. Dis., 73: 48–55 (doi:10.1136/annrheumdis-2013–203696).
- 38. Mease P.J., Genovese M.С., Greenwald M.W. et al. (2014) Brodalumab, an anti-IL17RA monoclonal antibody, in psoriatic arthritis. N. Engl. J. Med., 370: 2295–2306 (doi:10.1056/NEJMoa1315231).
- 39. Menter A., Korman N.J., Elmets C.A. et al. (2009) Guidelines of care for the management of psoriasis and psoriatic arthritis. Section 4. Guidelines of care for the management and treatment of psoriasis with traditional systemic agents. J. Am. Acad. Dermatol., 61: 451–485.
- 40. Nestle F.O., Kaplan D.H., Barker J. (2009) Psoriasis. N. Engl. J. Med., 361(5): 496–509.
- 41. Page C.P., Spina D. (2011) Phosphodiesterase inhibitors in the treatment of inflammatory diseases. Handb. Exp. Pharmacol., 204: 391–414.
- 42. Palfreeman A.C., McNamee K.E., McCann F.E. (2013) New developments in the management of psoriasis and psoriatic arthritis: a focus on apremilast. Drug Des. Devel. Ther., 7: 201–210.
- 43. Piskin G., Sylva-Steenland R.M.R., Bos J.D. et al. (2006) In vitro and in situ expression of IL-23 by keratinocytes in healthy skin and psoriasis lesions: enhanced expression in psoriatic skin. J. Immunol., 176(3): 1908–1915.
- 44. Raychaudhuri S.P., Raychaudhuri S.K., Genovese M.C. (2012) IL-17 receptor and its functional significance in psoriatic arthritis. Mol. Cell. Biochem., 359(1–2): 419–429.
- 45. Schafer P.H., Partona A., Capone L. et al. (2014) Apremilast is a selective PDE4 inhibitor with regulatory effects on innate immunity. Cell Signal., 26: 2016–2029 (doi:10.1016/j.cellsig.2014.05.014).
- 46. Scottish Intercollegiate Guidelines Network (SIGN) (2010) Diagnosis and management of psoriasis and psoriatic arthritis in adults. Edinburgh, SIGN: 1–65 (http://www.sign.ac.uk/pdf/sign121.pdf).
- 47. Serezani C.H., Ballinger M.N., Aronoff D.M. et al. (2008) Cyclic AMP: master regulator of innate immune cell function. Am. J. Respir. Cell. Mol. Biol., 39(2): 127–132.
- 48. Spadaro A., Montepaone M., Lubrano E. (2014) A novel biological target for the treatment of psoriatic arthritis. Immunotherapy, 6(5): 515–518 (doi:10.2217/imt.14.39).
- 49. Veale D.J. (2013) Psoriatic arthritis: recent progress in pathophysiology and drug development. Arthritis Res. Ther., 15(224): 1–6 (doi:10.1186/ar4414).
- 50. Villaseñor-Park J., Wheeler D., Grandinetti L. (2012) Psoriasis: evolving treatment for a complex disease. Cleve. Clin. J. Med., 79(6): 413–423.
- 51. Weger W. (2010) Current status and new developments in the treatment of psoriasis and psoriatic arthritis with biological agents. Br. J. Pharmacol., 160: 810–820.
- 52. Wilson F.C., Icen M., Crowson C.S. et al. (2009) Incidence and clinical predictors of psoriatic arthritis in patients with psoriasis: a population-based study. Arthritis Rheumatol., 61(2): 233–239.
- 53. Woolacott N., Bravo Vergel Y., Hawkins N. et al. (2006) Etanercept and infliximab for the treatment of psoriatic arthritis: a systematic review and economic evaluation. Health Technol. Assess., 10(31): 1–239.
- 54. Yawalkar N., Tscharner G.G., Hunger R.E. et al. (2009) Increased expression of IL-12p70 and IL-23 by multiple dendritic cell and macrophage subsets in plaque psoriasis. J. Dermatol. Sci., 54(2): 99–105.
- 55. Zaba L.C., Fuentes-Duculan J., Eungdamrong N.J. et al. (2009) Psoriasis is characterized by accumulation of immunostimulatory and Th1/Th17 cell-polarizing myeloid dendritic cells. J. Invest. Dermatol., 129(1): 79–88.
- 56. Zaba L.C., Fuentes-Duculan J., Eungdamrong N.J. et al. (2010) Identification of TNF-related apoptosis-inducing ligand and other molecules that distinguish inflammatory from resident dendritic cells in patients with psoriasis. J. Allergy Clin. Immunol., 125(6): 1261–1268.
Адрес для переписки:
Тарадин Геннадий Геннадьевич
Украина, 83003, Донецк, просп. Ильича, 16
Донецкий национальный медицинский
университет им. Максима Горького,
кафедра внутренней медицины № 1
Е-mail: taradin@inbox.ru

Leave a comment