Характеристика імунного статусу та структурно-функціонального стану серця у пацієнтів із дифузним міокардитом у динаміці захворювання
Резюме. Резюме. Мета роботи — виявити ранні лабораторні маркери, асоційовані з тяжким перебігом дифузного міокардиту, та вивчити особливості імунної відповіді в різні строки від початку захворювання, а також їх взаємозв’язок зі структурно-функціональним станом серця. У периферичній крові визначали концентрації Т- і В-лімфоцитів, антитіл до міокарда (АТм), цитокінів інтерлейкіну (ІЛ)-1β, ІЛ-10, фактора некрозу пухлини (ФНП)-α, а також активність реакції бласттрансформації лімфоцитів, індукованих міокардом (РБТЛм); за допомогою двовимірної ехокардіографії розраховували величину фракції викиду та індекси кінцево-діастолічного і кінцево-систолічного об’єму лівого шлуночка (ЛШ); на основі результатів рентгенографії визначали величину кардіоторакального індексу. Встановлено, що дифузний міокардит у 1-й місяць від початку захворювання характеризується активацією клітинної ланки імунітету і високою концентрацією прозапальних цитокінів, що супроводжується ремоделюванням та зниженням систолічної функції ЛШ. Через 6 міс від початку захворювання відбувається зниження активності імунозапальної реакції з переключенням імунної відповіді на гуморальний тип і поступове відновлення систолічної функції ЛШ. Виявлено ранні лабораторні маркери, що асоціюються із тяжким перебігом дифузного міокардиту, до них належать: ІЛ-1β, ФНП-α, ІЛ-10, титр АТм, активність РБТЛм.
Введение
Проблема острого диффузного миокардита (ОДМ) является актуальной для современной кардиологии, поскольку это заболевание характеризуется высокой инвалидностью и смертностью, в особенности среди лиц молодого возраста (Heymans S., 2007; Коваленко В.Н., 2008; Мравян С.Р., Гуревич М.А., 2008; Kindermann I. et al., 2008; Blauwet L.A. et al., 2010). На сегодняшний день изменения показателей иммунного статуса в ходе развития воспалительного процесса в миокарде и их связь со структурно-функциональным состоянием сердца остаются недостаточно изученными (Canningham M.W., 2006; Tousilus D. et al., 2007; Kuhl U., Schultheiss H.P., 2009; Rose N.R., 2009; Elamm C. et al., 2012). Настоящая работа посвящена поиску дополнительных лабораторных маркеров тяжелого течения диффузного миокардита и углублению существующих представлений о взаимосвязи структурно-функционального состояния сердца и активности иммунопатологических реакций в динамике заболевания.
Цель работы — выявить ранние лабораторные маркеры, ассоциированные с тяжелым течением диффузного миокардита, изучить особенности иммунного ответа в различные сроки от начала заболевания, а также их связь со структурно-функциональным состоянием сердца.
Объекты и методы исследования
Всего обследовано 42 больных с клиническими проявлениями ОДМ — 29 мужчин и 13 женщин в 1-й месяц от начала заболевания, через 6 и 12 мес наблюдения. Все пациенты находились на обследовании и лечении в отделе некоронарогенных болезней сердца и клинической ревматологии ГУ «ННЦ «Институт кардиологии им. Н.Д. Стражеско» НАМН Украины».
Диагноз устанавливали на основании диагностических критериев, изложенных в последних Рекомендациях Рабочей группы по заболеваниям миокарда и перикарда Европейского общества кардиологов 2013 г. (Сaforio A.L.P. et al., 2013). Данные критерии состоят из двух групп, первая группа включает клинические проявления, к которым относятся: появление боли в груди, одышки, усталости, сердцебиения, синкопальных состояний и кардиогенного шока. Ко второй группе относятся вновь возникшие изменения на электрокардиограмме (ЭКГ), маркеры лизиса кардиомиоцитов, нарушения глобальной или региональной сократимости сердца, выявленные при помощи визуализационных методик, а также характерные изменения при магнитно-резонансной томографии сердца. Для установления диагноза в соответствии с введенным Рабочей группой новым термином «клинически подозреваемый миокардит» необходимо наличие ≥1 клинического проявления и ≥1 диагностического критерия. При этом необходимо отсутствие значимого (≥50%) стеноза коронарных сосудов и любой другой кардиальной патологии, которая может иметь подобные клинические проявления.
Детально изучали анамнез заболевания с целью уточнения времени появления первых жалоб со стороны сердечно-сосудистой системы и их возможной связи с недавно перенесенной инфекцией, обострением инфекционного заболевания или активацией очага хронической инфекции. Особое внимание также уделяли изучению первичной документации: заново возникшим нарушениям ритма, проводимости и другим изменениям ЭКГ, появлению симптомов и объективных признаков сердечной недостаточности, кардиомегалии, лабораторным показателям (повышение концентрации кардиоспецифических ферментов и тропонинов), данным физикального обследования.
Пациенты находились на стандартной терапии сердечной недостаточности, в соответствии с последними рекомендациями Европейского общества кардиологов, которые включали: блокаторы бета-адренорецепторов, ингибиторы ангиотензинпревращающего фермента, антагонисты минералокортикоидных рецепторов и диуретики (McMurray J.V. et al., 2012). Нестероидные противовоспалительные препараты, глюкокортикоиды, иммуносупрессанты, ингибиторы фосфодиэстеразы, препараты интерферона и другие лекарственные средства, способные оказывать прямое влияние на показатели иммунного статуса и не имеющие четкой доказательной базы при миокардите, не применялись (Dennert R. et al., 2008; Howlett J.G. et al., 2009; Schultheiss H.P. et al., 2011).
Исследование иммунного статуса проведено в лаборатории иммунологии ГУ «ННЦ «Институт кардиологии им. Н.Д. Стражеско» НАМН Украины». В периферической крови, взятой натощак, исследовали такие иммунологические показатели:
- количество лимфоцитов с антигенными детерминантами CD8 (цитотоксические Т-клетки), CD16 (Т-киллеры), CD19 (В-лимфоциты), с использованием моноклональных антител фирмы «Bioprobe BW» (Нидерланды). Учет реакции проводили на проточном цитофлюориметре фирмы «Beckton Dickens» (США);
- интенсивность пролиферативного ответа лимфоцитов на специфический антиген к тканям миокарда оценивали с помощью реакции бласттрансформации лимфоцитов (РБТЛм);
- величину титра антител к миокарду (АТм) рассчитывали при помощи реакции связывания комплемента;
- уровни цитокинов в супернатантах мононуклеарных клеток методом иммуноферментного анализа: фактора некроза опухоли (ФНО)-α с использованием тест-системы фирмы «ProCon» (Россия), интерлейкина (ИЛ)-1β и ИЛ-10 с использованием тест-системы «Цитокин» (Санкт-Петербург, Россия). Супернатанты получали после 24 ч инкубации при температуре 37 °С.
Показатели структурно-функционального состояния сердца определяли с помощью эхокардиографического (эхоКГ)-исследования на аппарате «Imagic-5000» («Kontron Medical», Франция) и рентгенографии грудной полости на аппарате «Shimadzu» (Япония).
ЭхоКГ-исследование включало измерение в В-режиме конечно-диастолического (КДО) и конечно-систолического объема (КСО) левого желудочка (ЛЖ), а также расчет величины фракции выброса (ФВ) ЛЖ биплановым методом дисков по Симпсону (Шиллер Н., Осипов М.А., 2005). Индекс КДО (ИКДО) и индекс КСО (ИКСО) ЛЖ получали путем вычисления соотношения величин КДО и КСО ЛЖ к площади поверхности тела.
Кроме того, всем пациентам был проведен расчет кардиоторакального индекса (КТИ).
Все участники исследования имели систолическую дисфункцию ЛЖ в соответствии с последней редакцией «Классификации, стандартов диагностики и лечения сердечно-сосудистых заболеваний», используемых в Украине, — ФВ ЛЖ ≤45% (Коваленко В.М. та співавт., 2011).
Результаты исследования обработаны при помощи программ Microsoft Excel и Statistica 6 путем вычисления средней арифметической (М) и ошибки средней арифметической (m). Достоверность различий устанавливали по t-критерию Стьюдента, различия показателей в группах пациентов считали достоверными при р<0,05. Для выявления степени корреляционных связей между показателями использовали коэффициент парной корреляции Пирсона.
Результаты и их обсуждение
Как видно из данных, представленных на рис. 1, при изучении показателей клеточного звена иммунитета было установлено, что максимальные концентрации CD8 и CD16 выявляли в 1-й месяц от начала заболевания, затем через 6 мес наблюдали их снижение на 23,8 и 26,4% соответственно (р<0,05). В то же время к 6-му месяцу от начала заболевания наблюдали рост концентрации CD19 (В-лимфоцитов), которые при дальнейшем развитии иммунопатологических реакций ответственны за синтез антител. Активность РБТЛм, характеризующая аутосенсибилизацию лимфоцитов к тканям миокарда, была максимальной в 1-й месяц от начала заболевания, а через 6 и 12 мес происходило ее снижение на 37,4 и 42,1% соответственно (р<0,02).
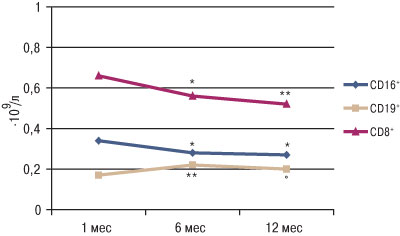
Рис. 1. Содержание CD8 и CD16 (Т-лимфоцитов) и CD19+ (B-лимфоцитов) в периферической крови пациентов с диффузным миокардитом в различные сроки от начала заболевания. Различия показателя достоверны по сравнению с таковыми в 1-й месяц от начала заболевания: *р<0,05, **р<0,02; различия показателя достоверны по сравнению с таковым через 6 мес от начала заболевания: °р<0,05
Выраженная активность клеточного иммунитета в дебюте заболевания закономерно сопровождалась высоким содержанием провоспалительных цитокинов — ФНО-α и ИЛ-1β, в то время как концентрация противовоспалительного ИЛ-10 была наименьшей (рис. 2). В дальнейшем через 6 и 12 мес наблюдали снижение активности системной воспалительной реакции, характеризующееся достоверным снижением концентрации провоспалительных цитокинов и повышением содержания противовоспалительного ИЛ-10.
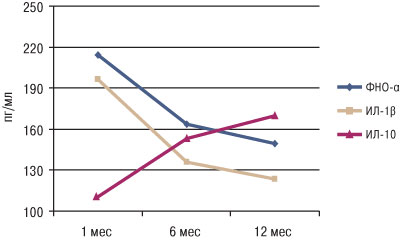
Рис. 2. Содержание цитокинов в супернатанте мононуклеарных клеток у пациентов с диффузным миокардитом в различные сроки от начала заболевания. Различия показателя достоверны по сравнению с таковыми в 1-й месяц от начала заболевания: *р<0,05, **р<0,01
При изучении частоты выявления АТм установлено, что в 1-й месяц от начала заболевания она составила 34%, через 6 мес — 58%, а через 12 мес наблюдения — 28% случаев. Средний титр АТм достоверно повышался к 6-му месяцу от начала заболевания в среднем на 41,0% (р<0,01), а через 12 мес установлено его достоверное снижение практически до исходного уровня. Повышение частоты выявления и рост среднего титра АТм свидетельствуют об активации реакций гуморального иммунитета. Подтверждением этому стали ранее представленные данные, свидетельствующие о достоверном повышении через 6 мес от начала заболевания концентрации В-лимфоцитов (CD19) в периферической крови, которые при трансформации в плазматическую клетку ответственны за синтез антител, в том числе аутоантител к миокарду. К 12-му месяцу в сравнении с 6-м отмечали достоверное снижение титра АТм и концентрации В-лимфоцитов.
Полученные результаты свидетельствуют о том, что в острую стадию миокардита, в первую очередь, активируются реакции клеточного иммунитета, что сопровождается выработкой провоспалительных цитокинов, а при переходе воспалительного процесса в хроническую стадию через 6 мес от начала заболевания происходит переключение иммунного ответа на гуморальный тип с активацией В-лимфоцитов и выработкой кардиоспецифических аутоантител.
При анализе показателей структурно-функционального состояния сердца установлено, что наиболее выраженные признаки ремоделирования сердца и снижения его систолической функции наблюдали в 1-й месяц от начала заболевания, о чем свидетельствовали наибольшие показатели ИКДО и ИКСО ЛЖ, КТИ и низкая величина ФВ ЛЖ (табл. 1). Достоверное увеличение ФВ ЛЖ происходило уже к 6-му месяцу от дебюта диффузного миокардита, а ИКДО и КТИ достоверно снижались через 12 мес от начала заболевания.
Таблица 1. Показатели структурно-функционального состояния сердца у пациентов с диффузным миокардитом в различные сроки от начала заболевания
| Показатель | Величина показателя (М±m) в различные сроки | ||
|---|---|---|---|
| 1 мес | 6 мес | 12 мес | |
| ИКДО ЛЖ, мл/м² | 116,2±9,8 | 96,4±9,4 | 90,2±9,6* |
| ИКСО ЛЖ, мл/м² | 83,9±7,9 | 55,2±5,9* | 46,1±5,1** |
| ФВ ЛЖ, % | 32,3±2,7 | 39,2±2,8* | 44,1±3,1** |
| КТИ, усл. ед. | 0,63±0,04 | 0,58±0,04 | 0,53±0,03* |
Различия показателей достоверны по сравнению с таковыми в первый месяц от начала заболевания: *р<0,05; **р<0,01.
Выявленные изменения структурно-функциональных показателей, очевидно, имеют связь с активностью иммуновоспалительной реакции. Так, наиболее выраженное угнетение систолической функции ЛЖ и увеличение его полости наблюдали в острую стадию заболевания, когда выраженность иммунопатологических реакций клеточного типа была максимальной. Через 6 и 12 мес от начала заболевания происходило постепенное восстановление систолической функции ЛЖ и уменьшение выраженности признаков его ремоделирования, что наблюдали на фоне снижения активности к 6-му месяцу клеточного, а к 12-му месяцу — гуморального звена иммунитета.
При помощи корреляционного анализа нами изучена взаимосвязь иммунологических показателей в 1-й месяц от дебюта ОДМ и данных инструментальных методов исследования через 12 мес от начала заболевания для выделения тех иммунологических маркеров, которые могли бы быть в дальнейшем использованы для раннего прогнозирования структурно-функциональных нарушений со стороны сердца вследствие наличия воспалительного процесса в миокарде. Данные корреляционного анализа представлены в табл. 2.
Таблица 2. Корреляционная связь между иммунологическими показателями в 1-й месяц от начала заболевания и показателями структурно-функционального состояния сердца через 12 мес от начала заболевания
| Показатель | ФВ ЛЖ | ИКДО ЛЖ | КТИ |
|---|---|---|---|
| ИЛ-1β | r=–0,56; р<0,05 | r=0,43; р<0,05 | r=0,31; р>0,05 |
| ИЛ-10 | r=0,64; р<0,01 | r=–0,46; р<0,05 | r=–0,38; р<0,05 |
| ФНО-α | r=–0,62; р<0,01 | r=0,43; р<0,05 | r=0,30; р>0,05 |
| Титр АТм | r=–0,49; р<0,05 | r=0,39; р<0,05 | r=0,16; р>0,05 |
| РБТЛм | r=–0,76; р<0,01 | r=0,30; р>0,05 | r=0,38; р<0,05 |
Выявленные достоверные корреляционные связи показателей структурно-функционального состояния сердца (ИКДО и ФВ ЛЖ, КТИ) различной силы и направленности с концентрациями ИЛ-1β, ИЛ-10, ФНО-α, активностью РБТЛм и титром АТм могут свидетельствовать о прогностической ценности определения этих показателей на ранних стадиях диффузного миокардита.
Таким образом, проведенный комплексный анализ показателей иммунного статуса и структурно-функционального состояния сердца у пациентов с ОДМ позволил установить взаимосвязь активности иммунопатологических реакций с процессами ремоделирования ЛЖ и нарушения его систолической функции, а также выявить лабораторные маркеры, ассоциированные с тяжелым течением диффузного миокардита.
Выводы
1. ОДМ характеризуется выраженной активацией иммуновоспалительных реакций (высокие концентрации ИЛ-1β, ФНО-α), клеточного звена иммунитета (высокое содержание СD8, CD16 и высокая активность РБТЛм), сопровождающейся значительным ремоделированием ЛЖ со снижением его систолической функции.
2. Через 6 мес от дебюта диффузного миокардита происходит снижение активности системного воспаления и клеточного звена иммунитета с переключением иммунного ответа на гуморальный тип (повышение частоты выявления АТм и их среднего титра, концентрации CD19), что сопровождается обратным ремоделированием сердечной мышцы и постепенным восстановлением ее систолической функции.
3. Выделены лабораторные маркеры, ассоциированные с развитием кардиомегалии и систолической дисфункции ЛЖ при ОДМ, к таковым относятся: высокие концентрации ИЛ-1β, ФНО-α, высокий титр АТм, высокая активность РБТЛм, а также низкое содержание ИЛ-10 в 1-й месяц от начала заболевания.
Список использованной литературы
- Коваленко В.Н., Несукай Е.Г. (2008) Миокардит: В кн. Руководство по кардиологии под редакцией В.Н. Коваленко. МОРИОН, Киев, 971с.
- Коваленко В.М., Лутай М.І., Сіренко Ю.М. (2011) Серцево-судинні захворювання: класифікація, стандарти діагностики та лікування. ВМБ, Київ, 96 с.
- Мравян С.Р., Гуревич М.А. (2008) Особенности клиники, диагностики и лечения миоперикардитов и диффузных миокардитов. Медицина неотложных состояний, 1: 16–18.
- Шиллер Н., Осипов М.А. (2005) Клиническая эхокардиография, второе издание. Практика, Москва, 344 с.
- Blauwet L.A., Cooper L.T. (2010) Myocarditis. Prog. Cardiovasc. Dis., 54(2): 274–288.
- Caforio A.L.P., Pankuweit S., Arbustini E. et al. (2013) Current state of knowledge on aetiology, diagnosis, management and therapy of myocarditis: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur. Heart J., 34: 2636–2648.
- Cunningham M.W. (2006) T regulatory cells sentinels against autoimmune heart disease. Circ. Res., 99: 1024–1026.
- Dennert R., Crijns H.L., Heymans S. (2008) Acute viral myocarditis. Eur. Heart J., 29: 2073–2082.
- Elamm C., Fairweather D.L., Cooper L.T. (2012) Pathogenesis and diagnosis of myocarditis. Heart, 96: 835–840.
- Heymans S. (2007) Myocarditis and heart failure: need for better diagnostic, predictive and therapeutic tools. Eur. Heart J., 28: 1279–1280.
- Howlett J.G., McKelve R.S., Arnold J.M. et al. (2009) Canadian Cardiovascular Society Consensus Conference guidelines on heart failure, update 2009: diagnosis and management of right-sided heart failure, myocarditis, device therapy and recent important clinical trials. Can. J. Cardiol., 25(2): 85 — 105.
- Kindermann I., Kindermann M., Kandolf R. et al. (2008) Predictors of outcome in patients with suspected myocarditis. Circulation, 118: 639–648.
- Kuhl U., Schultheiss H.P. (2009) Viral myocarditis: diagnosis, etiology and management. Drugs., 69: 1287–1302.
- McMurray J.V., Adamopoulos S., Anker S. et al. (2012) Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur. Heart J., 61 p.
- Rose N.R. (2009) Myocarditis: infection versus autoimmunity J. Clin. Immunol., 29: 730–737.
- Schultheiss H.P., Kuhl U., Cooper L.T. (2011) The management of myocarditis. Eur. Heart J., 32: 2616–2625.
- Tousilus D., Antoniades C., Stefanadis C. et al. (2007) Assessing inflammatory status in cardiovascular disease. Heart, 93: 1001–1007.
Адрес для переписки:
Чернюк Сергей Владимирович
03680, Киев, ул.
Народного ополчения, 5
ГУ «Национальный научный центр
«Институт кардиологии
им. Н.Д. Стражеско» НАМН Украины»,
отдел некоронарогенных болезней сердца
и клинической ревматологии
Е-mail vertebrata@bigmir.net

Leave a comment