Еозинофільний фасцит: огляд літератури і власне спостереження
Гармиш Е.А.1, Романовский А.В.2, Левченко В.Г.2, Тютюнник И.Н.3
- 1Національний науковий центр «Інститут кардіології ім. М.Д. Стражеска» НАМН України
- 2ДУ «Національний науковий центр «Інститут кардіології ім. М.Д. Стражеска» НАМН України», Київ
- 3Диагностический центр «Медекс»
Резюме. Резюме. Стаття містить огляд публікацій із проблеми еозинофільного фасциту. Висвітлено питання історії, епідеміології, клініки і діагностики цього захворювання. Представлено власне клінічне спостереження і можливість застосування магнітно-резонансної томографії з метою oб’єктивного підтвердження запалення фасцій у разі неможливості проведення біопсії.
Эозинофильный фасцит (ЭФ) — заболевание относительно молодое и достаточно редкое. Существование новой нозологической формы ведет свой отсчет с 1974 г., когда Shulman впервые описал два случая развития у мужчин склеродермоподобного уплотнения кожи конечностей, которое сопровождалось эозинофилией и гипергаммаглобулинемией. При гистологическом исследовании выявлено отчетливое утолщение фасций между подкожно-жировой клетчаткой и мышцами, а также их интенсивную инфильтрацию лимфоцитами и плазматическими клетками. Особенностью описанных случаев было преимущественное поражение кожи в области предплечий и кистей, отсутствие висцеральных поражений и синдрома Рейно, а также хороший эффект при применении глюкокортикоидов (ГК). В последующий год опубликовано информацию о более 20 подобных случаев, что позволило предположить наличие новой нозологической формы среди ревматических болезней. На основании общности гистологических изменений подкожной фасции во всех описанных клинических случаях в 1975 г. Rodnan предложил термин «эозинофильный фасцит».
До настоящего времени нет четких данных относительно распространенности и заболеваемости. С 1974 г. в литературе описаны отдельные клинические случаи или немногочисленные групповые наблюдения, в целом около 250 случаев (Endo Y., Tamura A. et al., 2007). Заболеваемость ЭФ преобладает у европеоидной расы. Описаны случаи ЭФ у афроамериканцев, африканцев и представителей азиатского региона (Moutsopoulos H.M., Webber B.L. et al., 1980; Nawata Y., Sueishi M. et al., 1983).ЭФ чаще отмечается у женщин (Lakhanpal S., Ginsburg W.W. et al., 1988; Bischoff L., Derk C.T. et al., 2008). Возраст начала заболевания варьирует от 1 года до 88 лет. Однако пик заболеваемости приходится на третью–шестую декады жизни. По данным М. Antic и соавторов (2006) и L. Bischoff, C.T. Derk (2008), описавших серию наблюдений из 11 и 12 случаев, средний возраст начала заболевания составил соответственно 54,4 и 49,8 года.
Этиология ЭФ неизвестна. Большое количество факторов рассматривалось в качестве этиологических с различной степенью доказательности. Чрезмерная физическая нагрузка и предшествующая травма в качестве триггеров описаны у 30–50% пациентов (Lakhanpal S. et al., 1988; Bischoff L., Derk C.T., 2008). Отмечена связь с применением различных лекарственных препаратов, включая симвастатин, аторвастатин, фенитоин, препараты железа для парентерального применения, а также проведением лучевой терапии (Buchanan R.R. et al., 1980; Choquet-Kastylevsky G. et al., 2001; DeGiovanni C. et al., 2006). Данные некоторых исследований свидетельствуют о развитии ЭФ на фоне приема L-триптофана. Не исключается возможное влияние бактериальной инфекции. Немногочисленные наблюдения демонстрируют наличие антител к боррелиям и микоплазме, а также наличие спирохет при микроскопии у больных ЭФ (Granter S.R. et al., 1996).
Существуют множественные наблюдения развития ЭФ, ассоциированного с различными гематологическими заболеваниями, включая апластическую и гемолитическую анемию, тромбоцитопению, миелопролиферативные и миелодиспластические заболевания, лимфому, лейкемию, моноклональную гаммапатию и множественную миелому (Masuoka H. et al., 1998; Garcia V.P. et al., 1998). Описаны единичные случаи развития ЭФ на фоне заболеваний щитовидной железы, опухолей солидных органов и первичного билиарного цирроза печени, что свидетельствует о роли клеточной дисрегуляции и процессов аутоиммунитета в патофизиологии заболевания (Hur J.W. et al., 2005).
Основой патологического процесса при ЭФ является воспалительная клеточная инфильтрация фасций с развитием в последующем дегрануляции эозинофилов, что приводит к активации фибробластов. In vitro фибробласты пораженной фасции отличаются гиперпродукцией коллагена и белков экстрацеллюлярного матрикса в ответ на экспрессию трансформирующего фактора роста-β и других фиброгенных цитокинов. J.F. Viallard с коллегами в 2001 г. у пациентов с ЭФ продемонстрировал гиперпродукцию мононуклеарами периферической крови интерлейкина (ИЛ)-5 и интерферона (ИФГ)-γ. ИЛ-5 известен как основной активатор хемотаксиса, роста и дифференцировки эозинофилов. ИФГ активирует клеточные макрофаги и Т-клетки. Показано, что повышенные уровни ИЛ-5 и ИФГ-γ нормализуются на фоне терапии ГК. Исследованиями M. Jinnin в 2004 г. установлено повышение в сыворотке крови концентрации супероксиддисмутазы и тканевого ингибитора металлопротеиназы (ТИМП)-1 у пациентов с ЭФ. Уровень ТИМП-1 может также служить маркером активности болезни (Endo Y. et al., 2007).
Морфологически выявляется поражение фасций и прилежащих к ним мышц, подкожной клетчатки, дермы. В ранней стадии заболевания преобладают признаки экссудативно-пролиферативного воспаления: отек и фибриноидные изменения коллагеновых волокон с их клеточной инфильтрацией. В более поздние сроки наблюдаются фиброзно-склеротические изменения (Насонова В.А., Бунчук Н.В. (ред.), 1997).
В клинической картине заболевания преобладают кожные проявления, интенсивность и спектр которых зависят от стадии заболевания. Острая стадия сопровождается симметричным воспалительным отеком и гиперемией кожи с последующей трансформацией в индуративный отек и фиброз на более поздних стадиях (Abeles M. et al., 1979; Manzini C. et al., 2012). Объективно выявляется уплотнение предплечий, голеней, с распространением процесса на бедра, плечи, туловище. Реже изменения локализуются на коже туловища и шеи, крайне редко — в области лица и кистей. Пораженная кожа приобретает каменистую плотность, спаивается с подлежащими тканями. В области верхних конечностей могут наблюдаться изменения кожи по типу «апельсиновой корки» или «булыжной мостовой», а также формирование линейных очагов подкожного фиброза по типу «желоба». Вследствие натяжения пораженных участков кожа на спине, животе и груди становится плотной и приобретает блеск. Пациенты обычно жалуются на ощущение «набухания» и уплотнение конечностей, ограничение подвижности, боли в мышцах, суставах. На более поздних стадиях появляются диффузные очаги гиперпигментации. Другие кожные проявления включают уртикарную или буллезную сыпь, алопецию, витилиго, атрофический лишай и гиперпигментацию.
Из внекожных проявлений у 50–70% пациентов появляются и прогрессируют ограничения активных и пассивных движений в конечностях, тугоподвижность, стойкие сгибательные контрактуры в локтевых, лучезапястных, голеностопных, коленных, плечевых суставах. В редких случаях выраженный фиброз кожи туловища может приводить к ограничению экскурсии грудной клетки. S. Lakhanpal в 1988 г., L. Bischoff и C.T. Derk в 2008 г. при анализе наблюдения 52 и 12 пациентов с ЭФ сообщают о наличии воспалительного артрита в 40% случаев, развитии карпального туннельного синдрома у 16–23% больных. Висцеральные поражения развиваются крайне редко. При их наличии необходимо в первую очередь исключить другое заболевание склеродермической группы.
Эозинофилия в периферической крови наблюдается у 61–83% пациентов и является важным диагностическим признаком. Степень выраженности ее варьирует в зависимости от длительности заболевания и эффективности терапии. С несколько меньшей частотой выявляется гипергаммаглобулинемия — у 18–67% пациентов. Основной источник — поликлональная экспрессия иммуноглобулина G. По данным M. Antic и соавторов (2006) повышение скорости оседания эритроцитов (СОЭ) зарегистрировано в 29–70% случаев.
Дополнительные методы исследования, за исключением магнитно-резонансной томографии (МРТ), как правило, не имеют диагностической ценности. Определение функции внешнего дыхания, проведение электронейромиографии и эзофагодуоденогастроскопии демонстрирует сомнительные или неспецифические результаты. В настоящее время МРТ является методом выбора и позволяет диагностировать утолщение фасций в пораженных областях. Метод МРТ информативен не только в диагностических целях, его применение позволяет более точно определить область для проведения биопсии и мониторировать эффективность терапии. До внедрения МРТ в широкую ревматологическую практику золотым стандартом диагностики была кожно-мышечная биопсия в пораженной области. В настоящее время биопсия продолжает оставаться ведущим методом исследования для верификации диагноза и параллельно некоторыми исследователями рассматривается вопрос об альтернативном применении метода МРТ с этой целью, в особенности при невозможности или недоступности гистологического исследования. Первое описание МР-признаков, характерных для ЭФ, было опубликовано L.S. DeClerk и соавторами в 1989 г. Существующие на сегодняшний день данные сводятся к публикации единичных клинических случаев в основном в радиологических журналах (Baumann F. et al., 2005; Moulton S.J. et al., 2005). К сожалению, ввиду редкости данной патологии невозможно провести прямое сравнительное исследование диагностической значимости обоих методов. Однако необходимо отметить, что во всех описанных случаях при наличии типичных МР-изменений гистологическая картина соответствовала ЭФ (Chan V. et al., 2004; Sugimoto T. et al., 2007). По данным M. Ronneberger (2009), в двух случаях наблюдения при неубедительных результатах гистологического исследования выявлено утолщение фасций и их фиброз без клеточной инфильтрации. Дополнительное проведение МРТ позволило выявить диффузное накопление контрастного агента в области фасций и тем самым подтвердить диагноз.
Препаратами выбора для лечения ЭФ являются ГК. Согласно данным литературы в ⅓ случаев при установленных провоцирующих факторах происходит спонтанное выздоровление, что не требует длительного применения ГК в высоких дозах (Manzini C. et al., 2011). В некоторых случаях возможно субклиническое течение.
P.C. Avgerinos и соавторами (1982) опубликован клинический случай асимптомного ЭФ, когда заболевание было выявлено в качестве случайной находки при поступлении в стационар 70-летней женщины по поводу острого холецистита. При осмотре в отсутствие жалоб выявлено уплотнение кожи на туловище и конечностях, сопровождающееся эозинофилией в периферической крови. В последующем диагноз был подтвержден гистологически наличием уплотнения фасций и их массивной клеточной инфильтрацией.
Дозы ГК варьируют от 20 до 100 мг/сут по преднизолону в зависимости от интенсивности симптомов и, как правило, высокоэффективны. Эффективность терапии оценивается клинически. При этом учитывается уменьшение отека и утолщения кожи, степени выраженности контрактур в суставах, исчезновение туннельных синдромов (Carneiro S. et al., 2005). Эозинофилия и другие лабораторные маркеры не являются критерием эффективности терапии и активности заболевания ввиду быстрого снижения их уровня после начала применения ГК. Даже после однократного приема ГК периферическая эозинофилия может более никогда не наблюдаться, несмотря на обострения заболевания или неэффективность терапии. Описаны случаи применения антигистаминных препаратов, гидроксихлорохина, хлорохина, азатиоприна, циклоспорина, метотрексата, такролимуса, D-пеницилламина, инфликсимаба, гризеофульвина, кетотифена и альфа-интерферона у пациентов с резистентным к ГК течением ЭФ с различным терапевтическим эффектом. Однако ввиду малочисленности наблюдений и отсутствия контролируемых исследований нет единого консенсуса по применению различных болезнь-модифицирующих препаратов. C. Manzini и соавторы (2012) рассматривают блокаторы ФНО-α в качестве перспективного направления.
Прогноз заболевания в основном благоприятный, однако имеются ограниченные данные о хроническом прогрессирующем течении ЭФ, несмотря на терапию ГК в адекватных дозах, а также развитие обострения заболевания при отмене ГК.
Клинический случай
Пациентка П., 41 год, заболела остро в начале августа 2013 г. после чрезмерной физической нагрузки, когда появилась уртикарная сыпь на туловище и конечностях, которая в последующем трансформировалась в очаги депигментации. Через 10 дней появился симметричный воспалительный отек кожи и подкожно-жировой клетчатки в области предплечий, проксимальнее и дистальнее коленных суставов. Затем в течение 2 дней присоединились боль и скованность в верхних и нижних конечностях, включая ягодичные области; скованность жевательных мышц, ограничения при открывании рта; диффузное уплотнение кожи верхних и нижних конечностей до «деревянной» плотности, что привело к ограничению объема движений в крупных суставах (тазобедренных, коленных, голеностопных, плечевых, локтевых) и к затруднениям при ходьбе. Повышение температуры тела не зарегистрировано. По месту жительства пациентка была госпитализирована, проводился дифференциальный диагноз между ревматоидным артритом, дерматомиозитом, системным заболеванием соединительной ткани. Был применен дексаметазон 4 мг в/в капельно № 3, что привело к купированию вышеуказанных симптомов. ГК в таблетках не назначали. Через 1 сут после отмены дексаметазона наблюался рецидив клинических проявлений. При поступлении в ревматологическое отделение в сентябре 2013 г. пациентка предъявляла жалобы: выраженную скованность в мышцах и крупных суставах верхних и нижних конечностей, боль в них при движениях, ограничение объема движений в суставах вследствие этого и ограничение при ходьбе подъеме со стула и по лестнице. Объективно определялось значительное симметричное уплотнение кожи в области предплечий, дистальной трети плеча, бедер, проксимальнее коленных суставов, голеней. Тугоподвижность в височнонижнечелюстных, плечевых, локтевых, тазобедренных, коленных, голеностопных суставах. Слабовыраженные очаги гипо- и гиперпигментации в области предплечий, в местах локализации уртикарной сыпи. Уровень эозинофилов в норме. В начале заболевания по месту жительства зафиксировано однократное повышение эозинофилов до 6%. Глобулины — 50%. Гамма-глобулины — 20,4%. Ревматоидный фактор, СРП негативны. КФК, МВ-КФК — в норме. Незначительное повышение ЛДГ — 472 U/l (норма 210–425 U/l). В остальном без отклонений. Проведена игольчатая электронейромиография: скорость проведения возбуждения нервами нижних конечностей в норме. Сила сокращения мышц стоп и пальцев незначительно снижена, флексоров — в пределах нормы. Спонтанная активность мышечных волокон отсутствует. Потенциалы двигательных единиц сниженной длительности с повышением полифазных потенциалов. Заключение: признаков первично-мышечного процесса не выявлено, умеренно-выраженные изменения потенциалов двигательных единиц по миопатическому типу (миопатический синдром).
Пациентке проведено МРТ-обследование мягких тканей бедер в трех взаимно перпендикулярных проекциях в режимах PDFS (взвешенных по протонной плотности с подавлением сигнала от жировой ткани) и T1tse (Т1-взвешенных турбоспинэхо). На полученных МР-томограммах в режимах PDFS отчетливо визуализируется утолщение фасций задней группы мышц и прямой мышцы обоих бедер до 2–3 мм (рис. 1, 2). МР-сигнал от структуры утолщенных фасций повышенной интенсивности на PDFS, что свидетельствует об отеке. МР-сигнал от структуры мышечных волокон не изменен. На основании полученных данных установлен диагноз: Диффузный эозинофильный фасцит. МКБ-10 — М 35.4. Назначен метилпреднизолон 12 мг/сут, все симптомы купированы в течение 1 мес. Пациентка продолжает применение ГК.
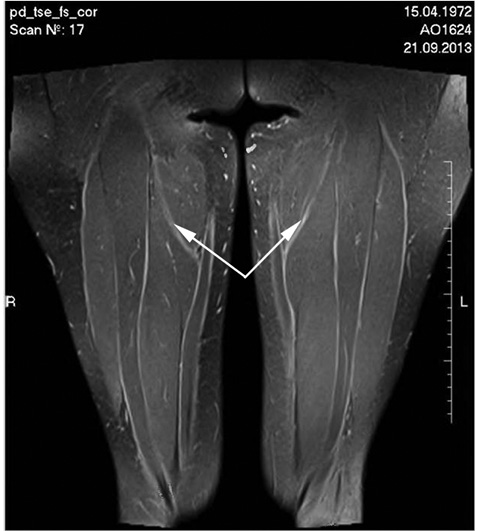
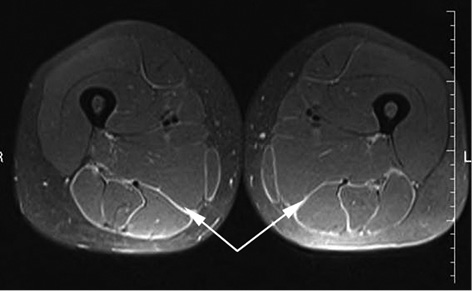
В данном случае пусковым моментом для развития заболевания послужило сочетание факторов чрезмерной физической нагрузки и вдыхания пыльцы цветущих сорных трав (пациентка пропалывала большую площадь земельного участка после месячного отсутствия в период цветения сорных трав). Эозинофилия наблюдалась однократно и более не зарегистрирована. Отмечены гипергаммаглобулинемия и повышение ЛДГ. Диагноз установлен на основании типичной клинической картины и исключения других ревматических болезней, подтвержден методом МРТ.
Список использованной литературы
- Насонова В.А., Бунчук Н.В. (ред.) (1997) Ревматические болезни: Руковод. для врачей. Медицина, Москва, 520 с.
- Abeles M., Belin D.C., Zurier R.B. (1979) Eosinophilic fasciitis: a clinicopathologic study. Arch. Intern. Med., 139(5): 586–588.
- Antic M., Lautenschlager S., Itin P.H. (2006) Eosinophilic fasciitis 30 years after — what do we really know? Report of 11 patients and review of the literature. Dermatology, 213(2): 93–101.
- Avgerinos P.C., Papadimitriou C.S., Kokkini G. et al. (1982) Asymptomatic diffuse fasciitis with eosinophilia. Аnn. Rheum. Dis., 41: 621–622.
- Baumann F., Bruhlmann P., Andreisek G. et al. (2005) MRI for diagnosis and monitoring of patients with eosinophilic fasciitis. Am. J. Roentgen., 184: 169–174.
- Bischoff L., Derk C.T. (2008) Eosinophilic fasciitis: demographics, disease pattern and response to treatment: report of 12 cases and review of the literature. Int. J. Dermatol., 47(1): 29–35.
- Buchanan R.R., Gordon D.A., Muckle T.J. et al. (1980) The eosinophilic fasciitis syndrome after phenytoin (dilantin) therapy. J. Rheumatol., 7(5): 733–736.
- Carneiro S., Brotas A., Lamy F. et al. (2005) Eosinophilic fasciitis (Shulman syndrome). Cutis., 75(4): 228–232.
- Chan V., Soans B., Mathers D. (2004) Ultrasound and magnetic resonance imaging features in a patient with eosinophilic fasciitis. Australian Radiol., 48: 414–417.
- Choquet-Kastylevsky G., Kanitakis J., Dumas V. et al. (2001) Eosinophilic fasciitis and simvastatin. Arch. Intern. Med., 161(11): 1456–1457.
- DeClerk L.S., Degryse H.R., Wonters E. et al. (1989) Magnetic resonance imaging in the evaluation of patients with eosinophilic fasciitis. J. Rheumatol., 16: 1270–1273.
- DeGiovanni C., Chard M., Woollons A. (2006) Eosinophilic fasciitis secondary to treatment with atorvastatin. Clin. Exp. Dermatol., 31(1): 131–132.
- Endo Y., Tamura A., Matsushima Y. et al. (2007) Eosinophilic fasciitis: report of two cases and a systematic review of the literature dealing with clinical variables that predict outcome. Clin. Rheumatol., 26(9): 1445–1451.
- Hur J.W., Lee H.S., Uhm W.S. et al. (2005) Eosinophilic fasciitis associated with autoimmune thyroiditis. Korean J. Intern. Med., 20(2): 180–182.
- Garcia V.P., de Quiros J.F., Caminal L. (1998) Autoimmune hemolytic anemia associated with eosinophilic fasciitis. J. Rheumatol., 25(9): 1864–1865.
- Granter S.R., Barnhill R.L., Duray P.H. (1996) Borrelial fasciitis: diffuse fasciitis and peripheral eosinophilia associated with Borrelia infection. Am. J. Dermatopathol., 18(5): 465–473.
- Jinnin M., Ihn H., Yamane K. et al. (2004) Serum levels of tissue inhibitor of metalloproteinase-1 and 2 in patients with eosinophilic fasciitis. Br. J. Dermatol., 151(2): 407–412.
- Lakhanpal S., Ginsburg W.W., Michet C.J. (1988) Eosinophilic fasciitis: clinical spectrum and therapeutic response in 52 cases. Semin. Arthritis Rheum., 17(4): 221–231.
- Manzini C., Sebastiani M., Giuggioli D. et al. (2012) D-penicillamine in the treatment of eosinophilic fasciitis: case reports and review of the literature. Clin. Rheumatol., 31(1): 183–187.
- Masuoka H., Kikuchi K., Takahashi S. et al. (1998) Eosinophilic fasciitis associated with low-grade T-cell lymphoma. Br. J. Dermatol., 139(5): 928–930.
- Moulton S.J., Kransdorf M.J., Ginsburg W.W. et al. (2005) Eosinophilic fasciitis: spectrum of MRI findings. Am. J. Roentgen., 184: 975–978.
- Moutsopoulos H.M., Webber B.L., Pavlidis N.A. et al. (1980) Diffuse fasciitis with eosinophilia. A clinicopathologic study. Am. J. Med., 68(5): 701–709.
- Nawata Y., Sueishi M., Koike T. et al. (1983) Eosinophilic fasciitis with autoimmune features. Arthritis Rheum., 26(5): 688.
- Ronneberger M., Janka R., Schett G. et al. (2009) Can MRI substitute for biopsy in eosinophilic fasciitis? Ann. Rheum. Dis., 68(10): 1651–1652.
- Viallard J.F., Taupin J.L., Ranchin V. et al. (2001) Analysis of leukemia inhibitory factor, type 1 and type 2 cytokine production in patients with eosinophilic fasciitis. J. Rheumatol., 28(1): 75–80.
- Sugimoto T., Nitta N., Kashiwagi A. (2007) Usefulness of magnetic resonance imaging in eosinophilic fasciitis. Rheumatol. Int., 27: 791–792.
Адрес для переписки:
Гармиш Елена Алексеевна
03680, Киев, ул. Народного ополчения, 5
ГУ «Национальный научный центр
«Институт кардиологии
им. Н.Д. Стражеско» НАМН Украины»,
отделение клинической ревматологии

Leave a comment