VI НАЦІОНАЛЬНИЙ КОНГРЕС РЕВМАТОЛОГІВ УКРАЇНИ
Національна академія медичних наук України
Міністерство охорони здоров’я України
Асоціація ревматологів України
Державна установа «Національний науковий центр
«Інститут кардіології імені академіка М.Д. Стражеска» НАМН України»
Інститут травматології та ортопедії НАМН України
Інститут патології хребта та суглобів імені М.І. Ситенка НАМН України
Інститут педіатрії, акушерства і гінекології НАМН України
19–21 листопада 2013 р.
Київ
ОСОБЕННОСТИ МИНЕРАЛЬНОЙ ПЛОТНОСТИ КОСТНОЙ ТКАНИ ПРИ ОТДЕЛЬНЫХ ФОРМАХ НЕДИФФЕРЕНЦИРОВАННОЙ ДИСПЛАЗИИ СОЕДИНИТЕЛЬНОЙ ТКАНИ
А.Б. Андруша
Харьковский национальный медицинский университет
Цель: изучить особенности структурно-функционального состояния костной ткани (СФС КТ) при некоторых вариантах внешних и висцеральных проявлений недифференцированных дисплазий соединительной ткани (НДСТ) с поражением органов желудочно-кишечного тракта и НДСТ без данной висцеральной патологии.
Методы исследования. Диагноз НДСТ базировался на основании углубленного анализа анамнестических и антропометрических данных, результатов клинического обследования с учетом количества и выраженности фенотипических признаков и лабораторно-инструментальной верификации висцеральных диспластикозависимых нарушений. НДСТ устанавливали при наличии у пациента ≥6 признаков дисплазии соединительной ткани. СФС КТ оценивали при помощи пяточного ультразвукового денситометра LUNAR Achilles express, США, 2008. Определяли следующие параметры: скорость распространения ультразвука (СРУ); широкополосное ослабление ультразвука (ШОУ); индекс прочности костной ткани; Т- и Z-критерии. Полученные денситометрические показатели оценивали в соответствии с рекомендациям ВОЗ по критериям диагностики остеопороза.
Результаты. Обследован 41 пациент в возрасте 42–57 лет (17 мужчин и 24 женщины) с НДСТ. Все больные были распределены на две группы: 1-я группа (19 человек) с преимущественно висцеральными симптомами НДСТ со стороны ЖКТ (дивертикулез кишечника, долихосигма, дуоденогастральный рефлюкс и др.), 2-я группа (22 пациента) без аномалий со стороны органов ЖКТ, преимущественными фенотипическими признаками у которых были внешние кожные проявления (повышенная растяжимость кожи, тонкая, легкоранимая кожа, обилие пушковых волос и др.), костно-суставные (сколиоз/кифоз, межпозвонковые грыжи, килевидная/воронкообразная деформация грудной клетки и др.), пролапс митрального клапана. Для получения показателей нормы была обследована группа практически здоровых лиц (20 человек) соответствующего возраста.
Оценивая СФС КТ, у всех обследованных больных мы выявили однотипные изменения — снижение минеральной плотности КТ, соответствующее остеопении I степени, и нарушение архитектоники кости (показатель СРУ в среднем составил 1554±9,6 при значении в группе контроля 1589±13,6 м/с). Нами выявлена статистически достоверная разница в показателе скорости распространения ультразвука, который в большей степени, чем показатель ШОУ, отражает степень минерализации КТ. Снижение показателя СРУ во 2-й группе пациентов составило 3%, в то время как в 1-й группе больных — 1% в сравнении с группой практически здоровых людей.
Выводы. СФС КТ у больных с НДСТ претерпевает изменения, степень выраженности которых зависит от клинических вариантов заболевания — наличия/отсутствия висцеральных патологий, вовлечения той либо иной системы. Наличие фенотипических проявлений НДСТ со стороны ЖКТ не является прогностически неблагоприятным маркером, отражающим степень нарушения состояния костной ткани. Более существенные изменения в СФС КТ наблюдаются при доминирующей локализации соединительно-тканных аномалий в костно-суставном аппарате, внешних кожных проявлениях на фоне отсутствия аномалий со стороны ЖКТ. У пациентов с НДСТ имеются дефекты минерализации скелета, причина которых, вероятнее всего, кроется не в дефиците содержания кальция в организме, а в генетически детерминированной коллагенопатии, степень выраженности которой более существенна у пациентов с НДСТ без аномалий со стороны ЖКТ, но с преобладанием внешних кожных и костно-суставных проявлений.
ЭФФЕКТИВНОСТЬ ПРИМЕНЕНИЯ ПРЕПАРАТОВ ГИАЛУРОНОВОЙ КИСЛОТЫ в КОМПЛЕКСНОМ ЛЕЧЕНИИ ПРИ ОСТЕОАРТРОЗЕ КОЛЕННЫХ СУСТАВОВ на РАЗНЫХ СТАДИЯХ ЗАБОЛЕВАНИЯ
В.Г. Апанасович, С.В. Хидченко, А.В. Старостина
УО «Белорусский государственный медицинский университет», Минск, Республика Беларусь
Цель: оценить эффективность применения препаратов гиалуроновой кислоты (ГК) в лечении при остеоартрозе (ОА) коленных суставов у пациентов на разных стадиях заболевания.
Методы исследования. Курс лечения состоял из 5 еженедельных инъекций препаратов ГК 47 пациентам. В группу наблюдения входили преимущественно женщины (96%) пенсионного возраста (64,2±2,8 года) с избыточной массой тела (ИМТ 34,3±2,1). 80% пациентов получали терапию нестероидными противовоспалительными препаратами (НПВП), 63% в комплексном лечении применяли хондропротекторы. Для оценки эффективности лечения использовали индекс Лекена, визуально-аналоговую шкалу боли (ВАШ), анкетирование с учетом медицинских и социальных особенностей применения препаратов ГК. По рентгенологическим стадиям группа разделилась следующим образом: 2 ст. — 13 суставов, 3 ст. — 30 суставов и 4 ст. — 12 суставов. Участники находились под наблюдением 1,5 года. Полученные результаты были обработаны статистически с использованием критерия Стьюдента.
Результаты. Через 1 мес после окончания курса лечения выявлено достоверное уменьшение выраженности болевого синдрома: показатель ВАШ снизился с 7,6±1,1 4 до 4,5±1,03 и улучшение функциональных возможностей суставов — по индексу Лекена с 13,5±2,6 до 9,03±2,9, с сохранением клинического эффекта в течение 6 мес (ВАШ 5,6±1,1; индекс Лекена — 10,6±2,7). 8 пациентов повторили курс лечения через 1 год. 8 больным с 4-й стадией ОА проведено эндопротезирование коленных суставов. Среди пациентов, которые не повторяли курс лечения, индекс Лекена через 1,5 года составил 11,9±3, показатели ВАШ — 5,8±1,3 балла. 42% пациентов отказались от НПВП вообще и только 4% продолжают принимать НПВП постоянно. Не зарегистрировано побочных эффектов внутрисуставного введения препарата.
Выводы. Препараты ГК оказывают статистически значимое влияние на выраженность болевого синдрома и функцию суставов у пациентов с гонартрозом не менее чем на 6 мес, что сопровождается уменьшением потребности в применении НПВП.
ВЛИЯНИЕ ТЕРАПИИ ПРИ ОСТЕОАРТРОЗЕ НА ТЕЧЕНИЕ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ
О.М. Бабинец, Е.И. Гришина,
О.В. Мурадян
ГУ «Институт микробиологии и иммунологии им. И.И. Мечникова НАМН Украины», Харьков
Остеоартроз (ОА) является одним из самых распространенных заболеваний суставов, частота которого повышается с возрастом. Следствием этого является наличие большого числа коморбидных состояний у больных ОА. Так, по данным различных авторов, сочетание ОА и артериальной гипертензии (АГ) отмечается в 52–87%. Все это порождает существенные сложности в подборе медикаментозной терапии.
Цель: изучение влияния терапии ОА на течение АГ.
Методы исследования. Обследовано 123 пациента, обратившихся за медицинской помощью по поводу АГ и имевших ОА как сопутствующее заболевание — 74 (60%) женщин и 49 (40%) мужчин, средний возраст которых составил (M±SD) (59±9,4) года. При установлении диагноза ОА использовали диагностические критерии R.D. Althmann. Диагноз АГ устанавливали в соответствии рекомендациям Украинской ассоциации кардиологов (2004).
Пациентам измеряли артериальное давление (АД), учитывали количество эпизодов повышения АД в неделю, рассчитывали клиренс креатинина по формуле Кокрофта — Голта, предлагали заполнить анкету EQ-5D.
Статистический анализ проводили с использованием пакета статистических программ SPSS версии 15.0. Порог статистической погрешности разных тестов был установлен на уровне 5%.
Всем им была рекомендована адекватная (с учетом уровня АД и сопутствующих/конкурирующих болезней) гипотензивная терапия. Далее они случайным образом были распределены на две группы для лечения сопутствующего ОА. 1-й группе (60 пациентов) была назначена фиксированная комбинация 500 мг хондроитина сульфата натрия (ХС) и 500 мг глюкозамина гидрохлорида (ГА), 2-й группе (63 пациента) — нестероидные противовоспалительные препараты по требованию. Динамика исследуемых показателей через 3 мес представлена в таблице. Количество пациентов, полностью соблюдавших рекомендации по лечению АГ, составило 104 (84%) и равномерно распределилось между группами — 9 (15%) в 1-й группе и 10 (16%) во 2-й группе. По лечению ОА в 1-й группе рекомендации полностью выполнили 47 (78%) больных.
Таблица. Динамика исследуемых показателей у больных АГ и ОА
| Показатель | 1-я группа | 2-я группа | ||
| До лечения | Послелечения | До лечения | Послелечения | |
| АД систолическое, мм рт. ст. |
(168±29) | (135±27)* | (165±31) | (142±28)* # |
| АД диастолическое, мм рт. ст. |
(91±21) | (83±23)* | (99±23) | (91±21)* # |
| Количество эпизодов повышения АД | (5,4±1,9) | (1,1±0,3)* | (5,7±1,8) | (1,9±0,5)* # |
| Клиренс креатинина, мл/мин |
(91±18) | (98±21)* | (94±25) | (93±23) |
| EQ-5D, баллов | (15,8±2,6) | (7,6±1,8)* | (16,1±3,2) | (8,3±1,1)* # |
*р<0,05 при сравнении показателей в группах до и после лечения; #р<0,05 при сравнении показателей между группами.
Выводы. Таким образом, терапия ОА комбинацией ХС и ГА у больных АГ, получающих гипотензивную терапию, приводит к улучшению результатов лечения, что проявляется в более значимом снижении уровней АД, его стабилизации, и повышению качества жизни пациентов.
ОСОБЛИВОСТІ БОЛЬОВОГО СИНДРОМУ У ХВОРИХ ПОХИЛОГО ВІКУ З ОСТЕОАРТРОЗОМ
Т.Г. Бакалюк, І.Р. Мисула, А.О. Голяченко, В.Б. Коваль, І.М. Салайда, О.М. Лавріненко
ДВНЗ «Тернопільський державний медичний університет ім. І.Я. Горбачевського»
Больовий синдром при остеоартрозі (ОА) становить значну медичну проблему, що пов’язано з великою поширеністю захворювання (≈12% популяції), різноманітністю причин болю, переважно контингентом хворих похилого віку і труднощами, пов’язаними з вибором лікувальної тактики. Біль постає одним із найбільш обтяжливих відчуттів, що визначає тяжкість страждань і змін якості життя пацієнтів, тому ефективна діагностика та виявлення патогенетичних механізмів больового синдрому з подальшою цілеспрямованою терапією є основою реабілітаційних заходів.
Мета: визначити клінічний перебіг хронічного больового синдрому у пацієнтів похилого віку та встановити взаємозв’язок характеру больового синдрому з даними артросонографії (АСГ), активністю процесу, ступенем функціональних порушень суглобів та рентгенологічною стадією.
Методи дослідження. Під нашим спостереженням знаходились 78 пацієнтів з ОА колінних суглобів, серед яких 65 жінок та 13 чоловіків (віком 62–78 років, середній вік — 66,3±7,4 року), середня тривалість захворювання — 6,6±2,3 року. Всі пацієнти були розподілені на три групи залежно від типу больового синдрому. У 1-й групі (n=34) больовий синдром характеризувався виникненням у період фізичного навантаження та вщуханням під час відпочинку та в нічний час. У 2-й групі (n=23) пацієнти відзначали стартовий біль у колінних суглобах та біль при ходьбі сходами вниз. У 3-й групі відзначали біль при тривалій ходьбі та локальний біль при пальпації колінних суглобів (n=21). Усім хворим було проведене комплексне клінічне, лабораторне (ШОЕ, С-реактивний протеїн) та інструментальне дослідження (рентгенографія, АСГ). При проведенні АСГ оцінювали структуру і товщину суглобового хряща, величину суглобової щілини, стан менісків, зв’язок, сухожиль, м’язів, сумок та заворотів. Результати досліджень порівнювались з контрольними величинами (10 чоловік аналогічного віку без ознак ураження суглобів).
Результати дослідження. У всіх трьох групах за даними АСГ не було достовірної різниці між такими показниками: товщина суглобового хряща становила 1,2±0,23 мм, висота суглобової щілини — 0,9±0,31 мм. Середній рівень болю в колінних суглобах при ходьбі за шкалою ВАШ у трьох групах був однаковий і трактувався як помірний. Показник обмеження щоденної активності за WOMAC та індекс M. Lequesne у досліджуваних групах суттєво не відрізнялися. Рентгенознаки OA були однаковими у всіх групах, серед обстежених переважали пацієнти з ІІ рентгенологічною стадією. Лабораторна активність запального процесу була відзначена лише в 2-й групі. Різниця в обстежених групах виявлялась у таких показниках: у пацієнтів 1-ї групи візуалізувалися фіброз суглобової капсули та спазм навколосуглобових м’язів; у 2-й групі переважали явища синовіту з розширенням верхнього завороту, потовщенням бічних зв’язок; у 3-й групі — виражені крайові остеофіти, меніскопатія та набряк параартикулярних тканин.
Висновки. Проведене нами дослідження продемонструвало високу ефективність використання ультразвукового методу обстеження суглобів. Визначено специфічні ультразвукові ознаки больових синдромів, коли рентгенологічні та лабораторні дані малоінформативні. Перевагою АСГ є можливість виявити ранні ознаки ураження всіх структур суглоба, які практично не визначаються рентгенологічно та з достатньою точністю оцінити і виявити точне місце локалізації уражень як суглобів, так і навколосуглобових м’яких тканин та цілеспрямовано вибрати лікувальну тактику.
НАРУШЕНИЯ РЕОЛОГИЧЕСКИХ СВОЙСТВ КРОВИ И ЭНДОТЕЛИАЛЬНОЙ ФУНКЦИИ СОСУДОВ У БОЛЬНЫХ СИСТЕМНОЙ СКЛЕРОДЕРМИЕЙ
Т.Б. Бевзенко, В.Я. Микукстс, Е.Д. Егудина, И.Н. Левада, Е.М. Лаушкина
Национальный медицинский университет им. Максима Горького, Донецк
Системная склеродермия (ССД) сопровождается изменениями эритроцитарно-тромбоцитарного звена (ЭТЗ) реологических свойств крови (РСК) у 82% числа больных, которые проявляются достоверным повышением на 23% индекса агрегации эритроцитов (ИАЭ) в 69% наблюдений, на 40% — индекса деформируемости эритроцитов (ИДЭ) у 89% и на 20% — индекса агрегации тромбоцитов (ИАТ) у 68%, зависят от степени активности патологического процесса, тяжести поражения суставов, мышц, легких, клапанного аппарата сердца, печени и периферической нервной системы, систолической функции левого желудочка, давления в малом круге кровообращения, уровня в крови С-реактивного протеина, фибриногена, фибронектина и числа CD95, прямо коррелируя с параметрами иммуноглобулина G и циркулирующих иммунных комплексов (ИАЭ), фибриногена (ИДЭ), числа клеток с рецепцией CD16 и CD38 (ИАТ). Регистрируется достоверное повышение на 38% объемной вязкости плазмы (ВП) крови, на 2% поверхностного натяжения (ПН) при t=0,01 с и t=1 с при уменьшении на 22% модуля вязкоэластичности и на 11% — времени релаксации, что наблюдаются соответственно у 74; 57; 68; 58 и 42% больных, зависит от активности заболевания, тяжести поражения кожи, легких, почек и печени, уровня артериального давления и периферического сосудистого сопротивления, нарушений возбудимости миокарда, размеров камер сердца и систоло-диастолической функции левого желудочка. У больных ССД развиваются нарушения эндотелиальной функции сосудов (ЭФС), которые проявляются достоверным повышением на 42% эндотелина-1, в 2,5 раза тромбоксана-A2, на 14% — нитритов (стойких продуктов метаболизма оксида азота) и на 19% — циклического гуанозинмонофосфата при уменьшении в 2,2 раза простациклина, причем увеличение параметров соответственно регистрируется в 79; 47; 39; 57 и 66% наблюдений, что зависит от длительности и степени активности заболевания, тяжести поражения суставов, мышц, сердца и почек, синдрома Рейно и периферического сосудистого сопротивления, нарушений возбудимости миокарда, размеров камер сердца, давления в малом круге кровообращения и систоло-диастолической функции левого желудочка. Показатели ЭФС при ССД прямо коррелируют с параметрами ЭТЗ и плазменного звена (ПЗ) РСК, причем уровень тромбоксанемии определяет межфазную активность сыворотки крови в зоне длинных времен существования поверхности, а нитритемии — агрегационные свойства эритроцитов. Изменения ЭТЗ РСК, ПЗ РСК и ЭФС участвуют в патогенетических построениях при ССД, определяя степень тяжести патологии суставов, кожи, мышц, сердца, легких, печени, почек, центральной и периферической нервной системы, развитие нарушений возбудимости миокарда, электрической проводимости сердца, поражений клапанного аппарата и аорты, возникновение легочной гипертензии и диастолической дисфункции левого желудочка. Улучшение в процессе патогенетической терапии клинических признаков заболевания, коррекция ЭТЗ РСК, ПЗ РСК и ЭФС достигаются в результате применения глюкокортикоидных гормонов, антиагрегантов, тивортина, добезилата кальция, антагонистов кальция, ингибиторов ангиотензинпревращающего фермента, блокаторов рецепторов ангиотензина-2 и полиферментных смесей системной энзимотерапии. При ССД параметры ИАЭ >2,0 о.е., ВП >2,5 мПа•с и нитритов >6,5 мкмоль/л свидетельствуют о высокой степени активности заболевания, показатели ИДЭ >2,5 о.е. являются прогностически негативными в отношении течения легочной патологии, ИАТ >30% — суставной, мышечной и печеночной, равновесного (статического) ПН >50 мН/м — систоло-диастолической функции левого желудочка сердца. Прогнозпозитивными критериями эффективности последующей патогенетической терапии ССД могут быть параметры ИАT <25% и ВП <2,0 мПа•с.
ЗВ’ЯЗОК МІЖ ГІПЕРУРИКЕМІЄЮ ТА ФУНКЦІОНАЛЬНИМ СТАНОМ НИРОК У ПАЦІЄНТІВ ІЗ ГІПЕРТОНІЧНОЮ ХВОРОБОЮ
В.Б. Безродний1,Т.М. Антончук2
1ДУ «ННЦ «Інститут кардіології ім. М.Д. Стражеска» НАМН України», Київ
2ДНУ «Науково-практичний центр профілактичної та клінічної медицини»
Державного управління справами
Мета: дослідити наявність звязку між вмістом сечової кислоти в крові та порушенням функції нирок у пацієнтів із гіпертонічною хворобою (ГХ).
Методи дослідження. У дослідження було включено 104 хворих на ГХ II–III стадії, 1–2-го ступеня з гіпертензивною нефропатією — швидкість клубочкової фільтрації (ШКФ) — від 30 до 89 мл/хв, мікроальбумінурія — 30–300 мг/добу. Середній вік обстежених становив 65,8±1,2 роки. Загалом по групі ШКФ — 58,2±1,5 мл/хв, креатинінемія — 108,2±2,9 мкмоль/л, середній рівень мікроальбумінурії — 89,8±5,9 мг/добу. Рівень сечової кислоти у середньому становив 331,9±12,4 ммоль/л. Екскрецію альбумінів із сечею визначали турбідиметричним методом за допомогою біохімічного автоматичного аналізатора «Biosystems A25» (Іспанія). ШКФ оцінювали за кліренсом ендогенного креатиніну. Концентрацію креатиніну в плазмі крові та сечі оцінювали за допомогою біохімічного автоматичного аналізатора «Biosystems A25» (Іспанія).
Результати. Пацієнти були розподілені у дві підгрупи залежно від вихідної ШКФ. У 1-шу підгрупу увійшло 55 пацієнтів із помірним порушенням ниркової функції — ШКФ 60–89 мл/хв, у 2-гу підгрупу — 49 хворих із ШКФ 30–59 мл/хв. Рівень сечової кислоти у крові хворих двох груп становив 300,7±11,9 та 363,2±13,2 ммоль/л відповідно (p<0,001). Аналіз функціонального стану нирок свідчить про більш виражені зміни у пацієнтів другої підгрупи: рівень креатиніну крові у них був вірогідно вищим (р<0,001) порівняно з таким у пацієнтів першої підгрупи. З метою визначення зв’язку між величиною ШКФ та рівнем сечової кислоти у крові проведено кореляційний аналіз за Спірменом. Встановлено, що ШКФ зворотно пов’язана з сечовою кислотою (r=–0,311; p<0,05), рівнем креатиніну крові (r=–0,395; p<0,01) та мікроальбумінурією (r=–0,412; p<0,01).
Висновки. У хворих на ГХ ІІ–ІІІ стадії з гіпертензивною нефропатією рівень сечової кислоти у крові зворотно корелює зі ШКФ, що свідчить про можливу патогенетичну роль гіперурикемії у розвитку та прогресуванні АГ та гіпертензивного ураження нирок.
Потреба інвалідів із патологією сполучної тканини в заходах медико-соціальної реабілітації
Н.М. Беляєва, С.В. Шевчук, І.В. Куриленко, О.Б. Яворовенко, Л.В. Кульчевич, В.В. Бойко
Науково-дослідний інститут реабілітації інвалідів Вінницького національного медичного університету ім. М.І. Пирогова, Вінниця
Медико-соціальна реабілітація є — одна з найскладніших міждисциплінарних проблем, яка має велике соціальне значення. Метою її є відновлення соціального статусу інваліда, досягнення адаптації людини в суспільство. У межах медико-соціальної реабілітації розрізняють медичну, психолого-педагогічну, фізичну, професійну, трудову, фізкультурно-спортивну, соціально-побутову реабілітацію з використанням технічних засобів реабілітації та виробів медичного призначення, які надаються інваліду залежно від потреб (Закон України «Про реабілітацію інвалідів в Україні» від 06.10.2005 р.). Потреби інваліда фіксуються медико-соціальними експертними комісіями (МСЕК) в індивідуальній програмі реабілітації (ІПР) відповідно до Постанови КМУ від 23.05.2007 р. № 757. Основною функцією її є забезпечення комплексної реабілітації конкретного інваліда.
Мета: визначення потреб інвалідів із патологією сполучної тканини в заходах медико-соціальної реабілітації.
Методи дослідження. Статистичний, аналітичний, копіювання даних з ІПР.
Результати. Дослідження проведено у 22 областях України, проаналізовано дані ІПР у 27 737 інвалідів, які проходили освідчення на МСЕК у 2012 р. З них інвалідів молодого (18–44) — 35,3%, середнього (45–60) — 56,4%, похилого віку (<60 років) — 8,3%, інвалідів І групи — 6,0%, ІІ — 20,2%, ІІІ — 73,8%.
Отримані дані свідчать про те, що інваліди мають потребу в послугах медичної реабілітації, а саме у відновному лікуванні в 100,0%, медичному спостереженні — 64,43%, санаторно-курортному лікуван-ні — 43,01%, реконструктивній хірургії — 5,43%, психіатричній допомозі — 1,87%; психолого-педагогічній реабілітації — 15,7% інвалідів, особливо це актуально для осіб молодого віку та пов’язано з вибором професії, навчанням, працевлаштуванням; у фізичній реабілітації — 60,39% інвалідів, лікувальній фізкультурі — 40,66%, лікувальному масажі — 36,16%, ерготерапії — 2,34%; у професійній реабілітації — 26,7%, в експертизі потенційних професійних здібностей — 17,20%, професійної орієнтації — 13,02%, професійному відборі — 10,42%, професійній підготовці, перепідготовці, освіті — 6,17%; трудовій реабілітації — 52,4% інвалідів, у пристосуванні та створенні робочого місця з урахуванням безпеки та особливих потреб інваліда — 14,55%, раціональному працевлаштуванні — 60,13%; соціальній та побутовій реабілітації — 2,8% інвалідів, у тому числі соціального побутового патронажу, адаптації житлових приміщень до потреб інвалідів, навчання основним соціальним навичкам. Технічні засоби реабілітації повністю або частково компенсують обмеження життєдіяльності. Так, у засобах пересування мали потребу 31,3% інвалідів (палиці, милиці, крісла колісні), спеціальних засобах для самообслуговування — 0,65%, для догляду — 2,06%, протезних виробах — 27,02% інвалідів, у виробах медичного призначення — 1,77% інвалідів, переважно ендопротезах.
Потреби інвалідів і групи суттєво відрізнялися від потреб інвалідів ІІ–ІІІ груп у лікувальному масажі, засобах пересування та догляду); інвалідів ІІ–ІІІ груп — у санаторно-курортному лікуванні, ЛФК, заходах професійної, трудової реабілітації; інвалідів ІІ порівняно з ІІІ групою — у засобах пересування та догляду (різниця в групах достовірна — р<0,05).
Висновки. Таким чином, отримані дані свідчать про комплексний характер потреб інвалідів із патологією сполучної тканини, дозволяють диференційовано планувати організацію медико-соціальної реабілітації залежно від виду реабілітаційних заходів і тяжкості інвалідності.
ДОСЛІДЖЕННЯ ВЗАЄМОЗВ’ЯЗКУ МІЖ ПОКАЗНИКАМИ БОЛЬОВОГО СИНДРОМУ і ПСИХОВЕГЕТАТИВНИМИ ПОРУШЕННЯМИ У ХВОРИХ НА ПСОРІАТИЧНИЙ АРТРИТ
І.І. Благініна1, О.О. Реброва1, І.І. Покришка2, О.В. Фельдман2
1ДЗ «Луганський державний медичний університет»
2Луганська обласна клінічна лікарня
Однією з актуальних проблем сучасної медицини є психосоматичні стани, які останнім часом все частіше трапляються в ревматологічній практиці. У зв’язку з наявністю схожості патофізіологічних механізмів болю і психовегетативних розладів стає необхідністю визначення їх взаємозв’язку у хворих на псоріатичний артрит (ПА). Дослідження взаємозв’язку між вираженістю больового синдрому і психовегетативними порушеннями у цієї категорії пацієнтів сприятиме оптимізації ефективності диференційованих методів комплексної терапії цього захворювання.
Мета: дослідити наявність зв’язків між функціональною вираженістю хронічного больового синдрому та психовегетативними порушеннями у хворих на ПА.
Методи дослідження. У дослідженні брали участь 49 хворих (15 чоловіків і 34 жінки) на ПА (середній вік — 44,5±1,2 року, середня тривалість ПА — 9,2±0,8 року). У більшості пацієнтів (28 випадків) встановлено II фазу активності запального процесу. У 67,3% хворих встановлено поліартритичний варіант суглобового синдрому. Больовий синдром, тривалість ранкової скутості, показник стану здоров’я пацієнта (СЗП) оцінювалися за візуальною аналоговою шкалою (ВАШ) самими пацієнтами, а лікарем проводився підрахунок кількості болючих (КБС) і набряклих суглобів (КНС). Рівень тривожності за шкалою Спілбергера <30 балів оцінювали як низький, 30–45 балів — помірний, >45 балів — високий. Результати тестування за шкалою депресії Гамільтона (ШДГ) оцінювали, як: 6–8 балів — норма, 16–18 балів у осіб молодого віку і 18–20 у осіб похилого віку — наявність непсихотичного депресивного стану, а >18–20 балів — можлива психотична депресія. Для виявлення вегетативних порушень використовували анкету «Вейн-пацієнт», що заповнюється пацієнтом (результати >15 балів свідчать на користь наявності вегетативної дисфункції) і «Вейн-лікар», що заповнюється лікарем (сума балів >25 підтверджує ознаки вегетативних розладів).
Результати. За показниками больового синдрому у хворих на ПА отримано такі дані: КБС — 6,8±0,5, КНС — 3,5±0,3, біль у суглобах — 60,0±2,6 мм, у хребті — 64,1±2,5 мм, ранкова скутість — 64,6±2,4 мм, СЗП — 65,7±2,4 мм. Показники реактивної (РТ) і особистісної (ОТ) тривожності у хворих на ПА (відповідно 37,9±1,2; 46,1±1,1 бала) були достовірно вище нормативних. При цьому у 26,5% спостерігалася висока РТ, а у 32,7% хворих — висока ОТ. При оцінці результатів тестування за ШДГ середні значення у хворих на ПА були значно вищими, ніж нормативні — 17,8±0,84 бала. Депресивні розлади виявлено у 31 пацієнта. Результати анкетування «Вейн-пацієнт» та «Вейн-лікар» свідчили про наявність вегетативних порушень у 43 обстежених хворих — 23,0±0,8 та 33,5±1,1 бала відповідно.
За даними кореляційного аналізу встановлено взаємозв’язок між окремими показниками больового синдрому та психовегетативного статусу. а саме вираженість депресії за ШДГ залежала від болю в суглобах і хребті та СЗП (відповідно r=0,49; р<0,001; r=0,32; р=0,024; r=0,29; p=0,044). Визначено прямий кореляційний зв’язок між РТ, ОТ та СЗП (r=0,35; p=0,013; r=0,32; p=0,026 відповідно), а також достовірні зв’язки між ознаками вегетативної дисфункції («Вейн-пацієнт», «Вейн-лікар») та СЗП (відповідно r=0,36; р=0,012; r=0,29; р=0,042). Слід зазначити, що достовірні зв’язки встановлено лише стосовно тих показників больового синдрому, які визначалися самим пацієнтом, тобто більш значущим у формуванні психовегетативних розладів був емоційно-афективний компонент болю.
Висновки. Встановлені зв’язки між окремими показниками больового синдрому та психовегетативного статусу свідчать про необхідність оптимізації лікувально-реабілітаційного процесу шляхом надання хворим на ПА диференційованої медичної допомоги. У зв’язку з цим надалі у пацієнтів з ПА доцільно вивчення впливу антидепресантів і психовегетокоректорів із метою зниження проявів тривожності, вегетативних розладів і для пришвидшення регресу больового синдрому.
ЦИТОКІНОВІ МАРКЕРИ ВАРІАНТІВ КЛІНІЧНОГО ПЕРЕБІГУ ЮВЕНІЛЬНОГО РЕВМАТОЇДНОГО АРТРИТУ
Я.Є. Бойко1, Л.І. Омельченко2, В.П. Чернишов2
1Комунальний заклад Львівської обласної ради «Західноукраїнський спеціалізований дитячий медичний центр», Львів
2ДУ «Інститут педіатрії, акушерства і гінекології НАМН України», Київ
Для визначення обсягу і тактики лікування хворих на ювенільний ревматоїдний артрит (ЮРА) важливими є верифікація варіанта перебігу, визначення ступеня активності та наявності прогностично несприятливих критеріїв. Для лабораторної ідентифікації необхідних предикторів вибору терапії проведено дослідження цитокінового профілю у хворих на ЮРА.
Мета: визначити зміни цитокінового профілю у хворих із різними варіантами ЮРА для уточнення ступеня активності та прогнозування рефрактерного перебігу хвороби.
Методи дослідження. У 105 хворих на різні варіанти ЮРА проведено дослідження в сироватці крові рівня цитокінів (IL-1β, IL-4, IL-6, IL-8, IL-10, IL-17, IFN-γ) та їхніх розчинних рецепторів і антагоністів: антагоніста рецептора IL-1 (IL-1Ra), розчинних рецепторів IL-2 (sCD25), IL-6 (sIL6R), фактора некрозу пухлини (sTNFR1). Клінічний варіант перебігу ЮРА верифікували згідно з критеріями ILAR (Durban, 1997; Edmonton, 2001). Розподіл пацієнтів із ЮРА за ступенем активності захворювання проводили згідно з рекомендаціями T. Beukelman (2011). З урахуванням терміну досягнення ремісії були сформовані дві групи хворих: з рефрактерним та нерефрактерним клінічним перебігом ЮРА. Проведено порівняння рівнів цитокінів у крові хворих з різними ступенями активності та у період ремісії захворювання, а також порівняльне дослідження цитокінового профілю у пацієнтів щодо рефрактерного та нерефрактерного перебігу ЮРА.
Результати. У всіх хворих на системний варіант ЮРА в сироватці крові виявлено значне підвищення рівнів IL-6 та IL-1Ra. При поліартикулярному варіанті ЮРА спостерігається зростання рівня прозапальних цитокінів TNF-α, IFN-γ, IL-17. При олігоартикулярному та ентезитасоційованому варіантах хвороби характерним є підвищення концентрації TNF-α у крові та зниження рівня протизапального цитокіну IL-10. Чутливим маркером активності ЮРА є рівень sTNF-R1, який підвищений в пацієнтів у період активності хвороби при всіх варіантах клінічного перебігу ЮРА. У хворих із середнім ступенем активності ЮРА виявлено підвищення IL-6 та sTNF-R1, а у хворих із високим ступенем активності — IL-6, sTNF-R1 та sCD25. Підвищення рівня sCD25 у сироватці крові хворих на ЮРА є ознакою високого ступеня активності захворювання. Пацієнти із рефрактерним перебігом ЮРА мали достовірно більш високі рівні IL-6, sCD25, IL-1Ra, sTNF-R1 у крові порівняно з хворими на нерефрактерний ЮРА.
Висновки. Показники рівнів цитокінів, їх розчинних рецепторів і агоністів у сироватці крові можуть бути використані як біомаркери різних варіантів ЮРА, а також при оцінці активності та прогнозу клінічного перебігу захворювання. Визначення цитокінового профілю у хворих на ЮРА доцільне при вирішенні питання про обсяг терапії, моніторування її ефективності та необхідність заміни базисних та біологічних препаратів.
CУГЛОБОВИЙ СИНДРОМ У ДІТЕЙ З ГЕМОРАГІЧНИМ ВАСКУЛІТОМ
О.Р. Боярчук, Л.Я. Рудько, Т.В. Гаріян, Н.Я. Машталяр, О.С. Орел, І.Я. Свистун
ДВНЗ «Тернопільський державний медичний університет ім. І.Я. Горбачевського МОЗ України» Тернопільська міська дитяча комунальна лікарня
Проблема діагностики та лікування васкуліту в дітей стосується як педіатрів, так і дитячих кардіоревматологів, гематологів, нефрологів і часто лікарів інших спеціальностей. Одним із найбільш поширених серед васкулітів у дітей є геморагічний васкуліт (пурпура Шенлейна — Геноха). Захворювання часто має тривалий, рецидивуючий перебіг, знижує якість життя пацієнтів.
Мета: визначити особливості перебігу суглобового синдрому у дітей з геморагічним васкулітом для покращення діагностики захворювання.
Методи дослідження. Під спостереженням перебували 34 дітей віком від 1,5 року до 14 років, хворих на геморагічний васкуліт, які знаходились на стаціонарному лікуванні в гематологічному відділенні Тернопільської міської дитячої комунальної лікарні впродовж останніх 2 років. Середній вік дітей становив (5,9±0,7) року. Хлопчиків було 20 (58,8%), дівчаток — 14 (41,2%).
Тривалість захворювання на час госпіталізації становила від 1 до 12 днів. У 5 (14,7%) дітей при направленні встановлювали інші діагнози. У 2 дітей на догоспітальному етапі діагностовано гостру алергічну реакцію, ще у 2 — була підозра на менінгококову інфекцію та в 1 дитини — виявлено токсичну вазопатію. Найчастіше виникали труднощі у встановленні діагнозу у дітей з нетиповими проявами шкірної форми геморагічного васкуліту. При шкірно-суглобовій формі помилки мали місце лише в одному випадку. Більшість дітей (52,9%) поступали у стаціонар у перші 3–6 днів від початку хвороби; 32,4% — у перші 2 дні, решта — на 7-й день і пізніше.
Найчастіше діти та їх батьки пов’язували захворювання із передуючою вірусною інфекцією (у 8 — 23,5%), в одиноких випадках — з ангіною, фізичним перевантаженням та прийомом антибактеріальної терапії. Проте у більшості випадків ймовірну причину розвитку хвороби встановити не вдалося.
Результати. Шкірний геморагічний синдром виявляли в усіх дітей. Суглобовий синдром спостерігався у 25 (73,5%), абдомінальний — у 5 (14,7%) дітей. Ураження нирок у вигляді гломерулонефриту виявлено в 1 дитини.
У дітей зі шкірно-суглобовою формою найчастіше спостерігалося ураження суглобів нижніх кінцівок, серед яких патологічний процес переважав у гомілковостопних суглобах (у 19 — 76,0% дітей). Рідше втягувалися колінні суглоби (у 5 — 20,0%), дрібні суглоби стопи (у 4 — 16,0%) та кисті (в 1 — 4,0%). У більшості пацієнтів (76,0%) відзначено симетричність ураження суглобів. Суглобовий синдром найчастіше характеризувався припухлістю, що призводило до дефігурації суглоба. Біль у суглобах відзначали у 40,0% дітей, який часто був причиною обмеження рухів у суглобах. В окремих випадках (3–12,0%) уражений суглоб був гарячим на дотик та спостерігали почервоніння суглоба. У 8 (32,0%) дітей суглобовий синдром передував появі геморагічного висипу.
У 8 (32,0%) дітей зі шкірно-суглобовою формою геморагічного васкуліту спостерігали підвищення рівня серомукоїду.
Суглобовий синдром у дітей з геморагічним васкулітом характеризувався доброякісним перебігом. Його тривалість становила від 2 до 14 днів, у середньому (7,0±1,6) днів. Рецидивів суглобового синдрому не відзначали.
Висновки. Таким чином, у 32,0% дітей суглобовий синдром передує появі висипу у дітей з геморагічним васкулітом, характеризується переважним ураженням великих суглобів нижніх кінцівок та доброякісним перебігом, у частини дітей супроводжується підвищенням рівня гострофазових показників запалення. Комбінація геморагічного висипу із суглобовим синдромом полегшує діагностику захворювання.
ІНФІКОВАНІСТЬ ВІРУСАМИ РОДИНИ HERPESVIRIDAE ДІТЕЙ З ЮВЕНІЛЬНИМ АРТРИТОМ
О.Р. Боярчук, І.Р. Сагаль
ДВНЗ «Тернопільський державний медичний університет ім. І.Я. Горбачевського МОЗ України»
Персистенції вірусів надається важливе місце у розвитку автоімунних захворювань. У ряді досліджень останніх років показано роль мімікрії вірусів у розвитку автоімунних процесів. Особливе значення надається вивченню ролі вірусів родини Herpesviridae у виникненні ревматоїдного артриту у дорослих.
Мета: визначити частоту інфікованості вірусами родини Herpesviridae, зокрема цитомегаловірусом, вірусами герпесу і та ІІ типу, вірусом Епштейна — Барр та їх реактивації у дітей з ювенільним артритом (ЮА).
Методи дослідження. Обстежено 30 дітей віком від 7 до 17 років, хворих на ЮА, які перебували на стаціонарному лікуванні в дитячих лікувальних закладах міста Тернополя. Контрольну групу становили 25 відносно здорових дітей. Діагноз ЮА встановлювали за наявності запального процесу в суглобах, що тривав >6 тиж у дітей віком до 16 років. Проводили кількісне визначення в сироватці крові методом імуноферментного аналізу типу ELISA ІgG- та IgM-антитіл до цитомегаловірусу; ІgG- та IgM-антитіл до вірусів герпесу І–ІІ типу; ІgG- та IgM-антитіл до капсидного (VCA) антигену вірусу Епштейна — Барр та ІgG-антитіл до ядерного антигену (EBNA) вірусу Епштейна — Барр. За наявністю ІgG-антитіл до вірусів визначали інфікованість тим чи іншим вірусом та хронічну інфекцію, за наявності IgM-антитіл — гостру первинну інфекцію чи реактивацію хронічної інфекції залежно від виявлення ІgG-антитіл.
Результати. Серед обстежених дітей з ЮА лише у 1 (3,3%) хворого не виявлено IgG-антитіл до жодного з вищенаведених вірусів. У 13,3% пацієнтів визначали IgG-антитіла до одного збудника, у 56,7% дітей — до двох збудників та у 26,7% хворих виявляли інфікування усіма трьома вірусами родини герпес. Інфікованість цитомегаловірусом та вірусом герпесу І–ІІ типу спостерігалося з однаковою частотою — у 21 (70,0%) дитини, тоді як у контрольній групі IgG-антитіла до цитомегаловірусу визначали у 48,0%, а до вірусу герпесу І–ІІ типу — у 40,0% дітей. Дещо рідше (у 18–60,0%) пацієнтів відзначали інфікованість вірусом Епштейна — Барр. У контрольній групі IgG-антитіла до вірусу Епштейна — Барр виявлялись у 48,0% дітей. Реактивація цитомегаловірусної інфекції спостерігалася у 5 (16,7%) хворих на ЮА проти 1 (4,0%) дітей контрольної групи (р>0,05). Реактивацію вірусу герпесу І–ІІ типу виявляли у 9 (30,0%) пацієнтів проти 2 (8,0%) дітей контрольної групи (р=0,08), а реактивацію Епштейна — Барр вірусної інфекції — у 4 (13,3%) хворих на ЮА проти 1 (4,0%) дитини контрольної групи (р>0,05).
Висновки. Таким чином, значна частка інфікованості вірусами родини Herpesviridae у дітей з ЮА, що перевищує показники контрольної групи у 1,25–1,75 раза, потребує подальшого вивчення з метою визначення ролі вірусів у розвитку і прогресуванні захворювання. Наявність інфікованості вірусами герпес необхідно також враховувати при призначенні лікування, оскільки базисною терапією ЮА є препарати імуносупресивної дії, які можуть сприяти активації вірусів, про що свідчить зростання частки реактивації вірусів у 3–4 рази порівняно з контролем. Спостерігали тенденцію до підвищення частоти реактивації вірусу герпесу І–ІІ типу у дітей з ЮА, що також може впливати на перебіг основного захворювання.
ВЛИЯНИЕ ЧЕЛОВЕЧЕСКОГО РЕКОМБИНАНТНОГО
ЭРИТРОПОЭТИНА НА АКТИВНОСТЬ ВОСПАЛИТЕЛЬНОГО ПРОЦЕССА У ЛИЦ С РЕВМАТОИДНЫМ АРТРИТОМ С АНЕМИЕЙ ХРОНИЧЕСКОГО ЗАБОЛЕВАНИЯ
Н.Т. Ватутин, А.С. Смирнова
Донецкий национальный медицинский университет им. Максима Горького
Цель: изучить влияние человеческого рекомбинантного эритропоэтина (ЧРЭ) на активность воспалительного процесса у больных ревматоидным артритом (РА) с анемией хронического заболевания (АХЗ).
Методы исследования. Под наблюдением находились 32 женщины (средний возраст — 47±10 лет) с РА и АХЗ (уровень гемоглобина — 103,52±5,61 г/л). Больным назначали ЧРЭ в дозе 4000 МЕ 3 раза в неделю до нормализации уровня гемоглобина (но не более 2 мес) с последующей поддерживающей терапией в дозе 2000 МЕ 3 раза в неделю подкожно на протяжении 3 мес. До начала терапии, после нормализации уровня гемоглобина и через 3 мес поддерживающей терапии у пациенток измеряли скорость оседания эритроцитов (СОЭ), содержание С-рективного белка (СРБ), фактора некроза опухоли (ФНО)-α и интерлейкина (ИЛ)-1β в сыворотке крови.
Результаты. У всех больных на фоне терапии (в среднем через 1,72±0,19 мес) наблюдалась нормализация уровня гемоглобина (126,21±3,4 г/л), что сопровождалось достоверным (р<0,05) снижением уровня СОЭ с 45,93±6,89 до 33,54±4,3 мм/ч и СРБ с 41,93±3,57 до 20,3±4,09 мг/дл. В то же время достоверное (р<0,05) снижение концентрации ФНО-α (до начала лечения — 29,06±2,93 пкг/мл; после нормализации гемоглобина — 23,2±1,94 пкг/мл; через 3 мес поддерживающей терапии — 10,67±1,22 пкг/мл) и ИЛ-1β (до начала лечения — 154,25±6,02 пг/мл; после нормализации гемоглобина — 149,14±5,31 пг/мл; через 3 мес поддерживающей терапии –108,6±4,81 пг/мл) наблюдалось только через 3 мес поддерживающей терапии.
Выводы. Нормализация уровня гемоглобина на фоне терапии ЧРЭ сопровождается снижением уровня СОЭ и СРБ. Достоверное снижение концентрации ФНО-α и ИЛ-1β наблюдается лишь после завершения поддерживающей терапии.
ОЦІНКА АКТИВНОСТІ РАННЬОГО РЕВМАТОЇДНОГО АРТРИТУ ЗА ДОПОМОГОЮ МАГНІТНО-РЕЗОНАНСНОЇ ТОМОГРАФІЇ КИСТІ
Д.В. Вершиніна1, В.М. Рижик1, О.М. Михальченко2, І.П. Семенів2, А.В. Ашихмін2, П.Ф. Дудій1, І.Ю. Головач2, С.А. Грабовецький2, О.В. Гретчин3, О.П. Черепінська2, О.С. Шевчук3, І.А. Сметанюк2, Р.Ю. Веліканович2
1Національний Івано-Франківський медичний університет
2Клінічна лікарня «Феофанія» Державного управління справами, Київ
3Івано-Франківська обласна клінічна лікарня
Впровадження новітніх методів лікування ревматоїдного артриту (РА) зумовлює необхідність розробки об’єктивних методів оцінки активності ревматоїдного процесу і визначення прогностичних ознак розвитку й прогресування деструктивних змін у суглобах на ранніх стадіях. Результати останніх досліджень показали перевагу магнітно-резонансної томографії (МРТ) перед стандартним клінічним і рентгенологічним обстеженням щодо візуалізації запального і деструктивного процесів у суглобах.
Мета: визначити можливості МРТ кисті для оцінки активності запального процесу у пацієнтів з раннім РА.
Методи дослідження. Для досягнення поставленої мети проведено зіставлення між даними МРТ кисті й показниками клініко-лабораторної активності РА. Обстежено 48 пацієнтів зі встановленим діагнозом РА (на підставі класифікаційних критеріїв EULAR/ARC’2010) із тривалістю суглобового синдрому до 1 року від дебюту захворювання — ранній РА. Середня тривалість суглобового синдрому становила 8,9±2,4 міс, жінок було 35, чоловіків — 13, середній вік пацієнтів — 37,6±5,8 року. При першому візиті були проведені: огляд ревматолога, клінічні обстеження, рентгенограми кистей і зап’ястка, МРТ суглобів кистей домінантної кінцівки. Клініко-лабораторне дослідження включало: визначення DAS28, ШОЕ, концентрації ревматоїдного фактора (РФ), антитіл до циклічного цитрульованого пептиду (анти-ЦЦП) і циклічного модифікованого віментину (анти-ЦМВ). МРТ домінуючої кисті проводили на високопольному МР-томографі Siemens MAGNETOM Espree з індукцією магнітного поля 1,5 Тл. Протокол дослідження включав таку послідовність Т1-ЗЗ спін-ехо в корональних проекціях, Т1-FS-ЗЗ спін-ехо в корональній проекції до і відразу після введення контрастуючого агента Gd-DTPA; аксіальні і корональні STIR-зображення, Т2-ЗЗ.
Результати. При проведенні клінічного обстеження високий ступінь активності РА, за даними DAS28 (5,4±1,7 бала), виявлено у 22 пацієнтів (45,8%). Клінічно явища синовіту суглобів кистей виявлено у 31 (64,6%) пацієнта. При дослідженні сероприналежності позитивними за анти-ЦЦП виявилися 32 (66,7%) пацієнти, за анти-ЦМВ — 27 (56,25%), серопозитивними за двома маркерами — 26 (54,1%), серонегативними — 16 (33,3%). За даними МРТ, набряк кісткового мозку був виявлений у всіх пацієнтів (100%), синовіт — у 45 пацієнтів (93,75%), при цьому рахунок синовіту >6 балів (за критеріями OMERACT-RAMRIS) встановлено у 37 осіб. Дані МРТ і клінічного огляду щодо наявності синовіту співпадали тільки у 31 пацієнта, у решти 14 пацієнтів синовіт визначався за допомогою МРТ у клінічно інтактних суглобах. Необхідно зазначити, що синовіт візуалізувався у всіх хворих, серопозитивних за анти-ЦЦП і анти-ЦМВ. Кореляційні зв’язки встановлено між рахунком синовіту за МРТ і показником запальної активності DAS28 (r=0,43; р=0,001) та ШОЕ (r=0,26; р=0,001). Крім того, рахунок синовіту та набряк кісткового мозку слабко корелювали з кількістю припухлих суглобів (r=0,30; р<0,05; r=0,24; р<0,05 відповідно). За даними стандартної рентгенографії, ерозивний процес виявлено у 9 осіб (18,75%) із тривалістю перебігу РА понад 6 міс. При МРТ ерозії виявлено у 29 (60,4%) пацієнтів, що локалізувалися здебільшого у кістках зап’ястку. Рентгенологічно виявлені ерозії підтверджені при МРТ у всіх пацієнтів. Рахунок ерозій за МРТ корелював з індексом активності DAS28, серопозитивність — за анти-ЦЦП і анти-ЦМВ; не встановлено кореляційних зв’язків із ШОЕ та кількістю болючих суглобів. Виявлення синовіту, набряку кісткового мозку при МРТ може свідчити про активність ревматоїдного процесу, навіть за відсутності клініко-лабораторних ознак запалення.
Висновки. Результати МРТ, проведеної в ранні терміни виникнення суглобового синдрому, дозволяють вірогідно візуалізувати симптоми запальної активності РА — синовіт, набряк кісткового мозку, а також ерозії у більшості хворих та прогнозувати прогресуючий перебіг артриту, а також виступати незалежними ознаками запальної активності. Наявність у пацієнтів одночасно анти-ЦЦП, анти-ЦМВ і змін на МРТ кистей в дебюті захворювання (синовіт, набряк кісткового мозку, ерозії) є маркерами більш тяжкого, прогностично несприятливого перебігу РА.
ВЗАЄМОЗВ’ЯЗОК МІНЕРАЛЬНОЇ ЩІЛЬНОСТІ КІСТКОВОЇ ТКАНИНИ ІЗ ЕРОЗИВНИМИ ЗМІНАМИ, ВИЯВЛЕНИМИ ПРИ МРТ СУГЛОБІВ КИСТІ, У ПАЦІЄНТІВ із РАННІМ РЕВМАТОЇДНИМ АРТРИТОМ
Д.В. Вершиніна
Національний Івано-Франківський медичний університет
Мета: оцінити зміни мінеральної щільності кісткової тканини (МЩКТ) у пацієнтів із раннім ревматоїдним артритом (РА) та наявність зв’язку із ерозивними змінами суглобів кистей при МРТ.
Методи дослідження. Обстежено 56 пацієнтів із РА із тривалістю суглобового синдрому до 1 року (середній показник — 9,3±2,4 міс). Діагноз РА встановлено на підставі класифікаційних критеріїв EULAR/ARC’2010. Середній вік пацієнтів — 40,2±6,8 року. Клініко-лабораторне дослідження включало: визначення індексу активності DAS28, ШОЕ, концентрації ревматоїдного фактора (РФ), антитіл до циклічного цитрульованого пептиду (анти-ЦЦП) і циклічного модифікованого віментину (анти-ЦМВ). Стандартне рентгенологічне дослідження кистей проводили у прямій проекції. МЩКТ дистального відділу променевої кістки і поперекового відділу хребта (LІ–LIV) оцінювали за допомогою двохенергетичного рентгенівського денситометра «Challenger» (DMS, Франція). МРТ домінуючої кисті проводили на високопольному МР-томографі Siemens MAGNETOM Espree з індукцією магнітного поля 1,5 Тл. Протокол дослідження включав такі послідовності: Т1-ЗЗ спін-ехо в корональних проекціях, Т1-FS-ЗЗ спін-ехо в корональній проекції до і відразу після введення контрастуючого агента Gd-DTPA; аксіальні й корональні STIR-зображення, Т2-ЗЗ. З метою вивчення отриманих результатів у роботі використовувалися методи статистичного аналізу, які проводилися на ПК за допомогою стандартної програми Statistica 8.0.
Результати. Проведення денситометрії дозволило встановити втрату кісткової маси у пацієнтів із раннім РА. Так, при дослідженні поперекового відділу хребта остеопороз виявлено у 3 (5,4%) пацієнтів, остеопенічний синдром — у 21 (37,5%); при дослідженні дистального відділу променевої кістки встановлено більш значні втрати кісткової маси. Так, остеопороз діагностовано у 12 (21,4%) хворих, остеопенічний синдром — у 32 (57,1%). Зниження МЩКТ в дистальному відділі променевої кістки корелювало з DAS28 (r=–0,57; р<0,001), ШОЕ (r=–0,41; р<0,05), кількістю припухлих суглобів (r=–0,44; р<0,01). Щодо МЩКТ поперекового відділу хребта, то середньої сили кореляційний зв’язок встановлено тільки із DAS28. Остеопенія і остеопороз з більшою частотою виявлялися у пацієнтів із серопозитивним перебігом РА; так, у всіх 22 пацієнтів, серопозитивних за РФ, анти-ЦЦП і анти-ЦМВ, діагностовано достовірне зниження МЩКТ як у поперековому відділі хребта, так і дистальному відділі променевої кістки. Ерозії, за даними стандартної рентгенографії, виявлено у 12 пацієнтів. Здебільшого вони розташовувалися в кістках зап’ястку і у 2 пацієнтів — у ділянці головок п’ясткових кісток. Виявлення ерозій на рентгенограмах корелювало із наявністю синовіту суглобів кисті, клінічно встановленому (r=0,40; р<0,05), DAS28 (r=0,48; р<0,01), серопозитивність за трьома антитілами (r=0,52; р<0,001). У всіх пацієнтів із рентгенологічними ерозіями водночас відзначено зниження МЩКТ дистального відділу променевої кістки (r=–0,67; р<0,001). Подібного кореляційного зв’язку не встановлено при аналізі змін мінеральної щільності поперекового відділу хребта. При проведенні МРТ домінантної кисті виявлено такі МР-симптоми: набряк кісткового мозку — у 54 (96,4%) пацієнтів, синовіт — у 40 (71,4%) пацієнтів, ерозії — у 34 (60,7%). При МРТ ерозії виявлялися в 2,8 разів частіше, ніж при стандартній рентгенографії. Найчастіше ерозії візуалізувалися в кістках зап’ястка: головчастій, напівмісяцевій, тригранній, човноподібній кістках. У 4 пацієнтів виявлено ерозії променевої кістки. Ерозії були верифіковані, насамперед, у пацієнтів із високим показником DAS28, у серопозитивних пацієнтів, а також за наявності синовіту. Встановлено сильний кореляційний взаємозв’язок між МЩКТ дистального відділу променевої кістки та наявністю ерозій за МРТ (r=–0,72; р<0,001), а також МЩКТ поперекового відділу хребта і ерозіями (r=–0,48; р<0,01).
Висновки. Результати проведеного дослідження свідчать, що зниження МЩКТ дистального відділу променевої кістки і поперекового відділу хребта корелювали з виявленням ерозій на стандартній рентгенографії і МРТ кистей. Таким чином, за змінами денситометричних показників можна прогнозувати розвиток ерозивного процесу в пацієнтів з раннім РА.
ОЦІНКА ЩІЛЬНОСТІ КІСТКОВОЇ ТКАНИНИ У ХВОРИХ НА ЦУКРОВИЙ ДІАБЕТ ІІ ТИПУ ЗАЛЕЖНО ВІД ТРИВАЛОСТІ ЗАХВОРЮВАННЯ
О.І. Вітцівська, Т.Ю. Гріненко
Запорізький державний медичний університет
Мета: поширеність цукрового діабету (ЦД) у всьому світі висока і продовжує зростати. Тому метою нашого дослідження стала оцінка щільності кісткової тканини (ЩКТ) у хворих на ЦД ІІ типу залежно від тривалості захворювання.
Методи дослідження. Обстежений 51 хворий, середній вік становив 60,6±1,03 року з діагнозом ЦД ІІ типу. Тривалість ЦД до 5 років мали 25 (49%) осіб, від 5 до 10 років — 15 (29%), >10 років — 11 (22%). Стан ЩКТ визначали за допомогою ультразвукового денситометра Omnisense 7000, за трьома зонами: на проксимальній фаланзі третього пальця кисті, дистальній третині променевої кістки та середині великогомілкової кістки. Статистична обробка проводилась за допомогою комп’ютерної програми «Statistica 6.1» (Stat Soft Inc, США).
Результати. Показник Т-критерію у групі з тривалістю захворювання до 5 років знаходився в межах норми, зі збільшенням тривалості до 10 років він достовірно знижувався у всіх трьох зонах, але знаходився на нижній межі норми. При тривалості ЦД ІІ типу >10 років Т-індекс становив: на гомілці –1,1±0,05, на фаланзі –1,4±0,07 та на променевій кістці –1,2±0,02, що свідчить про наявність остеопенії. При цьому найменша ЩКТ була на фаланзі третього пальця кисті, потім на променевій кістці, а вже потім на гомілці.
Ризик переломів (РП) підвищується в 1,7 раза, на фаланзі в 2,7 раза та на променевій кістці в 1,9 раза у групі з тривалістю ЦД ІІ типу >10 років.
Висновки. Отже, можемо зробити висновки, що ЩКТ у хворих на ЦД ІІ типу достовірно знижується зі зростанням тривалості ЦД ІІ типу, а РП достовірно підвищується. Тому оцінку ЩКТ бажано включити в план обстеження хворих на ЦД ІІ типу, особливо з тривалістю >10 років.
ПЕРЕЛОМИ У ЖІНОК З ОСТЕОПОРОЗОМ В ПОСТМЕНОПАУЗАЛЬНИЙ ПЕРІОД
Л.А. Вознюк
Вінницький національний медичний університет ім. М.І. Пирогова
Мета: вивчити частоту низькоенергетичних переломів різної локалізації у жінок в постменопаузальний період залежно від віку, наявності вертебрального больового синдрому, стану кісткової системи.
Методи дослідження. Використовували загальноприйняті методи: огляд, опитування, анкетування, клінічне та ортопедичне обстеження, інструментальні та лабораторні обстеження. Мінеральну щільність кісткової тканини (МЩКТ) у 28 жінок 40–79 років визначали з використанням двохенергетичного рентгенівського денситометра «Prodigy». Больовий синдром оцінювали окремо в грудному та поперековому відділах хребта за допомогою візуально-аналогової шкали (ВАШ) у балах від 0 (біль відсутній) до 10 (нестерпний біль). Статистичний аналіз проводили із визначенням параметричних та непараметричних критеріїв. При аналізі використовували пакети програм Statistica 6.0. Відмінності показників вважали вірогідними при р<0,05.
Результати. Установлено, що підвищення частоти низькоенергетичних переломів у жінок відбувається за рахунок частки переломів аксіального скелета (від 10% у віці 50–59 років до 27% у віці 70–79 років) та комбінованої локалізації (від 5% у віці 50–59 років до 9% у віці 70–79 років). Незалежно від показників МЩКТ у всіх групах жінок у постменопаузальний період трапляються низькоенергетичні переломи різної локалізації. Частота розвитку низькоенергетичних переломів різної локалізації змінюється з віком залежно від стану кісткової тканини. Так, 50% жінок з остеопорозом віком 50–59 років мають переломи, 60–69 років — 80%, 70–79 років — 78%. Біль у спині реєструється у 71% жінок без переломів, 89% жінок з вертебральними переломами, 74% жінок з переломами периферичного скелета в анамнезі та 85% пацієнток із переломами комбінованої локалізації.
Висновки. У результаті проведеного дослідження встановлено, що з віком зростає частота остеопоротичних переломів з 18% у 40–49 років до 50–54% у 70–79 років. Низькоенергетичні переломи виявлено у 70% жінок з остеопорозом, 43% — з остеопенією, 40% — з нормальними показниками кісткової тканини. Аналіз структури вертебрального больового синдрому продемонстрував його наявність у 71% жінок без переломів, 89% жінок з вертебральними переломами, 74% жінок з переломами периферичного скелета в анамнезі та 85% пацієнток із переломами комбінованої локалізації. Отже, отримані результати потребують диференційованого підходу до ведення та лікування жінок старших вікових груп, які мають патологію кістково-м’язової системи.
ВИЗНАЧЕННЯ ФАРМАКОЛОГІЧНИХ АСПЕКТІВ ВЗАЄМОДІЇ МЕЛОКСИКАМУ ТА ХОНДРОПРОТЕКТОРІВ
А.К. Галицька, Н.О. Горчакова
ДУ «ННЦ «Інститут кардіології ім. М.Д. Стражеска» НАМН України», Київ
Національний медичний університет ім. О.О. Богомольця, Київ
Відома доцільність поєднаного застосування мелоксикаму з хондропротекторами — глюкозаміном і хондроїтинсульфатом при лікуванні хворих на остеоартроз.
Мета: визначити фізико-хімічні та фармакологічні аспекти взаємодії мелоксикаму з глюкозаміном та хондроїтинсульфатом в експерименті та клініці.
Методи дослідження. Спектрофотометричні, фармакологічні, клінічні.
Результати. У дослідах in vitro за допомогою УФ-спектрофотометрії визначали можливість фізико-хімічної взаємодії мелоксикаму з хондроїтинсульфатом та глюкозаміном. Показана відсутність зміщення значення піків оптичного поглинання у парах досліджуваних медикаментів та відсутність появи нових піків, що свідчить про те, що не відбувається взаємодії між препаратами при їх введенні в організм. При моделюванні формалінового набряку у щурів у сироватці крові підвищується концентрація жирних кислот, продуктів перекисного окиснення ліпідів (ПОЛ) за рахунок пригнічення активності ендогенної антиоксидантної системи (АОС): гальмування синтезу глутатіонпероксидази, глутатіонредуктази, супероксиддисмутази, каталази. Пероральне введення щурам мелоксикаму та більшою мірою його сполучень з глюкозаміном та хондроїтинсульфатом протягом місяця в умовно терапевтичних дозах відновлює показники прооксидантно-антиоксидантного гомеостазу в сироватці крові. Аналогічні зміни показників ПОЛ, АОС відзначені в сироватці крові у хворих з остеоартрозом до і після лікування мелоксикамом у поєднанні з глюкозаміном та хондроїтинсульфатом.
Висновки. При поєднаному застосуванні мелоксикаму з хондропротекторами не відбувається фізико-хімічної взаємодії компонентів, а реалізується адитивна антиоксидантна дія.
АКТИВНІСТЬ ФАКТОРА ВІЛЛЄБРАНДА У ХВОРИХ НА РЕВМАТОЇДНИЙ АРТРИТ, ЗВ’ЯЗОК ІЗ ТРАДИЦіЙНИМИ ФАКТОРАМИ РИЗИКУ
О.Ю. Галютіна
Науково-дослідний інститут реабілітації інвалідів Вінницького національного медичного університету ім. М.І. Пирогова, Вінниця
За сучасними уявленнями, одним із маркерів пошкодження ендотелію вважається підвищення концентрації фактора Віллєбранда (ФВ). За даними літератури, у пацієнтів із ревматичними захворюваннями виявляється зростання його активності в сироватці крові. Водночас чітких даних стосовно рівнів ФВ у хворих на рематоїдний артрит (РА) обмаль, а його зв’язків із традиційними факторами ризику судинних уражень взагалі не вивчали. Дослідження цього питання дало б змогу більш чіткому розумінню механізмів пошкодження ендотелію і як наслідок — серцево-судинним ускладненням.
Мета: вивчити рівні ФВ у сироватці крові у хворих на РА та оцінити їх зв’язок із традиційними факторами ризику коронарних подій.
Методи дослідження. Обстежено 160 хворих на РА (123 жінки і 37 чоловіків, середній вік —46,3±9,9 року). Контрольну групу становили 76 здорових осіб відповідного віку і статі. Діагноз РА встановлювали на основі АСR-критеріїв (1987). Вміст ФВ визначали імуноферментним методом за реактивами «Shield diagnostics», Велика Британія. Визначали також вміст загального холестерину (ЗХС), холестерину ліпопротеїнів високої щільності (ХС ЛПВЩ), тригліцеридів (ТГ), холестерину ліпопротеїнів низької щільності (ХС ЛПНЩ).
Результати. Встановлено, що у хворих на РА активність ФВ к крові становила в середньому 151,2±40,2%, тоді як у осіб контрольної групи — 85,9±10,2%. Чоловіки з РА мали лише на 10% вищу активність ФВ, ніж жінки. Аналіз рівнів ФВ залежно від віку також не показав істотних відмінностей між досліджуваними групами хворих. Водночас хворі на РА з аретріальною гіпертензією (АГ) мали достовірно вищу (на 10,8%) активність ФВ, ніж такі без АГ. Аналіз активності ФВ залежно від тютюнопаління виявив подібні (як для хворих на АГ) закономірності. Так, якщо в осіб з наявністю цього фактора ризику концентрація ФВ становила 166,9±35,4%, то в групі хворих, які не палять — 147,3±40,5%, а була нижчою на 13,6%. Наявність ожиріння суттєво не впливала на активність ФВ. Показники ліпідного обміну (рівні ЗХС, ХС ЛПНЩ, ХС ЛПВЩ та ТГ) також слабко впливали на концентрацію в сироватці крові ФВ. Лише рівні ЗХС та ХС ЛПНЩ мали слабкої сили (r=0,22, r=0,24 відповідно) кореляційний зв’язок із рівнем ФВ.
Висновки. У хворих на РА порівняно зі здоровими пацієнтами виявлено підвищення активності ФВ в сироватці крові. Концентрація ФВ тісно асоціюються з такими традиційними факторами ризику коронарних подій, як АГ, тютюнопаління, рівнями ЗХС та ХС ЛПНЩ, і не залежать від віку, статі, надмірної маси тіла, ХС ЛПВЩ і ТГ.
НАРУШЕНИЯ ЦИТОКИНОВОЙ СЕТИ ПРИ СИСТЕМНОМ ВАСКУЛИТЕ И ПЕРСПЕКТИВЫ ЛЕЧЕНИЯ БОЛЬНЫХ
А.М. Герасименко, М.В. Ермолаева, О.В. Синяченко, В.А. Толстой, И.Н. Левада
Национальный медицинский университет им. Максима Горького, Донецк
В последние годы доказана роль нарушений провоспалительных и иммунорегуляторных цитокинов в патогенетических построениях гранулематозного полиангиита Вегенера (ГП), болезни Бехчета, неспецифического аортоартериита Такаясу (НА) и гигантоклеточного артериита Хортона. Нами изучена значимость интерлейкинов (IL)-1b, -4, -6, -8, -10, -11, -13 и -17, а также фактора некроза опухоли (TNF)-α и клеток с рецепцией CD25, отражающих рецепцию IL-2, при геморрагическом васкулите Шенлейна — Геноха (ГВ), криоглобулинемическом васкулите (КВ), узелковом панартериите (УП), эозинофильном васкулите Черджа — Стросса (ЭВ), ГП и НА. Интегральные изменения цитокиновой сети при системном васкулите характеризуются повышением IL-b, -6, -8, -11 и TNF-α на фоне уменьшения IL-4 и -10. По уровням TNF-α в сыворотке крови (от большего к меньшему) больные распределились следующим образом — УП, ГП, ЭВ, КВ, НА, ГВ, а по частоте повышенных параметров — IL-1b (>M+SD значений у здоровых людей) — ГП, УП, НА, КВ, ЭВ и ГВ. Концентрации IL-1b и -6 при всех вариантах системных васкулитов прямо коррелируют с содержанием в крови эндотелина-1 и тромбоксана-А2, а при УП и НА, кроме того, обратно соотносятся с показателями простациклина и циклического гуанозинмонофосфата, что демонстрирует участие этих цитокинов в эндотелиальной дисфункции сосудов. Существуют тесные позитивные корреляционные взаимосвязи значений IL-1b и -8 у больных ГП, УП и ЭВ, а в случаях КВ и ГВ — обратные корреляции IL-1b с уровнем IL-4. Отмечена положительная регрессионная зависимость концентраций С-реактивного протеина и фибронектина в крови пациентов, страдающих УП, ГП, КВ и НА, от параметров IL-1b и -6. При ГВ содержание IL-1b позитивно коррелирует с показателем соотношения иммуноглобулина а от общей суммы иммуноглобулинов в сыворотке крови. Выявлено дисперсионное влияние уровня IL-8 на параметры антител к протеиназе-3 при ГП и ЭВ, а также значения антител к миелопероксидазе при УП. Необходимо отметить, что у больных КВ и ГВ подобные результаты исследований имеют разнонаправленные корреляционные связи. При всех вариантах системных васкулитов состояние цитокиновой сети достоверно связано с интегральными параметрами сывороточного, эритроцитарного и тромбоцитарного звеньев реологических свойств крови, что демонстрирует ANOVA/MANOVA Уилкоксона — Рао. По результатам однофакторного дисперсионного анализа, уровни IL-1b и TNF-α оказывают достоверное воздействие на значения объемной и поверхностной вязкости сыворотки крови, модуля ее вязкоэластичности и индекса агрегации эритроцитов при УП, ГП, КВ и ГВ, а IL-4 и -8 — на время релаксации сыворотки крови и индекс агрегации тромбоцитов при УП, КВ, ЭВ и НА. Учитывая важную патогенетическую значимость у больных системными васкулитами такого провоспалительного цитокина, как TNF-α, обосновано использование в программе терапевтических мероприятий ГП, УП, ЭВ и НА генно-инженерных биологических противоцитокиновых (анти-TNF) средств, как этанерцепт, инфликсимаб и адалимумаб. Этарнецепт является белком-рецептором TNF75-иммуноглобулин G1, инфликсимаб — химерными (человеческими и частично мышиными) моноклональными антителами к TNF-α, адалимумаб — препаратом полностью человеческих рекомбинантных моноклональных антител к TNF-α.
ОЦІНКА РИЗИКУ ПЕРЕЛОМІВ І ФАКТОРІВ РИЗИКУ ОСТЕОПОРОЗУ У ПАЦІЄНТІВ ІЗ РЕВМАТОЇДНИМ АРТРИТОМ
І.Ю. Головач1, І.П. Семенів1, Г.М. Пелешенко1, О.М. Михальченко1, Д.В. Вершиніна2,Т.М. Чіпко1, О.О. Лазоренко1
1Клінічна лікарня «Феофанія» Державного управління справами, Київ
2Національний Івано-Франківський медичний університет
Мета: встановити та оцінити чинники ризику остеопорозу (ОП) і переломів кісток у хворих на ревматоїдний артрит (РА).
Методи дослідження. Обстежено 60 пацієнтів зі встановленим діагнозом РА. Діагноз встановлено на підставі класифікаційних критеріїв EULAR/ARC’2010. Середній вік пацієнтів становив 53,2±12,7 року; жінок було 42, чоловіків — 18. Серед обстежених пацієнтів переважали особи із тривалістю захворювання >5 років (середня тривалість — 5,3±2,6 року), серопозитивні за РФ (71,6%). Здебільшого пацієнти мали середню активність захворювання — DAS28 у середньому становив 4,8±1,8. Стан мінеральної щільності кісткової тканини (МЩКТ) поперекового відділу хребта (LI–LIV) оцінювали методом двохенергетичної рентгенівської абсорбціометрії за допомогою апарату «Discovery-A» (HOLOGIC, США). При оцінці результатів денситометрії використовували рекомендації ВООЗ (1994), згідно з якими зниження МЩКТ за Т-критерієм >1 стандартне відхилення (SD) розглядається як остеопенічний синдром, а >2,5 SD як ОП. Проводилася оцінка абсолютного 10-річного ризику переломів за допомогою FRAX.
Результати. Проведене дослідження дозволило встановити значну поширеність змін МЩКТ у пацієнтів із РА, що дозволяє стверджувати про існування ревматоїдасоційованої остеопенії, розвиток якої пов’язаний з основними патогенетичними механізмами прогресування захворювання. Так, зниження МЩКТ виявлено у переважної кількості обстежених пацієнтів — 52 (86,7%). При цьому ОП діагностовано у 29 пацієнтів (48,3%), остеопенію — у 23 (38,3%). Зниження МЩКТ у поперековому відділі хребта корелювало із тривалістю захворювання (r=–0,53; p<0,001), серопозитивністю за РФ (r=–0,40; p<0,01) і рентгенологічною стадією РА (r=–0,68; p<0,001). У всіх пацієнтів, які отримували в минулому чи отримують у даний час глюкокортикоїди (ГК), діагностували ОП (25 пацієнтів). Встановлено слабкі кореляції із активністю РА в даний час: рівнем ШОЕ (r=–0,12; p>0,05) і індексом активності DAS28 (r=–0,20; p<0,05). При оцінці абсолютного 10-річного ризику виникнення переломів (FRAX) установлено, що у пацієнтів із РА з нормальним станом кісткової тканини (8 (13,3%) пацієнтів) відзначається низький ризик переломів (коливання показника від 0,7 до 1,8%, середнє значення — 1,2±0,6%). Ситуація змінювалася за умов діагностики змін МЩКТ. Ризик переломів підвищувався відповідно до зниження показників МЩКТ. При ОП у всіх пацієнтів відзначався високий ризик переломів, особливо значним він був у хворих, які тривало приймали ГК. Із 52 пацієнтів, в яких виявлено зниження МЩКТ на рівні ОП/остеопенії, лише у 7 пацієнтів встановлено помірний ризик переломів (8,8±3,3%); у решти хворих — високий ризик, що перевищував 20%.
Висновки. Для пацієнтів із РА властивий розвиток асоційованого ураження кісткової тканини — остеопенії та ОП, що діагностувалися, за даними нашого дослідження, у 86,7% пацієнтів. Водночас реєструвався високий ризик переломів за FRAX. Найбільш значущими чинниками ризику розвитку ОП і переломів кісток виступають тривалість захворювання, прийом ГК, рентгенологічна стадія.
ЕФЕКТИВНІСТЬ ВНУТРІШНЬОСУГЛОБОВОГО ВВЕДЕННЯ ЛОРНОКСИКАМУ У ПАЦІЄНТІВ ІЗ СИНОВІТОМ КОЛІННИХ СУГЛОБІВ
І.Ю. Головач, Т.М. Чіпко, О.О. Лазоренко
Клінічна лікарня «Феофанія» Державного управління справами, Київ
Усі нестероїдні протизапальні препарати (НПЗП) для парентерального застосування — розчини, що швидко виводяться з порожнини суглоба, і, будучи слабкими кислотами, при безпосередньому контакті з синовіальної оболонкою викликають її хімічне подразнення. Тому внутрішньосуглобове введення НПЗП до останнього часу практично не використовувалося. Однак поява сучасних ін’єкційних форм НПЗП, призначених для введення в порожнину суглоба, відкриває нові можливості в лікуванні при хронічних запальних захворюваннях суглобів, що супроводжуються рецидивним синовітом.
Мета: оцінити ефективність і безпеку внутрішноьсуглобових введень лорноксикаму у пацієнтів із синовітом колінних суглобів.
Методи дослідження. Внутрішньосуглобове введення лорноксикаму в колінні суглоби проведено 23 пацієнтам із рецидивним синовітом колінних суглобів, що не піддавалися дієвому лікуванню при пероральному/парентеральному застосуванні лікарських препаратів. Наявність синовіту була підтверджена клінічно і при ультразвуковому дослідженні (УЗД). Серед пролікованих пацієнтів у 6 діагностовано остеоартроз, у 11 — ревматоїдний артрит, у 4 — серонегативний спондилоартрит, у 1 пацієнта — недиференційований рецидивуючий синовіт і ще в 1 — вильозний синовіт обох колінних суглобів. Вік хворих у середньому становив 52,6±9,4 року, тривалість захворювання 8,8±6,7 року. Лорноксикам у дозі 8 мг вводили внутрішньосуглобово 1 раз на тиждень, на курс 1–3 ін’єкції. Перед кожним наступним уведенням проводили клінічний огляд, вимірювали об’єм колінних суглобів (см), визначали інтенсивність больового синдрому за ВАШ. Для об’єктивізації впливу лорноксикаму на синовіт у динаміці проведено УЗД колінних суглобів на апараті BK medical Flex focus 400 з лінійним датчиком 7,5 MHz. Вивчали вплив на товщину (см) синовіальної оболонки і ексудативні зміни суглобів. Визначали вміст синовіальної рідини в супрапателярній синовіальній сумці, під колатеральними зв’язками, у нижніх і задніх заворотах. З метою аналізу отриманих результатів у роботі використовували методи статистичного аналізу, які проводили на ПК за допомогою стандартної програми Statistica 8.0.
Результати. Після попередньої евакуації синовіальної рідини і введення 8 мг лорноксикаму 5 (21,7%) пацієнтів відзначили повний регрес больового синдрому і симптомів синовіту; спостерігалася позитивна клінічна і УЗ-динаміка, що стало причиною тільки одноразового введення препарату. Ще у 2 (8,7%) пацієнтів суттєве покращання настало після 2 внутрішньосуглобових ін’єкцій лорноксикаму, тому курс лікування обмежився двома введеннями. Решта пацієнтів отримали 3 ін’єкції лорноксикаму 8 мг внутрішньосуглобово, у 2 пацієнтів проводили введення в обидва суглоби. При клінічній оцінці дієвості внутрішньосуглобового введення лорноксикаму відзначено зменшення окружності колінних суглобів з 43,06±4,57 до 40,86±2,13 см (р<0,01), суттєве зменшення болючості колінних суглобів за ВАШ. Так, через 1 тиж після введення препарату оцінка ВАШ становила 31,57±12,86 бала (вихідні дані — 62,67±9,33 бала; р<0,001), через 4 тиж — 27,18±12,33 бала (р<0,001). При УЗД товщина синовіальної оболонки у обстежених пацієнтів коливалася від 4,02 до 3,34 мм, у середньому — 3,72±0,43 мм. Через 4 тиж терапії товщина синовіальної оболонки становила 3,22±0,38 мм (р<0,01). Об’єм запального ексудату зменшився у середньому з 1,94±0,93 до 1,52±0,67 бала (р<0,01). Ці динамічні зміни супроводжувалися суттєвим зменшенням площі супрапателярної синовіальної сумки (у середньому з 193,67±97,94 до 143,33±87,02 мм2; р<0,05) і кількості синовіальної рідини під колатеральними зв’язками колінних суглобів (у середньому з 3,83±1,12 до 3,03±1,24 мм; р<0,001). Ускладнень і алергічних реакцій під час введення препарату не було. Регрес больового синдрому і відсутність прогресування синовіту відзначено у всіх пацієнтів упродовж наступних 2 міс.
Висновки. Висока концентрація препарату, що створюється при внутрішньосуглобовому введенні (безпосередньо у вогнище запалення), може забезпечити більш виражене клінічне поліпшення, ніж при пероральному застосуванні. Результати внутрішньосуглобового введення лорноксикаму свідчать його високу ефективність у швидкому купіруванні симптомів синовіту і зменшенні вираженості больового синдрому. Внутрішньосуглобове введення лорноксикаму показане, насамперед, пацієнтам із хронічним рецидивним синовітом як додатковий захід до основного протизапального лікування.
ОСОБЕННОСТИ ТЕЧЕНИЯ, ПАТОГЕНЕЗА И ЛЕЧЕНИЯ ГОНАРТРОЗА И КОКСАРТРОЗА У БОЛЬНЫХ С МЕТАБОЛИЧЕСКИМ СИНДРОМОМ
Е.С. Головкина, Т.С. Ютовець, Н.В. Науменко, М.В. Ермолаева
Национальный медицинский университет им. Максима Горького, Донецк
При остеоартрозе чаще поражаються так называемые нагрузочные суставы — коленные и тазобедренные, а гонартроз и коксартроз являются прогностически неблагоприятными вариантами течения заболевания. Изучение клинико-патогенетических взаимоотношений остеоартроза и метаболического синдрома (МС) стало очень актуальной медицинской проблемой. По нашим данным, МС формируется у 84% больных остеоартрозом мужчин и 65% женщин, на что дисперсионно влияют длительность манифестации заболевания, распространенность и тяжесть течения суставного синдрома, стадия болезни, наличие синовита и темпы прогрессирования патологического процесса, которые прямо соотносятся с выраженностью инсулинорезистентности, с показателями адсорбционного гликемического интегрального критерия и гликемического коэффициента межфазной активности, с уровнями урикемии и индекса массы тела Кетле, а на тяжесть МС оказывают влияние рентгено-сонографические признаки гонартроза и коксартроза, которые, в свою очередь, зависят от отдельных составляющих МС. Гонартроз развивается у 89% пациентов с остеоартрозом, а коксартроз — у 46%, на что влияет наличие МС, в частности гиперинсулинемия, выраженность инсулинорезистентности, наличие гипергликемии, тип гиперлипидемии, ожирение, артериальная гипертензия и периферическое сосудистое сопротивление, причем комбинированные нарушения углеводного, липидного и пуринового обмена участвуют в патогенетических построениях поражения коленных сочленений (в формировании остеофитоза, энтезопатий, изменений менисков). При остеоартрозе наблюдаются нарушения интегральных адсорбционно-реологических свойств сыворотки крови, гонартроз сопровождается достоверным повышением гликемического коэффициента межфазной активности на 82%, а коксартроз — на 54% при снижении на 20% модуля вязкоэластичности и на 28% — фазового угла тензиограмм. Интегральные адсорбционно-реологические свойства крови зависят от наличия у больных всех составляющих МС (в первую оче-редь от параметров инсулиемии, тяжести инсулинорезистентности, массы тела, урикемии, липидемии, типа гиперлипидемии и характера артериальной гипертензии), а в патогенезе гонартроза и коксартроза (в частности таких признаков, как остеофитоз, остеокистоз, остеоузурация, эпифизарный остеопороз, субхондральный склероз, поражение менисков, развитие кист Бейкера и энтезопатий) участвуют показатели адсорбционного гликемического интегрального критерия, вязкоупругости и межфазной активности крови. У 93% больных гонартрозом и у 90% коксартрозом констатированы улучшение или значительное улучшение от проведенного комплексного патогенетического медикаментозного лечения, что зависит от возраста пациентов, распространенности, рентгенологической стадии, тяжести течения суставного синдрома, наличия спондилоартроза, выраженного остеокистоза, артрокальцинатов, лигаментоза и тендовагинитов, причем эффективность лечения гонартроза тесно связана с применением хондромодификаторов и антиагрегантов, коксартроза — полиферментных смесей системной энзимотерапии. МС резко ухудшает эффективность терапии гон- и коксартроза, результаты лечения негативно зависят от тяжестью инсулинорезистентности и других параметров углеводного обмена, от наличия нарушений проводимости миокарда и диастолической функции левого желудочка сердца, а значения исходных адсорбционно-реологических свойств крови имеют прогностическую значимость в отношении дальнейшего лечения больных с МС.
ГЕНДЕРНЫЕ ОСОБЕННОСТИ ТЕЧЕНИЯ, ПАТОГЕНЕЗА И ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ РЕВМАТОИДНОГО АРТРИТА
Г.А. Гончар, А.Ю. Яковленко, Ю.В. Новикова, В.А. Толстой
Национальный медицинский университет им. Максима Горького, Донецк
По нашим данным, ревматоидный артрит (РА) у женщин отличается более тяжелым течением патологического процесса, причем, как свидетельствует многофакторный дисперсионный анализ, от пола больных зависит интегральное поражение суставов («артикулярный пейзаж»), у мужчин в 2,2 раза чаще отмечается поражение крестцовоподвздошных сочленений, на 36% — развитие тендовагинитов и в 4,6 раза — внутрисуставных тел Гоффа, а РА у женщин характеризуется большей степенью поражения проксимальных межфаланговых суставов пальцев рук и ног, а также верхнечелюстных и коленных. Существует половой диморфизм интегральных экстраартикулярных (системных) проявлений РА, при этом мужчинам свойственно более частое (в 2,8 раза) поражение легких и периферической нервной системы (в 2,5 раза), а синдром Шегрена и изменения со стороны центральной нервной системы отмечаются исключительно в женской группе. Пол больных РА оказывает достоверное влияние на интегральные вязкоэластичные свойства крови, причем существуют корреляционные связи С-реактивного протеина с объемной вязкостью, которая у больных возрастает на 62%, а гендерные особенности заболевания касаются больше показателей у мужчин поверхностной вязкости, зависимости от поверхностной вязкости тяжести поражения опорно-двигательного аппарата в мужской группе и экстраартикулярных проявлений болезни от поверхностной упругости в женской. Пол больных оказывает дисперсионное воздействие на параметры паратиреоидного гормона и марганца в крови, степень активности патологического процесса у мужчин коррелирует с уровнем купремии, у женщин — с содержанием кремния, меди, стронция и цинка, при этом существуют общность (сдвиги паратирина и остеокальцина) и гендерные отличия концентраций остеоассоциированных гормонов и химических элементов у больных остеопорозом. Эффективность комплексной патогенетической терапии РА у женщин достоверно выше, хорошие и отличные результаты у них достигаются на 33% чаще, причем гендерные отличия касаются зависимости результатов терапевтических мероприятий у мужчин от стадии патологического процесса, поражения плечевых суставов, наличия тяжелых остеоузур, тендовагинита, периферической полинейропатии и системного остеопороза, а у женщин — от применения антиагрегантов и миорелаксантов, изменений грудинноключичных сочленений, развития асептических остеонекрозов, артрокальцинатов и синдрома Шегрена. Гендерные особенности РА проявляются влиянием на эффективность лечения у мужчин параметров в крови остеокальцина, а у женщин — показателей вязкоупругости сыворотки крови, концентрации в ней кремния и магния. Сделаны заключения, имеющие практическую направленность: 1) значения ревматоидного фактора >50 МЕ/мл у мужчин и >30 МЕ/мл у женщин являются прогнознегативными в отношении темпов прогрессирования суставного процесса; 2) изменения вязкоэластичных свойств крови у мужчин определяют тяжесть изменений со стороны опорно-двигательного аппарата, а у женщин — со стороны экстраартикулярных проявлений болезни; 3) в мужской группе интегральным показателем тяжести течения РА может быть поверхностная вязкость >20 мН/м, а у женщин — поверхностная упругость >55 мН/м; 4) у мужчин показатели паратиреоидного гормона >80 пг/мл, а у женщин >70 пн/мл при остеокальцине >20 нг/мл независимо от пола свидетельствуют о наличии у больных остеопороза; 5) у всех больных РА комплекс лечебных мероприятий должен включать полиферментные смеси системной энзимотерапии, а у женщин — антиагреганты и миорелаксанты; 6) у мужчин маркером неудовлетворительных результатов дальнейшей патогенетической терапии может служить поражение плечевых суставов и периферической нервной системы, наличие выраженных остеоузур костей, образующих сустав, и тендовагинита, а у женщин — вовлечение в процесс грудинноключичных сочленений, развитие асептического остеонекроза, артрокальцината и синдрома Шегрена.
СТАН ЩІЛЬНОСТІ КІСТКОВОЇ ТКАНИНИ У ХВОРИХ НА ПЕРВИННИЙ ОСТЕОАРТРОЗ
Т.Ю. Гріненко
Запорізький державний медичний університет
Мета: оцінити стан щільності кісткової тканини (ЩКТ) у хворих на первинний остеоартроз (ОА).
Методи дослідження. Обстежено 82 пацієнта з первинним ОА, середній вік становив 63,2±1,22 роки, жінок було 86,5%, чоловіків — 13,5%. Середня тривалість захворювання становила 7,5 року. Верифікацію діагнозу проводили на підставі клініко-інструментальних досліджень згідно з нормативними документами Міністерства охорони здоров’я України. Усім пацієнтам проведено анкетування з використанням хвилинного тесту оцінки факторів ризику розвитку остеопорозу. ЩКТ визначали за допомогою ультразвукової денситометрії на апараті «Omnisense 7000» («BeamMed Ltd», Ізраїль) з визначенням Т-критерію та 10-річного ризику переломів при обстеженні трьох кісток: середньої фаланги ІІІ пальця кісті, променевої та великої гомілкової кісток. Статистична обробка отриманих даних проводилася за допомогою «Statistica 6.0» (Stat Soft Inc, США) з використанням непараметричних методів.
Результати. Стан ЩКТ оцінювався за величиною Т-критерію згідно з рекомендаціями Всесвітньої організації охорони здоров’я: нормальний стан — вище за –1,0 стандартне відхилення (SD), остеопенія — між -1,0 і –2,5 SD, остеопороз — нижче за –2,5 SD. У 68% хворих на первинний ОА відзначено остеопенію, а в 32% було діагностовано остеопороз (середнє значення Т-критерію становило –1,9±0,32 SD та –3,2±0,51 SD відповідно). При цьому у всіх обстежених чоловіків виявлена лише остеопенія, а ризик переломів становив у середньому 4,5%. Тоді як у жінок 10-річний ризик переломів при остеопенії становив від 7 до 21%, а при остеопорозі коливався від 20 до 48%.
Аналізуючи фактори ризику остеопорозу, виявлено, що у хворих на первинний ОА 7% осіб в анамнезі мали низько енергетичні переломи, 7% палили, 6% надмірно вживали алкоголь, 18% пацієнтів відзначали зменшення свого росту більше ніж на 3 см, а у 29,5% жінок — настання ранньої менопаузи. Також 27% обстежених хворих мали супутню патологію — цукровий діабет ІІ типу, який, згідно з даними літератури, погіршує ЩКТ. У 18% пацієнтів з первинним ОА діагностовано патологію щитоподібної залози — гіпертиреоз та гіпотиреоз з подальшою замісною терапією, що теж впливає на стан кісткової тканини. Оскільки препарати кальцію та вітаміну D не входять до стандартів лікування хворих на ОА, то рання діагностика у таких пацієнтів порушень ЩКТ дозволить своєчасно почати лікування з метою профілактики остеопорозу та запобігання патологічним переломам.
Висновки. Таким чином, у хворих на первинний ОА за даними ультразвукової денситометрії має місце порушення ЩКТ у вигляді остеопенії та остеопорозу. Тому при виявленні у пацієнтів з первинним ОА факторів ризику розвитку остеопорозу доцільно проводити дослідження стану кісткової тканини з метою оптимізації тактики ведення цих хворих.
ТЕЧЕНИЕ ОСТЕОАРТРОЗА У БОЛЬНЫХ САХАРНЫМ ДИАБЕТОМ
Е.И. Гришина, О.М. Бабинец, Е.В. Менкус
ГУ «Институт микробиологии и иммунологии им. И.И. Мечникова НАМН Украины», Харьков
Сахарный диабет (СД) является независимым фактором риска развития остеоартроза (ОА). В исследованиях in vitro показано, что гипергликемия снижает транспорт дегидроаскорбата в хондроциты, что может поставить под угрозу синтез коллагена типа II и увеличивает продукцию реактивных форм кислорода — одних из основных медиаторов деструкции хряща.
Цель: динамическое наблюдение за течением ОА у больных СД ІІ типа в зависимости от гликемического профиля.
Методы исследования. Обследовано 54 пациента СД ІІ типа с сопутствующим ОА — 26 (48%) мужчин и 28 (52%) женщин в возрасте от 47 до 75 лет, средний возраст которых составил (M±SD) (60±9,7) года.
При установлении диагноза ОА использовали диагностические критерии R.D. Althmann. У всех пациентов был диагностирован полиостеоартроз. Диагноз СД устанавливали на основании критериев ВОЗ (1999). Все пациенты нуждались в коррекции гипогликемической терапии, которая была им назначена в соответствии с «Обновленными рекомендациями Американской ассоциации диабета по ведению сахарного диабета», 2010. Лечение ОА на данном этапе было представлено периодическим приемом нестероидных противовоспалительных средств.
Клиническое обследование включало определение индексов Лекена, WOMAC, заполнение Стенфордской анкеты здоровья (HAQ), оценку боли по визуально-аналоговой шкале (ВАШ). Содержание гликозилированного гемоглобина (HbA1C) определяли иммунотурбидиметрическим методом, глюкозы — оксидазным методом.
Статистический анализ проводили с использованием пакета статистических программ SPSS версии 15.0. Порог статистической погрешности разных тестов был установлен на уровне 5%.
Через 3 мес после соответствующих назначений пациенты были распределены на две группы. 1-я группа — следовавшие рекомендациям (31 (57%) человек), 2-я группа — не выполнявшие в силу различных причин назначенных предписаний (23 (43%) человека).
Результаты. Анализ результатов обследования показал, что на момент включения в исследование группы были сопоставимы по таким показателям, как пол, возраст, длительность заболевания СД, HbA1C, гликемия натощак, назначенное лечение. Через 3 мес в 1-й группе произошло снижение глюкозы крови (натощак) с (8,1±2,1) до (6,9±2,3) моль/л; р=0,036; HbA1C с (7,4±1,4) до (6,6±1,5)%; р=0,034. Во 2-й группе уровень глюкозы крови снизился с (8,2±2,1) ммоль/л (р=0,86 по сравнению с 1-й группой до лечения) до (7,8±2,2) ммоль/л (р=0,02 по сравнению с 1-й группой после лечения); р=0,53 внутри группы; HbA1C — с (7,5±1,9)% (р=0,82 по сравнению с 1-й группой до лечения) до (7,4±1,3)% (р=0,045 по сравнению с 1-й группой после лечения); р=0,83 внутри группы.
В отсутствие патогенетической терапии ОА в 1-й группе отмечалось улучшение его течения по сравнению со 2-й группой. Так, при сопоставимых показателях до коррекции лечения СД, через 3 мес индексы Лекена и WOMAC были достоверно большими у пациентов 2-й группы: (15,1±5,5) против (12,3±4,5), р=0,04 и (47,2±9,9) против (41,6±10,1), р=0,047. Оценка качества жизни пациентов с использованием HAQ показала достоверно более низкое качество жизни пациентов во 2-й группе (15,1±4,5) балла по сравнению с пациентами 1-й группы (12,8±3,9) балла; р=0,05. Оценка по ВАШ боли пациентами составила в 1-й группе (51,5±12,8) мм, а во 2-й группе — (58,4±11,9); р=0,048.
Выводы. Таким образом, снижение гликемии при СД приводит к улучшению течения сопутствующего ОА без дополнительной терапии последнего.
ЯКІСТЬ ЖИТТЯ У ХВОРИХ НА ОСТЕОАРТРОЗ: ЗВ’ЯЗОК МІЖ ВИРАЖЕНІСТЮ БОЛЬОВОГО СИНДРОМУ ТА РЕНТГЕНОЛОГІЧНОЮ СТАДІЄЮ ЗАХВОРЮВАННЯ
О.В. Гуменюк, М.А. Станіславчук
Вінницький національний медичний університет ім. М.І. Пирогова
Остеоартроз (ОА) — найпоширеніша форма ураження суглобів, яка є однією з основних причин хронічного больового синдрому, що значно знижує якість життя хворих і веде до передчасної втрати працездатності та інвалідності. Частота ОА прогресивно підвищується з віком. За статистичними даними в Україні кожен третій мешканець страждає на ОА певних суглобів.
Мета: визначити наявність асоціативних зв’язків між стадією ОА, вираженістю больового синдрому та якістю життя хворих.
Методи дослідження. Обстежено 119 хворих на ОА з переважним ураженням кульшових та колінних суглобів (27 чоловіків і 92 жінки), середній вік — 58,6±8,3 року (від 41 до 71року), середня тривалість захворювання — 11±7,2 року. Діагноз ОА встановлено на основі класифікаційних критеріїв Американської колегії ревматологів для ОА колінних (1986) та кульшових суглобів (1991). Рентгенологічну стадію ОА встановлювали за класифікацією J.N. Kellgren і J.S. Lawrence (І стадія — 8 хворих, ІІ — 71, ІІІ — 40). Оцінено вираженість больового синдрому і характер функціональних порушень колінних і кульшових суглобів за опитувальником WOMAC OSTEOARTHRITIS INDEX VERSION VA 3.1 та якість життя за анкетою SF-36 у хворих на ОА залежно від рентгенологічної стадії.
Результати. Серед обстежених хворих I стадію діагностовано у 6,7%, IІ стадію — у 59,7% та IІІ рентгенологічну стадію — у 33,6% хворих. Оцінка вираженості больового синдрому та характеру функціональних порушень суглобів за опитувальником WOMAC свідчила, що у хворих ОА з І стадії були мінімальної вираженості больовий синдром та порушення функції (17,7±5,0 та 13,9±3,78 відповідно), максимальні зміни реєструвались у хворих на ОА ІІІ рентгенологічної стадії (58,7±30,6 та 64,8±32,9). Проміжні значення досліджуваних показників реєструвались у хворих на ОА ІІ рентгенологічної стадії. Оцінка якості життя (фізичного та психічного здоров’я) за опитувальником якості життя SF-36 у пацієнтів з І стадією була найвищою — 44,8±11,4 та 37,6±9,5 відповідно. Якість життя прогресивно погіршувалася з наростанням тяжкості ОА. При ІІ стадії стан фізичного та психічного здоров’я були на рівні 32,4±16,8 та 35,2±18,3 а у хворих на ОА ІІІ стадії — 28,4±14,1 та 34,9±16,9 відповідно.
Висновки. У хворих на ОА колінних та кульшових суглобів встановлено наявність прямого зв’язку між вираженістю больового синдрому, якістю життя та рентгенологічною стадією захворювання.
ОСОБЛИВОСТІ
МОРФОФУНКЦІОНАЛЬНИХ ЗМІНИ ПЕЧІНКИ ТА ЕНДОТОКСИКОЗУ У ХВОРИХ НА ПОДАГРУ З КАРДІОВАСКУЛЯРНИМ РИЗИКОМ
С.В. Даньчак, О.В. Соліляк, Л.Л. Легка, Л.В. Задорожна, Н.В. Грималюк, О.І. Зарудна
Тернопільський державний медичний університет ім. І.Я. Горбачевського
Тернопільська університетська лікарня
Мета: вивчення особливостей морфофункціональних змін печінки у хворих на подагру з урахуванням кардіоваскулярного ризику.
Методи дослідження. Показники функціональної активності печінки досліджено у 51 хворого на подагру. У роботі використана класифікація подагри згідно з наказом МОЗ України № 676 від 12.10.2006 р. Середній вік обстежених становив 52,2±0,65 року. Проводили стандартизоване клінічне обстеження хворих, визначали показники біохімічного аналізу крові, показники ендогенної інтоксикації, перекисного окиснення ліпідів, антиоксидантної системи. Для визначення кардіоваскулярного ризику використовували таблицю SCORE. Хворим проводили обстеження на носійство вірусів гепатиту В і С.
Результати. Встановлено, що низький кардіоваскулярний ризик наявний у 1,97% хворих, помірний — у 37,25%, високий — у 32,35% та дуже високий — у 28,43% пацієнтів. Суб’єктивні ознаки ураження печінки проявилися больовим синдромом у пацієнтів зі високим (23% хворих) та дуже високим кардіоваскулярним ризиком (30% хворих). Об’єктивні ознаки стеатогепатиту у вигляді гепатомегалії (клініко-інструментально) при низькому кардіоваскулярному ризику виявлено у 8% хворих, помірному кардіоваскулярному ризику — у 18% хворих, високому і дуже високому кардіоваскулярному ризику відповідно у 25 і 34% хворих. При низькому та помірному кардіоваскулярному ризику не виявлено значного відхилення від норми показників біохімічного аналізу крові. За умови високого кардіоваскулярного ризику виявлено статистично достовірне підвищення рівня білірубіну у 4% хворих, гамма-глутамілтрансферази — 6%, загального холестерину — 87%, ліпопротеїдів низької щільності — 65%, тригліцеридів — 33%, у 25% хворих підвищені показники ендогенної інтоксикації, у 16% перекисного окиснення ліпідів. Щодо дуже високого кардіоваскулярного ризику, то в цьому випадку виявлено статистично достовірне підвищення рівня білірубіну у 7% хворих, гамма-глутамілтрансферази — 8%, загального холестерину — 83%, ліпопротеїдів низької щільності — 56%, тригліцеридів — 57%, у 31% хворих підвищені показники ендогенної інтоксикації, у 28% — перекисного окиснення ліпідів.
Висновки. У хворих на подагру спостерігається розвиток порушення функціональних показників печінки, що підвищуються зі зростанням кардіоваскулярного ризику, що необхідно враховувати при призначенні лікувальних програм.
ОСОБЛИВОСТІ КЛІНІЧНОЇ КАРТИНИ СТРУКТУРИ СНУ У ХВОРИХ НА ФІБРОМІАЛГІЮ. ЗВ’ЯЗОК ІЗ ТРИВОЖНО-ДЕПРЕСИВНИМИ РОЗЛАДАМИ
О.В. Дзекан, М.А. Станіславчук
Вінницький національний медичний університет ім. М.І. Пирогова
Згідно з сучасними уявленнями, розлади сну відіграють одну з провідних ролей у підтриманні хронічного больового синдрому у цих пацієнтів. Клінічна картина сомнологічних розладів у хворих на фіброміалгію (ФМ) вивчена недостатньо. Зважаючи на можливу значимість сомнологічних порушень у формуванні депресивних розладів, тривоги та больової поведінки, дослідження клінічної картини структури сну хворих на ФМ може стати підґрунтям для розроблення нових напрямків патогенетичної терапії цієї когорти хворих у майбутньому.
Мета: дослідження наявності та особливостей сомнологічних розладів та їх можливого зв’язку з вираженістю тривоги та депресії у хворих на ФМ.
Методи дослідження. Обстежено 63 хворих на ФМ (критерії ACR, 1990) віком 54,3±4,7 року та 32 особи контрольної групи, зіставних із хворими за віком і статтю. Середня тривалість захворювання — 5,3±2,1 року.
Наявність та вираженість сомнологічних розладів визначали за опитувальниками: Insomnia Symptom Questionnaire (ISQ) (Spielman A.J. et al., 1987), Insomnia Severity Index (ISI) (Morin C.M. et al., 1993) and a Pittsburgh Sleep Quality Index (Buysse D.J. et al., 1989); наявність та вираженість депресії — за Hamilton Depression Rating Scale (HAM-D) (Hamilton M., 1960), наявність і рівень тривоги — за Hamilton Anxiety Rating Scale (HAM-A) (Hamilton M., 1959).
Результати. Сомнологічні розлади у вигляді пре-, інтра- та постсомнічних порушень виявлено у 55 хворих на ФМ (87,3%), в той час як серед здорових осіб вони визначалися у 2 (6,3%) обстежених у вигляді ізольованих постсосмнічних порушень. Подальший аналіз структури сну виявив поєднання пре- та інтрасомній у 20 хворих на ФМ (31,7%) та комбінацію інтра- та постсомнічних розладів у 33 (52,4%) пацієнтів. Ізольовані інтрасомнічні розлади мали 2 (3,2%)хворих на ФМ. Незначні депресивні порушення були наявні у 35 (55,6%) хворих на ФМ та відсутні в групі здорових обстежених. У 32 (50,8%) хворих на ФМ визначалися помірні та виражені тривожні розлади, в той час як серед здорових осіб — низький рівень тривожності у 3 (9,4%) обстежених. Серед хворих на ФМ з поєднанням пост- та інтрасомній та ізольованими постсомнічними розладами вираженість депресії була більшою порівняно з рештою хворих (10,6±2,8 і 4,2±2,8 відповідно; p<0.05). Серед хворих на ФМ з поєднанням пре- та інтрасомній визначався високий рівень тривожності, в той час як у хворих на ФМ з комбінацією інтра- та постсомнічних порушень та ізольованими постсомнічними розладами рівень тривоги був помірним (26,3±2,8 і 19,1±2,8 відповідно; p<0.05).
Висновки. Хворим на ФМ властиві порушення клінічної структури сну. Сомнологічні розлади у пацієнтів із ФМ характеризуються переважним поєднанням інтрасомнії з постсомнією чи пресомнії з інтрасомнією. Наявність поєднання пре- та інтрасомнії у хворих на ФМ асоціюється з високим рівнем тривожності, а комбінація інтра- та постсомнічних порушень — зі збільшенням вираженості депресії.
ЛЕЧЕНИЕ ОСТЕОАРТРОЗА У БОЛЬНЫХ СТАРШИХ ВОЗРАСТНЫХ ГРУПП С КАРДИОВАСКУЛЯРНОЙ ПАТОЛОГИЕЙ
Г.В. Дзяк, Т.А. Симонова, М.Г. Гетман
ГУ «Днепропетровская медицинская академия МЗ Украины»
Актуальность обусловлена широкой распространенностью остеоартроза (ОА), сложностями лечения и ранней инвалидизацией больных. Установлено, что ОА относится к болезням с высокой коморбидностью. Наиболее часто ОА сочетается с артериальной гипертензией, атеросклерозом, ишемической болезнью сердца. На фоне коморбидности избыточное и нерациональное назначение лекарств приводит к резкому возрастанию вероятности развития нежелательных эффектов терапии и усугублению течения заболеваний.
Цель: изучить сравнительную эффективность, анальгезирующий, противовоспалительный эффекты и безопасность схемы лечения комбинацией высоких доз витаминов группы В (тиамина мононитрат (витамина B1) 200 мг, пиридоксина гидрохлорида (витамина B6) 50 мг, цианокобаламина (витамина B12) 1 мг и пластыря с действующим веществом диклофенак в сравнении с монотерапией пластырем, содержащим диклофенак у пациентов с ОА на фоне сердечно-сосудистых заболеваний (ССЗ).
Методы исследования. В исследование включено 60 пациентов в возрасте 50–75 лет, разделенных по группам: 1-я группа — (n=30) применяли пластырь с действующим веществом диклофенак по схеме 1 пластырь 1 раз в день в течение 20 дней. 2-я группа — (n=30) применяли пластырь, содержащий диклофенак по 1 пластырю 1 раз в день в комбинации с препаратом, содержащим высокие дозы витаминов группы В (тиамина мононитрат (витамин B1) 200 мг, пиридоксина гидрохлорид (витамин B6) 50 мг, цианокобаламина (витамин B12) 1 мг) по 1 таблетке 2 раза в сутки в течение 20 дней.
Все пациенты получали стабильную адекватную медикаментозную терапию по ССЗ. Критерии эффективности лечения: общее клиническое обследование, общий анализ крови, креатинин, общий билирубин, АлАТ, АсАТ, Ro-графия коленных суставов, объем движений в коленных суставах (сгибание), индекс Лекена, шкала WOMAC, ВАШ, тест 6-минутной ходьбы.
Результаты. Отмечена положительная динамика функционального состояния опорно-двигательного аппарата в обеих группах пациентов: 1-я группа — 76,6%, 2-я группа — 86,7%. Более выражен положительный эффект во 2-й группе пациентов: более выражено снижение индекса Лекена, шкалы WOMAC, ВАШ, повышение показателя теста 6-минутной ходьбы. За период лечения снизилась потребность в приеме нестероидных противовоспалительных препаратов. Ухудшение кардиоваскулярного статуса не наблюдалось.
Выводы. Исследование продемонстрировало эффективное влияние комбинации препаратов; трансдермальный пластырь, содержащий диклофенак, в сочетании с высокими дозами витаминов группы В на течение ОА у пациентов с ССЗ. Местное применение нестероидных противовоспалительных препаратов предполагает преимущество в виде местной доставки препарата к тканям с более низким количеством системных побочных действий. Сочетанное применение пластыря и комбинации витаминов группы в показало более высокую эффективность в плане купирования болевого синдрома и улучшения функциональной способности суставов, а также безопасность использованной схемы лечения.
ДИНАМІКА І СТРУКТУРА СМЕРТНОСТІ НАСЕЛЕННЯ УКРАЇНИ ПРИ ХВОРОБАХ КІСТКОВО-М’ЯЗОВОЇ СИСТЕМИ ТА СПОЛУЧНОЇ ТКАНИНИ
А.П. Дорогой
ДУ «ННЦ «Інститут кардіології ім. М.Д. Стражеска» НАМН України», Київ
Хвороби кістково-м’язової системи та сполучної тканини (ХКМССТ, коди за МКХ-10 M00–M99) не належать до провідних класів хвороб смертності, проте поширеність цієї патології в 2012 р. досягла 4 525 518 осіб, що перевищує таку новоутворень, деяких інфекційних та паразитарних хвороб і цукрового діабету разом узятих, або більше половини пацієнтів з ішемічною хворобою серця чи третина хворих на артеріальну гіпертензію.
Від ХКМССТ у працездатному віці вмирають 41% пацієнтів (чоловіків — 51%, жінок — 34%), в той час як від усіх причин — лише 20% (чоловіків 32%, жінок — 8%).
Мета: аналіз динаміки смертності та її структури при ХКМССТ за 2005–2012 рр.
Методи і результати роботи. Починаючи з 2005 р. в Україні почала неухильно знижуватися смертність від усіх причин, у тому числі й від ХКСССТ (таблиця). Загальна смертність знизилася в абсолютних величинах і в стандартизованих показниках, в міських поселеннях і в сільській місцевості, у чоловіків і жінок у межах 7,9–19,3%. При ХКМССТ також смертність знизилась за всіма параметрами в межах 15,0–33,7%, у тому числі при запальній поліартропатії (коди M05–M14) — на 17,1–31,8%, включаючи ревматоїдний артрит (коди М05 та М06), при системних хворобах сполучної тканини (коди M30–M36) — на 11,2–25,3%, включаючи системний червоний вовчак (код М32), та при інших остеопатіях — на 34,8–57,9%, включаючи остеомієліт, крім жінок у міських поселеннях (код М86).
На наведені (див. таблицю) ХКМССТ у 2005 і 2012 р. приходилося понад 90% всіх випадків смерті, тому вони реально відображають динаміку смертності при XIII класі хвороб.
Таблиця. Динаміка смертності населення України при ХКМССТ
| Причини смерті | Роки | Міське населення | Сільське населення | Чоловіки | Жінки | ||||
| осіб | на 100 тис. | осіб | на 100 тис. | осіб | на 100 тис. | осіб | на 100 тис. | ||
| Усі причини | 2005 | 471561 | 1476,2 | 310400 | 2047,3 | 403440 | 1853,2 | 378521 | 1494,1 |
| 2012 | 411787 | 1312,3 | 251352 | 1768,2 | 325584 | 1544,8 | 337555 | 1376,8 | |
| Δ, % | –12,7 | –11,1 | –19 | –13,6 | –19,3 | –16,6 | –10,8 | –7,9 | |
| ХКМССТ | 2005 | 472 | 1,478 | 288 | 1,9 | 297 | 1,364 | 463 | 1,828 |
| 2012 | 394 | 1,256 | 191 | 1,344 | 230 | 1,091 | 355 | 1,448 | |
| Δ, % | –16,5 | –15 | –33,7 | –29,3 | –22,6 | –20 | –23,3 | –20,8 | |
| Запальні поліартропатії | 2005 | 189 | 0,592 | 111 | 0,732 | 95 | 0,436 | 205 | 0,809 |
| 2012 | 154 | 0,491 | 71 | 0,499 | 70 | 0,332 | 155 | 0,632 | |
| Δ, % | –18,5 | –17,1 | –36 | –31,8 | –26,3 | –23,8 | –24,4 | –21,9 | |
| Системні хвороби сполучної тканини | 2005 | 170 | 0,532 | 95 | 0,627 | 78 | 0,358 | 187 | 0,738 |
| 2012 | 138 | 0,44 | 71 | 0,499 | 67 | 0,318 | 142 | 0,579 | |
| Δ, % | –18,8 | –17,3 | –25,3 | –20,3 | –14,1 | –11,2 | –24,1 | –21,5 | |
| Інші остеопатії | 2005 | 51 | 0,16 | 35 | 0,231 | 66 | 0,303 | 20 | 0,079 |
| 2012 | 48 | 0,153 | 17 | 0,12 | 45 | 0,214 | 20 | 0,082 | |
| Δ, % | –5,9 | –4,4 | –51,4 | –48,2 | –31,8 | –29,5 | 0 | 3,3 | |
| Спондилопатії | 2005 | 15 | 0,047 | 15 | 0,099 | 21 | 0,097 | 9 | 0,036 |
| 2012 | 16 | 0,051 | 11 | 0,077 | 17 | 0,081 | 10 | 0,041 | |
| Δ, % | 6,7 | 8,5 | –26,7 | –21,8 | –19 | –16,8 | 11,1 | 13,3 | |
| Артрози | 2005 | 14 | 0,044 | 12 | 0,079 | 7 | 0,032 | 19 | 0,075 |
| 2012 | 9 | 0,029 | 7 | 0,049 | 8 | 0,038 | 8 | 0,033 | |
| Δ, % | –35,7 | –34,8 | –41,7 | –37,7 | 14,3 | 18,6 | –57,9 | –56,5 | |
У структурі смертності міських поселень зросла питома вага інших остеопатій та спондилопатій відповідно від 10,8 до 12,2% та від 3,2 до 4,1%. У сільській місцевості зросла питома вага системних хвороб сполучної тканини від 33,0 до 37,2%. Серед чоловіків збільшилася питома вага системних хвороб сполучної тканини та артрозу, серед жінок — інших остеопатій та сподилопатій.
Висновки. За останні 13 років в Україні відбулося значне зниження стандартизованих показників загальної смертності (на 12,4%) і смертності від ХКМССТ (на 20,5%). Структура смертності при ХКМССТ залишилася без змін. Перше місце займають запальні поліартропатії, друге — системні хвороби сполучної тканини, третє — інші остеопатії.
ДИНАМІКА ТА СТРУКТУРА СМЕРТНОСТІ НАСЕЛЕННЯ УКРАЇНИ ПРИ ГОСТРІЙ РЕВМАТИЧНІЙ ГАРЯЧЦІ ТА ХРОНІЧНИХ РЕВМАТИЧНИХ ХВОРОБАХ СЕРЦЯ
А.П. Дорогой
ДУ «ННЦ «Інститут кардіології ім. М.Д. Стражеска» НАМН України», Київ
Відповідно до МКХ-10 ревматичні хвороби поділяють на гостру ревматичну гарячку (ГРГ, код I00–I02) і хронічні ревматичні хвороби серця (ХРХС, код I05–I09). За період від 2005 по 2012 р. смертність від усіх форм ревматизму знизилася на 40,5% в абсолютних величинах і на 38,5% — за стандартизованими показниками, від ГРГ — на 80,2 і 79,7%, від ХРХС — на 38,1 і 36,0% (таблиця). Зниження смертності відбулося як у міських поселеннях, так і в сільській місцевості з перевагою майже в 2 рази за рахунок ГРГ.
Внаслідок цього у структурі смертності частка ГРГ зменшилася від 5,7 до 1,9%, а ХРХС відповідно зросла від 94,3 до 98,1%. Фактично на сьогодні при ревматизмі домінуючою причиною смерті є ХРХС. У 2012 р. порівняно з 2005 р. не зареєстровано випадків смерті при ГРГ без залучення серця (код I00.X), від гострого ревматичного міокардиту (код I01.2), а також ревматичної хореї (код I02). На 78–82% знизилася смертність при ГРГ із залученням серця у міських поселеннях та сільській місцевості, в тому числі при гострому ревматичному перикардиті й ендокардиті (на 75 і 71%), при інших та неуточнених ревматичних хворобах серця (коди I01.8 і I01.9 відповідно на 79 і 82%). Отже, ГРГ як причина смерті вже належить до казуїстичних випадків. Причини такої трансформації залишаються остаточно не з’ясованими.
При ГРГ із залученням серця смертність населення України у 2005 р. була вищою в міських поселеннях, ніж у сільській місцевості (0,057 і 0,028 на 100 тис. відповідного населення). Смертність серед чоловіків були вищою, ніж у жінок у міських поселеннях у півтора рази (0,069 і 0,047 відповідно), у сільській місцевості — у 3,4 раза (0,045 і 0,013 відповідно).
У структурі смертності перше місце при ГРГ посідав гострий ревматичний ендокардит, від якого чоловіки вмирали частіше, ніж жінки.
При ХРХС смертність у 2005 р. була вищою в сільській місцевості, ніж у міській (2,723 і 2,381 на 100 тис. відповідного населення). Смертність серед жінок була вищою, ніж у чоловіків (2,786 і 2,14) як у міських поселеннях (2,749 і 1,946), так і у сільській місцевості (2,868 і 2,558).
У структурі смертності при ХРХС перше місце у міських поселеннях та сільській місцевості займали випадки з ураженнями декількох клапанів (41,9 і 39,5% відповідно), включаючи чоловіків і жінок (42,8 і 40,0%). Перше місце у структурі смертності при ураженні декількох клапанів займали сукупні ураження мітрального й аортального клапанів (70,4%) з перевагою у сільській місцевості порівняно з міськими поселеннями (71,9 і 69,6%) і у чоловіків з перевагою над жінками (76,7 і 65,9%). На наступній сходинці структури знаходилися сукупні ураження мiтрального, аортального й тристулкового клапанів (13,5%) і сукупне ураження мiтрального й тристулкового клапанів (7,9%).
Другу сходинку займали пацієнти з ревматичними хворобами мітрального клапана (35,2%). У структурі смертності при ревматичних хворобах мітрального клапана перше місце займають випадки мітрального стенозу з недостатністю (41,4%), друге — ревматична недостатність мітрального клапана — 21,6% з перевагою у чоловіків над жінками (25,6 і 19,8%), третю — мітральний стеноз — 18,8% з перевагою у жінок над чоловіками (20,5 і 14,9%). Далі ідуть інші та неуточнені хвороби мітрального клапана.
Третю сходинку у структурі смертності займають ревматичні хвороби аортального клапана (12,1%). У цих випадках перше місце займає смертність від ревматичного аортального стенозу з недостатністю (40,1%), друге — ревматичний аортальний стеноз (34,3%), третє — ревматична недостатність аортального клапана (7,3%). Решта випадків смерті приходиться на неуточнені та інші ревматичні хвороби аортального клапана (18,2%). Далі ідуть інші ревматичні хвороби серця (11,1%) та ревматичні хвороби тристулкового клапана (0,5%).
Характерною рисою у структурі смертності є те, що у жінок рематичні хвороби мітрального клапана становили 40,7%, у чоловіків — 26,8%. Ревматичні хвороби аортального клапана чоловіків становили 20,0%, у жінок — 6,9%.
Таким чином, при ГРГ чоловіків вмирає більше, ніж жінок. При ХРХС навпаки, більше вмирає жінок, ніж чоловіків. У структурі смертності переважають жінки з ревматичними хворобами мітрального клапана з перевагою мітрального стенозу, а у чоловіків — ревматичні хвороби аортального клапана з перевагою ревматичного аортального стенозу з недостатністю.
Таблиця. Динаміка показників смертності населення України при ревматизмі (всі форми) за 2005 і 2012 р.
| Хвороби | Роки | Всі поселення | Міське населення | Сільське населення | |||
| осіб | на 100 тис | осіб | на 100 тис. | осіб | на 100 тис | ||
| Ревматизм, усі форми | 2005 | 1942 | 4,123 | 1274 | 3,988 | 668 | 4,406 |
| 2012 | 1156 | 2,535 | 765 | 2,438 | 391 | 2,751 | |
| Δ, % | –40,5 | –38,5 | –40,0 | -38,9 | –41,5 | –37,6 | |
| ГРГ | 2005 | 111 | 0,236 | 85 | 0,266 | 26 | 0,172 |
| 2012 | 22 | 0,048 | 18 | 0,057 | 4 | 0,028 | |
| Δ, % | –80,2 | –79,7 | –78,8 | -78,6 | –84,6 | –83,7 | |
| ХРХС | 2005 | 1831 | 3,887 | 1189 | 3,722 | 642 | 4,234 |
| 2012 | 1134 | 2,487 | 747 | 2,381 | 387 | 2,723 | |
| Δ,% | –38,1 | –36,0 | –37,2 | –36,0 | –39,7 | –35,7 | |
ТРИВАЛІСТЬ ЖИТТЯ НАСЕЛЕННЯ УКРАЇНИ ПРИ ХВОРОБАХ КІСТКОВО-М’ЯЗОВОЇ СИСТЕМИ ТА СПОЛУЧНОЇ ТКАНИНИ
А.П. Дорогой
ДУ «ННЦ «Інститут кардіології ім. М.Д. Стражеска» НАМН України», Київ
Серед померлих від усіх причин частка хвороб кістково-м’язової системи та сполучної тканини (ХКМССТ) становила в 2012 р. лише 0,1%. Проте при детальному аналізі виявляються деякі обставини, які привертають увагу до цього класу хвороб. В Україні вже налічується 4 525 518 пацієнтів із ХКМССТ, серед яких 2 185 966 (43,3%) осіб працездатного віку. Щорічно виявляється ще близько 1,5 млн пацієнтів, серед яких працездатних — 59%. Максимальна частка померлих від усіх причин приходилася на вік 80–84 роки (16,3%), а при ХКМССТ — на вік 60–64 роки (15,0%).
Мета і методи дослідження. Проведення розрахунків середньої очікуваної тривалості життя при різних нозологіях ХКМССТ для виявлення ще однієї особливості цієї патології.
Результати. Середній вік померлих (таблиця) від усіх причин становив у 2012 р. 70,2 року, у жінок — 75,8, у чоловіків — 65. При ХКМССТ вік усіх пацієнтів скорочується на 13,4 року, чоловіків — на 10,5, жінок — на 17,3. Найменша тривалість життя була у пацієнтів при системному червоному вовчаку — 47,7 року, що менше тривалості життя померлих від усіх причин на 22,6 року (!). На другій позиції за віком померлі від остеомієліту — 48,1 року.
Вік померлих жінок при ХКМССТ старший, ніж у чоловіків, за винятком системного червоного вовчаку (у жінок 47,4 року, у чоловіків — 49,3).
Для ХКМССТ характерна ще одна важлива обставина. Від усіх причин смерті у працездатному віці вмирають 20,1%, а при цій патології — у 2 рази більше (41,0%). У жінок такі показники різняться у 4 рази — 8,3 і 34,4% померлих у працездатному віці, у чоловіків — у півтора рази. При всій нозології ХКМССТ частка померлих чоловіків працездатного віку значно більша, ніж жінок.
Висновки. ХКМССТ завдають суспільству значний медико-соціальний тягар. Вони мають велику популяційну поширеність і щорічну захворюваність. Тривалість життя при даній патології значно менша, ніж середня тривалість життя населення в країні. Питома вага померлих в працездатному віці коливається від 23 до 65,3%, у жінок — від 16,8 до 63,9%, у чоловіків — від 45 до 72,7%.
Таблиця. Тривалість життя населення України при ХКМССТ, 2012
| Причини смерті | Обидві статі | Жінки | Чоловіки | ||||||||
| n* | ср/вік | % пц* | n* | ср/вік | % пц* | n* | ср/вік | % пц | |||
| Усього померлих | 663 062 | 70,2 | 20,1 | 337 536 | 75,8 | 8,3 | 325 526 | 65,0 | 32,3 | ||
| ХКМССТ | 585 | 56,9 | 41 | 355 | 58,4 | 34,4 | 230 | 54,4 | 51,3 | ||
| Ревматодоїдний артрит | 183 | 62,5 | 23 | 143 | 63,0 | 16,8 | 40 | 60,8 | 45,0 | ||
| Системний червоний вовчак | 72 | 47,7 | 65,3 | 61 | 47,4 | 63,9 | 11 | 49,3 | 72,7 | ||
| Остеомієліт | 64 | 48,1 | 56,3 | 19 | 56,7 | 47,4 | 45 | 44,5 | 60,0 | ||
| Інші хвороби КМССТ | 266 | 57,6 | 43,2 | 132 | 59,0 | 37,9 | 134 | 56,3 | 48,5 | ||
*n — кількість померлих осіб; ср/вік — середній вік;% пц — частка працездатних.
СУЧАСНІ МОЖЛИВОСТІ ЕКСПРЕС-ДІАГНОСТИКИ СУГЛОБОВОГО СИНДРОМУ У ДІТЕЙ З ВИКОРИСТАННЯМ ТЕСТ-СИСТЕМ RHEUMACHEC
В.М. Дудник1, Ю.В. Вижга1, Г.С. Гумінська2, Л.Л. Віннічук2, О.І. Марчук2
1Вінницький національний медичний університет ім. М.І. Пирогова
2Вінницька обласна дитяча клінічна лікарня
Одна із найчастіших причин звернення до лікаря сімейної практики у дитячому віці є поява суглобового синдрому, що може бути проявом великої кількості ревматичних захворювань. Клінічні дослідження свідчать про труднощі у проведенні диференційної діагностики патології опоно-рухового апарату, що підтверджується кількістю помилок на догоспітальному етапі (40–45%).
Мета: оцінити визначення вмісту антитіл до модифікованого цитрулінованого віментину (анти-МЦВ) за допомогою експрес-методу Rheumachec для діагностики суглобового синдрому нез’ясованого гене-зу у дітей.
Методи дослідження. У процесі дослідження комплексно обстежено 64 дитини з клінічними проявами суглобового синдрому (42 дівчинки та 24 хлопчики), які перебували на лікуванні у Вінницькій обласній дитячій клінічній лікарні. Середній вік пацієнтів становив 10,3±1,4 року. У 28 (43,7%) дітей встановлено діагноз ювенільного ревматоїдного артриту (ЮРА), а у решти 36 (56,3%) пацієнтів — реактивної артропатії (РАП). Комплексне обстеження дітей включало загальноклінічне обстеження, біохімічне дослідження сироватки крові, експрес-методику визначення анти-МЦВ та ревматоїдного фактора (РФ) у капілярній крові («Rheumachec», «Organtec», Німеччина), а також кількісне визначення анти-МЦВ у сироватці крові (ELISA).
Результати. Клінічно суглобовий синдром у дітей з ЮРА та РАП проявлявся відчуттям артралгії періодичного характеру (81,2%), набряком уражених суглобів та періартикулярних тканин (76,5%), а також відчуттям ранкової скутості — у дітей з ЮРА (40,6%). У дітей з РАП зазвичай відзначали моно-артрит (91,6%), в той час як для дітей з ЮРА більш характерне множинне ураження суглобів у вигляді оліго- та поліартриту (57,1%). Лабораторна характеристика артриту свідчила про активність запального процесу, що проявлялася підвищенням вмісту С-реактивного протеїну, як у дітей з ЮРА (8,4±1,2 г/л), так і у пацієнтів з РАП (6,9±0,8 г/л). Результати експрес-діагностики встановили, що у 13 (46,4%) хворих на ЮРА виявлено позитивні показники анти-МЦВ, а у 2 (7,1%) пацієнтів визначався позитивний РФ у капілярній крові. У дітей з РАП позитивний анти-МЦВ виявлено у 3 (8,3%) пацієнтів та у жодної дитини не визначався РФ. За результатами визначення рівня анти-МЦВ в сироватці крові у дітей з ЮРА та РАП встановлено, що у пацієнтів з ЮРА цей показник (27,8±3,6 Од/мл) достовірно перевищував значення дітей з РАП (12,1±1,4 Од/мл, р<0,05). Нами також встановлено, що результати експрес-методу визначення анти-МЦВ практично зіставні з показниками вмісту анти-МЦВ у сироватці крові дітей, хворих на ЮРА.
Висновки. З метою диференційної діагностики суглобового синдрому у дітей доцільно визначати вміст анти-МЦВ у крові. Експрес-метод визначення анти-МЦВ та РФ («Rheumachec», «Organtec», Німеччина) дозволяє покращити та значно прискорити верифікацію суглобового синдрому у дітей та може використовуватися для діагностики ЮРА.
ОЦІНКА ЕФЕКТИВНОСТІ БАЗИСНОЇ ТЕРАПІЇ ПРИ ЮВЕНІЛЬНОМУ РЕВМАТОЇДНОМУ АРТРИТІ
В.М. Дудник, Ю.В. Вижга
Вінницький національний медичний університет ім. М.І. Пирогова
Ефективність фармакотерапії ювенільного ревматоїдного артриту (ЮРА) визначається шляхом досягнення та підтримки клініко-лабораторної ремісії, що можливо за умов пригнічення запальної та імунологічної ланок патогенезу, купірування небезпечних для життя системних проявів захворювання, запобігання розвитку деструктивних процесів у суглобах, інвалідизації хворих та ятрогенних впливів. Незважаючи на активну терапію, до 25 років життя у 30% пацієнтів, які захворіли на ЮРА у ранньому віці, зберігається висока активність запального процесу.
Під динамічним 6-місячним спостереженням знаходилось 68 дітей з ЮРА із тривалістю захворювання 18,2±1,3 міс, які перебували на лікуванні у Вінницькій, Житомирській та Хмельницькій обласних дитячих лікарнях.
Мета і методи дослідження. Оцінити ефективність базисної терапії (БТ) ЮРА за 6 міс лікування. Як БТ застосовували метотрексат (32 дитини), сульфасалазин (25 пацієнтів) та лефлуномід (у 11 дітей). Верифікацію діагнозу проводили згідно з чинним наказом МОЗ України від 22.10.2012 р. № 832, пацієнтів обстежували за критеріями активності захворювання Американського коледжу ревматологів (АКР) та з визначенням вмісту інтерлейкіну (ІЛ)-1β, ІЛ-6, нуклеарного фактора-kB (NF-kB) у сироватці крові.
Результати. Нами спостерігалася висока клінічна ефективність фармакотерапії за 6 позиціями з 8 досліджуваних у дітей 1-ї групи, які як хворобо-модифікуючий протиревматичний препарат (ХМПРП) отримували метотрексат. Так, кількість болісних суглобів у дітей зменшилася на 24,2±2,8%, достовірно нижчими стали індекси болю — на 23,7±2,1%, оцінки загального стану, на думку пацієнта — на 16,6±1,9% та лікаря — на 12,8±1,8%, а також суттєво знизились лабораторні показники активності запального процесу — ШОЕ — на 35,4±4,9% та вміст СРП — на 30,8±3,7%. У дітей 2-ї групи динаміка спостерігалась за 4 показниками з 8, а саме загальними оцінками стану за версією пацієнта та лікаря — на 15,5±1,1 та 11,3±1,6% відповідно, та показниками лабораторної активності — ШОЕ (31±3,3%) та вмістом СРП (18,5±3,1%). У дітей 3-ї групи, де ХМПРП був лефлуномід, зміни встановлено за 5 показниками з 6: оцінки болю (27,3±3,15), загального стану за версією пацієнта та лікаря (26,1±3,8 та 23,9±6,2%), ШОЕ (14,4±5,7%) та вмісту СРП (21,2±2,2%). За 6 міс БТ серед дітей 1-ї групи, які отримували метотрексат, ефективність фармакотерапії на рівні АКР 30 досягнута у 17 (53,1%) пацієнтів, серед дітей, які отримували сульфасалазин та лефлуномід, у 11 (44%) та 5 (45,4%) пацієнтів відповідно. Терапевтична відповідь на рівні АКР 50 одержана у 7 (21,9%) дітей на БТ метотрексатом, а також у 2 (8%) та 1 (9%) пацієнтів на БТ сульфасалазином та лефлуномідом. Пригнічення активності запального процесу у дітей 1-ї групи проявлялося зниженням показників ІЛ-1β (на 38,7±3,7%) та особливо ІЛ-6 (на 36,3±3,8%), що перевершувало показники у дітей 2-ї (28,5±3,5%) і 3-ї (29,1±5,1%) груп. Динаміка вмісту NF-kB була максимальною на фоні терапії метотрексатом (на 43,4±8,5%) та перевищувала показники інших двох груп у 2 рази.
Висновки. Таким чином, показана висока ефективність застосування метотрексату як базисного препарату для лікування ЮРА, на рівні АКР 50 (21,9%) та зниження вмісту прозапальних цитокінів (ІЛ-1β на 38,7±3,7% та ІЛ-6 на 36,3±3,8%), NF-kB (на 43,4±8,5%) порівняно з пацієнтами із застосуванням сульфасалазину та лефлуноміду.
АУТОАНТИТІЛА ПРИ ОСТЕОАРТРОЗІ ТА МЕТАБОЛІЧНОМУ СИНДРОМІ
Л.Н. Єфременкова, І.Г. Кольцова, А.П. Боровик, В.В. Клочко, К.С. Ковалевська
Одеський національний медичний університет
Актуальність проблеми остеоартрозу (ОА) при метаболічному синдромі (МС) зумовлена частим їх поєднанням, негативним впливом на якість і тривалість життя, поліморбідністю, що ускладнює підбір адекватної терапії, та необхідністю тривалого і високовартісного лікування.
Мета: вивчення рівнів лептину, інсуліну, С-реактивного білка, наявності аутоантитіл (антинуклеарних (АНА), антимітохондріальних, антиендотеліальних) та особливостей перебігу ОА при МС.
Методи дослідження. Обстежено 34 хворих із МС, 14 чоловіків і 20 жінок, середній вік — 56,4±2,5 року. Проводили загальноклінічне дослідження, а також визначення рівнів інсуліну, лептину, С-реактивного білка, наявність аутоантитіл (АНА, антимітохондріальних, антиендотеліальних). Діагноз МС встановлювали за критеріями ВОЗ. Діагноз ОА встановлювали за критеріями Л.І. Беневоленської. Контрольну групу становили 34 хворих із МС без ОА. Рівень лептину, інсуліну, С-реактивного білка визначали імуноферментним методом. Індекс НОМА визначали за співвідношенням рівнів інсуліну та глюкози. Наявність аутоантитіл у досліджуваній групі визначали за допомогою імунофлюоресцентного методу.
Результати. Виявлено, що у хворих досліджуваної групи порівняно з контрольною групою при зіставному рівні інсуліну (16,5±0,19 та 15,9±0,20 мкМЕ/мл відповідно) та індексу НОМА (4,9±0,3 та 4,5±0,2 відповідно) достовірно вищі рівні лептину (як у чоловіків (7,5±0,3 та 6,1±0,4 нг/мл відповідно), так і в жінок (16,9±0,4 та 14,7±0,5 нг/мл відповідно) та С-реактивного білка (3,6±0,05 та 2,2±0,07 мг/л відповідно).
У хворих досліджуваної групи вивлені аутоантитіла: у 6 антинуклеарні, у 1 — антимітохондріальні та у 12 — антиендотеліальні. Таким чином, аутоантитіла різних типів виявлені у 19 (55,9%) із 34 хворих досліджуваної групи. АНА асоціювалися за наявністю синовіту колінних та дрібних суглобів кистей (у 5 з 6 хворих із АНА). Наявність антимітохондріальних антитіл асоціювалася із періодичним підвищенням рівнів ферментів (АсАТ, АлАТ, ГГТП). Наявність анитендотеліальних антитіл асоційована з наявністю мікроангіопатій (ураження сітківки та мікроальбумінурія). Рівень С-реактивного білка становив у групі з АНА 6,4±0,3 мг/л, за наявності антимітохондріальних антитіл — 5,5 мг/л, за наявності антиендотеліальних антитіл — 2,3±0,1 мг/л. У контрольній групі аутоантитіла виявлені у 2 хворих (5,9%) (в обох випадках антиендотеліальні).
Протягом наступного року спостереження у групі хворих з ОА при МС та наявністю аутоантитіл синовіти спостерігались у 7 (36,8%) хворих. За відсутності аутоантитіл синовіт виявляли у 2 (13,3%) з 15 хворих, що достовірно рідше.
Висновки. Таким чином, ОА при МС характеризується високим рівнем лептину та С-реактивного білка, частим виявленням аутоантитіл різних типів, що відіграють роль в ураженні органів-мішеней (мікроангіопатії, цитолітичний печінковий синдром). Наявність аутоантитіл асоційована з більш частим розвитком синовіту, що сприяє прогресуванню ураження суглобового хряща при ОА.
КОМПЛЕКСНЕ ЛІКУВАННЯ ХВОРИХ З АРТРОЗОМ КОЛІННИХ СУГЛОБІВ
І ГІПЕРТОНІЧНОЮ ХВОРОБОЮ ІІ СТАДІЇ
Р.М. Заворітна
ДУ «ННЦ «Інститут кардіології ім. М.Д. Стражеска» НАМН України», Київ
Проблеми лікування деформуючого артрозу до сьогодні залишаються актуальними і пошук адекватних методів терапії заслуговує пильної уваги з боку клініцистів. Згідно з сучасними поглядами деформуючий артроз є поліетіологічним захворюванням. Відомо, що залежно від ступеня дегенеративно-дистрофічних процесів існує три стадії деформуючого артрозу. Фізіотерапія показана на всіх трьох стадіях. Цілком виправдано призначення таким хворим на фоні медикаментозної терапії фізичних методів, які б діяли позитивно на всіх ланках патологічного процесу і потенціювали дію фармацевтичних препаратів, а також усували їх побічну дію. Розширення компетенції лікаря у використанні природних факторів у комплексному лікуванні цих хворих може послужити на благо пацієнтам. Фізіотерапія активує процеси саногенезу, що суттєво покращує загальний стан хворого, стимулює імуногенез, кровообіг, центральну саморегуляцію на рівні цілісного організму. Фізичні фактори, як правило, не викликають побічних дій при адекватній дозі. За останні роки широко застосовується бішофітотерапія при цілому ряді захворювань. Полтавський бішофіт відомий в Україні 15 років. Вперше бішофіт був відкритий німецьким ученим Бішофом і є мінералом реліктового походження. За своїм складом він нагадує внутріклітинне середовище людського організму. Загальна мінералізація до 400 г/л, куди входять: магній, калій, кальцій, йод і цілий ряд мікроелементів (селен, кремній, марганець, мідь, залізо…). У сучасних умовах розроблені показання для комплексної реабілітаційної терапії на базі стаціонарних поліклінічних і санаторно-курортних закладів. Одержані позитивні результати застосування полтавського бішофіту в кардіології, гастроентерології, ревматології, травматології.
Проведені експериментальні та клінічні дослідження, які встановили біохімічно зумовлений ефект при гіпертонічній хворобі, а також при захворюваннях суглобів. Під спостереженням перебували 43 хворих віком 48–69 років із діагнозом гіпертонічна хвороба ІІ стадії та деформуючий артроз колінних суглобів. На фоні медикаментозної терапії хворі приймали бішофітні ванни, 100 мл бішофіту на одну ванну, температура 36–38 °С 10–15 хв через день, або 2 дні підряд з одним днем відпочинку, всього 7–10 ванн. Магнітотерапію на кінцівки хворі приймали на апараті «Алимп». Особливість методики комплексного лікування полягала в тому, що перед магнітотерапією наносився гель — бішофіт на нижні кінцівки, після чого проводилася магнітотерапія. Через 1–2 год відпускалися ванни. Під час перебування в стаціонарі хворі отримували базове медикаментозне лікування, а також сегментарний масаж. Слід зазначити що 85% хворих позитивно переносили комплекс лікування без побічних дій, відзначали зниження артеріального тиску, покращання загального стану, зменшення вираженості болю в ділянці колінних суглобів, їх набряків, деформації. Після виписки зі стаціонару хворим рекомендовано продовжувати лікування в домашніх умовах а саме: ванну з бішофітом через день, до 21 ванни, магнітотерапію апаратом МАГ (для домашнього користування) і аплікації гель-бішофіту перед процедурами. При повторній госпіталізації хворі відзначали позитивну динаміку в лікуванні: артеріальний тиск мав тенденцію до зниження, нормалізувався сон, покращувався загальний стан (підвищувалась працездатність), значно зменшувалася вираженість болю при ходьбі в колінних суглобах. Магнітотерапія покращує кровообіг, нормалізує реологічні показники крові, викликає гіпотензивний ефект, стимулює роботу надниркових залоз, активує компенсаторно-адаптаційні реакції організму хворого. Бішофітотерапія має досить виражений протизапальний і спазмолітичний ефект, впливає на процеси імунітету через стимуляцію активності фагоцитів. Магній, введений в організм при бішофітотерапії, викликає гіпотензивний і седативний ефект, йод та інші мікроелементи стимулюють регенаторні й метаболічні процеси. Метод бішофітотерапії та магнітотерапії на фоні медикаментозної терапії має наукове обґрунтування у осіб із гіпертонічною хворобою ІІ стадії та деформуючим артрозом, заслуговує уваги і може бути рекомендованим для широкого застосування.
ОПЫТ ЛЕЧЕНИЯ ОТ КУРЕНИЯ ТАБАКА МЕТОДОМ РЕФЛЕКСОТЕРАПИИ — ПРОФИЛАКТИКА ОТ МНОГИХ ЗАБОЛЕВАНИЙ, В ТОМ ЧИСЛЕ И СЕРДЕЧНО-СОСУДИСТЫХ
Р.М. Заворотная
ГУ «ННЦ «Институт кардиологии им. Н.Д. Стражеско» НАМН Украины, Киев
Курение табака является одной из самых вредных привычек, опасной для здоровья не только самих курящих, но и их окружающих.
В настоящее время курение превратилось в массовую эпидемию, наносящую существенный ущерб населению и национальной экономике. Отношение к курению у людей разное, поэтому многие курильщики полагают, что с ними ничего не произойдет и что основные неприятности, связанные с курением, их минуют. Однако, к сожалению, это не так, и за вредную привычку придется расплачиваться здоровьем и даже жизнью. Поэтому не случайно во многих странах мира сейчас развернулась активная борьба с курением, ее возглавила Всемирная организация здравоохранения (ВОЗ), под эгидой которой выполнен целый ряд крупных исследований и разработаны предложения по решению проблемы «Курение или здоровье?». Что же такое курение — привычка или болезнь? на этот вопрос однозначного ответа нет. Борьбу с курением следует проводить целенаправленно и комплексно, используя всевозможные способы и средства, включая меры индивидуального воздействия. Как же бросить курить?
Методы лечения никотиновой наркомании применяются в зависимости от трех стадий курения (бытового, привычного и пристрастного) и подразделяются на групповые (главным образом групповая психотерапия) и индивидуальные методы, включая психотерапию, гипноз, рефлексотерапию и ее разновидности: акупунктуру, электропунктуру, лазеропунктуру, химиотерапию. Достаточно устойчивые результаты дает рефлексотерапия методом электропунктуры. При реализации так называемой программы «Антитабак» рекомендовано первоначально воздействовать на восемь точек ушной раковины. Если пациент правша, воздействие проводится в правое ухо, а если левша — в левое. Первой берется точка нулевая «Ножье» в центре ушной раковины или так называемая точка «Зеро». Остальные точки, по методике В.Г. Вогралика, берутся в области завитка, на них воздействуют кратковременными импульсами 45 с на минусе и 15 с на плюсе, длительностью 1–2 мин (аппарат «Элап-1»). Локализация точек определяется тем же прибором. Помимо аурикулярных точек, используются точки общего воздействия: Дзу-сань-ли, Хе-гу, симметрично слева и справа. Процедуру следует проводить не менее чем через 10 ч после последней выкуренной сигареты, 3 дня подряд а если эффект незначителен, то продолжаем лечение 1 раз в 5–7 дней и воздействуем уже на противоположное ухо. Реакция на данный метод лечения достаточно выраженная (отвращение к запаху табака, ощущение запаха травы). Под наблюдением было 105 больных (60 мужчин и 45 женщин). Бросили курить после трех процедур 80%. Следует отметить возрастную особенность: быстрее бросают курить люди пожилого возраста, а также мужчины. Женщины большей частью уменьшают количество выкуренных сигарет. Метод рефлексотерапии можно применять при любой патологии, и в любом возрасте, он безопасный, не дает никаких побочных реакций, заслуживает внимания при борьбе с таким злом, как курение, но только в руках врача — специалиста, владеющего методом рефлексотерапии.
АНТРОПОМЕТРИЧНІ ОСОБЛИВОСТІ ХВОРИХ НА АНКІЛОЗИВНИЙ СПОНДИЛОАРТРИТ, УСКЛАДНЕНИЙ ПАТОЛОГІЄЮ СТРАВОХОДУ
А.А. Заздравнов
Харківський національний медичний університет
Сучасні погляди на ревматичну патологію спрямовані не лише на сучасні методи діагностики та лікування, але й на нові підходи у виявленні невідомих патогенетичних ланок формування цілісного патологічного комплексу хвороба — ускладнення. Сучасна діагностика не виключає використання перевірених часом і доступних фізикальних методів обстеження. Існування комплексу хвороба — ускладнення змінює акценти діагностичногго пошуку, розширює можливості дещо забутих методик, що дозволяє більш раціонально застосовувати подальші складні інструментальні та лабораторні методи дослідження.
Анкілозивний спондилоартрит (АС) належить до захворювань, перебіг яких характеризується вираженою деформацією хребта, порушеннями статури та пригніченням рухової активності пацієнтів. Означені порушення впливають як на якість життя пацієнтів з АС, так і на функціональний стан окремих органів і систем (серце, легені тощо), змінюючи клінічну картину захворювання та погіршуючи його перебіг.
Мета: дослідити особливості антропометричних характеристик хворих на АС, перебіг якого ускладнений ураженням стравоходу.
Методи дослідження. Обстежено 22 хворих на АС, ускладнений патологією стравоходу (основна група) та 20 осіб з АС без езофагеальних уражень (група порівняння). За основними ознаками групи хворих були зіставними. Езофагеальні ураження діагностувалися на основі ендоскопічного (за умов можливості його виконання) та/чи клінічного обстеження. Метричні величини окремих тестів вимірювалися мірною стрічкою.
Результати. За основними антропометричними характеристиками (зріст, індекс маси тіла) розбіжностей між групами хворих на РА не виявлено. Однак при оцінці специфічних для АС антропометричних тестів встановлено певні відмінності у групах хворих. Так, позитивний симптом Форестьє спостерігався у 19 (86,4%) хворих основної групи та у 14 (70%) осіб групи порівняння. Ці відмінності були достовірними (df=1, χ2=3,923; р=0,048). При характеристиці абсолютних величин антропометричних показників також виявлено вірогідні розбіжності між групами хворих на АС (таблиця).
Таблиця. Результати антропометричних тестів у хворих на АС, см (M±m)
| Група | Симптом Форестьє | Симптом Отта | Екскурсія грудної клітки |
| Основна (n=22) | 8,1±0,61* | 2,05±0,131 | 2,49±0,177** |
| Порівняння (n=20) | 5,8±0,81 | 2,40±0,195 | 3,43±0,282 |
Відмінності достовірні: *порівняно з аналогічним показником групи порівняння (p<0,05); **порівняно з аналогічним показником групи порівняння (p<0,01).
Достовірна різниця у вираженості симптому Форестьє та зменшенні екскурсії грудної клітини у хворих основної групи порівняно з особами групи порівняння свідчили, що зміни в шийно-грудному відділі хребта при АС можуть бути етіопатогенетичним фактором виникнення езофагеальних ускладнень. Гіперлордоз шийного та кіфоз грудного відділлу хребта сприяють анатомічно-функціональній деструктуризації кардіальної частини стравоходу, впливають на загальну езофагеальну топографію. Обмеження дихальної екскурсії грудної клітки веде до напруження передньої групи м’язів шиї. Тиск м’язів на передню езофагеальну стінку порушує перистальтику органа, викликає дисбаланс між пропульсивними та циркулярними скороченнями стравоходу, і в результаті, створює передумови для виникнення гастроезофагеального рефлюксу та езофагіту.
Висновки. Антропометричні характеристики хворих на АС з ураженням стравоходу відображають деформацію шийно-грудного відділу хребта у хворих на АС, яка змінює езофагеальну топографію, сприяє функціональним порушенням моторики стравоходу й може бути етіопатогенетичним чинником езофагеальних ускладнень у цих пацієнтів.
ВПЛИВ АФІННО ОЧИЩЕНИХ АНТИТІЛ ДО ЛЮДСЬКОГО ФАКТОРА НЕКРОЗУ ПУХЛИН-Α НА АКТИВНІСТЬ РЕАКТИВНОГО АРТРИТУ ТА ХРОНІЧНОГО ПІЄЛОНЕФРИТУ
О.В. Залявська, О.С. Хухліна
Буковинський державний медичний університет, Чернівці
Мета: виявити вплив афінно очищених антитіл до людського ФНП-α (суміш гомеопатичних розведень С12, С30 та С200) на імунологічні показники активності реактивного артриту (РеА) у осіб із коморбідною хронічною хворобою нирок (ХХН): хронічним пієлонефритом (ХП).
Методи дослідження. Проведено дослідження в динаміці лікування у 60 хворих на РеА I–III ст. активності. Функціональна недостатність суглобів (ФНС) I–III ст. без патології нирок (30 осіб) та РеА, активність I–III ст. ФНС I–III ст. із коморбідним перебігом ХХН І–ІІ ст.: хронічний пієлонефрит, ХНН 0–I ст. (30 осіб). Згідно з призначеним лікуванням обстежені хворі були поділені на дві групи. Контрольну (1-шу) групу становили 15 хворих на РеА без патології нирок, 15 хворих на РеА на тлі хронічного пієлонефриту, які отримували традиційну терапію: харчування з урахуванням обмежень дієти № 6/7, антибіотики (доксициклін, або моксифлоксацин, або азитроміцин), нестероїдні протизапальні препарати (НПЗП) (лорноксикам 0,004 г 2 раза на добу). Основну (2-гу) групу становили пацієнти (30 осіб), які, окрім аналогічних дієтичних рекомендацій, антибактеріальної та протизапальної терапії, застосовували антитіла до людського ФНП-α (по 0,006 г 4 рази на добу) впродовж 3 міс. Контрольну групу становили 20 практично здорових осіб (ПЗО) відповідного віку. Для оцінки цитокінового статусу у обстежених хворих визначали вміст ІЛ-6, ФНП-α і ІЛ-1β у сироватці крові методом твердофазового імуноферментного аналізу (ІФА) з використанням моноклональних антитіл (набір реактивів «Diaclone», Франція).
Результати. Середня тривалість захворювання обстежених хворих становила 24,4±4,7 міс. Середній вік хворих — 32,5±1,2 року. При вивченні динаміки основних прозапальних цитокінів у хворих обох груп вміст у крові ФНП-α та ІЛ-1β перевищував значення у групі ПЗО у 1,6 та 1,5 раза відповідно (р<0,05), у той час, як вміст у крові ІЛ-6 був нижчий від показника у групі контролю у 1,5 раза (р<0,05). Водночас у хворих контрольної та основної груп спостерігалися близькі дані діапазону середніх значень вмісту у крові протизапального ІЛ-4 порівняно із ПЗО (р>0,05). Через 3 міс лікування у 2-й групі відзначено статистично достовірне зниження рівня цитокінів ФНП-α, ІЛ-1β та ІЛ-6 на 45; 41 і 50% відповідно порівняно із вихідними показниками (р<0,05). У групі порівняння відзначалася лише тенденція до зниження цих цитокінів впродовж усього періоду спостереження. В обох групах до початку терапії визначали низькі рівні протизапального цитокіну ІЛ-4. На 3-му місяці лікування виявлено значне зростання ІЛ-4 у 2-й групі порівняно із вихідними даними та з показниками 1-ї групи на 38,8 та 38% відповідно в той же період лікування (р<0,05). З метою контролю функціонального стану нирок було визначено швидкість клубочкової фільтрації (ШКФ) на всіх етапах дослідження. В обох групах вихідні величини ШКФ були дещо знижені порівняно із ПЗО (р>0,05). Проте вже в 1-й місяць лікування у 2-й основній групі хворих спостерігалося підвищення ШКФ майже на 5%, а на 3-й місяць — на 6% порівняно із вихідними даними та достовірно вище порівняно із групою контролю (р<0,05). Зовсім протилежна динаміка спостерігалася в 1-й досліджуваній групі, де величина ШКФ впродовж всього періоду спостереження мала тенденцію до зниження.
Висновки. На тлі прийому антитіл до людського ФНП-α спостерігалося зниження ключових прозапальних цитокінів (ФНП-α, ІЛ-6, ІЛ-1β) та підвищення рівня протизапального цитокіну ІЛ-4 через 3 міс (р<0,05), а максимальний ефект препарату досягався при його безперервному і тривалому прийомі впродовж не менше 3 міс, що дозволило зменшити активність запалення і покращити функціональний стан нирок, а дозу НПЗП знизити до 50% через 1 міс лікування, а впродовж 3 міс — відмінити всім хворим, які їх отримували, і, отже, знизити ризик розвитку НПЗП-гастро- і нефропатій.
НЕСПЕЦИФІЧНИЙ АОРТОАРТЕРІЇТ (ТАКАЯСУ): КЛІНІЧНІ «МАСКИ» ТА СТРУКТУРА ЛЕТАЛЬНОСТІ
О.О. Зімба
Львівський національний медичний університет ім. Данила Галицького
Мета: з’ясувати частоту розбіжностей клінічного та патолого-анатомічного діагнозів, клінічні «маски» та причини смерті хворих на неспецифічний аортоартеріїт (НАА).
Методи дослідження. Проведено ретроспективний клініко-патологоанатомічний аналіз 60 секційних спостережень НАА. Серед померлих було 52 чоловіки та 8 жінок віком від 14 до 65 років (середній вік — 47 років). Професійний склад померлих в основному — робітничі спеціальності (63%). Найчастіше були професії, при яких є контакт із ксенобіотиками: пестицидами (працівники сільського господарства); важкими металами (працівники транспорту: шофери, трактористи, акумуляторщики, механізатори); важкими металами та розчинниками (будівельно-ремонтні робітники: електрогазозварювальники, маляри, слюсарі, шахтарі, ливарники, арматурники, некваліфіковані працівники).
Результати. За класифікацією E. Lupi-Herrera (1977) у 4 (6,7%) померлих під час патологоанатомічного дослідження діагностовано НАА I типу (ураження дуги аорти та її гілок), у 14 (23,3%) — II типу (ізольоване ураження черевного відділу аорти та його гілок), у 35 (58,3%) — III типу (генералізований), у 7 (11,7%) — IV типу (ураження легеневої артерії та її гілок у поєднанні з будь-яким із перших трьох варіантів). У 33 (55%) випадках виявлено невідповідність клінічного та патологоанатомічного діагнозів. Атеросклероз аорти та її гілок виявився найчастішим клінічним діагнозом, що був встановлений 14 померлим від НАА. При цьому у 5 випадках діагностовано атеросклероз аорти, що ускладнився її розшаруванням та розривом, у 9 — атеросклероз черевного відділу аорти та її гілок (черевного стовбура, мезентеріальних, ниркових, клубових, стегнових артерій). Інші клінічні діагнози: ішемічна хвороба серця, інфаркт міокарда — у 5 померлих; пептична виразка дванадцятипалої кишки, що ускладнилась пенетрацією — у 3; вузликовий поліартеріїт — у 3; інфекційний ендокардит — у 2; гостре порушення мозкового кровообігу — у 1; хронічна ревматична хвороба серця — у 1; тромбоемболія легеневої артерії — у 1; вторинна артеріальна гіпертензія (феохромоцитома) — у 1; хронічний гломерулонефрит — у 1; канцероматоз легень — у 1. У структурі летальності хворих на НАА переважала інтоксикація — у 31,7% померлих. При цьому її безпосередньою причиною у 12 випадках був перитоніт, внаслідок оклюзії мезентеріальних артерій та некрозу кишок, у 6 — гангрена нижніх кінцівок, у 1 — нагноєння алопротезу аорти. Друга за частотою причина смерті хворих на НАА — серцева недостатність (25%). Причини її виникнення: інфаркт міокарда — у 12 випадках та вазоренальна артеріальна гіпертензія — у 3. Третє місце у структурі смертності посіла гостра кровотеча з розвитком геморагічного шоку (23,3%). Джерела гострої крововтрати: розрив розшаровуючої аневризми черевної аорти — у 6 випадках, розрив висхідної аорти з тампонадою серця — у 4, кровотеча з виразок шлунково-кишкового тракту — у 2, ятрогенні кровотечі під час оперативних втручань — у 2. Інші причини смерті хворих на НАА: гостре порушення мозкового кровообігу, набряк мозку (10%); ниркова недостатність (5%); легенева недостатність (1,7%), синдром реваскуляризації (1,7%). У одному випадку НАА поєднувався зі склеромою дихальних шляхів, яка стала безпосередньою причиною смерті хворої внаслідок асфіксії.
Висновки. 1. Серед хворих на НАА переважають чоловіки, робота яких пов’язана зі впливом ксенобіотиків. 2. Найчастіше виявляли НАА III типу з генералізованим ураженням аорти. 3. Клінічними «масками» НАА є хвороби серцево-судинної системи (атеросклероз, ішемічна хвороба серця, артеріальна гіпертензія, тромбоемболія легеневої артерії, хронічна ревматична хвороба серця, інфекційний ендокардит); травної системи (пептична виразка дванадцятипалої кишки); нирок (гломерулонефрит); центральної нервової системи (цереброваскулярна хвороба), інші системні васкуліти (вузликовий поліартеріїт). 4. Найчастіші причини смерті хворих на НАА: а) інтоксикація, внаслідок перитоніту та гангрени нижніх кінцівок; б) серцева недостатність (інфаркт міокарда, вазоренальна артеріальна гіпертензія); в) гостра кровотеча (розрив розшаровуючої аневризми аорти; шлунково-кишкові кровотечі).
КЛІНІЧНИЙ ВИПАДОК СКЛАДНОЇ ДИФЕРЕНЦІйНОЇ ДІАГНОСТИКИ МІЖ ТУБЕРКУЛЬОЗОМ ЛЕГЕНь ТА ГРАНУЛЕМАТОЗОМ іЗ ПОЛІАНГІЇТОМ (ВЕГЕНЕРА)
О.О. Зімба, В.П. Михальчишин
Львівський національний медичний університет ім. Данила Галицького
Позасудинний розвиток поліморфної грануляційної тканини у легенях з її казеозним некрозом, подальшою секвестрацією та утворенням каверн при гранулематозі з поліангіїтом (ГПА) зумовлює схожість цієї хвороби з туберкульозом легень. При туберкульозі легень можуть виявлятися позитивними антинейтрофільні цитоплазматичні антитіла (АНЦА), визначення яких традиційно застосовується для діагностики АНЦА-асоційованих васкулітів, у тому числі ГПА. Це додатково утруднює диференційну діагностику ГПА з туберкульозом легень.
Мета: продемонструвати складність диференційної діагностики між туберкульозом легень та гранулематозом із поліангіїтом.
Методи дослідження. Проаналізовано один летальний випадок туберкульозу легень із вивченням клінічних, лабораторних, інструментальних і патоморфологічних даних.
Результати. Чоловік віком 61 рік госпіталізований у терапевтичне відділення зі скаргами на схуднення біля 10 кілограм протягом останніх 2 міс, нудоту, відсутність апетиту, різку загальну слабкість. З анамнезу відомо, що хворіє протягом 2 міс, за медичною допомогою не звертався, палить і зловживає алкоголем понад 20 років, має професійні шкідливості — контакт із продуктами згоряння газів. На 2-й тиждень після госпіталізації у пацієнта раптово з’явилися задишка у спокої, набряки на ногах. Послідовно підозрювали рак шлунка з метастазуванням в легені, пневмонію, периферичний рак легені, тромбоемболію легеневої артерії, ГПА. Із дифереційно-діагностичною метою було проведено рентгенографію органів грудної клітки, фіброезофагогастродуоденоскопію, фібробронхоскопію, мультиспіральну комп’ютерну томографію органів грудної клітки. Домінуючими синдромами у клінічній картині були легеневий (легеневі інфільтрати з розпадом) та нирковий (зміни у загальному аналізі сечі: протеїнурія, гематурія, циліндрурія). З метою виключення системного васкуліту, поєднаного з легенево-нирковим синдромом, проведено реакцію непрямої імунофлуоресценції (РНІФ) та імуноферментний аналіз (ІФА) для визначення АНЦА. РНІФ показала підвищення рівня АНЦА більше ніж у 2 рази порівняно з нормою, що вказувало на високу ймовірність діагнозу АНЦА-асоціований васкуліт. Проте результати ІФА з визначенням АНЦА до протеїнази-3 та мієлопероксидази виявилися від’ємними, і діагноз АНЦА-асоційований васкуліт, у тому числі ГПА, не був підтверджений. У зв’язку з посиленням задишки хворого переведено у фтизіопульмонологічний центр, де діагностовано туберкульоз легень, виявлено кислотостійкі бактерії в мокротинні. За даними патологоанатомічного дослідження пацієнт хворів на лобарну казеозну пневмонію нижньої частки лівої легені з розпадом, прогресуванням та генералізацією туберкульозного процесу. Під час лікування основне захворювання ускладнилось емпіємою плеври з обох боків, піопневмотораксом зліва. Безпосередньою причиною смерті стало прогресування туберкульозного процесу з розвитком серцево-легеневої недостатності.
Висновки. Для диференційної діагностики ГПА з туберкульозом легень застосовують визначення АНЦА. Проте метод виявлення АНЦА за допомогою РНІФ є недостатньо специфічним, оскільки дає позитивний результат не тільки при АНЦА-асоційованому васкуліті, але й при інших хворобах, зокрема при туберкульозі. У зв’язку з цим РНІФ не може замінити метод ІФА. Визначення АНЦА до протеїнази-3 та мієлопероксидази методом ІФА є найбільш специфічним для діагностики АНЦА-асоційованого васкуліту та дозволяє виключити туберкульоз.
ПЕРВИННА ІНВАЛІДНІСТЬ В УКРАЇНІ ВНАСЛІДОК ГОСТРОЇ РЕВМАТИЧНОЇ ГАРЯЧКИ ТА ХРОНІЧНИХ РЕВМАТИЧНИХ ХВОРОБ СЕРЦЯ
А.В. Іпатов, О.М. Лисунець, І.Я. Ханюкова, Н.М. Бірець, Ю.В. Ткаченко, О.В. Танцура
ДУ «Український державний науково-дослідний інститут медико-соціальних проблем інвалідності МОЗ України», Дніпропетровськ
Впродовж останніх років відзначається поступове зниження питомої ваги гострої ревматичної гарячки та хронічних ревматичних хвороб серця у структурі первинної інвалідності як дорослого, так і працездатного населення по всіх регіонах України (з 0,6 і 0,7% відповідно у 2009 р. до 0,2 і 0,3% — у 2012 р. на 10 тис. населення).
Серед адміністративних територій найвищі місця займали у 2007 р. Житомирська (0,9), Вінницька та Чернівецька (по 0,7) області; у 2010 р. — Вінницька, Волинська, Житомирська, Чернівецька області та м. Севастополь (по 0,5 на 10 тис. населення), у 2012 р. — Вінницька та Чернівецька області. Протягом цього терміну первинна інвалідність дорослого населення суттєво знизилась у АР Крим, Дніпропетровській, Сумській, Херсонській (з 0,5 до 0,2), Житомирській (з 0,9 до 0,5), Івано-Франківській (з 0,6 до 0,4), Чернівецькій (з 0,7 до 0,5 на 10 тис. населення) областях та Рівненській області з 1,2 відповідно у 2009 р. до 0,4 у 2012 р. За цей період не зросла первинна інвалідність дорослого населення щодо гострої ревматичної гарячки та хронічних ревматичних хвороб серця в жодній з областей.
Серед вперше визнаних інвалідами внаслідок хронічних ревматичних хвороб серця у 2009–2012 рр. в Україні серед міського населення переважали особи працездатного віку. Аналіз структури інвалідності по групах показав, що серед вперше визнаних інвалідами у вивчений період часу збільшилася частка інвалідів ІІІ групи.
За даними проведеного в клініці Інституту аналізу причинних факторів інвалідизації внаслідок хронічних ревматичних хвороб серця, визначено, що формування інвалідності залежить: на 56% від медичних чинників (головні серед яких — несприятливі перебіг і прогноз захворювання), на 23% — від професійно-трудових чинників (провідні серед них — протипоказані й несприятливі характер і умови праці, рівні загальної та професійної освіти), на 21% — від соціального статусу і рівня доходів.
Вищенаведені дані свідчать про те, що потреба інвалідів унаслідок ревматичних хвороб у різних заходах медико-соціальної реабілітації достатньо велика, що зумовлює важливість і складність завдань щодо реалізації цієї потреби закладами охорони здоров’я і соціального захисту населення на регіональному і державному рівнях.
ПРОБЛЕМИ ДІАГНОСТИКИ ШКІРНОГО ВАСКУЛІТУ (АНГІЇТУ)
В.К. Казимирко, Л.М. Іваницька, А.Г. Дубкова, Т.С. Сілантьєва, Г.П. Іванова, Т.М. Костюченко, О.П. Цуцаріна
Національна медична академія післядипломної освіти ім. П.Л. Шупика, Київ
Клінічна лікарня № 6, Київ
Діагностика шкірного васкуліту нерідко становить значні труднощі. Спостерігається термінологічна неточність при відсутності загальновизнаної класифікації васкулітів. Досі лікарі використовують такі терміни, як «алергічний васкуліт», «алергічний ангіїт», «гіперергічний васкуліт», хоча їх застосування не рекомендується, оскільки природа захворювання не алергічна, а антигени часто не встановлені. Більш коректним є термін «васкуліт із переважним ураженням шкіри», але необхідно враховувати, що у пацієнтів, крім ураження шкіри, можуть відзначатися артралгія, біль у животі та ін. Шкірний васкуліт клінічно проявляється пурпурою, яка появляється гостро на стопах та гомілках, шкірі тулуба, передпліч та кистей. Висипання пурпурного кольору спочатку над поверхнею шкіри не виступають і не супроводжуються будь-якими відчуттями. В центрі елементів висипки виникають некрози, виразки, можлива трансформація у вузлики і пухирці. Часто відзначається кропив’янка, ураження шкіри за типом багатоформної еритеми або у вигляді сітчастого ліведо. При діагностиці лейкоцитокластичного васкуліту (або поліморфного дермального ангіїту за класифікацією О.Л. Іванова (2002)) ревматологу, на наш погляд, бажано конкретизувати тип ангіїту (геморагічний, уртикарний, папулонодулярний, папулонекротичний, пустульозно-виразковий, некротично-виразковий, поліморфний), але внаслідок частого поєднання цих уражень визначити тип не завжди можливо. Також лікарю необхідно враховувати, що до шкірного васкуліту відносять (А.І. Іванов, 2002) різні типи пурпури пігментної хронічної (дерматозу геморагічно пігментного, або хвороби Шамберга — Майоккі), а саме петехіальний (хвороба Шамбера), телеангіектатичний (пурпура Майоккі), ліхеноїдний (ангіодерміт Гужеро — Блюма), екзематозний (пурпура Дукаса — Капенатакіса). Лікарі-ревматологи, як правило, з цими типами шкірних васкулітів не знайомі та приймають їх за лейкоцитокластичні. У таких випадках до діагностики слід долучати дерматологів, оскільки ці дермальні васкуліти в їх компетенції.
Лікарі мають знати, що термін «вузловата еритема», який вони часто застосовують, не є коректним, і становить собою данину традиції. У зарубіжній літературі викорисовується назва «вузловатий васкуліт», «нодулярний васкуліт», «підгострий гіподерміт». У класифікації О.Л. Іванова представлені у вигляді синонімів вузловатої еритеми «васкуліт вузловатий (нодулярний)», «гіподерміт варіабельний». Необхідно пам’ятати, що у хворих із підгострою вузловатою еритемою спостерігається так звана мігруюча вузловата еритема, яка починається одиноким вузлом рожево-синюшного кольору, що швидко збільшується в розмірах і перетворюється в глибоку бляшку з центром, який запався, з валом по периферії. Ураження зберігається декілька місяців, інколи супроводжується субфебрилітетом, слабкістю та артралгією. Цей вузол іноді супроводжують одиничні дрібні вузлики. Слід також враховувати: 1) що хронічній формі вузловатої еритеми часто передує тривалий продромальний період у вигляді загальної слабкості, «втоми ніг», набряку гомілок та стоп; 2) що різноманітні форми шкірного ангіїту виявляють у хворих із системним васкулітом (гранулематоз Вегенера, синдром Чарджа — Стросс та ін.). При цьому діагноз шкірного васкуліту потребує патоморфологічного підтвердження.
ВЗАИМОСВЯЗИ ПОКАЗАТЕЛЕЙ УЛЬТРАЗВУКОВОГО ИССЛЕДОВАНИЯ СУСТАВОВ И АНГИОТЕНЗИН-АЛЬДОСТЕРОНОВОЙ СИТЕМЫ У БОЛЬНЫХ РЕВМАТОИДНЫМ АРТРИТОМ
С.С. Касинец1, Е.Б. Комарова1, Т.М. Синенко2, В.В. Былино2
1ГУ «Луганский государственный медицинский университет»
2Луганская областная клиническая больница
Ультразвуковое исследование (УЗИ) суставов — современный метод ранней диагностики ревматоидного артрита (РА), позволяющий выявлять не только рентгеннегативную деструкцию костной ткани (паннус, эрозии), но и ранние изменения мягких тканей сустава (синовит, гиперваскуляризацию, тендосиновиты). Учитывая, что активация ангиотензин-альдостероновой системы играет важную роль в экссудативно-пролифератиных (стимуляция провоспалительных цитокинов, факторов роста, неоангиогенеза, эндотелиальной дисфункции) процессах патогенеза РА, исследование изменений и взаимодействия данных факторов является перспективным направлением в современной ревматологии.
Цель: выявления взаимосвязей между показателями УЗИ суставов и уровнями ангиотензина (Aнг) II, альдостерона (ALD) в сыворотке крови у больных РА.
Методы исследования. Обследовано 98 больных с верифицированным диагнозом РА АСR/EULAR, 2010, иммуноферментным методом ELISA были определены уровни Aнг II, ALD («BCM Diagnostic», Канада). Всем обследованным сделано УЗИ суставов кисти, методика которого разработана рабочей группой Ассоциации ревматологов Украины в 2009 г. (Коваленко В.М. и соавт., 2008), выполнена оценка суставных поверхностей, наличие выпота, толщина синовиальной оболочки (СО) и околосуставных структур в режиме серой шкалы и с использованием допплера. УЗИ суставов проводилось на аппарате «ESAOTE MyLAB40» (Нидерланды) с линейным датчиком частотой 7,5 Mгц. Все показатели УЗИ суставов оценивались по шкале Hau 0–3 балла (0 — отсутствие признака, 1 — незначительно выраженный признак, 2 — умеренно выраженная визуализация признака, 3 — максимальное отображение исследуемого показателя).
Средний возраст пациентов был 41,3 года (от 24 до 58 лет), женщины составили 83%. Для статистической обработки использовали тест Крускала — Уоллиса (Н) — ранговый непараметрический критерий, аналог однофакторного дисперсионного анализа, проверка силы влияния номинативного показателя с ≥3 значениями на другие переменные.
Результаты. При анализе теста Крускала — Уоллиса выявлено, что с повышением уровня Aнг II увеличивалось количество выпота в сустав (Н=22,56; р<0,001), а концентрация ALD не влияла на уровень жидкости (Н=2,08; р=0,36); с нарастанием уровня ALD увеличивалась толщина СО сустава (Н=47,41; р<0,001), у Aнг II такого влияния не выявлено (Н=4,41; р=0,22). На показатели васкуляризации, паннуса и эрозий влияли уровни концентрации и ALD и Aнг II, однако сила влияния была различной: для васкуляризация и Aнг II (Н=88,03; р<0,001), а для ALD (Н=31,99; р<0,01); выраженность паннуса, количество эрозий и ALD (Н=81,83; р<0,001; Н=66,69; р<0,001 соответственно), а для Aнг II (Н=12,22; р<0,05; Н=14,49; р<0,05 соответственно).
Выводы. Учитывая данные нашего исследования, можно предположить, что Aнг II обусловливает экссудативно — воспалительные процессы, превалирующие на ранних этапах патогенеза РА, а альдостерон, вероятно, играет важную роль в пролиферативно-деструктивных процессах патогенеза РА, что требует дальнейшего детального исследования.
СУДИННО-ЕНДОТЕЛІАЛЬНИЙ ФАКТОР РОСТУ ЯК МАРКЕР АТЕРОСКЛЕРОТИЧНОГО УРАЖЕННЯ СУДИН У ХВОРИХ НА РЕВМАТОЇДНИЙ АРТРИТ ІЗ ГІПОТИРЕОЇДНОЮ ДИСФУНКЦІЄЮ
А.К. Князєва1, Г.Б. Благодаренко1, М.В. Волощук2, Н.Г. Блудова1
1ДЗ «Луганський державний медичний університет»
2Обласна клінічна лікарня, Луганськ
Однією з причин високої захворюваності та смертності від серцево-судинних ускладнень у хворих на ревматоїдний артрит (РА), зумовлених атеросклеротичним ураженням судин, є відсутність повноцінної програми первинної та вторинної профілактики, тобто своєчасного виявлення і корекції факторів ризику, ураження органів-мішеней, асоційованих порушень. До прогресування атеросклеротичного ураження судин у хворих на РА може призводити гіпотиреоїдна дисфункція (ГТД). Раннє дослідження маркерів атеросклеротичного ураження судин у хворих на РА з ГТД сприятиме визначенню подальшого прогнозу й оптимізації ефективності методів комплексної діагностичної та терапевтичної тактики.
Мета: вивчити особливості змін рівня судинно-ендотеліального фактору росту (СЕФР) у крові пацієнтів із РА з ГТД.
Методи дослідження. Під спостереженням перебували 98 хворих на РА. Усі хворі були розподілені на дві групи. До 1-ї групи увійшли 59 (60,2%) хворих на РА із супутньою ГТД, до 2-ї — 39 (39,8%) пацієнтів з РА без супутньої ГТД. Діагноз РА встановлювали згідно з критеріями АСR/EULAR, 2010. Стан щитоподібної залози визначали згідно з міжнародними стандартами діагностики ГТД. Усі досліджувані мали жіночу стать. Хворі 1-ї та 2-ї груп не розрізнялися за віком і тривалістю РА. Усім хворим проводили клініко-функціональну діагностику РА. Оцінювали рівень загального холестерину (ЗХС), холестерину ліпопротеїдів високої щільності (ХС ЛПВЩ), холестерину ліпопротеїдів низької щільності (ХС ЛПНЩ), холестерину ліпопротеїдів дуже низької щільності (ХС ЛПДНЩ) та розраховували коефіцієнт атерогенності (КА). Усім хворим проводили УЗД судин для виявлення ендотеліальної дисфункції (ЕД). Визначення рівня СЕФР у сироватці крові проводили методом ІФА ELISA (дослідні набори «Вектор-Бест»).
Результати. За даними нашого дослідження, рівень СЕФР у плазмі крові був найвищим у хворих 1-ї групи — 745 (551; 906) пг/мл. У 2-й групі цей показник становив — 644 (283; 744) пг/мл. За цим показником слід відзначити наявність високодостовірних відмінностей між досліджуваними групами (р=0,001).
Встановлено вплив СЕФР на ліпідний спектр крові в обох групах, що підтверджувалося наявністю прямих кореляцій між СЕРФ та рівнями ЗХС, ХС ЛПНЩ, ХС ЛПДНЩ, КА (r=0,34; r=0,41; r=0,22; r=0,4 і r=0,27; r=0,34; r=0,28; r=0,27; всі p<0,05) та зворотних між СЕРФ та ХС ЛПВЩ (r=–0,39 і r=–0,26; p<0,05).
Проаналізовано ступінь впливу показника СЕРФ на порушення стану судинно-рухової функції ендотелію в групах. У групі хворих на РА з ГТД визначено вплив показника концентрації СЕРФ на ендотелійзалежну вазодилатацію (F=8,03; р=0,006), ендотелійнезалежну вазодилатацію (F=6,66; р=0,01), коефіцієнт чутливості ендотелію до напруження зсуву (F=6,78; р=0,01), ступінь ЕД (F=12,8; р<0,001), яка не зберігалася у пацієнток 2-ї групи (F=2,9, р=0,09; F=1,24, р=0,27; F=0,09, р=0,77; F=0,002; р=0,96).
Висновки. Отримані результати демонструють більші значні зміни СЕФР у хворих на РА із супутньою ГТД, його вплив на показники ліпідного спектра та функцію ендотелію, що дозволяє вважати його інформативним маркером атеросклерозу у цих хворих. Це ставить за потребу лікарям приділяти більше уваги ретельному обстеженню хворих на РА з ГТД, для того щоб запобігти небажаним серцево-судинним ускладненням, які призводять до летальних випадів у хворих на РА з ГТД.
МЕТАБОЛІЧНІ ПОРУШЕННЯ В УМОВАХ ХРОНІЧНОГО ЗАПАЛЕННЯ НИЗЬКИХ ГРАДАЦІЙ ТА МОЖЛИВОСТІ ТЕРАПЕВТИЧНОГО ВПЛИВУ
А.С. Козлюк, В.С. Присяжна, І.В. Гончарук
ДУ «Національний науковий центр «Інститут кардіології ім. М.Д. Стражеска» НАМН України», Київ
Мета: у клінічних та експериментальних умовах визначити наявність і характер залежності між інтенсивністю системного запалення та метаболічними порушеннями і встановити ефективність застосування препарату системної ензимної терапії (СЕТ) на вираженість компонентів метаболічного синдрому.
Методи дослідження. Експериментальний фрагмент дослідження проведено на 40 кролях, що знаходились на високоліпідній дієті протягом 8 тиж. 20 кролів на стандартній дієті становили контрольну групу. Препарат СЕТ застосовували у двох режимах: 10 кролям він призначався з метою профілактики з 1-го дня перебування на дієті в дозі, відповідній до стандартної терапевтичної дози у людини, 10 кролів входило в групу лікування та отримували терапію з 5-го тижня перебування на високоліпідній дієті. Через 2; 4; 6 та 8 тиж визначали показники інтенсивності системного запального процесу (СРП, активність моноцитів (МЦ)), концентрацію циркулюючих імунних комплексів (ЦІК), вміст у ЦІК холестерину (ХС) і тригліцеридів (ТГ). Досліджували показники вуглеводного (вміст глюкози та глікозильованого гемоглобіну (HbA1c)) та стандартні показники ліпідного обміну. Клінічний фрагмент виконано на 33 пацієнтах з остеоартрозом (ОА) у стадії ремісії, які були розподілені на дві групи: 1-ша група — 18 пацієнтів, що протягом 3 міс отримували препарат СЕТ (Вобензим), пацієнти 2-ї групи (контрольної) не отримували СЕТ. Визначали інтенсивність системного запалення (вміст СРП, концентрацію ЦІК, вміст у ЦІК ХС і ТГ, показники метаболічного статусу (вміст глюкози та HbA1c, концентрацію сечової кислоти)), загальні показники ліпідного обміну, вміст у крові апо-А-1 та апо-В.
Результати. Перебування кролів на високоліпідній дієті супроводжувалося розвитком комплексу біохімічних порушень, що відповідали критеріям МС. Через 2 тиж спостерігалося 4-кратне зростання концентрації СРП та активності МЦ з подальшим їх зростанням через 8 тиж у 18 та 5 разів відповідно. Паралельно відзначено розвиток та прогресування метаболічних розладів: вміст глюкози у кінці 8-го тижня зріс на 90%, HbA1c — в 3,7 раза. Порушення ліпідного обміну проявлялися підвищенням рівня ТГ у 3,4 раза, зниженням концентрації ліпопротеїнів високої щільності на 41%. Це поєднувалося з більш вираженими якісними змінами обміну ліпідів і ліпопротеїнів крові та набуття ними антигенних властивостей, що проявлялося підвищенням концентрації в ЦІК ХС (у 4,5 раза) та ТГ (у 5,6 раза). Парний кореляційний аналіз свідчив про наявність прямого зв’язку між рівнем СРП та концентрацією ТГ у ЦІК (r=0,9), активністю МЦ (r=0,86), вмістом у крові HbA1c (r=0,73) та глюкози (r=0,6).
Застосування препарату СЕТ як в профілактичному, так і в лікувальному режимах характеризувалося вираженим протекторним впливом. При застосуванні терапії СЕТ з 1-го дня перебування на високоліпідній дієті вже на 4-му тижні спостерігалося незначне зменшення приросту СРП та зниження активності МЦ на 48%, зниження приросту СРП у 4 рази і активності МЦ на 57% — на 8-му тижні лікування. Пригнічення системного запалення супроводжувалося попередженням порушень глікемічного та ліпідного статусу: на 8-му тижні відзначено зниження рівня глюкози крові на 20% та HbA1c на 48% порівняно з контролем, на 50% був менший приріст концентрації ХС і ТГ та їх рівня у ЦІК на 62 і 64% відповідно. При застосуванні препарату СЕТ з 5-го тижня перебування тварин на дієті відзначалося зниження концентрації СРП майже у 3 рази в кінці 8-го тижня, зниження активності МЦ — на 40%. Як результат цих змін, на 27% зменшувався вміст у крові глюкози, на 26% — HbA1c, на 40% — ТГ, на 28% — ХС, на 36% — ХС в ЦІК та на 34% — ТГ у ЦІК.
У клінічному фрагменті дослідження практично у всіх хворих наявність системного запалення поєднувалась із ознаками метаболічних порушень, характерних для МС. Застосування препарату СЕТ супроводжувалося зниженням рівня СРП на 24% (р<0,05), тоді як у 2-й групі рівень СРП достовірно не змінився. У пацієнтів 1-ї групи спостерігалося також зменшення вмісту ЦІК на 22% (р<0,05), тоді як в контролі відзначалося його зростання на 16% (р<0,05). Рівень ХС та ТГ у ЦІК в контрольній групі знизився на 6 та 12% відповідно, тоді як в групі СЕТ ці показники були у 7 та 3,5 раза більшими відповідно (р<0,05). Спостерігалася також тенденція до нормалізації метаболічного статусу в 1-й групі зі зниженням рівня глюкози та HbA1c на 4 та 15% відповідно, тоді як у групі контролю відзначений його приріст на 4 та 7% відповідно. Незважаючи на відсутність вірогідних змін традиційних показників обміну ліпідів та ліпопротеїдів, у групі лікування відзначалося двократне підвищення концентрації апоА-1 та зниження — апо-В на 10%, в той час, як у групі контролю ці показники не змінилися.
Висновки. Отримані дані свідчать про важливу роль хронічного системного запалення в розвитку метаболічних реакцій, характерних для МС. Встановлена достатньо висока ефективність препаратів СЕТ у пригніченні системного запалення як патогенетичної основи МС та нормалізації системних метаболічних порушень, перш за все — пригнічення аутоімунних реакцій зі зниженням проатерогенного потенціалу плазми крові.
ВЛИЯНИЕ ДЛИТЕЛЬНОСТИ ЗАБОЛЕВАНИЯ НА АНГИОТЕНЗИН-АЛЬДОСТЕРОНОВУЮ СИСТЕМУ У БОЛЬНЫХ РЕВМАТОИДНЫМ АРТРИТОМ
Е.Б. Комарова1, Б.А. Ребров1, С.С. Касинец1, И.А. Целая2
1ГУ «Луганский государственный медицинский университет»
1Луганская областная клиническая больница
Данные клинических и экспериментальных исследований свидетельствуют о важной роли ренин-ангиотензин-альдостероновой системы (РААС) в патогенезе ревматоидного артрита (РА). Активация РААС способствует развитию и хронизации воспаления (активируя унифицированные сигнальные пути — NFkB), увеличивает сосудистую проницаемость и лейкоцитарную инфильтрацию, стимулирует выработку провоспалительных цитокинов, молекул адгезии и различных факторов роста. Ангиотензин II (Aнг II) регулирует синтез TNF-α, IСАМ-1, VEGF, что способствует развитию ангиогенеза, воспалительно-инфильтративных изменений, а альдостерон (ALD), стимулируя фактор роста фибробластов (FGF), играет важную роль в пролиферативных и деструктивны процессах при РА.
Цель: определить взаимосвязь между показателями Aнг II, ALD и TNF-α, IСАМ-1, VEGF, FGF у пациетнов с РА с разной длительностью заболевания.
Методы исследования. Стандартные клинико-лабораторные исследования проведены у 162 больных с верифицированным диагнозом РА без сопутствующей патологии сердечно-сосудистой и мочевыводящей системы. С помощью иммуноферментного метода ELISA были определены уровни Aнг II, ALD и FGF («BCM Diagnostic», Канада), ICAM-1 («Diaclone», Франция), VEGF и TNF-α («Вектор-Бест», Россия). Средний возраст пациентов был 42,96 года (от 26 до 61 года), женщины составили 85%. Все обследованные были распределены в группы по длительности РА: в 1-ю группу вошли пациенты с длительностью от 2 до 23 мес (34%), во 2-ю — от 2 до 5 лет (32,5%), в 3-ю — ≥6 лет (33,5%). Для статистической обработки использовали непараметрические методы: критерий Крускала — Уоллиса (Н) и коэффициент Спирмена (r).
Результаты. При анализе теста Крускала — Уоллиса (для оценки различий одновременно между тремя исследуемыми группами по уровню какого-либо показателя) выявлено, что максимальные показатели Aнг II (Н=21,68; р<0,001), ICAM-1 (Н=18,79; р<0,001) и VEGF (Н=6,06; р=0,048) были в группе раннего РА и затем постепенно снижались с увеличением длительности заболевания. Уровень TNF-α был максимален во 2-й группе обследованных (Н=10,42; р=0,005), но также снижался с увеличением длительности заболевания. Что касается уровней ALD (Н=78,66; р<0,001) и FGF (Н=96; р<0,001), они повышались с увеличением длительности РА.
При анализе взаимосвязей исследуемых показателей установлены прямые корреляции Анг II с TNF-α, IСАМ-1, VEGF (r=0,39; r=0,41; r=0,48; все p<0,001 соответственно) и АLD с FGF (r=0,74, p<0,001); обратные корреляции выявлены у Анг II с FGF (r=–0,19, p<0,01) и АLD с IСАМ-1, VEGF (r=–0,19, r=–0,26; p<0,01 соответственно)
Выводы. Таким образом, возможно Анг II играет важную роль в патогенезе раннего развития РА (стимуляция провоспалительных цитокинов, неоангиогенеза, эндотелиальной дисфункции, оксидативного стресса), а АLD участвует в хронизации процессов воспаления, способствует гиперплазии и пролиферации паннуса, что способствует ускорению костно-деструктивных изменений. Из вышесказанного следует, что дифференцированный подход к супрессии РААС в зависимости от длительности РА будет перспективным способом лечения в комплексной терапии РА, что требует дальнейшего исследования.
ЕЛЕКТРО- ТА ЕХОКАРДІОГРАФІЧНІ ФЕНОМЕНИ У ХВОРИХ НА АНКІЛОЗИВНИЙ СПОНДИЛОАРТРИТ
В.Є. Кондратюк1, В.О. Коржук1, О.О. Карпенко1,Т.О. Ковганич2, О.Б. Корнієнко2
1 Національний медичний університет ім. О.О. Богомольця, Київ
2 Олександрівська клінічна лікарня, Київ
Анкілозивний спондилоартрит (АС) вважається системним захворюванням сполучної тканини, яке вже в молодому віці призводить до порушення професійної діяльності та згодом до інвалідності. Більше того, відзначено більш ранній розвиток серцево-судинної патології та її ускладнень у цієї когорти пацієнтів, що зумовлює необхідність подальших досліджень як структури, так і біоелектричної активності міокарда.
Мета: дослідити особливості порушень біоелектричної активності та структури серця у хворих на АС.
Методи дослідження. Обстежено 87 хворих на АС (73 чоловіків і 14 жінок, середній вік —46,0±1,5 року), середня тривалість АС становила 17,6±1,2 року. Пацієнти з АС розподілялися за ступенем активності: 8; 45 і 47% — із мінімальною, помірною і вираженою відповідно, на думку лікаря, 5; 33 і 62% — за індексом BASDAI та 0; 15 і 85% — за індексом ASDAS (швидкість осідання еритроцитів). Центральна та периферійна форма визначались у 66,7 і 33,3% пацієнтів відповідно, при цьому HLA-B27-позитивних — 71%. У хворих на АС превалювали найтяжкі — III і IV рентгенологічні стадії сакроілеїту — у 45 і 28% відповідно. У обстежених переважав II ступінь функціональної недостатності суглобів — 85%. Усі хворі на АС знаходились на стандартній терапії: нестероїдні протизапальні препарати отримували 67%, базисні протизапальні: сульфасалазин, метотрексат, глюкокортикоїди перорально та локально 33; 13; 8 і 2% відповідно. Контрольну групу становили 164 особи без кардіоваскулярної патології (66 чоловіків і 98 жінок, середній вік —45,3±1,2 року). Проводили вимірювання артеріального тиску (АТ), електрокардіографію (ЕКГ), ехокардіографію (ехоКГ) і статистичний аналіз даних.
Результати. АТ у порівнюваних груп був зіставним. За даними ЕКГ, у хворих на АС порівняно зі здоровими особами гіпертрофія лівого шлуночка (ГЛШ) виявляється частіше, ніж у здорових (відповідно 35% проти 7%; р<0,01). Аналіз хроноторопної функції серця показав, що у пацієнтів з АС порівняно зі здоровими частота серцевих скорочень (ЧСС) була більшою (відповідно 70,4±1,5 проти 64,0±0,7 уд./хв; р<0,05), зумовлюючи в них гірший прогноз щодо розвитку серцево-судинних захворювань та смертності з підвищенням ЧСС у спокої. Дослідження дромотропної функції серця виявило, що у пацієнтів з АС порівняно з контролем частіше реєструються: блокада лівої та правої ніжки пучка Гіса та атріовентрикулярна блокада I ступеня (12,6; 8,1 та 4,6% проти 4,3; 1,2 та 0%; усі р<0,05). Синдром ранньої реполяризації шлуночків (кардіальний маркер сполучнотканинної дисплазії) у хворих на АС реєструвався частіше, ніж у здорових осіб (відповідно 28,7% проти 4,3%; р<0,01), що є несприятливим внаслідок частої асоціації його з надшлуночковими порушеннями ритму. У пацієнтів з АС порівняно з контролем ЕКГ-феномени поєднувалися з більш частим виявленням малих аномалій розвитку сполучної тканини (за даними ехоКГ): додаткових хорд та пролапсу мітрального клапана (відповідно 31 і 27,6% проти 3,1 і 6,1%; обидва р<0,01). Це можна пояснити не тільки генетичною детермінованістю щодо розвитку сполучної тканини, а впливом хронічного запалення. Підтвердженням цього може бути більш висока частота виявлення сепарації листків перикарда у хворих на АС порівняно з контролем (відповідно 23% проти 1%; р<0,01) та вищий індекс BASDAI у пацієнтів із наявністю цього феномену та без нього (відповідно 5,1±1,0 проти 3,2±0,9; р<0,05).
Висновки. Ураження серця при АС характеризується частим поєднанням порушень хронотропної та дромотропної функції з наявністю малих аномалій серця, змінами в перикарді, що асоціюється з високою активністю захворювання та потребує більш активної протизапальної терапії.
ОСОБЛИВОСТІ СТРУКТУРНО-ФУНКЦІОНАЛЬНОГО СТАНУ СЕРЦЯ У ХВОРИХ НА АНКІЛОЗИВНИЙ СПОНДИЛОАРТРИТ
В.Є. Кондратюк1, С.Х. Тер-Вартаньян2, Н.В. Шебеко2, Л.Г. Карпович1
1 Національний медичний університет ім. О.О. Богомольця, Київ
2 Олександрівська клінічна лікарня, Київ
Анкілозивний спондилоартрит (АС) розглядається як системне хронічне захворювання сполучної тканини з переважним ураженням зв’язок хребта, периферичних та осьових суглобів. Разом з тим патологічні зрушення відзначаються також з боку внутрішніх органів, насамперед у серці та аорті, що робить актуальним подальше дослідження морфофункціональної перебудови серця у цієї категорії пацієнтів.
Мета: вивчити особливості морфофункціонального стану серця у хворих на АС.
Методи дослідження. Обстежено 87 хворих на АС (73 чоловіки і 14 жінок, середній вік — 46,0±1,5 років), у яких середня тривалість АС становила 17,6±1,2 року. Пацієнти з АС розділялися за ступенем активності: 8; 45 і 47% — із мінімальною, помірною і вираженою відповідно. Усі хворі на АС знаходились на стандартній терапії. Контрольну групу становили 164 особи без кардіоваскулярної патології (66 чоловіків і 98 жінок, середній вік — 45,3±1,2 року). Проводили вимірювання артеріального тиску (АТ) і ехокардіографію (ехоКГ).
Результати. За рівнями систолічного, діастолічного і пульсового АТ порівнювані групи були зіставні. За даними ехоКГ, у хворих на АС порівняно зі здоровими особами гіпертрофія лівого шлуночка (ГЛШ) виявляється частіше, ніж у здорових (відповідно 41% проти 21%; р<0,01). Аналізуючи структуру серця у пацієнтів з АС порівняно з контролем, виявлено вірогідне збільшення діаметра лівого передсердя (відповідно 3,97±0,05 проти 3,62±0,03 см; р<0,05) за відсутності розбіжностей у величині кінцево-діастолічного об’єму ЛШ (відповідно 117,1±2,3 та 116,6±1,8 мл). У хворих на АС порівняно зі здоровими збільшена товщина міжшлуночкової перетинки і задньої стінки ЛШ (відповідно 1,06±0,0 і 1,06±0,02 см проти 0,92±0,01 і 0,84±0,01 см; обидва р<0,001). Це пояснювало достовірне підвищення індексу маси міокарда ЛШ у пацієнтів з АС порівняно з контрольною групою (відповідно 128,4±4,0 проти 100,0±1,9 г/м2; р<0,01). Аналіз показника глобальної скоротної здатності серця — фракції викиду ЛШ — показав, що його величина у пацієнтів з АС була менше, ніж у здорових осіб (відповідно 61,6±0,55 проти 66,1±0,41 ум. од.; р<0,001) хоча і знаходиться в межах норми. Про наявність передумов до порушення діастолічної функції ЛШ у хворих на АС свідчить менше, ніж у здорових, значення співвідношення швидкостей раннього та пізнього діастолічного наповнення (відповідно 1,01±0,05 проти 1,34±0,03 ум. од.; р<0,001).
Аналізуючи клапанний апарат серця, виявлено, що, на відміну від здорових осіб, у хворих на АС часто реєструється зворотний кровоплин (від мінімального до вираженого) на аортальному (що в нормі не може бути), мітральному та найбільше тристулковому клапанах (відповідно 63,2; 83,9 і 88,5%). Останній факт заслуговує на увагу, оскільки не встановлено достовірних розбіжностей між хворими на АС та здоровими особами у діастолічних розмірах правого шлуночка (відповідно 2,07±0,05 проти 2,09±0,03 см), аорти (відповідно 3,23±0,04 проти 3,17±0,02 см) і може свідчити про залучення до патологічного процесу ендокарда, хордального апарата та самих стулок клапанів. З одного боку, такі особливості сполучної тканини можуть бути детерміновані генетично, з іншого, тривалістю АС та його активністю.
Висновки. Для хворих на АС притаманне ураження серця, що проявляється підвищенням частоти виявлення ГЛШ за рахунок потовщення міжшлуночкової перегородки та його задньої стінки, збільшенням лівого передсердя на тлі виявлення передумов для діастолічної дисфункції міокарда. У пацієнтів з АС структурно-функціональні зміни міокарда асоціювалися з ураженням клапанів серця: відзначалася висока частота виявлення аортальної, мітральної та більшою мірою трикуспідальної недостатності, що можна пояснити як генетичними передумовами, так і тривалістю та активністю системного запалення.
ОЦІНКА ВИРАЖЕНОСТІ БОЛЬОВОГО СИНДРОМУ, ФУНКЦІОНАЛЬНОЇ АКТИВНОСТІ ТА ЯКОСТІ ЖИТТЯ У ЖІНОК ІЗ ГОНАРТРОЗОМ ЗАЛЕЖНО ВІД ПОКАЗНИКІВ СТРУКТУРНО-ФУНКЦІОНАЛЬНОГО СТАНУ КІСТКОВОЇ ТКАНИНИ
С.П. Крочак, А.А. Ткачук, Н.В. Григор’єва, В.В. Поворознюк
ДУ «Інститут геронтології ім. Д.Ф. Чеботарьова НАМН України», Київ
Мета: оцінити показники больового синдрому в колінних суглобах, функціональної активності та якості життя у хворих з остеоартрозом колінних суглобів залежно від структурно-функціонального стану кісткової тканини.
Методи дослідження. Нами обстежено 180 жінок у постменопаузальний період віком 50–79 років з остеоартозом колінних суглобів ІІ–ІІІ ст., поділених на вікові групи 50–59 років, 60–69 років та 70–79 років. Діагноз остеоартрозу встановлювали за критеріями Американської асоціації ревматологів (1995), стадію — за класифікацією Кеllgren — Lawrence, параметри больового синдрому в колінних суглобах та показники функціональної активності оцінювали за даними візуально-аналогової шкали, індексу Лекена, статичного балансування та 15-метрового тесту; показники якості життя — за шкалою Euro-Qol-5D. Стан кісткової тканини визначали за допомогою двохенергетичної рентгенівської денситометрії («Prodigy» (GE Medical systems, Lunar, model 8743, 2005)). Для аналізу показників було виділено такі групи: 1-ша — хворі з остеопорозом, 2-га — пацієнтки з остеопенією та нормальними показниками кісткової тканини.
Результати. У хворих з остеопорозом у віковій групі 60–69 років виявлено достовірно вищі показники больового синдрому в колінних суглобах та гірші показники функціональної активності порівняно з показниками жінок з остеопенією та нормальною кістковою тканиною. Так, показники стартового болю становили відповідно 4,1±0,8 та 2,5±0,2 бала (F=5,83; р=0,02), болю при тривалій ходьбі — 3,2±1,2 та 2,3±0,2 бала (F=5,75; р=0,018), болю при ходьбі по сходах — 5,9±1,1 та 3,7±0,3 бала (F=5,23; р=0,024), індекс Лекена відповідно — 13,9±1,4 та 11,2±0,4 бала (F=3,07; р=0,05). Подібних відмінностей у вікових групах 50–59 і 70–79 років не встановлено. Крім того, у всіх вікових групах не виявлено достовірних відмінностей між показниками статичного балансування, 15-метрового тесту та якості життя у пацієнток з гонартрозом залежно від стану кісткової тканини.
Висновки. Структурно-функціональний стан кісткової тканини у жінок віком 60–69 років з гонартрозом ІІ–ІІІ ст. достовірно впливає на показники больового синдрому та функціональної активності. Посилення больового синдрому та обмеження функціональної активності на тлі остеоартрозу та остеопорозу слід враховувати при лікуванні цих пацієнтів.
ЗНАЧЕННЯ ШКАЛИ CHA2DS2-VASc ПРИ ХРОНІЧНІЙ РЕВМАТИЧНІЙ ХВОРОБІ СЕРЦЯ
А.П. Кузьміна, Т.В. Хакімова
ДЗ «Дніпропетровська медична академія», Кривий Ріг
В Українi спостерігається збiльшення медико-соцiального навантаження на суспiльство наслідків хронічної ревматичної хвороби серця (ХРХС), ускладнення якої є причинами передчасної летальності (Ілляш М.Г., 2005). У світі майже 15,6 млн осіб мають ХРХС, причому щороку реєструється 470 тис. випадків гострої ревматичної лихоманки (ГРЛ) і 233 тис. смертей, зумовлених ГРЛ і ХРХС (Carapetis J.R., 2007; Ammar H., 2009). ВООЗ і Всесвітня федерація серця фінансують проект «RHD», cпрямований на профілактику і лікування ревматичної хвороби в Беніні, Бразилії, Румунії, В’єтнамі, Вануату, на Кубі, а також у країнах Тихого океану та Африки. Для контролю захворюваності на ХРХС у світі створено суспільний ресурс World Heart Federation, на якому представлена інформація як для лікаря, так і для пацієнта щодо діагностики і лікування цієї хвороби.
Мета: визначити практичну значимість шкали ризику негативних системних тромбоемболічних подій CHA2DS2-VASc у пацієнтів із ХРХС.
Методи дослідження. Під спостереженням перебували 82 пацієнти з ХРХС віком від 27 до 63 років, тривалість набутої вади серця становила в середньому 18,1±1,45 року. Оцiнювали цінність шкали ризику негативних системних тромбоемболічних подій за шкалою CHA2DS2-VASc (модифікована Бірмінгемська схема, 2009). Сума балів за шкалою CHA2DS2-VASc становила частку ризику тромбоемболічних ускладнень.
Результати. Серед 82 пацієнтів з ХРХС, які перебували під спостереженням, у 19 (з прогресуючим фіброзом клапанів серця) визначено високі рівні про- та протизапальних цитокінів (TNF (124,67±21,30 пг/мл), IL-4 — 182,12±29,25 пг/мл, IL-8 — 82,45±25,16 пг/мл та IL-10 — 140,33±22,09 пг/мл). Саме це підтверджує гіпотезу P. Copra та співавторів (2007) щодо ролі про- та протизапальних цитокінів у прогресуванні фіброзу клапанів серця внаслідок їх ревматичного запалення.
Визначено, що значення шкали тромбоемболічних подій CHA2DS2-VASc позитивно корелює з віком — (r=0,171; р<0,001), класом NYHA (r=0,290; р=0,001), наявністю фібриляції передсердь (r=0,149; р<0,01). В окремих випадках зростання значення за шкалою CHA2DS2-VASc корелювало зi зниженням фракцiї викиду лiвого шлуночка та зростанням передньозаднього розмiру лівого передсердя (р<0,05).
Застосування шкали CHA2DS2-VASc надає можливість розширення профілактичних і лікувальних заходів, у тому числі і у пацієнтів із ХРХС. У осіб із ХРХС без ураження клапанів серця, але ускладненою фібриляцією передсердь, профілактика тромбоемболічних ускладнень залежить від суми балів за шкалою CHA2DS2-VASс. Вже при сумі балів за шкалою CHA2DS2-VASс — ≥2 призначаються пероральні антикоагулянти з урахуванням значення шкали ризику кровотеч за шкалою HAS-BLED.
Висновки. Таким чином, у пацієнтів із ХРХС набуває чинності шкала CHA2DS2-VASc, яка з великою ймовірністю оцінює ризик негативних системних тромбоемболічних подій. Потужність шкали CHA2DS2-VASc дозволяє перевести частину пацієнтів із групи проміжного ризику в групу високого ризику та своєчасно призначити адекватну коригувальну терапію антикоагулянтами.
КЛІНІЧНА СХОЖІСТЬ СИМПТОМІВ СИСТЕМНИХ ВАСКУЛІТІВ
ПРИ РІЗНОМУ ПОХОДЖЕННІ
А.П. Кузьміна
ДЗ «Дніпропетровська медична академія», Кривий Ріг
Васкуліт — незалежно від того, яким чином він розвивається, викликає пошкодження судинної стінки. Серед класичних причин системного васкуліту є вплив імунних комплексів (ІК), а також виявлена останнім часом провідна роль нейтрофілів, активованих антитілами проти цитоплазматичних антигенів (АНЦА), так званого феномена — АНЦА. Незалежно від причини, васкуліт завершається запаленням, порушенням функції дрібних судин і клінічно ідентичною картиною. АНЦА можуть активувати TNF-премійовані нейтрофіли, викликаючи дегрануляцію, продукцію реактивних окиснених метаболітів, секрецію прозапальних цитокінів (Насонов Е.Л., 2000). Поєднана інкубація АНЦА-активованих нейтрофілів і ендотеліальних клітин приводить до лізису ендотеліоцитів.
Мета: визначити клінічну схожість симптомів ураження шкіри при різному походженні васкуліту.
Методи дослідження. Під спостереженням перебували пацієнти з типовими імунокомплексними васкулітами: кріоглобулінемічним (КГВ — 92 пацієнти), АНЦА-асоційованим (39). Пацієнти не відрізнялися статистично за віком, початком хвороби, зв’язком із перенесеними інфекціями, втратою маси тіла, лихоманкою, проявами з боку системи органів дихання, суглобів, м’язів, периферичної нервової системи. Визначали кріоглобуліни, АНЦА та в окремих випадках (16) з тяжким перебігом васкуліту — фактор некрозу пухлини (TNF), інтерлейкін (ІL-6), антиендотеліальні антитіла (АЕТА).
Результати. Ознаки ураження слизової оболонки верхніх дихальних шляхів відзначали майже у 69% (у тому числі виразки слизової оболонки — у 28%) пацієнтів із КГВ та у майже 10% хворих з АНЦА-асоційованим. Без статистичної різниці виявили характерні для васкуліту ураження шкіри — симптоми: пурпура, що пальпується, еритема, сітчасте ліведо, поверхневі некрози, вогнища атрофії епідермісу з депігментацією, ерозії, рубці, глибокі виразки шкіри, панікуліти, фолікуліти, вогнища запальної пігментації. Симптоми з боку шкіри були специфічні й віддзеркалювали розлади мікроциркуляції. Серед 16 пацієнтів визначався підвищений рівень TNF (в 1,5–2 рази), ІL-6. За даними аналізу гістологічного дослідження, у 50% випадків із КГВ та 7% з АНЦА-асоційованим васкулітом визначено запалення судин з лейкоклазією. Запалення дрібних судин у середніх відділах дерми на рівні придатків шкіри спостерігали в усіх пацієнтів із КГВ та у 43% — з АНЦА-асоційованим васкулітом. Запалення дрібних судин у ділянці від дерми в підшкірну клітковину при васкуліті, опосередкованому ІК спостерігали у більшості хворих (91%), тоді як при АНЦА-позитивному васкуліті — лише у 14%. Симптоми васкуліту не є винятково специфічними і лише віддзеркалюють розлади мікроциркуляції. Не виключено, що саме АЕТА посилюють визволення ІL-6 із ендотеліоцитів, беручи участь у патогенезі запалення (Насонов Е.Л., 1999). Тим самим пояснюється велика різниця в участі судин у переході дерми в підшкірну клітковину.
Висновки. Таким чином, незважаючи на те що за патогенезом КГВ і АНЦА-асоційований васкуліт різного походження, у клінічному та гістоморфологічному плані вони мають низку спільних проявів. Можливо, це тому, що кріоглобуліни і АНЦА — одного джерела походження (В-лімфоцитів).
МОЖЛИВІ ХАРАКТЕРИСТИКИ ЛЮПУС-ВАСКУЛІТУ
А.П. Кузьміна
ДЗ «Дніпропетровська медична академія», Кривий Ріг
Ізольоване чи поширюване судинне ураження є невід’ємною частиною системного червоного вовчака (СЧВ), включаючи судини усіх калібрів (переважно дрібних судин). Запальний процес судин відбувається у 56% хворих на СЧВ, в той час венооклюзія за рахунок антифосфоліпідного синдрому сягає 15% (Насонов Е.Л., 2005). Системне запалення судин морфологічно та патогенетично різне, а саме незапальна (некротична) люпус-васкулопатія, запальний васкуліт (дрібні й великі судини), тромботичні (мікро-) ангіопатії та дегенеративні. Функціональна і фенотипова неоднорідність ендотелію судин є основною мішенню травматизації, диктує різні типи уражень судин у різних органах, варіабельність клінічних проявів, прогнозу і терапії.
Мета: визначити особливості ознак васкуліту у хворих на СЧВ.
Методи дослідження. Під спостереженням перебували 72 пацієнти на СЧВ. Оцінку клінічної активності проводили згідно з індексом SLEDAI (Systemic Lupus Erythematosus Disease Activity Index), SLEDAI-K2 (Насонов Е.Л., 2007). Застосовували індекс пошкодження SLICC/ACR DАМАGЕ INDЕХ (Насонов Е.Л., 2007). Певний васкуліт встановлено гістологічно і/або артеріографії у 9 хворих, у останніх ймовірний був діагностований клінічно з урахуванням характерних шкірних виразок.
Результати. Шкірні виразки були основними клінічними проявами васкуліту у майже половини (34) пацієнтів. Порівняно із хворими на СЧВ без васкулітних проявів визначалася більш висока поширеність сітчастого ліведо (р=0,01), більш висока активність (ECLAM-оцінка) (р<0,05), а також більш висока частота анемії (р<0,01), швидкість осідання еритроцитів (ШОЕ) >50 мм/год (<0,05) і анти-La/SS-B-антитіл (р=0,01). Індекси активності за SLEDAI і SLEDAIК2 (від 5–9 балів) спостерігали у ⅓ хворих; а індексом SLICC/ACR (1–2 бали) — майже у половини. У хворих визначалися виразки та ішемічне ураження шкіри (р<0,01). Індекс пошкодження SLICC/ACR у хворих із кріоглобулінемією (КГЕ) достовірно не відрізнявся від групи без КГЕ, однак у майже 20% індекс становив >3 балів, чого не спостерігалося у групі без КГЕ; достовірно вищий індекс пошкодження відзначався при високій КГЕ (II типу) (2,4±0,1; р<0,05), достовірно менший — при сумнівній КГЕ (1,06±0,04; р<0,05). Встановлено взаємозв’язок КГЕ і антифосфоліпідних антитіл, що свідчить про можливе одночасне судинне ураження у хворих на СЧВ.
Висновки. Таким чином, незважаючи на достовірно меншу давність захворювання, достовірно більш часте ураження органів і тканин за індексом SLICC/ACR зазначалося у групі з КГЕ, що співпадало з більш високою активністю гострого початку хвороби. Дані ураження шкіри дещо частіше відзначалися при високому (II типі) і середньому (III типі) вмісті кріоглобулінів. Вважають, що КГЕ при СЧВ супроводжується відкладенням у шкірі імунних комплексів, що містять кріоглобуліни, і це, в поєднанні з іншими патогенетичними механізмами, може призвести до розвитку васкуліту шкіри (De Araujo T.S., 2001), що раніше також було описано при СЧВ (Баранаускайте А.А., 1991). Показано, що наявність антитіл до ДНК у поєднанні з кріопреципітатом, відповідає більш тяжким проявам з боку шкіри.
ПОРАЖЕНИЕ ОРГАНОВ-МИШЕНЕЙ У ПАЦИЕНТОВ С ГИПЕРТОНИЧЕСКОЙ БОЛЕЗНЬЮ И ИХ ДИНАМИКА ПОД ВЛИЯНИЕМ ФОЗИНОПРИЛА С ГИДРОХЛОРОТИАЗИДОМ
Е.Г. Купчинская, И.В. Лизогуб, О.А. Волошина
ДУ «ННЦ «Институт кардиологии им. Н.Д. Стражеско» НАМН Украины», Киев
Национальный медицинский университет им. А.А. Богомольца, Киев
Цель: изучить взаимосвязь между гипертензивным поражением сонных артерий и сердца и влияние длительного применения комбинации фозиноприла (Ф) с гидрохлоротиазидом (Г) на структурно-функциональное состояние миокарда у лиц с гипертонической болезнью (ГБ) с учетом поражения сонных артерий.
Методы исследования. В исследование включили 45 больных ГБ II стадии, с мягкой и умеренной артериальной гипертензией (мужчин 28, женщин 17) в возрасте от 30 до 45 лет, без клинических признаков ишемической болезни сердца и сахарного диабета. У 19 из них толщина комплекса интима-медиа сонных артерий (ТКИМ) была <0,9 мм (1-я группа), у 26 — составляла ≥0,9 мм (2-я группа). Комплексное обследование (суточное мониторирование АД, допплерографию сонных артерий, эхокардиографию по общепринятым методикам) проводили до начала лечения и через 6–7 мес приема фозиноприла (10–20 мг/сут) и гидрохлоротиазида (12,5 мг/сут).
В общей группе пациентов выявили корреляционную связь между ТКИМ и индексом массы миокарда левого желудочка (ИММЛЖ), толщиной его задней стенки и межжелудочковой перегородки (соответственно r=0,41; r=0,49; r=0,54; р<0,01 во всех случаях), но не с размером полости ЛЖ. В общей группе обследованных нами также выявлена положительная корреляционная связь между ТКИМ и среднесуточными значениями систолического артериального давления (САД) (r=0,68; р<0,001), его среднесуточной вариабельностью (r=0,59; р<0,001). Исходно 2-я группа больных (с утолщенным КИМ) характеризовалась более тяжелым течением заболевания — достоверно большими среднегрупповыми значениями САД и диастолического АД (ДАД), их вариабельности во все периоды суток, скоростью утреннего прироста АД (СУП) и меньшим суточным индексом (р<0,05 — во всех случаях по сравнению с 1-й группой). У больных этой группы более выраженным (во всех случаях р<0,05) оказалось и гипертензивное поражение сердца — чаще отмечалась гипертрофия левого желудочка (ГЛЖ) — достоверно большими были толщина стенок ЛЖ, размер левого предсердия. Показатели насосной функции ЛЖ между группами достоверно не различались.
Лечение способствовало значимому снижению САД и ДАД во все периоды суток (р<0,001), уменьшению СУП (р<0,01 в 1-й группе и р<0,001 — во 2-й группе), а также нормализации суточного индекса САД и ДАД у большинства пациентов (от 63,2 до 89,5% обследованных в 1-й группе и от 42,3 до 88,5% обследованных — во 2-й группе). Целевого уровня АД по данным офисного измерения удалось достичь у 63,1% больных 1-й группы и у 57,6% — 2-й группы, по данным суточного мониторирования АД — соответственно у 78,9 и 80,8%. Длительный прием Ф + Г способствовал уменьшению ИММЛЖ в обеих группах (со 134,7±10,1 до 116,1±9,9 г/м2; р<0,05 — в 1-й группе, со 165,3±10,3 до 138,7±7,0 г/м2; р<0,01 — во 2-й группе) как за счет уменьшения толщины стенок ЛЖ, так и вследствие некоторого уменьшения его полости. Комбинированная терапия также способствовала достоверному (р<0,05) уменьшению размеров левого предсердия, что может косвенно свидетельствовать об улучшении диастолической функции ЛЖ. Фракция выброса достоверно не изменилась ни в одной из обследованных групп (следует отметить, что исходно систолическая функция ЛЖ была сохранена в обеих группах). Толщина КИМ под влиянием длительного лечения в 1-й группе достоверно не изменилась, а во 2-й группе уменьшилась (р<0,05). Причем это сопровождалось снижением индекса резистентности сонных артерий (р<0,05). Все обследованные отмечали существенное улучшение самочувствия. У одного пациента к концу исследования появился сухой кашель.
Выводы. Таким образом, у лиц с ГБ утолщение КИМ ассоциируется с утолщением стенок ЛЖ и повышением ИММЛЖ, а также со среднесуточными значениями САД и его вариабельностью. Длительное (6–7-месячное) применение Ф + Г способствует достижению целевых значений АД у >75% пациентов (по данным суточного мониторирования АД), значительному улучшению суточного профиля АД, регрессии ГЛЖ, уменьшению толщины КИМ при ее исходном утолщении.
ПОРУШЕННЯ ФЕРОКІНЕТИКИ У ПАЦІЄНТІВ ІЗ СИСТЕМНИМ ЧЕРВОНИМ ВОВЧАКОМ, ЗВ’ЯЗОК З АКТИВНІСТЮ ЗАХВОРЮВАННЯ
І.В. Куриленко, С.В. Шевчук, О.В. Шевчук
Науково-дослідний інститут реабілітації інвалідів Вінницького національного медичного університету ім. М.І. Пирогова, Вінниця
Розвиток анемічного синдрому у хворих на системний червоний вовчак (СЧВ) є одним з найбільш поширених ускладнень, частота якого сягає за даними епідеміологічних досліджень 50–75%. Серед провідних патогенетичних механізмів розвитку анемії при СЧВ є порушення обміну заліза.
Мета: оцінити показники ферокінетики у хворих на СЧВ з різними варіантами анемічного синдрому та визначити їх зв’язок з активністю запального процесу.
Методи дослідження. Відповідно до мети дослідження нами було обстежено 127 хворих на СЧВ з анемією, серед них 50 осіб (39,4%) з анемією хронічного захворювання (АХЗ), 27 (21,3%) — з поєднанням АХЗ з дефіцитом заліза, 25 (19,7%) — з залізодефіцитною анемією (ЗДА), решта 25 (19,6%) — хворі з автоімунною гемолітичною анемією та анемією, зумовленою нирковою недостатністю. Всім хворим проводилось визначення загальної залізозв’язуючої здатності плазми крові (ЗЗЗП), рівня сироваткового заліза, коефіцієнту насичення трансферину залізом (КНТЗ), феритину (Фн), рівнів розчинних рецепторів до трансферину (рРтф) та значення рРтф/logФн. Активність запального процесу оцінювалась за індексом SLEDAI, рівнем ШОЕ, вмістом СРБ, прозапальних цитокінів (ІЛ-1β, ІЛ-6, ФНП-α), визначався індекс ушкодження внутрішніх органів.
Результати. Встановлено, що найбільші відмінності серед показників ферокінетики стосувались ЗЗЗП: ЗДА характеризувалась найвищою ЗЗЗП (71,5±2,20 мкмоль/л), що було на 24,9% вищим відносно такої при АХЗ. У хворих з АХЗ вміст заліза був достовірно вищим на 21,6% порівняно з ЗДА (8,62±0,20 мкмоль/л). Найнижче значення КНТЗ виявлено у хворих із ЗДА (12,4±0,62%), тоді як при АХЗ він становив 20,6±0,28%. Рівень Фн був достовірно найвищим у осіб з АХЗ та становив 120,0±10,9 мкг/л проти 20,8±3,27 мкг/л при ЗДА (різниця у групах достовірна; р<0,05). Найвищий вміст рРтф та співвідношення rTF/logFer реєстрували у хворих на ЗДА — 7,98±0,10 мг/л та 6,97±0,32 відповідно, проти 3,66±0,04 мг/л та 1,86±0,04 при АХЗ. Тобто ЗДА характеризувалася найвищими ЗЗЗП крові, рРтф, значенням рРтф/logФн та найнижчими КНТЗ, сироватковим залізом, феритином. Хворі з АХЗ в поєднанні з дефіцитом заліза за цими показниками займали проміжні позиції між пацієнтами з ЗДА та АХЗ. Аналіз показав, що показники обміну заліза у хворих на СЧВ слабко асоціювалися з тяжкістю органних уражень та активністю запального процесу, свідченням чому було виникнення слабкої сили негативних кореляційних зв’язків (r=–0,20…–0,22) між рівнем заліза, КНТЗ, з одного боку, та індексом «ушкодження» внутрішніх органів і концентрацією ФНП-α — з іншого. Максимальної сили пряма кореляційна залежність тяжкості органних уражень та концентрації прозапальних цитокінів простежувалась з рівнем Фн (r=0,40–0,56).
Висновки. Таким чином, спрямованість змін показників ферокінетики у хворих на анемію при СЧВ суттєво залежала від етіопатогенетичного варіанту анемічного синдрому. Рівні феритину в умовах активного запального процесу більшою мірою відображають активність захворювання, ніж стан запасів заліза в організмі у хворих на СЧВ.
СИСТЕМНИЙ ЧЕРВОНИЙ ВОВЧАК ТА ФАКТОРИ РИЗИКУ, СУБКЛІНІЧНІ ПРОЯВИ АТЕРОСКЛЕРОЗУ
О.В. Курята1, О.Ю. Нода1, Т.К. Лисунець2
1Дніпропетровська державна медична академія
2КЗ «Обласна клінічна лікарня ім. І.І. Мечникова», Дніпропетровськ
Мета: оцінка взаємозв’язку між глобальними та додатковими факторами ризику та субклінічними проявами атеросклерозу у хворих на СЧВ.
Методи дослідження. Обстежено 30 пацієнтів із достовірним діагнозом СЧВ і та ІІ ступеня активності, тривалістю прийому глюкокортикоїдів не менше 1 року. Серед них було 25 жінок та 5 чоловіків віком від 30 до 59 років, середня тривалість захворювання — 85,9±8,38 міс. Контрольну групу становили 293 особи, зіставні за статтю та віком з основною групою. Усім хворим було проведене загальноклінічне обстеження, визначення рівня загального холестерину (ЗХС) і тригліцеридів (ТГ) у сироватці крові, визначення ендотелійзалежної вазодилатації (ЕЗВД) за результатами проби з реактивною гіперемією, товщини комплексу інтима-медіа (ТІМ), оцінка ризику фатальних серцево-судинних подій за шкалою SCORE, статистичні методи.
Результати. У пацієнтів із СЧВ серед традиційних факторів ризику пріоритетними були ожиріння (у 56,7% випадків), переважно за абдомінальним типом (у 70% хворих); артеріальна гіпертензія (у 67% випадків) та дисліпідемія (у 50% випадків підвищений показник ЗХС та у 10% випадків гіпертригліцеридемія). При визначенні субклінічних проявів атеросклерозу встановлено, що у 33,3% випадків була порушена реактивна гіперемія, у 53,3% хворих збільшена ТІМ. Водночас за отриманими даними кардіоваскулярний ризик у пацієнтів із СЧВ, який оцінюється за класичними факторами ризику шкали SCORE, становив у середньому 1,0±0,89%, що вважається низьким рівнем ризику. Встановлено достовірні прямі зв’язки між підвищенням ТІМ та рівнем ризику фатальних подій за шкалою SCORE при СЧВ (r=0,69; p<0,05), а також між підвищенням показника проби з реактивною гіперемією та рівнем ризику фатальних подій (r=0,71; p<0,05).
Висновки. Кардіоваскулярний ризик у пацієнтів із СЧВ, який оцінюється за класичними факторами ризику, не перевищує середьопопуляційного рівня. У пацієнтів основної групи встановлені ознаки субклінічного атеросклерозу та прямий кореляційний зв’язок між рівнем серцево-судинного ризику і показником ТІМ, реактивною гіперемією. Тому, можливо, що саме додаткові фактори відповідають за високий ризик розвитку серцево-судинних ускладнень при СЧВ, що потребує подальшого більш глибокого дослідження.
ВЛИЯНИЕ РЕМОДЕЛИРОВАНИЯ МИОКАРДА НА ПОКАЗАТЕЛИ ВАРИАБЕЛЬНОСТИ РИТМА СЕРДЦА И ДИСПЕРСИИ И ИНТЕРВАЛА Q–T ЭКГ
А.В. Легконогов, Е.А. Соколовская
ГУ « Крымский государственный медицинский университет им. С.И. Георгиевского», Симферополь
Цель: оценка изменений показателей вариабельности ритма сердца (ВРС) и дисперсии интервала Q–T ЭКГ при различных вариантах ремоделирования миокарда и связанных с ними желудочковых нарушениях ритма сердца (ЖНРС).
Методы исследования. Обследовано 239 пациентов, в том числе 95 — с ишемической болезнью сердца (ИБС) (35 с постинфарктным кардиосклерозом (ПИКС) и 60 — без инфаркта миокарда в анамнезе), 44 пациента с артериальной гипертензией (АГ), 59 — с некоронарогенными заболеваниями и поражениями миокарда (33 — с миокардиофиброзом, 16 — с дилатационной (ДКМП), 10 — с гипертрофической кардиомиопатией (ГКМП), 22 пациента с врожденными, 19 — с приобретенными пороками сердца (ППС) и 58 практически здоровых лиц.
Результаты. Снижение временных, геометрических и спектральных показателей ВРС с одновременным снижением циркадного индекса (ЦИ) частоты сердечных сокращений (ЧСС) и показателя LF/HF, характеризующего симпато-парасимпатический баланс, в большей степени было характерно для больных ДКМП, ППС, АГ и ПИКС, при которых наблюдались наиболее выраженные проявления ремоделирования миокарда и соответствующие изменения показателей структурно-функционального состояния сердца. При этом вагусно-симпатический дисбаланс усиливался по мере нарастания процессов дезадаптивного и структурно-геометрического ремоделирования миокарда. Частота выявления желудочковой экстрасистолии высоких градаций (ЖЭВГ) и неустойчивой желудочковой тахикардии (НЖТ) была непосредственно связана с дезадаптивным и структурно-геометрическим ремоделированием миокарда в виде эксцентрической гипертрофии миокарда левого желудочка (ЛЖ). У больных с ЖЭВГ и НЖТ отмечалось достоверное снижение ЦИ ЧСС и LF/HF, что свидетельствует о наличии выраженного вегетативного дисбаланса. Дезадаптивное ремоделирование миокарда сопровождалось достоверным увеличением среднего максимального значения корригированного интервала Q–Tc ЭКГ, составившего 521±12 мс против 497±4 мс у лиц без признаков ремоделирования миокарда (p<0,01). Между показателями ВРС, с одной стороны, и значениями корригированного интервала Q–Tc, с другой, установлена достоверная отрицательная корреляционная зависимость — снижение показателей ВРС сопровождалось увеличением продолжительности максимальных и минимальных интервалов Q–Tc ЭКГ. При многофакторном дискриминантном анализе установлено, что статистически значимыми факторами риска спонтанной НЖТ явились изменения показателей структурно-функционального состояния сердца, характерные для дилатации полости ЛЖ, объемной его перегрузки и дезадаптивного ремоделирования, а также нарушение процессов реполяризации, характеризующихся удлинением максимальной продолжительности интервала Q–Tc ЭКГ. С другой стороны, снижение ВРС было связано с электрической негомогенностью процессов реполяризации, структурно-геометрическим ремоделированием миокарда ЛЖ, снижением его сократительной способности.
Выводы. Таким образом, ремоделирование миокарда, сопровождающееся снижением ВРС и электрической негомогенностью процессов реполяризации, характеризуется выраженными дилатацией, объемной перегрузкой, снижением сократительной способности миокарда ЛЖ.
ВРОЖДЕННЫЕ ПОРОКИ СЕРДЦА У ВЗРОСЛЫХ: ТРУДНОСТИ ДИАГНОСТИКИ ИЛИ ЗАПОЗДАЛЫЙ ДИАГНОЗ?
А.В. Легконогов, Е.А. Сосновская, Л.Г. Легконогова
ГУ «Крымский государственный медицинский университет им. С.И. Георгиевского», Симферополь
Цель: провести анализ причин несвоевременной диагностики врожденных пороков сердца (ВПС) у взрослыхи пациентов пожилого возраста.
Методы исследования. Проведен анализ результатов 28 000 допплер-эхокардиографических исследований, выполненных пациентам в возрасте старше 25 лет.
Результаты. На впервые диагностированные в зрелом и пожилом возрасте ВПС пришлось 1,41% проведенных допплер-эхокардиографических исследований (396 пациентов), причем ВПС впервые были выявлены у 39 из 4989 обследованных пациентов в возрасте старше 60 лет, что составило 0,78%. В целом у взрослых больных ВПС чаще всего выявлялся дефект межпредсердной перегородки (ДМПП) — 171 пациент, значительно реже диагностировали дефект межжелудочковой перегородки (ДМЖП) (48 наблюдений). В 88 наблюдениях выявлен двустворчатый аортальный клапан, сопровождавшийся гемодинамически значимыми аортальным клапанным стенозом и (или) недостаточностью в более чем 40% случаев. Коарктация аорты впервые выявлена у 24 больных, в 15 случаях она сочеталась с двустворчатым аортальным клапаном. Диагноз аномалии Эбштейна (АЭ) впервые установлен у 16 пациентов. Относительно редкими находками стали открытый артериальный проток (ОАП) (14 больных), изолированный стеноз легочной артерии (11 пациентов), корригированная транспозиция магистральных сосудов (КТМС) (6), тетрада Фалло (5), врожденная аневризма синуса Вальсальвы (ВАСВ) (5 больных), врожденная аневризма восходящей аорты (4), синдром Лютембаше (2), врожденная митральная недостаточность (2), левосформированное срединнорасположенное сердце (2). У больных ВПС в возрасте старше 60 лет преобладал ДМПП (27 наблюдений), реже выявляли ДМЖП (4), КТМС (2), ВАСВ (4), ОАП (1), АЭ (1).
Своевременное выявление и затруднения в первичной диагностике ВПС у взрослых и пациентов пожилого возраста могут быть обусловлены устоявшимися диагностическими стереотипами, когда результаты клинического наблюдения и инструментального обследования трактуются в пользу проявлений ИБС, артериальной гипертензии, хронической сердечной недостаточности, приобретенных клапанных пороков сердца, реже — кардиомиопатий, переоценкой сопутствующих возрастных и вторичных структурно-функциональных изменений сердца, а также ненадлежащим или вовсе отсутствующим, в силу социально-экономических причин, врачебным контролем.
Выводы. ВПС нередко впервые диагностируют в зрелом и даже пожилом возрасте. Первичная диагностика ВПС у взрослых представляет собой неординарную и выходящую за рамки сложившихся представлений клиническую проблему.
СТРУКТУРНАЯ И ФУНКЦИОНАЛЬНАЯ ПАТОЛОГИЯ СЕРДЦА У СПОРТСМЕНОВ МОЛОДОГО ВОЗРАСТА
А.В. Легконогов, Е.А. Сосновская, Е.А. Соколовская
ГУ «Крымский государственный медицинский университет им. С.И. Георгиевского», Симферополь
Цель: оценка изменений структурно-функционального состояния сердца при занятиях спортом по данным допплер-эхокардиографии (Д-эхоКГ) с учетом электрокардиографических данных и уровня спортивной квалификации.
Методы исследования. Проведен анализ результатов обследования 298 спортсменов (229 мужчин и 59 женщин, средний возраст — 17,6±0,3 года в возрастном диапазоне 12–30 лет) с использованием Д-эхоКГ, ЭКГ в динамике, холтеровского мониторирования ЭКГ.
Результаты. Функциональные нарушения или структурная патология сердца установлены у 184 спортсменов, что составило 61,7% всех обследованных; у 114 (38,3%) атлетов патологии сердечно-сосудистой системы не выявлено. Синдром «спортивного сердца», диагностированный у 49 (16,4% обследованных) атлетов, по сравнению со здоровыми спортсменами характеризовался относительной брадикардией (ЧСС в покое 50,2±1,1 уд./мин против 65,7±1,2), увеличением размеров полости левого желудочка (ЛЖ) по данным Д-эхоКГ (конечно-диастолический размер 5,85±0,03 см против 5,00±0,04 см), относительным увеличением размеров полостей левого предсердия и правого желудочка (соответственно 3,89±0,05 см против 3,36±0,04 см и 2,41±0,05 см против 20,4±0,03 см), толщины свободной стенки ЛЖ и межжелудочковой перегородки (соответственно 0,85±0,01 см против 0,77±0,01 см и 0,89±0,02 см против 0,77±0,01 см) (различия показателей между группами достоверны при p<0,001). У пациентов со «спортивным сердцем» наблюдались разнообразные нарушения ритма (частая желудочковая и суправентрикулярная экстрасистолия соответственно в 13 и 6 наблюдениях, миграция водителя ритма — в 10) и проводимости сердца (атриовентрикулярная блокада I ст. у 7 спортсменов, II ст. — у 4, полная блокада правой ножки пучка Гиса — в 3, синдром ранней реполяризации желудочков в 5 наблюдениях). Среди 49 пациентов со «спортивным сердцем» преобладали спортсмены высокой квалификации (19 мастеров и кандидатов в мастера спорта — 38,8%), тогда как в отсутствие патологии сердца их было всего 20 из 114, что составило 17,5% (p<0,001). В остальных 135 наблюдениях диагностированы нейроциркуляторная дистония по кардиальному типу (42 пациента), миокардиофиброз (32), аномалии хордального аппарата сердца (28), пролапс передней створки митрального клапана I ст. (9), латентный и манифестирующий синдром WPW (соответственно 6 и 3 наблюдения). У 15 спортсменов впервые выявлены врожденные пороки сердца с минимальными нарушениями внутрисердечной гемодинамики, в том числе в 9 наблюдениях — незначительный стеноз легочной артерии, открытое овальное окно межпредсердной перегородки (4), двустворчатый аортальный клапан (2 пациента).
Выводы. Регулярные занятия спортом способствуют увеличению размеров полостей сердца, массы миокарда, появлению брадикардии в покое, сочетание которых принято обозначать как «спортивное сердце». Спортсмены, как правило, уделяют повышенное внимание собственному здоровью и нередко обращаются к врачу по поводу сердцебиения, головокружения, утомляемости, боли в области сердца, одышки. Если же при рутинном клинико-электрокардиографическом обследовании определяются отклонения от нормы, то, с учетом широко распространенного мнения о повышенном риске внезапной сердечной смерти среди спортсменов, появляются поводы для тревожных ожиданий. Таким образом, состояние сердечно-сосудистой системы спортсменов может варьировать в широких пределах, что требует тщательного и продуманного врачебного подхода перед окончательным заключением об отстранении спортсмена от тренировок и состязаний, тем более когда спортивная профессия дает перспективу карьерного роста и/или является источником дохода.
АДСОРБЦИОННО-РЕОЛОГИЧЕСКИЕ СВОЙСТВА БИОЛОГИЧЕСКИХ ЖИДКОСТЕЙ ПРИ АРТРИТЕ
Л.В. Лукашенко, А.К. Павлюченко, Ю.О. Брыжатая, Д.В. Толстой, О.В. Синяченко
Национальный медицинский университет им. Максима Горького, Донецк
У больных ревматоидным артритом (РА) наблюдаются выраженные нарушения адсорбционно-реологических свойств крови (АРСК), которые проявляются повышением объемной вязкости (h), интегрального угла вязкоупругости (w) и времени релаксации сыворотки крови (t) на фоне уменьшения поверхностной вязкости (m), вязкоэластичности (e), угла реальной вязкоупругости (u) и статического (равновесного) поверхностного натяжения (s), что соответственно регистрируется в 85; 41; 44; 40; 49; 46 и 41% случаев, имеет половой диморфизм изменений (h), степенью активности (поверхностная упругость — r) и серопозитивностью по ревматоидному фактору и антителам к цитруллиновому пептиду (m), тяжестью течения и темпами прогрессирования суставного синдрома (e, t), с поражением отдельных суставов, характером рентгеносонографических признаков артрита и с наличием экстраартикулярных признаков болезни, а также с отдельными маркерами костного метаболизма. Для псориатического артрита (ПА) характерно увеличение объемных вискозных характеристик сыворотки крови, что регистрируется у 96% числа больных, причем АРСК зависят от пола (m) и возраста (e, w, t) пациентов, активности патологического процесса (h, u), кожной формы псориаза (m), наличия остеокистоза (t) и остеоузур (h), а в патогенезе подхрящевого склероза определенное значение отводится состоянию межфазной активности сыворотки. При анкилозирующем спондилите (АС) наблюдается повышение показателей m, h, r, s и фазового угла тензиограмм (j), что отмечается соответственно у 43; 91; 57; 51; 50 и 37% больных, определяется существующим половым диморфизмом патологического процесса (e, j), возрастом пациентов (j), распространенностью суставного синдрома (h, j), длительностью клинической манифестации (j) и степенью активности заболевания (m, j), частотой поражения отдельных периферических суставов (m, h, r), крестцовоподвздошных сочленений (w) и позвоночника (u, t), тяжестью костносуставных повреждений (r, s, t и угол наклона тензиограмм — l), тендовагинита (s, t), энтезопатии (e) и изменений нервной системы (m, e, t, j), а в патогенезе АС участвуют поверхностные и объемные вязкие, поверхностные упругие и вязкоупругие (вязкоэластичные), поверхностные активные и релаксационные составляющие АРСК. У больных РА по сравнению с показателями сыворотки крови достоверно повышаются на 29% значения h синовиальной жидкости, на 66% — e, на 26% — s и в 4,1 раза — t, при этом интегральное состояние АРСК связано с возрастом больных, наличием кист Бейкера и лимфаденопатии, а отдельные параметры (h, m, r, s, t) зависят от степени активности заболевания, распространенности суставного синдрома, его тяжести и темпов прогрессирования, наличия интраартикулярных хондромных тел, тел Пеллагри — Штайди и Гоффа. При офтальмопатиях у больных артритом (увеит, склерит, кератит, конъюнктивит) достоверно (на 25%) повышаются показатели m слезной жидкости, на 16% — r, на 20% — e, на 43% — l, вдвое t — при уменьшении на 4% уровня s, что имеет место соответственно в 22; 44; 56; 49; 71 и 73% случаев, причем существуют корреляционные связи между отдельными физико-химическими параметрами слезы, что тесно связано с полом (t) и возрастом больных (r, s, l), с тяжестью течения суставной патологии (s при РА, m — при реактивном хламидийном артрите, e — при ПА) и склерита (e, s), определяя выраженность увеита, кератита и склерита (s), а также конъюнктивита (t). Интегральное сурфактантное состояние крови оказывает влияние на отдельные АРСК при подагрическом артрите (h, e, s, l, j), ПА (l) и АС (s, z), а те или иные физико-химические показатели имеют особенности связей с концентрациями белков и липидов у больных с разными формами воспалительных заболеваний суставов.
ОСОБЛИВОСТІ СОНОГРАФІЧНОЇ КАРТИНИ ПРИ ПОДАГРИЧНОМУ АРТРИТІ ЗАЛЕЖНО ВІД ВІКУ ТА СТАТІ ПАЦІЄНТІВ
Л.М. Михайлів, М.І. Швед, Л.В. Зоря
ДВНЗ «Тернопільський державний медичний університет ім. І.Я. Горбачевського МОЗ України», Тернопіль
Зростання поширеності подагри серед жінок та ранній дебют захворювання зумовлює труднощі ранньої діагностики суглобового синдрому у цієї категорії пацієнтів та спонукає до пошуку нових підходів до її діагностики та лікування.
Мета: дослідження артросонографічних особливостей у хворих на подагру залежно від віку та статі.
Методи дослідження. Обстежено 138 хворих із хронічним подагричним артритом віком 49–69 років, з них 102 чоловіки (73,9%) та 36 (33,4%) жінок. Група контролю — 20 здорових осіб.
Усім пацієнтам проведено повне клінічне та лабораторне обстеження. Сонографію опорно-рухового апарату здійснювали на апараті «Aloka SSD-5000» мультичастотним датчиком 7,5–13,0 МГц згідно з рекомендаціями (Backhaus M. et al., 2001; EULAR, Working Party on Imaging in Rheumatology, 2005).
Результати. Артросонографічно у пацієнтів із подагричним артритом виявляли мікрокальцинати (20,29%), подвійний контур (66,67%) та ерозії (84,06%) гіалінового хряща, синовіт без ознак посилення кровообігу (57,97%), гомогенний (10,87%) та негомогенний випіт (53,62%), тофуси різного ступеня зрілості (30,43%).
Усі виявлені ультразвукові ознаки умовно розподілили на дві групи. До 1-ї віднесли прояви запального синдрому: наявність гомогенного та негомогенного випоту, синовіт із мінімальними ознаками кровоплину в СО. До 2-ї групи сонографічних симптомів віднесли прояви метаболічних порушень — мікрокристалічні включення в м’яких тканинах та хрящах, тофуси, субхондральні ерозії.
У жінок порівняно з чоловіками достовірно частіше виявлялися метаболічні порушення, які проявлялися мікрокальцинатами та подвійним контуром гіалінового хряща (100,00 та 54,90% відповідно). Тофуси різного ступеня зрілості у жінок діагностували в 2 рази частіше, ніж у чоловіків, 63,89 та 39,22% відповідно. Прогресування з віком метаболічних зрушень артросонографічно проявляється зростанням частоти мікрокристалічних включень у вигляді подвійного контура з 60,26 до 98,33% відповідно. Кровоплин у синовіальній оболонці візуалізується у 54,36% хворих середнього віку та 100% пацієнтів похилого віку.
Висновки. За даними артросонографії, у жінок відзначають глибші порушення метаболізму, ніж у чоловіків. У чоловіків, у свою чергу, переважають ультразвукові критерії, що відображають активність запальних проявів подагричного артриту. Зі зростанням віку пацієнтів посилюються прояви порушень метаболізму, що пов’язано з більшою тривалістю захворювання та кількістю атак подагричного артриту у цієї категорії хворих.
Перспектива подальших досліджень. Виявлені закономірності та взаємозалежності сонографічних проявів подагри залежно від віку та статі пацієнтів доцільно використовувати для оцінки динаміки патологічного процесу при застосуванні диференційованих програм лікування таких хворих.
ИЗМЕНЕНИЕ МАРКЕРОВ РЕМОДЕЛИРОВАНИЯ КОСТНОЙ ТКАНИ ПРИ ОСТЕОАРТРИТЕ, СОЧЕТАННОМ С ГИПЕРТОНИЧЕСКОЙ БОЛЕЗНЬЮ, У ЖЕНЩИН В ПОСТМЕНОПАУЗАЛЬНЫЙ ПЕРИОД
Н.Б. Некрасова1, О.И. Нишкумай2
1Луганская городская многопрофильная больница № 1
2ГЗ «Луганский государственный медицинский университет»
Менопауза приводит к развитию соматической патологии, в том числе гипертонической болезни, остеоартрита, остеопороза. Несмотря на значительные успехи медицины в снижении кардиоваскулярного риска, заболевания сердечно-сосудистой системы остаются ведущей причиной смерти населения в большинстве стран. Результаты исследований последних лет указывают на наличие общих патогенетических механизмов, которые обусловливают развитие в постменопаузальный период сердечно-сосудистой патологи, остеоартрита и системного остеопороза.
Учитывая синхронность развития кардиоваскулярной патологии, в частности гипертонической болезни, остеоартрита, остеопороза у женщин в постменопаузальный период , остаются невыясненными особенности изменения структурно-функционального состояния костной ткани, а также маркеров ремоделирования костной ткани при коморбидной патологии.
Цель: изучить изменения структурно-функционального состояния костной ткани, маркеров ремоделирования при остеоартрите, сочетанном с гипертонической болезнью, у женщин в постменопаузальный период.
Методы и результаты исследования. Обследовано 26 женщин в постменопаузальный период (средний возраст — 61,1±1,2 года, длительность менопаузы 5,4±2,2 года). Все обследуемые были разделены на основную и группу сравнения. Основную группу составили 11 женщин в постменопаузальный период (средний возраст — 60,2±2,2 года, длительность менопаузы — 4,6±2,5 года) с диагностированным остеоартритом (гонартрит) ІІ рентгенстадии по классификации Kеllgren — Lawrens(1957), группу сравнения — 15 женщин в постменопаузальный период (средний возраст — 60,3±1,4 года, длительность менопаузы — 4,8±2,1 года) с диагностированным остеоартритом (гонартрит) ІІ рентгенстадии в сочетании с гипертонической болезнью ІІ стадии 2-й степени. Всем пациентам проводили определение клиренса креатинина, уровня кальция, фосфора крови, паратиреоидного гормона, ультразвуковую денситометрию с помощью аппарата «Achilles+» фирмы «Lunar» (США). Нормальное состояние костной ткани определяли при значении Т-показателя (отклонение от референтного значения пиковой костной массы здорового человека) до –1,0 SD, остеопению — от –1,0 до –2,5 SD, остеопороз — при Т<–2,5 SD. Среди маркеров формирования костной ткани определяли уровень остеокальцина и пропептидов проколлагена I типа (P1NP). Состояние резорбции отражал уровень β-изомера C-терминального телопептида коллагена I типа (β-СТх) в сыворотке крови.
Статистический анализ проведен при помощи программ «Statistica 6.0» и «Microsoft Exel».
Выводы. При изучении структурно-функционального состояния костной ткани выявлено, что уровень кальция, фосфора, остеокальцина крови, значение Т-индекса не отличались в сравниваемых группах. Отмечалось достоверное повышение уровня паратгормона, маркера формирования костной ткани пропептида проколлагена I типа (P1NP) и снижение клиренса креатинина у пациенток с сочетанной патологией (р<0,05), что указывает на ускорение темпов ремоделирования кости.
УРАЖЕННЯ НИРОК ПРИ РЕВМАТИЧНИХ ХВОРОБАХ
Т.Д. Никула, В.О. Мойсеєнко, О.А. Бичков
Національний медичний університет ім. О.О. Богомольця, Київ
Ураження нирок при ревматичних хворобах об’єднують цілу низку нозологічних форм, зокрема ураження нирок, зумовлені системним васкулітом, системними захворюваннями сполучної тканини, ревматичним артритом, ревматизмом і мієломною хворобою. Лікування хворих тривале, призначення інгібіторів ангіотензинперетворювального ферменту (ІАПФ) та сартанів пожиттєве, призначення глюкокортикоїдів та цитостатиків різко підвищує ризик ураження нирок, виникнення тубулоінтерстиціального нефриту.
Мета: розробка методик своєчасної діагностики та профілактики уражень нирок при ревматичних хворобах на підставі поглибленого імунологічного дослідження.
Методи дослідження. За даними прижиттєвих нефробіопсій гострий тубулоінтерстиціальний нефрит виявляли у 5–15 % хворих на гостру ниркову недостатність. Ураження нирок може бути пов’язане із застосуванням лікарських засобів (прийом сульфаніламідів, пеніцилінів, цефалоспоринів, фторхінолонів, протитуберкульозних засобів, діуретиків, блокаторів Н2-гістамінових рецепторів, інгібіторів Na+/K+-АТФази, нестероїдних протизапальних препаратів); асоційоване з імуноопосередкованими хворобами (найчастіше — системним червоним вовчаком, хворобою Шегрена, АНЦА-пов’язаним васкулітом, саркоїдозом; увеїтом та іриїтом). Функціональний стан нирок оцінювали за формулою GFR-ЕРI, якщо рШКФц/рШКФк-ц <60 мл/хв/1,73 м2 — дiагноз хронічної хвороби нирок є підтвердженим, при ≥60 мл/хв/1,73 м2 — дiагноз хронічної хвороби нирок не підтверджується. У нефрологічній практиці найбільш небезпечним є васкуліт дрібних судин, що часто призводить до хронічної ниркової недостатності.
Результати. Імунологічний статус засвідчив про дисбаланс у системі та зсув у бік вазоконстрикторів: ЕТ-1 (у практично здорових — 6,0±0,18 пг/мл): 14,3±0,15*/7,5±0,02** (пг/мл), у групі порівняння — 14,1±0,02*/10,7±0,01** (пг/мл); ФНП-α (у практично здорових — 26,3±1,09 пг/мл): 67,4±1,18*/55,28±1,17 (пг/мл), у групі порівняння — 67,2±1,05*/61,28±1,17 (пг/мл); ІЛ-1β (у практично здорових — 52,6±0,57 пг/мл): 87,4±1,12*/56,08±1,06** (пг/мл), у групі порівняння — 82,9±1,34*/58,05±1,21** (пг/мл). При діагностиці важливо враховувати: наявність латентного періоду від дії етіологічного чинника до розвитку синдрому гіперчутливості (еозинофілія, шкірні висипання); відсутність залежності від дози лікарського засобу, наявність перехресної чутливості до медикаментів, старт хвороби після повторного прийому лікарського засобу; ознаки участі Т-клітинних реакцій гіперчутливості і Т-клітинних цитотоксичних реакцій (у клітинних інфільтратах наявні Т-хелпери/індуктори та Т-супресори/кілери); іноді в інтерстиції знаходять плазматичні клітини, що несуть IgE та базофіли; позитивні шкірні тести на деякі ліки, наявність мононуклеарів і гранульом.
Висновки. Профілактика ураження нирок при ревматичних захворюваннях полягає у ранній діагностиці нозологічних форм із детальним і поглибленим клініко-лабораторним (включаючи імунологічне) обстеженням і регулярним диспансерним спостереженням хворих.
ОЦІНКА РІВНЯ СЕЧОВОЇ КИСЛОТИ У ХВОРИХ НА ЦУКРОВИЙ ДІАБЕТ І ТА ІІ ТИПУ ТА ЇЇ ВПЛИВ У РОЗВИТКУ ДІАБЕТИЧНОЇ АРТРОПАТІЇ
Т.Д. Никула, Ю.П. Синиця, О.М. Кармазіна
Національний медичний університет ім. О.О. Богомольця, Київ
За останні десятиліття зросла кількість досліджень, які свідчать про те, що у хворих на цукровий діабет (ЦД) поряд із класичними пізніми ускладненнями (мікро-, макроангіопатіями, нейропатіями) спостерігаються ураження суглобів. Діабетичні артропатії — це дегенеративно-дистрофічні зміни структурних елементів суглобів, які спочатку призводять до обмеження рухливості, а потім і до розвитку контрактур. і хоча, за даними зарубіжних авторів (Chammas et al.,1995; Arkkila P.E.T. et al., 2012), ураження суглобів у хворих на ЦД виявляють досить часто: у 58% хворих на ЦД І типу та у 28% хворих на ЦД ІІ типу; відомі лише фрагментарні дослідження з питань розвитку, клініки та діагностики діабетичних артропатій.
Ще декілька років тому велися дискусії, чи є ураження суглобів у хворих на ЦД наслідком основного захворювання, чи артропатії — це супутні захворювання на тлі ЦД. У літературі виділяють специфічні ускладнення ЦД: діабетичну остеоартропатію та синдром обмеження рухливості суглобів (ОРС) і ті, які не є наслідком ЦД, але у хворих із цією патологією відзначаються значно частіше, ніж у загальній популяції, до них відносять і подагру.
Мета: дослідити взаємозв’язки між показниками пуринового, вуглеводного обміну у хворих на ЦД І та ІІ типу.
Методи дослідження. Досліджено 49 хворих на ЦД, які були розподілені на дві групи. До 1-ї групи увійшли 15 хворих на ЦД І типу віком від 38 до 69 років (середній вік — 53±3,6 року) та 34 хворих на ЦД ІІ типу віком від 45 до 65 років (середній вік — 52±1,9 року). Хворі обох груп скаржилися на біль у суглобах та мали різні ступені діабетичної артропатії. Обидві групи вірогідно не відрізнялися за віком, тривалістю основного захворювання та рівня компенсації ЦД. Глікозильований гемоглобін у хворих 1-ї групи становив 8,3±1,6%, 2-ї — 8,9±1,6%%,р≥0,05. У хворих у крові визначали концентрацію сечової кислоти (СК), досліджували рівень компенсації ЦД за рівнем HbA1c. Математичну обробку отриманих результатів здійснювали за допомогою програми «Statistica 5.0» методами варіаційної статистики, враховуючи рекомендації.
Результати. Показано, що середній рівень СК у сироватці крові хворих на ЦД І типу становив 351,3±28,3, (376,7±31,5 у чоловіків і 319,1±11,7 мкмоль/л — у жінок), у хворих на ЦД ІІ типу — 486,5±29,1 мкмоль/л (491,3±21,1 у чоловіків і 437,5±26,3 мкмоль/л — відповідно у жінок), р<0,05. Таким чином, незважаючи на наявність у всіх обстежених пацієнтів із ЦД І типу артропатій, рівень СК був підвищений тільки у 2% обстежених, у решти не виходив за межі референтних значень і достовірно був нижчим, ніж у пацієнтів із ЦД ІІ типу. Підвищення концентрації СК у крові пацієнтів із ЦД спостерігалося у 78,3% усіх обстежених пацієнтів із ЦД ІІ типу і не залежало від їхнього віку. Принципову роль у підвищенні показників вмісту СК у сироватці крові відіграє тривалість захворювання на ЦД, причому статистичної достовірності при р<0,01 ці відмінності досягали при тривалості захворювання >10 років порівняно з показниками у хворих ≤5 років. Ця закономірність виявлена як у чоловіків, так і у жінок, що за наявності різних гендерних референтних меж змісту СК у крові пацієнтів може свідчити про більшу вираженість порушень обміну у чоловіків, хворих на ЦД ІІ типу.
Висновки. 1. У хворих на ЦД ІІ типу в 78,3% випадків виявлено порушення обміну СК, які проявляються підвищенням рівня урикемії в міру збільшення тривалості захворювання незалежно від віку і статі.
2. Підвищення рівня СК у хворих на ЦД ІІ типу може слугувати маркером ураження суглобів — наявності діабетичної артропатії, тоді як у пацієнтів з ЦД І типу, ускладненим артропатією, підвищення рівня СК не виявлено. Гіперурикемія має розглядатися, як фактор ризику ураження суглобів у хворих на ЦД ІІ типу, у зв’язку з чим необхідна розробка методів корекції цього стану.
ВИМІРЮВАЧ СИЛИ М’ЯЗІВ НИЖНІХ КІНЦІВОК
В.О. Новоселецький, М.А. Станіславчук
Вінницький національний медичний університет ім. М.І. Пирогова
Однією з проблем хворих на остеоартроз (ОА) колінних суглобів є гіпотрофія та втрата сили м’язів нижніх кінцівок, яка прогресивно наростає з підвищенням тяжкості захворювання, що веде до зниження якості життя і передчасної втрати працездатності. За прогнозами ВООЗ, до 2020 р. на ОА будуть хворіти 71% населення віком старше 65 років. Тому визначення сили м’язів у цієї категорії пацієнтів та підтримання її на належному рівні є актуальним ревматологічним завданням. Водночас пристрої для визначення стану м’язів та їх тренування на сьогодні відсутні.
Мета: створення пристрою для визначення сили та ізометричного тренування м’язів згиначів та розгиначів гомілки. Пристрій (рисунок) складається з нерухомої опори (1), напрямної (2), яка закріплена кронштейнами (3) з обох боків до нерухомої опори. На напрямній (2) розташований повзун (4), до якого жорстко кріпиться приєднаний електронний вимірювальний пристрій (5). Повзун (4) виконаний із можливістю вертикального переміщення вздовж напрямної (2) і оснащений фіксатором (6). Електронний вимірювальний пристрій (5) з’єднаний з дистальним кінцем гомілки (7) через гнучкий, нерозтяжний елемент (8) та хомут (9).
Методи дослідження. При визначенні сили м’язів згиначів гомілки пацієнт сідає на стілець із твердим сидінням обличчям до вимірювального пристрою, ноги зігнуті в колінних суглобах під кутом 90˚, на дистальний кінець гомілки (7) надягають хомут (9) гнучкого нерозтяжного елемента (8). Після цього регулюють положення повзуна (4) на напрямній (2), щоб гнучкий нерозтяжний елемент (8) був горизонтально відносно поверхні підлоги. Потім повзун (4) фіксують фіксатором (6). Коли виконані всі необхідні регулювання, приступають до визначення сили м’язів. У разі визначення сили розгиначів цієї групи м’язів пацієнт повертається разом зі стільцем спиною до нього. Для тренування м’язів гомілки в ізометричному режимі: інтенсивність скорочення встановлюється на рівні 50% максимального, тривалість не більше 5 с і паузою відпочинку 5 с та кількість повторів 12 разів на 3 підходи, відпочинок між підходами 2 хв.
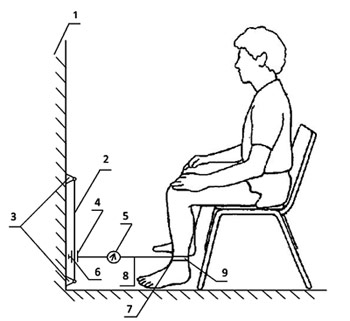
Результати. За допомогою запропонованого пристрою обстежено 7 хворих з ОА колінних суглобів. Встановлено, що у хворих на ОА колінних суглобів сила м’язів згиначів та розгиначів знижена. Так, у здорових осіб контрольної групи сила м’язів згиначів становила 13,5±0,28 кг, а сила м’язів розгиначів — 14,9±0,32 кг, а у хворих на ОА колінних суглобів цей показник становив: сила м’язів згиначів 4,8±0,27 кг, а сила м’язів розгиначів — 5,0±0,35 кг.
Висновки. Запропонований пристрій дозволяє у хворих на ОА колінних суглобів визначити силу м’язів, призначити індивідуалізований тренувальний режим і контролювати ефективність реабілітації. Пристрій можна застосовувати у пацієнтів із патологією колінних суглобів у ревматологічних, травматологічних, ортопедичних відділеннях медичних закладів лікувального, санаторного та фізкультурно-лікувального профілів.
ДОСЛІДЖЕННЯ АКТИВНОСТІ МАРКЕРІВ МЕТАБОЛІЗМУ ХРЯЩОВОЇ ТКАНИНИ У ХВОРИХ НА ПСОРІАТИЧНИЙ АРТРИТ
О.І. Олійник, Р.І. Яцишин, Ю.В. Дельва, Я.В. Сандурська, М.Я. Сухоребська, М.М. Волошин
ДВНЗ «Івано-Франківський національний медичний університет»
Псоріатичний артрит (ПА) — хронічне прогресуюче системне захворювання суглобів, асоційоване із псоріазом, з переважною локалізацією процесу у тканинах опорно-рухового апарату, яке призводить до розвитку ерозивного артриту, остеолізу та спондилоартриту.
Мета: для встановлення інтенсивності перебігу деструктивних процесів у суглобовому хрящі проводили визначення концентрації агрекану як основного компонента хрящового матриксу. Агрекан є домінуючим підтипом протеогліканів у хрящі: він становить ≈90% загальної маси протеогліканів у тканині.
Методи дослідження. Для досягнення поставленої мети нами обстежено 40 хворих на ПА: 33 (81%) чоловіків і 7 (19%) жінки. Вік хворих коливався від 19 до 72 років (середній вік — 48±6,5 року) з тривалістю захворювання від 1 року до 19 років (в середньому — 7±0,7 років). Всі пацієнти отримували базисну терапію ПА (метотрексат по 10–15 мг/тиж) та нестероїдні протизапальні препарати (НПЗП) у різних дозах залежно від показників активності та больового індексу. Концентрацію агрекану в сироватці крові визначали імуноферментним методом за допомогою набору «Biosourse RG Easia kit» (Бельгія). Метод базується на використанні суміші моноклональних антитіл, спрямованих проти різних епітопів протеоглікану.
Результати. У хворих на ПА концентрація агрекану в сироватці крові була вірогідно вищою, ніж у здорових добровольців: 157,63±7,5 і 98,41±4,3 нг/мл відповідно (р<0,001). Значення концентрації агрекану були варіабельні, що спонукало нас до індивідуального аналізу результатів обстеження хворих і виявлення основних тенденцій розвитку ПА. Встановлено що загалом у жінок, хворих на ПА, концентрація агрекану в сироватці крові (165,17±4,4 нг/мл) вища, ніж у чоловіків (142±5,4 нг/мл; р<0,05). Виявлено вірогідні відмінності концентрації агрекану у пацієнтів із різними варіантами перебігу захворювання. Так, у разі поліартикулярного ураження (ревматоїдоподібний варіант) вміст агрекану у сироватці крові становив 182,36±2,5 нг/мл, моноартикулярного ураження (асиметричний олігоартрит, артрит дистальних міжфалангових суглобів) — 143,58±5,2 нг/мл (р<0,05). З підвищенням кількості уражених суглобів зростала концентрація агрекану в сироватці крові, про що свідчить тісний кореляційний зв’язок між цими показниками (r=0,79; р<0,001). Проте у хворих зі спондилоартритичним варіантом ПА рівень агрекану становив 119,21±2,4 нг/мл (р<0,05), що зумовлено гістологічними особливостями будови хрящів хребетного стовпа.
Висновки. Отримані результати дозволяють пропонувати визначення вмісту агрекану в сироватці крові як об’єктивний метод оцінки ступеня порушення хрящового метаболізму, вираженості деструктивних процесів у суглобовому хрящі та клінічних особливостей перебігу хвороби.
УРАЖЕННЯ НИРОК У ХВОРИХ З ГІПЕРУРИКЕМІЄЮ
І.А. Палієнко, О.М. Кармазіна, Я.О. Кармазін, Ю.П. Синиця
Національний медичний університет ім. О.О. Богомольця, Київ
Гіперурикемія (виявляється у 2–12% (до 25%) осіб у світовій популяції) є предиктором розвитку артеріальної гіпертензії, ожиріння, інсулінорезистентності, цукрового діабету ІІ типу, ішемічної хвороби серця, ішемічного інсульту, хронічної хвороби нирок. Питання механізмів впливу уратів на нирку (безпосереднього, опосередкованого, через коморбідну патологію), існування хронічної уратної нефропатії та інших форм ураження нирок при гіперурикемії та подагрі залишаються дискутабельними.
Підвищення рівня сечової кислоти в крові приблизно в 10% випадків зумовлене гіперпродукцією і в 90% випадків — зменшенням її екскреції. Встановлена складна система ниркової екскреції уратів, яка включає етапи фільтрації, реабсорбції, секреції, повторної реабсорбції.
Мета: уточнити типи ураження нирок при гіперурикемії залежно від механізмів впливу уратів на нирку.
В патогенезі ураження нирок у хворих з гіперурикемією можна виділити кілька механізмів:
А. Кристал-індуковані — включають інтратубулярне відкладення кристалів сечової кислоти, локальну обструкцію канальців, їх розриви, формування кристалів в інтерстиції, запалення та інтерстиціальний фіброз навкруги кристалів.
Б. Не індуковані утворенням кристалів:
1. Судинні ураження
– Прегломерулярна артеріопатія, яка може виникати внаслідок часто існуючих супутніх артеріальної гіпертензії, гіперінсулінемії, цукрового діабету, ліпідних порушень та безпосередньої стимуляції сечовою кислотою активності ренін-ангіотензин-альдостеронової системи, синтезу циклооксигенази-2, інгібіції NO-реабсорбції синтетази, що приводить до зменшення синтезу вазодилататора NO, підвищення синтезу вазоконстриктора ендотеліну-1, стимуляція проліферації клітин гладких м’язів судин через міогенактивовану протеїнкіназу, екстрацелюлярно-ругульовану кіназу та пригнічення тромбоцитарного фактора росту і його рецептора.
– Гломерулярна артеріопатія та гіпертензія, яка виникає внаслідок вищезазначених причин, погіршення ниркової авторегуляції кровотоку, редукції ренального медулярного кровотоку та урикемічної стимуляції синтезу прозапальних цитокінів: інтерлейкіну-6, С-реактивного білка, фактора некрозу пухлини-α.
2. Тубулярні ураження внаслідок ішемії при судинних пошкодженнях, інгібіції целюлярної епітеліальної проліферації в проксимальних канальцях внаслідок активації цитоплазматичної фосфоліпази A2 та прозапального нуклеарного фактора каппа В, впливу прозапальних цитокінів.
3. Інтерстиціальні ураження внаслідок фенотипічної трансформації клітин ниркового канальцевого епітелію в мезенхімальні, які зумовлюють фіброзні процеси, та впливу прозапальних цитокінів, стимуляції цих процесів внаслідок активації ренін-ангіотензин-альдостеронової системи.
Ураження нирок у осіб з гіперурикемією та подагрою включає: гостру обструктивну уратну нефропатію, хронічну уратну нефропатію, уратний нефролітіаз, мезангіопроліферативний гломерулонефрит, мезангіокапілярний гломерулонефрит, пієлонефрит, амілоїдоз нирок, коморбідні: гіпертензивну нефропатію, діабетичну нефропатію; та медикаментозне ураження нирок.
Гостра уратна нефропатія — термін, який характеризує розвиток гострої олігоуричної ниркової недостатності внаслідок обструкції ниркових канальців уратами і кристалами сечової кислоти при гострому синдромі лізису пухлини в онкологічній практиці. Внаслідок масивного клітинного лізису сечова кислота преципітує в дистальних канальцях і в збиральних протоках нирок.
Методи і результати дослідження. Наявність хронічної уратної нефропатії ставиться під сумнів багатьма авторами. Фундаментальне швейцарське дослідження, що включало 11 408 аутопсій, виявило уратні включення в нирках лише у 37 осіб, і тільки у 3 них була діагностована ниркова недостатність, а відкладення уратів в нирках виявлялося також у хворих без подагри. Ця та низка інших робіт засвідчили, що виявлені нефропатії у хворих із гіперурикемією та подагрою зумовлені найімовірніше сечокам’яною хворобою, артеріальною гіпертензією, цукровим діабетом, процесами старіння, і переконливих доказів того, що хронічна гіперурикемія призводить до хронічної уратної нефропатії, немає. Однак у хворих із вродженими дефектами ферментів (дефіцит гіпоксантин-гуанін-фосфорибозилтрансферази, підвищення активності фосфорибозил-пірофосфатсинтетази), які беруть участь в обміні пуринів, зокрема при синдромах Леша — Ніхена або Келлі — Сигміллера, хронічна гіперурикемія призводить до ниркової недостатності. Зважаючи, що ці групи хворих належать до гіперпродуцентів сечової кислоти, яких серед осіб з гіперурикемією не більше 10%, можна зробити припущення про певні особливості виникнення нефропатії при гіперпродукції сечової кислоти з акцентом на кристал-індуковані механізми.
Існує також кілька форм вродженої ниркової патології, яка супроводжується гіперурикемією внаслідок зниження екскреції уратів та розвитком ниркової недостатності: медулярна кістозна хвороба нирок І типу та уромодулінзалежні хвороби (дефект синтезу білка Тамма — Хорсфала) — сімейна ювенільна гіперурикемічна нефропатія і медулярна кістозна хвороба нирок ІІ типу.
Роль уратного нефролітіазу у виникненні ниркових уражень через порушення уродинаміки, розвиток вторинного пієлонефриту не викликає сумнівів.
Найбільш суперечливим виглядає існування гломерулонефритів як результату вторинного ураження нирок у хворих із гіперурикемією та подагрою.
Висновки. Таким чином, у хворих із гіперурикемією та подагрою можна виділити кілька варіантів ураження нирок із відмінними патогенетичними механізмами. Їх виявлення необхідне для вибору адекватних рекомендацій щодо вибору оптимальної лікувальної тактики.
РИЗИК-ФАКТОРИ КАРДІОВАСКУЛЯРНИХ УРАЖЕНЬ ПРИ ПОДАГРІ
І.А. Палієнко1, О.М. Кармазіна1, Я.О. Кармазін1, І.С. Шепетько2, О.М. Тарасенко2
1 Національний медичний університет ім.О.О. Богомольця, Київ
2 Міська клінічна лікарня № 3, Київ
Подагра — одне з найрозповсюдженіших ревматологічних захворювань серед дорослого населення, найчастіша причина гострого артриту у чоловіків віком старше 30 років. Хвороба має тенденцію до поширення, агресивного перебігу з ураженням великої кількості суглобів, розвитку нефролітіазу, коморбідної патології. Однією з причин смерті хворих на подагру є фатальні ускладнення з боку серцево-судинної системи.
Мета: проаналізувати ймовірні причини кардіоваскулярних уражень у хворих на хронічний подагричний артрит.
Методи дослідження. Проаналізовані клінічні, анамнестичні, лабораторні, інструментальні дані 52 хворих на хронічний подагричний артрит, пролікованих у ревматологічному відділенні Клінічної лікарні № 3 м. Києва у 2012 р. Вік хворих становив 34–56 років. Тривалість захворювання — 3,5–13,2 року. Хворих розподілили на дві групи: 1-ша група (n=24) без лабораторних та ультразвукових ознак ураження нирок, 2-га група (n=28) мали нефролітіаз.
Результати. Серед хворих на хронічний подагричний артрит переважали чоловіки — 95%. Артеріальна гіпертензія спостерігалася у 92% хворих 1-ї групи та 100% хворих 2-ї групи. Рівень артеріального тиску був вищим у 2-й групі (САТ 165,7±7,22 мм рт. ст., ДАТ 94,3±5,21 мм рт. ст.), ніж у 1-й групі (САТ 148,3±5,4 мм рт. ст., ДАТ 88,3±3,6 мм рт.ст.). Тривалість захворювання була більшою у пацієнтів 2-ї групи. В обох групах переважали хворі з надмірною масою тіла (індекс маси тіла — 33,7 у 1-й групі, 31,5 — у 2-й групі; окружність талії у чоловіків перевищувала 102 см, у жінок — перевищувала 88 см). Рівень холестерину (6,08±0,33 ммоль/л) і тригліцеридів (3,71±0,15 ммоль/л) крові були підвищеними у 94% пацієнтів. Палили 67% хворих, 18% хворих вказували на наявність ІХС, інсульту, інфаркту у батьків. Ознаки гіпертрофії лівого шлуночка (за даними ехоКГ, ЕКГ) спостерігались у 65% хворих 1-ї групи та 96% хворих 2-ї групи.
Висновки. Факторами ризику кардіоваскулярних ускладнень у хворих на хронічний подагричний артрит є: гіперурикемія, артеріальна гіпертензія, абдомінальне ожиріння, дисліпідемія (гіперхолестеринемія, гіпертригліцеридемія), тютюнокуріння, наявність серцево-судинних захворювань в анамнезі, ушкодження нирок. Профілактикою кардіоваскулярних ускладнень при хронічному подагричному артриті є корекція кожного з цих чинників.
ЗАСТОСУВАННЯ L-АРГІНІНУ В КОМПЛЕКСНОМУ ЛІКУВАННІ ПРИ СИСТЕМНІЙ СКЛЕРОДЕРМІЇ
І.А. Палієнко1, О.М. Кармазіна1, І.С. Шепетько2, Я.О. Кармазін1, О.М. Тарасенко2, Ю.П. Синиця1
1 Національний медичний університет ім. О.О. Богомольця, Київ
2 Міська клінічна лікарня № 3, Київ
Системна склеродермія (ССД) — поліорганне захворювання стадійного перебігу з характерними вазоспастичними судинними реакціями і прогресуючою генералізованою васкулопатією з ішемічними порушеннями, при якому розвиваються своєрідні аутоімунні розлади, які супроводжуються активацією фіброзоутворення із надмірним відкладенням колагену та інших компонентів екстрацелюлярного матриксу у тканинах.
Порушення функції ендотелію спостерігається при багатьох захворюваннях. Системна вазомоторна ендотеліальна дисфукція є показником ризику розвитку серцево-судинних катастроф та зумовлює перебіг судинних уражень при системному червоному вовчаку, ревматоїдному артриті, системному васкуліті, визначає розвиток, клінічні прояви та прогноз при ССД. Дисфункція ендотелію — дисбаланс вазодилатуючих (оксид азоту, простациклін, ендотеліальний фактор гіперполяризації, натрійуретичний пептид С-типу та ін.) та вазоконстрикторних (ендотелін-1, тромбаксан А2, простагландин Н2) субстанцій — призводить до порушень у мікро- та макроциркуляторному руслі (ураження дрібних артерій, артеріол та капілярів шкіри, шлунково-кишкового тракту, нирок, серця, легень) та передує розвитку фіброзу при ССД.
Мета: оцінити клінічну ефективність застосування L-аргініну (напівнезамінної амінокислоти, яка є субстратом для ендотеліальної NO-синтази в утворенні NO) в комплексному лікуванні хворих на ССД.
Методи дослідження. Обстежено та проліковано згідно з рекомендаціями 26 хворих (23 жінок та 3 чоловіків) на ССД віком 38–62 років із хронічним перебігом, ІІ стадії (генералізованої), активністю І–ІІ ступеня, з ураженням різних органів та систем. Хворі були розподілені на дві групи, рівнозначні за віком, статтю, ступенем ураження внутрішніх органів. Пацієнтам 1-ї групи (n=14) у схему лікування був включений L-аргінін у дозі 100 мл (4,2 г аргініну гідрохлориду) внутрішньовенно крапельно 1 раз на день, на курс 10 інфузій. Пацієнти 2-ї групи (n=12) отримували лікування без L-аргініну.
Результати. Внаслідок проведеного лікування спостерігався позитивний клінічний ефект в обох групах хворих, але у пацієнтів 1-ї групи він був більш вираженим. Так, поліпшення периферичного кровообігу (зникнення відчуття холоду в кінцівках, поколювання, оніміння кінчиків пальців, болю в нижніх кінцівках при ходьбі) було достовірно частішим у хворих 1-ї групи, ніж у хворих 2-ї групи (р<0,05). За даними реовазографії кінцівок — збільшилося пульсове кровонаповнення, зменшився периферичний опір судин. У хворих 2-ї групи такої динаміки не спостерігалось. Отримані дані свідчать про можливість покращання периферичного кровообігу через вплив на ендотелій судин L-аргініну, який є донатором для синтезу оксиду азоту. Під впливом L-аргініну зменшились вираженість болю у м’язах, прояви синдрому Рейно, набряк шкіри, що свідчить про покращання у мікроциркуляторному руслі, поліпшення обміну речовин. Негативних побічних проявів не спостерігалося.
Висновки. Застосування L-аргініну в комплексному лікуванні хворих на ССД має позитивний клінічний ефект, дозволяє покращити периферичний кровотік та мікроциркуляцію.
ІМУННІ ПОРУШЕННЯ ПРИ ХВОРОБІ РЕЙТЕРА ЯК ЧИННИК ПРОГРЕСУВАННЯ ЗАХВОРЮВАННЯ
Л.М. Пасієшвілі
Харківський національний медичний університет
Хвороба Рейтера (ХР) — хронічне, схильне до рецидивів захворювання, що проявляється ураженням сечостатевої системи, суглобів, очей, шкіри та внутрішніх органів.Більшість авторів розглядає ХР як поліетіологічне захворювання з генетичною схильністю. Розвиток хвороби зумовлений імунопатологічними факторами, повʼязаними з порушенням імунного розпізнавання у осіб, які мають антиген HLA-B27. Тривала іритація імунної системи у пацієнтів із ХР веде до виникнення різноманітних за силою та формою імунних відповідей з нерідкими патологічними наслідками.
Мета: визначити зміни в показниках імунного спектра крові, які впливають на прогресування ХР.
Методи дослідження. Обстежено 29 чоловіків віком від 24 до 47 років із ХР із тривалістю захворювання від 6 міс до 5 років. Верифікація хламідійного чинника хвороби була підтверджена у 25 випадках при проведенні ІФА; у 2 хворих збудником хвороби були ієрсинії. Ще у 2 осіб визначили антитіла до хламідій у синовіальній рідині. Класичний варіант патології з тріадою симптомів було визначено лише у 11 хворих. Проведене імунологічне дослідження включало: визначення вмісту Т-, В-лімфоцитів, Т-хелперів/індукторів, Т-супресорів/кілерів в цитотоксичному тесті з комерційними моноклональними антитілами класів СD3+, СD4+, СD8+, СD22+; рівня ЦІК та імуноглобулінів сироватки крові (А, М, G). Наявність активного запального процесу доводили при вивченні вмісту ІЛ-1, ФНП-α та ІЛ-6 в сироватці крові. Отримані результати порівнювали з аналогічними показниками 20 практично здорових осіб.
Результати. Доведено, що у хворих на ХР спостерігалося достовірне підвищення вмісту ІЛ-1, ФНП-α та ІЛ-6 у сироватці крові, рівень яких корелював із вираженістю запального процесу. Показники специфічної клітинної ланки імунітету також набували значних змін. Так, вміст СD3+-клітин, які ідентифіковані як загальні Т-лімфоцити, був нижчим за норму та становив 50,3±3,1% проти 75,9±1,87% в контролі. Рівень СD4+ у >2 разів зменшувався (23,9±1,8% проти 52,1±1,33%). Абсолютне число СD8+-клітин зростало на тлі зниження індексу імунорегуляції (СD4/СD8) — 1,3±0,03 проти 2,2±0,08 у контролі, що можна розглядати як формування відносно супресорного варіанта вторинного імунодефіцитного стану. Особливо вираженими зміни були відзначені при вивченні вмісту В-лімфоцитів (СD22+) — 39,9±1,9% проти 20,9±1,02% в нормі. Одночасно відбувалося в 4,2 раза підвищення вмісту ЦІК (р<0,001), що, на нашу думку, є наслідком формування аутоімунного процесу й, у свою чергу, може зумовити блокування рецепторів Т-клітин, що, поряд із розвитком запалення, може пояснити зниженням загального пулу Т-лімфоцитів. При оцінці показників гуморального імунітету виявлена дисімуноглобулінемія основних класів, що проявлялося підвищенням концентрації IgA и G у крові (р<0,01). Такі зміни, ймовірно, є результатом підвищення функціональної активності В-лімфоцитів, а підвищення вмісту IgG, окрім того, наслідком напруження антиінфекційного імунітету за наявності збудника.
Висновки. Перебіг ХР супроводжується змінами в цитокіновій, клітинній та гуморальній ланках імунітету. Відзначається активація прозапальних цитокінів та розвиток вторинного імунодефіцитного стану за відносно супресорним варіантом. Підвищення ЦІК віддзеркалює розвиток аутоімунного процесу та пояснює прогресуючий характер перебігу хвороби.
ЧУТЛИВІСТЬ І СПЕЦИФІЧНІСТЬ МОДИФІКОВАНИХ ДІАГНОСТИЧНИХ КРИТЕРІЇВ ФІБРОМІАЛГІЇ АМЕРИКАНСЬКОЇ КОЛЕГІЇ РЕВМАТОЛОГІВ 2010
Л.С. Перебетюк, М.А. Станіславчук
Вінницький національний медичний університет ім. М.І. Пирогова
Діагностика фіброміалгії (ФМ) залишається непростим завданням, незважаючи на існування прийнятих у 1990 р. класифікаційних критеріїв. Труднощі їх використання полягають у значній індивідуальній варіабельності встановлення, необхідних для діагнозу 11 чутливих точок. У зв’язку з цим у 2010 р. Американською колегією ревматологів (АКР) були запропоновані й невдовзі модифіковані нові діагностичні критерії ФМ.
Мета: визначення чутливості та специфічності нових модифікованих діагностичних критеріїв ФМ (АКР) порівняно з існуючими (1990).
Методи дослідження. Нами використано опитувальник Fibromyalgia Symptom Questionnaire (FSQ), рекомендований для епідеміологічних та клінічних досліджень згідно з модифікованими критеріями АКР 2010. Цей опитувальник містить три секції — перша секція стосується оцінки вираженості втоми, когнітивних порушень та вранішньої розбитості протягом попередніх 7 днів та оцінюється від 0 до 9, друга стосується оцінки соматичних симптомів за останні 6 міс (біль чи спазм внизу живота, депресія, головний біль) — 0–3. Сума першої та другої секцій відповідає вираженості симптомів Symptom Severity (SS) score та становить 0–12 балів. Третя секція — індекс поширеності болю Widespread Pain Index (WPI) — включає наявність поширеного болю в 19 ділянках тіла за попередні 7 днів та становить, відповідно, 0–19 балів. Загальна сума балів Fibromyalgia Symptom (FS) scale всіх трьох секцій 0–31. FS ≥13 вказує на ФМ.
Обстежено 29 пацієнтів жіночої статі з попередньо встановленим діагнозом ФМ відповідно до діагностичних критеріїв АКР (1990), та 26 осіб групи контролю, репрезентативних за віком та статтю.
Результати. Згідно з модифікованими критеріями АКР (2010) діагноз ФМ підтверджено у 26 пацієнтів, що становило 89,6%, та виявлено ознаки ФМ у 2 осіб контрольної групи, що становило 7,1%. Чутливість опитувальника становила 89,6% та специфічність — 92,9%. Продемонстрована відтворюваність результатів за даним опитувальником.
Висновки. Нові модифіковані діагностичні критерії ФМ, запропоновані АКР у 2010 р., продемонстрували доступність їх використання, не потребують присутності спеціаліста та необхідності практичних навичок виявлення чутливих точок. Цей опитувальник може бути рекомендований для проведення скринінгу фіброміалгії в популяції на первинній ланці медичної допомоги.
ОЦІНКА ВИЖИВАНОСТІ ХВОРИХ НА ВУЗЛИКОВИЙ ПОЛІАРТЕРІЇТ
Л.Б. Петелицька, О.І. Івашківський, С.Х. Тер-Вартаньян
Національний медичний університет ім. О.О. Богомольця, Київ
Вузликовий поліартеріїт (ВП) — це системний васкуліт з ураженням судин середнього та дрібного калібру і несприятливим прогнозом. Так, за відсутності лікування рівень 5-річної виживаності хворих на ВП сягає лише 13%. При проведенні лікування, за даними огляду літератури на основі бази даних Sheffield Hallam University LitSearch і MEDLINE, виживаність хворих ВП становить 70–80%.
Мета: проаналізувати виживаність хворих на ВП Північного регіону України та визначити предиктори низької виживаності.
Методи дослідження. У дослідження було включено 53 хворих на ВП, які відповідали критеріям ACR (1990) або Chapel Hill (2012). Середня тривалість спостереження хворих становила 92 міс, коливаючись від 2 до 300 міс. При аналізі виживаності оцінювали демографічні (вік, стать), клінічні (схуднення на >5 кг, ураження шлунково-кишкового тракту (ШКТ), центральної нервової системи (ЦНС), наявність діастолічної артеріальної гіпертензії (ДАГ), міокардиту) і лабораторні (рівень швидкості осідання еритроцитів (ШОЕ) та креатиніну, наявність маркерів гепатиту В) параметри, а також 5-факторний індекс прогнозу та Бірмінгемський індекс активності васкулітів (BVAS). Аналіз виживаності включав як повні, так і цензуровані спостереження. Для дослідження кумулятивної виживаності хворих використовували метод Таблиць часів життя та Каплана — Мейєра, а для порівняння виживаності у групах — узагальнений критерій Вілкоксона — Гехана. Предиктори низької виживаності хворих визначали методом регресійного аналізу за допомогою створення моделі пропорційних інтенсивностей Кокса.
Результати. За час спостереження померли 15 (28,3%) хворих. Згідно з результатами проведеного аналізу 25% хворих на ВП помирають протягом перших 7 років, а 50% — не живуть більше 17 років. Результати дослідження методом Таблиць часів життя свідчать, що кумулятивна частка тих, які вижили на 1-, 3-, 5- та 10-му році спостереження, становила 88; 86; 84 та 65%. Виживаність на 1-, 3-, 5- та 10-му році спостереження, розрахована методом множинної оцінки Каплана — Мейєра, становила 88,6; 84,2; 81,8 та 68,2% відповідно. При порівнянні виживаності хворих на ВП залежно від віку та статі виявлено, що гендерні кумулятивні функції виживання хворих вірогідно не відрізняються (р=0,58), а вік в дебюті захворювання >60 років вірогідно знижує виживаність хворих на ВП. Криві виживання груп хворих з різною активністю захворювання, визначеною за BVAS, суттєво не відрізняються (p=0,59). При порівнянні груп хворих ВП, розподілених за кількістю балів 5-факторного індексу прогнозу, виявлено, що наявність двох несприятливих прогностичних факторів вірогідно зменшує виживання хворих (р<0,05), а наявність лише одного фактора не впливає на смертність. Інфікованість вірусом гепатиту В і рівень ШОЕ в дебюті захворювання, за даними узагальненого критерія Вілкоксона — Гехана, не впливають на виживаність хворих. За результатами проведеного регресійного аналізу визначено, що до вірогідних факторів низької виживаності хворих ВП належать: наявність міокардиту, підвищення рівня креатиніну >140 ммоль/л та вік хворих >60 років. Інші фактори (схуднення, ДАГ, ураження ЦНС та ШКТ) не впливали на криву виживаності.
Висновки. Незважаючи на сучасне лікування, прогноз пацієнтів із ВП залишається несприятливим. Кумулятивна виживаність хворих на ВП на 1-, 3-, 5- та 10-му році спостереження становить 89; 84; 82 та 68% відповідно. Активність васкуліту, визначена за індексом BVAS чи за рівнем ШОЕ, не впливає на смертність. Наявність міокардиту, підвищення рівня креатиніну >140 ммоль/л та вік хворих >60 років є предикторами низької виживаності пацієнтів із ВП. Визначення несприятливих прогностичних факторів може мати важливе значення для інтенсифікації схеми індукційної терапії.
РІВЕНЬ ВІТАМІНУ D У СИРОВАТЦІ КРОВІ В ДОРОСЛОГО НАСЕЛЕННЯ УКРАЇНИ
В.В. Поворознюк, Н.І. Балацька, О.В. Синенький, В.Я. Муц, Ф.В. Климовицький
ДУ «Інститут геронтології ім. Д.Ф. Чеботарьова НАМН України», Київ
Мета: для вивчення частоти дефіциту вітаміну D серед населення України проведено комплексне обстеження жителів різних регіонів країни, згідно з основними принципами епідеміологічного дослідження. Для визначення впливу вікового фактора та сезону на рівень 25(ОН)D проводили дослідження цього показника в різних вікових групах та у різні пори року.
Методи дослідження. Обстежено 1575 жителів України віком 20–95 років. Переважну більшість становили жінки (86,3%). Середній вік останніх — (58,61±0,37) року, чоловіків — (54,93±1,09) року. Усім обстеженим досліджували рівень 25(ОН) вітаміну D (25(ОН)D) в сироватці крові за допомогою електрохемілюмінісцентного методу на аналізаторі «Eleсsys 2010» («Roche Diagnostics», Німеччина) тест-системами cobas. Цей метод на сьогодні є найчутливішим і дозволяє вимірювати концентрацію досліджуваної речовини в широкому діапазоні із високою точністю.
Оцінку вітамін-D-статусу здійснювали відповідно до останньої класифікації (2011), згідно з якою: дефіцит вітаміну D (ДВD) встановлюється при вмісті 25(ОН)D в сироватці крові <50 нмоль/л, недостатність вітаміну D діагностується при рівнях 25(ОН)D 75–50 нмоль/л. Оптимальним є рівень 25(ОН)D у межах 75–125 нмоль/л.
Результати. Проведені дослідження показали, що лише 4,6% жителі України мали 25(ОН)D у межах норми, у 13,6% відзначено недостатність, а в 81,8% — ДВD. Слід зазначити, що тяжка форма ДВD (діагностується при показнику 25(ОН)D <25 нмоль/л) траплялася в 37,3% обстежених, а в 12,2% вміст 25(ОН)D знаходився нижче рівня, який може дослідити апарат. Аналіз показників 25(ОН)D у кожній віковій групі встановив, що достовірно вищі рівні 25(ОН)D були в осіб віком 20–29 років порівняно із обстеженими інших вікових груп (р<0,01–0,001). Із віком 25(ОН)D мав тенденцію до зниження.
Оскільки синтез вітаміну D залежить від географічної широти, тому проводили епідеміологічні дослідження цього показника в різних географічних регіонах країни. Найнижчі показники рівня 25(OH)D у сироватці крові реєструвалися у жителів Західного регіону країни при найвищому відсотку ДВD і тяжкого ДВD (85,9 та 43,5% відповідно). Населення Південного регіону мало рівень 25(ОН)D у сироватці крові в 1,5–1,7 раза вищий порівняно із показниками обстежених із інших регіонів, а частота тяжкого ДВD у них становила лише 20%.
Достовірно вищі показники 25(ОН)D відзначено у літню пору року (40,11±0,99) нмоль/л. Найнижчі показники рівня 25(ОН)D у сироватці крові відзначали взимку — (30,47±1,2) нмоль/л. Навесні та восени середній рівень 25(ОН)D у сироватці крові становив (31,04±1,28) та (23,97±1,12) нмоль відповідно. Слід зазначити, що найнижчий рівень 25(ОН)D у сироватці крові реєстрували у грудні в людей літнього та старечого віку ((12,36±1,23) та (22,34±2,06) нмоль/л відповідно). Середній рівень 25(ОН)D у сироватці крові у жінок становив (33,8±0,6) нмоль/л і був вірогідно нижчим (p<0,001) порівняно з показником у чоловіків ((38,9±1,6) нмоль/л).
Висновки. Результати проведеного вивчення залежності рівня 25(ОН)D у сироватці крові від ІМТ серед жителів України свідчать, що його рівень був достовірно нижчим в осіб із дефіцитом маси тіла і становив (25,5±4,2) нмоль/л та з ІМТ >35 кг/м2 — (29,8±1,4) нмоль/л. У цих же групах зареєстровано найвищу частку ДВD і тяжкого ДВD.
Таким чином, дефіцит вітаміну D реєструється у 81,8% жителів України. Встановлено, що з віком рівень 25(ОН)D у сироватці крові суттєво знижується від (41,16±2,53) нмоль/л у людей молодого віку до (32,65±1,7) нмоль/л в осіб старечого віку (p<0,05). Рівень 25(ОН)D у сироватці крові залежить від географічного положення місця проживання.
ДЕФІЦИТ ВІТАМІНУ D У ПАЦІЄНТІВ ІЗ ОСТЕОПОРОЗОМ
В.В. Поворознюк, Н.І. Балацька
ДУ «Інститут геронтології ім. Д.Ф. Чеботарьова НАМН України», Київ
Вітамін D відіграє ключову фізіологічну роль у підтримці позаклітинного рівня іонів кальцію в організмі людини. Дефіцит вітаміну D (ДВD) може викликати вторинний гіперпаратиреоз і, як наслідок, приводити до зниження мінералізації кісток, збільшення втрати компактної кісткової маси та бути однією із патогенетичних ланок розвитку остеопорозу (ОП).
Мета: вивчити вплив дефіциту та недостатності вітаміну D на показники мінеральної щільності кісткової тканини (МЩКТ) у пацієнтів із системним ОП.
Методи дослідження. Обстежено 283 пацієнти із системним остеопорозом віком 40–94 років, які перебували в клініці вікових змін опорно-рухового апарату ДУ «Інститут геронтології ім. Д.Ф. Чеботарьова НАМН України». Переважну більшість обстежених становили жінки 90,4%. Середній вік останніх — (65,26±0,60) року, чоловіків — (65,25±2,12) року. У свіх пацієнтів досліджували рівень 25-ОН вітаміну D (25(ОН)D) та інтактного паратгормону (іПТГ) за допомогою електрохемілюмінісцентного методу на аналізаторі «Eleсsys 2010» («Roche Diagnostics», Німеччина) тест-системами cobas. Визначення МЩКТ різних відділів скелета здійснювалося з використанням двохенергетичного рентгенівського денситометра «Prodigy». Оцінку вітамін D-статусу здійснювали відповідно до останньої класифікації,згідно з якою: ДВD встановлюється при рівні 25(ОН)D <50 нмоль/л, недостатність вітаміну D (НВD) знаходиться при рівнях 25(ОН)D 75–50 нмоль/л. Рівень 25(ОН)D ≥75 нмоль/л вважається в межах норми.
Результати. За результатами дослідження ДВD діагностовано в 80,7% обстежених. НВD реєструвалася в 11,5%, у 7,9% пацієнтів рівень 25(ОН)D знаходився в межах норми. У 16,8% пацієнтів вміст 25(ОН)D знаходився нижче рівня, який може дослідити апарат. 41,1% хворих мали тяжкий ДВD (показник 25(ОН)D <25 нмоль/л). Частота вторинного гіперпаратиреозу серед пацієнтів із ОП становила 13,9%. Дослідження стану МЩКТ у хворих із ОП за різного рівня 25(ОН)D не виявило достовірної різниці показників МЩКТ. При вивченні кореляційних зв’язків між вмістом 25(ОН)D та МЩКТ виявлено достовірні кореляційні зв’язки на рівні зони Варда (r=0,14; p<0,04), вертлюга (r=0,18; p<0,01), проксимального відділу стегнової кістки (r=0,16; p<0,02), нижніх кінцівок (r=0,14; p<0,04), кісток передпліччя 33% (r=0,13; p<0,05). Усім пацієнтам до розпочатого лікування проведено оцінку інтенсивності больового синдрому в грудному та поперековому відділах хребта, використовуючи шкалу ВАШ, також оцінювали біль за анкетою Роланда — Морріса. Якість життя оцінювали за шкалою EuroQoL-5D. Для оцінки впливу ДВD на інтенсивність болю та якість життя всіх пацієнтів розподілено на чотири групи: з тяжким дефіцитом — рівень 25(ОН)D у сироватці крові <25 нмоль/л; з помірним дефіцитом: >25 та <50 нмоль/л із НВD; четверту групу становили пацієнти з рівнем 25(ОН)D у сироватці крові в межах норми. Інтенсивність больового синдрому у поперековому відділі хребта була достовірно вищою у пацієнтів із тяжким та помірним ДВD і становила (43,1±3,51) та (45,4±3,63) бала проти (14,0±14) бала у пацієнтів з рівнем 25(ОН)D у сироватці крові в межах норми (p<0,05). Показники якості життя за шкалою EuroQoL-5D у пацієнтів із рівнем 25(ОН)D у сироватці крові в межах норми були достовірно нижчими порівняно з групами із тяжким та помірним ДВD і становили (2,0±1,53) бала проти (4,6±0,30) та (5,0±0,34) бала відповідно (р<0,05). Результати анкетування обстежених за опитувальником Роланда — Морріса виявили також низькі середні показники опитувальника у пацієнтів із рівнем 25(ОН)D у сироватці крові в межах норми. Так, в останніх він становив (5,3±0,9) бала проти (8,3±0,8) бала за тяжкого дефіциту та (9,5±0,8) за помірного ДВD.
Висновки. Таким чином, у пацієнтів із ОП реєструється значна частка ДВD (80,7%). Доведено, що у хворих із ДВD інтенсивність вертебрального больового синдрому є вірогідно вищою (p<0,05), а показники якості життя є гіршими порівняно з обстеженими із оптимальним рівнем 25(ОН)D у сироватці крові.
САРКОПЕНИЯ У УКРАИНСКИХ ЖЕНЩИН РАЗЛИЧНОГО ВОЗРАСТА
В.В. Поворознюк, Н.И. Дзерович
ГУ «Институт геронтологии им. Д.Ф. Чеботарева НАМН Украины», Киев
Цель: изучить особенности телостроения и частоту саркопении у украинских женщин различного возраста.
Методы исследования. Обследовано 8882 женщины в возрасте 20–89 лет (средний возраст — 56,70±0,14 года, средний рост — 1,62±0,07 м, средняя масса — 73,53±0,16 кг, индекс массы тела — 27,90±0,10 кг/м2). В зависимости от возраста женщины были распределены на группы: 20–24 (n=144), 25–29 (n=212), 30–34 (n=271), 35–39 (n=326), 40–44 (n=432), 45–49 (n=821), 50–54 (n=1366), 55–59 (n=1605), 60–64 (n=1223), 65–69 (n=981), 70–74 (n=879), 75–79 (n=377), 80–84 (n=198), 85–89 (n=47) лет. Показатели жировой и обезжиренной массы оценивали с использованием двухфотонной рентгеновской абсорбциометрии («Рrodigy, GE»). Статистический анализ проводили с помощью программы «Statistica 6.0». Использовали корреляционный, регрессионный и однофакторный дисперсионный анализ ANOVA.
Результаты. Установлены достоверные изменения жировой и обезжиренной массы у женщин с возрастом:
• жировая масса: 20–24 года — 18630,12 г; 25–29 лет — 18630,12 г; 30–34 года — 19201,00 г; 35–39 лет — 21528,15 г; 40–44 года — 24611,77 г, 45–49 лет — 27501,54 г; 50–54 года — 27501,54 г; 55–59 лет — 29909,92 г; 60–64 года — 31600,27 г; 65–69 лет — 33508,25 г; 70–74 года — 33155,54 г; 75–79 лет — 32284,86 г; 80–84 года — 30595,53 г; 85–89 лет — 30303,68 г; F=83,19; p<0,0000001;
• обезжиренная масса: 20–24 года — 37271,57 г; 25–29 лет — 37954,09 г; 30–34 года — 39019,72 г; 35–39 лет — 39928,62 г; 40–44 года — 40929,67 г; 45–49 лет — 41407,19 г; 50–54 года — 41936,27 г; 55–59 лет — 42564,79 г; 60–64 года — 42519,73 г; 65–69 лет — 41758,95 г; 70–74 года — 41233,77 г; 75–79 лет — 41105,52 г; 80–84 года — 40308,00 г; 85–89 лет — 38454,61 г; F=29,15; p<0,0000001.
Таким образом, максимальный уровень жировой и обезжиренной массы был установлен у женщин возрастной группы 50–59 лет.
Частота саркопении у обследуемых женщин в возрасте ≥65 лет составила 7%, при исключении женщин с ожирением — 10%. Частота саркопении в возрастной группе 65–69 лет (n=943) составила 7,6% (n=72), 70–74 года (n=877) — 6,1% (n=54), 75–79 лет (n=384) — 6,3% (n=24), 80–84 года (n=204) — 6,9% (n=14), 85–59 лет (n=48) — 10,4% (n=5). Данный показатель в возрастной группе 85–89 лет достоверно выше (р<0,005) по сравнению с другими группами.
Выводы. Возраст оказывает достоверное влияние на вариабельность показателей жировой и обезжиренной массы; максимальный уровень определяетсяу женщин в возрасте 50–59 лет. Частота саркопении у женщин в возрасте ≥65 лет составила 7%.
ГІПЕРУРИКЕМІЯ, ІНДЕКС МАСИ ТІЛА ТА ПОКАЗНИКИ МІНЕРАЛЬНОЇ ЩІЛЬНОСТІ КІСТКОВОЇ ТКАНИНИ У ЖІНОК У ПОСТМЕНОПАУЗАЛЬНИЙ ПЕРІОД
В.В. Поворознюк, Г.С. Дубецька
ДУ «Інститут геронтології імені Д.Ф. Чеботарьова НАМН України», Київ
Мета: вивчити частоту гіперурикемії у жінок в постменопаузальний період та її зв’язок із показниками індексу маси тіла (ІМТ), ліпідного обміну та мінеральної щільності кісткової тканини.
Методи дослідження. Обстеження проводили на базі відділу клінічної фізіології і патології опорно-рухового апарату ДУ «Інститут геронтології ім. Д.Ф. Чеботарьова НАМН України» та Українського науково-медичного центру проблем остеопорозу. Всього обстежено 380 жінок у постменопаузальний період.Пацієнтів розподілили на чотири групи залежно від ІМТ: 1-ша група (ІМТ=18,5–24,9), 2-га група (ІМТ=25,0–29,9), 3-тя група (ІМТ=30,0–34,9), 4-та група (ІМТ>35). За даними літератури, використовують таку класифікацію за показником ІМТ у дорослих: норма — ІМТ=18,5–24,9; передожиріння — ІМТ=25,0–29,9; ожиріння і ступеня — ІМТ=30,0–34,9; ожиріння ІІ ступеня — ІМТ=35,0–39,9; ожиріння ІІІ ступеня — ІМТ >40,0.
Визначення рівня сечової кислоти в плазмі крові здійснювали за допомогою ферментного уриказного методу.
Визначення мінеральної щільності кісткової тканини всього тіла, хребта і стегнової кістки проводили на апараті «Prodigy» (CE Medical systems, model 8743, 2005). Статистичний аналіз виконували з використанням програми Statistica 6.0.
Результати. Встановлена достовірна залежність між рівнем сечової кислоти та віком у жінок в постменопаузальний період (r=0,28; p<0,05). Частота гіперурикемії в групі обстежених жінок становила 26%. Виявлено найвищий рівень сечової кислоти в сироватці плазми крові в жінок у постменопаузальний період із найвищим індексом маси тіла (ІМТ>35). Так, у 1-й групі цей показник становив 277,52±8,40 мкмоль/л; у 2-й групі — 286,81±7,79 мкмоль/л, у 3-й групі — 291,81±7,56 мкмоль/л, у 4-й групі — 327,17±12,17 мкмоль/л. Частота пацієнтів із гіперурикемією серед жінок постменопаузального віку становила у 1-й групі 10,2%, у 2-й групі — 15,9%, у 3-й групі — 21,2%, у 4-й групі — 34,2%. Встановлена достовірна залежність між рівнем сечової кислоти та масою у жінок у постменопаузальний період (r=0,21; p<0,05).
Виявлено, що у жінок у постменопаузальний період існує достовірна залежність між деякими показниками ліпідного обміну, зокрема холестерину ліпопротеїдів дуже низької щільності (r=0,401; p<0,05), тригліцеридами (r=0,26; p<0,05) та коефіцієнтом атерогенності (r=0,24; p<0,05).
Нами не виявлено достовірної залежності між рівнем сечової кислоти та мінеральною щільністю кісткової тканини на рівні всього скелета (r=0,22; p>0,05) та поперекового відділу хребта (r=0,23; p>0,05) у жінок в постменопаузальний період.
Висновки. Постменопаузальний період у жінок можна віднести до одного із факторів ризику розвитку гіперурикемії, про що свідчить високий показник у них частоти цієї патології (26% — за результатами власних досліджень).
У жінок в постменопаузальний період існує достовірна залежність між рівнем сечової кислоти та віком, масою тіла, деякими показниками ліпідного обміну, не виявлено достовірної залежності із показниками мінеральної щільності кісткової тканини на рівні поперекового відділу хребта та всього скелета.
ВЛИЯНИЕ ГЛЮКОКОРТИКОИДОВ НА КАЧЕСТВО КОСТНОЙ ТКАНИ У ПАЦИЕНТОВ С РЕВМАТОИДНЫМ АРТРИТОМ
В.В. Поворознюк, Т.А. Карасевская, Н.И. Дзерович
ГУ «Институт геронтологии им. Д.Ф. Чеботарева НАМН Украины», Киев
Течение ревматоидного артрита (РА) сопровождается изменениями структурно-функционального состояния костной ткани в результате хронического персистирующего воспаления, нарушения функциональной активности пациентов и применения глюкокортикоидов (ГК), что приводит к повышению частоты вертебральных и других низкоэнергетических переломов у данной категории пациентов.
Цель: изучить влияние ГК на показатели качества трабекулярной костной ткани и минеральную плотность кости у больных РА и оценить динамику показателей на протяжении 1 года наблюдения.
Методы исследования. Обследовано 134 женщины с РА, которых распределили на три группы в зависимости от приема ГК: 1-ю группу составили 37 пациенток, которые не принимали ГК (средний возраст — 53,8±13,0 года; рост — 163,2±6,7 см, масса тела — 68,5±15,3 кг, средняя длительность заболевания — 8,7±7,1 года, длительность постменопаузального периода 8,7±7,4 года); 2-ю группу — 47 пациенток, которым назначались ГК только при обострении на короткий, менее 6 мес, срок (средний возраст — 50,9±10,6 года; рост 162,7±6,6 см, масса тела — 68,6±12,4 кг, средняя длительность заболевания — 9,9±8,8 года, длительность постменопаузального периода 5,7±6,3 года) и 3-ю группу — 50 больных, которые системно получали ГК в дозе ≥5 мг по преднизолону более 3 лет (средний возраст — 53,1±14,7 года; рост — 162,1±6,1 см, массса тела — 67,6±13,7 кг, средняя длительность заболевания — 8,6±6,7 года, длительность постменопаузального периода — 8,6±8,1 года). В качестве базисной терапии все пациентки принимали метотрексат в дозе от 7,5 до 20 мг/нед. По возрасту, основным антропометрическим параметрам, длительности заболевания, длительности постменопаузального периода группы не отличались.
Методом двухэнергетической рентгеновской абсорбциометрии (денситометр «Prodigy GE», «Lunar», США) определяли минеральную плотность костной ткани (МПКТ) на уровне поясничного отдела позвоночника, бедренной кости и костей предплечья. Показатель качества костной ткани поясничного отдела позвоночника (trabecular bone score — TBS LI–LIV) оценивали с помощью методики TBS iNsight («Med-Imaps», «Pessac», Франція). Анализировали динамику показателя качества костной ткани у пациентов 1-й и 3-й групп через 1 год при условии постоянной терапии, в том числе дозы ГК (для пациентов 3-й группы), и отсутствия остеотропного лечения.
Результаты. Показатель качества костной ткани TBS LI–LIV был достоверно ниже у пациентов 3-й группы по сравнению с пациентами 1 группы (1,147±0,168 мм-1 vs 1,250±0,135 мм-1 t=–3,07; p=0,003) и 2-й группы (1,274±0,138; t=–3,95; p=0,0002). Не установлено достоверных различий между группами по показателям МПКТ на уровне поясничного отдела позвоночника и бедренной кости. МПКТ на уровне костей предплечья была достоверно меньше у пациентов 3-й группы по сравнению с 1-й (0,583±0,176 г/см2 vs 0,675±0,229 г/см2; t=–2,18; p=0,032).
При определении динамики состояния костной ткани установлено, что через 1 год показатель TBS LI–LIV у пациентов 1-й группы составил 1,232±0,128 мм-1 (уменьшился на 1,4%), тогда как у пациентов 3-й группы — 1,080±0,114 мм-1 (снизился на 5,8%).
Выводы. Таким образом, при системном приеме ГК показатель качества костной ткани TBS LI–LIV достоверно снижается. При оценке состояния костной ткани у данной категории пациентов необходимо учитывать как показатели МПКТ разных участков скелета, так и TBS LI–LIV с целью определения риска вертебральных и других низкоэнергетических переломов.
КАЧЕСТВО ТРАБЕКУЛЯРНОЙ КОСТНОЙ ТКАНИ У ЖЕНЩИН С РЕВМАТОИДНЫМ АРТРИТОМ
В.В. Поворознюк, Т.А. Карасевская, Н.И. Дзерович
ГУ «Институт геронтологии им. Д.Ф. Чеботарева НАМН Украины», Киев
Цель: изучить влияние возраста, длительности постменопаузального периода и длительности заболевания на показатель качества трабекулярной костной ткани и минеральную плотность костной ткани (МПКТ) у женщин с ревматоидным артритом (РА).
Методы исследования. Обследовано 134 женщины с РА в возрасте от 31 года до 78 лет (средний возраст — 52,4±12,7 года; рост 162,6±6,4 см; масса тела — 68,5±13,8 кг; средняя длительность заболевания — 9,1±7,6 года). Методом двухэнергетической рентгеновской денситометрии («Prodigy», «GE Lunar», США) определяли МПКТ на уровне поясничного отдела позвоночника (ПОП), шейки бедренной кости (ШБК) и лучевой кости (ЛК). Показатель качества трабекулярной костной ткани ПОП (TBS LI–LIV) определяли с помощью методики TBS iNsight («Med-Imaps», «Pessac», Франция). Для оценки влияния возраста на показатели МПКТ и TBS LI–LIV пациенток распределили на пять групп по десятилетиям. Влияние длительности постменопаузального периода (ПМП) анализировали, распределив обследованных по группам: с сохраненной менструальной функцией, с длительностью ПМП <3 лет, 3–5 лет, 5–10 лет и >10 лет. Влияние длительности РА анализировали, выделив группы с длительностью заболевания <3 лет, 3–5 лет, 5–10 лет и >10 лет.
Результаты. У женщин, страдающих РА, начиная с 50 лет происходит достоверное ухудшение показателя качества костной ткани. Так, в возрастной группе 50–59 лет по сравнению с группой 30–39 лет показатель TBS LI–LIV достоверно ниже (1,156±0,140 мм-1 vs 1,318±0,155 мм-1; t=–3,5; p=0,001). С возрастом также происходит и снижение МПКТ. Так, МПКТ ПОП составила 0,994±0,245 г/cм2 vs 1,141±0,161 г/cм2; t=–2,1; p=0,04, ШБК — 0,716±0,245 г/cм2 vs 0,889±0,231 г/cм2; t=–2,4; p=0,02; ЛК — 0,585±0,231 г/cм2 vs 0,722±0,141 г/cм2; t=–2,1; p=0,04 по группам соответственно. При оценке влияния длительности ПМП установлено, что достоверно более низким является показатель TBS LI–LIV у женщин с длительностью ПМП >3 лет, по сравнению с женщинами, у которых менструальная функция сохранена (1,174±0,183 мм-1 vs 1,312±0,129 мм-1; t=–3,3; p=0,07). МПКТ ШБК достоверно снижается при длительности ПМП >5 лет, в сравнении с женщинами, у которых менопауза отсутствует (0,682±0,254 г/см2 vs 0,925±0,211 г/см2; t=–3,8; p=0,0004). На показатель TBS LI–LIV не влияет длительность заболевания. Однако МПКТ ЛК достоверно уменьшается при длительности заболевания >5 лет по сравнению с пациентами, которые болеют <3 лет (0,600±0,178 г/см2 vs 0,695±0,213 г/см2; t=–2,3; p=0,03). У пациентов, которые болеют 5–10 лет, в сравнении с пациентами, длительность РА у которых не превышает 3 лет, достоверно более низкой является МПКТ ПОП (0,983±0,192 г/см2 vs 1,115±0,181 г/см2; t=–2,7; p=0,008), а при длительности заболевания >10 лет — на уровне ШБК (0,654±0,224 г/см2 vs 0,783±0,245 г/см2; t=–2,1; p=0,04).
Выводы. Возраст в одинаковой мере влияет как на качество костной ткани, так и на МПКТ различных участков скелета, и начиная с 50 лет данные показатели достоверно снижаются. Достоверное уменьшение TBS LI–LIV наблюдается при длительности ПМП >3 лет. Длительность РА влияет на показатель МПКТ и достоверно снижается у пациентов, которые болеют >5 лет.
ОСОБЛИВОСТІ ЛІКУВАННЯ ПАЦІЄНТІВ З ОСТЕОАРТРИТОМ НА ФОНІ ДИСЛІПІДЕМІЇ
Г.О. Проценко, Н.С. Бойчук, В.В. Качур, С.О. Коваленко, К.А. Іванова
ДУ «ННЦ «Інституту кардіології ім. М.Д. Стражеска» НАМН України», Київ
Мета: визначити взаємозв’язок перебігу остеоартриту (ОА) із синовітом та порушенням ліпідного обміну, ефективність застосування фібратів у комплексному лікуванні хворих на ОА.
Методи дослідження. Оцінку клінічної ефективності застосування фенофібрату у комплексному лікуванні пацієнтів з ОА проведено на базі відділу некоронарогенних захворювань серця та клінічної ревматології ДУ «ННЦ «Інституту кардіології ім. М.Д. Стражеска» НАМН України». Було обстежено 50 хворих із достовірним діагнозом ОА (критерії ACR, 1997) колінних суглобів із синовітом віком 56,62±1,46 року, з яких чоловіків було 26% (n=13), жінок — 74% (n=37). Клінічні методи дослідження включали оцінку больового синдрому за візуальною аналоговою шкалою (ВАШ), альгодисфункціонального індексу Лекена (M. Leguesne, 1997), індексу EuroQol-5; ультразвукове дослідження суглобів; біохімічні дослідження крові: визначали вміст загального холестерину (ЗХС), ХС ліпопротеїдів високої щільності (ХС ЛПВЩ), ХС ліпопротеїдів низької щільності (ХС ЛПНЩ), ХС ліпопротеїдів дуже низької щільності (ХС ЛПДНЩ), тригліцеридів (ТГ), індексу атерогенності; С-реактивний білок (СРБ).
Усіх пацієнтів розподілили на дві групи: 1-ша група — 20 хворих на ОА з переважним ураженням колінних суглобів із наявністю синовіту та супутньою дисліпідемією та 2-га група — 30 хворих на ОА з переважним ураженням колінних суглобів з наявністю синовіту, без порушення ліпідного обміну.
У 1-й групі хворих середній вік становив 57,85±2,37 року, з них чоловіків було 4 (20%), жінок — 16 (80%). Усі пацієнти 1-ї групи отримували препарат фенофібрат у рекомендованій дозі 250 мг/добу (по 1 капсулі ввечері). Тривалість лікування становила 1 міс. Препарат призначали відповідно до рекомендацій виробника згідно із зазначеними в інструкції дозами. Усі пацієнти з больовим синдромом приймали нестероїдний протизапальний препарат (НПЗП) (диклофенак по 50 мг 2 рази на добу), короткими курсами, тиждень, на початку лікування.
У 2-й групі хворих середній вік становив 55,8±1,9 року, серед яких чоловіків було 9 (30%), жінок — 21 (70%), що отримувала НПЗП (диклофенак по 50 мг 2 рази на добу) протягом 1 міс. Обстежувані 1-ї групи продовжували приймати звичну терапію залежно від супутніх захворювань: у 14 осіб була наявна артеріальна гіпертензія (середні цифри артеріального тиску 165/95 мм рт. ст.) та у 1 хворого — цукровий діабет ІІ типу. Оскільки хворі 1-ї групи мали надмірну масу тіла, середні показники ІМТ у групі 29,06±1,24 кг/м² та супутню дисліпідемію, були дані рекомендації щодо харчування, з обмеженням жирів та вуглеводів.
Результати. У хворих 1-ї групи відзначено достовірне зниження рівня ТГ, показники знизились на 33% та відмічено тенденцію до нормалізації показників не лише ЛПВЩ і ТГ, а й усіх показників ліпідограми: рівень ЗХС зменшився на 1,02 (16,3%); рівень ЛПНЩ знизився на 0,77 (20,2%); рівень ЛПДНЩ зменшився на 0,21(19,4%); підвищився рівень ЛПВЩ на 0,17 (12,4%); в цілому показник індексу атерогенності знизився на 1,57 (35,5%).
Відзначена позитивна динаміка щодо показників лабораторної активності запального процесу: у 100% хворих досягнута нормалізація швидкості осідання еритроцитів (ШОЕ), СРП, в цілому показники ШОЕ знизилися на 38,5%, СРП — на 31,3%, що підтверджує роль запалення в прогресуванні ОА у пацієнтів із синовітом.
Протизапальна дія комплексної терапії підтверджується даними ультразвукового дослідження суглобів: зменшення або повна відсутність явищ синовіту (об’єм випоту знизився в середньому на 35%).
Висновки. Отримані результати свідчать про позитивний вплив комплексної терапії на артрологічний статус, активність запалення, показники ліпідного обміну у хворих на ОА з синовітом та дисліпідемією. Відзначено взаємозв’язок (r=0,3) між інтенсивністю запальної реакції та порушенням ліпідного обміну.
ХАРАКТЕРИСТИКА СУГЛОБОВОГО СИНДРОМУ ПРИ ПСОРІАТИЧНОМУ АРТРИТІ: МОЖЛИВОСТІ РІЗНИХ МЕТОДІВ ВІЗУАЛІЗАЦІЇ
Г.О. Проценко, В.В. Качур, К.А. Іванова, Н.С. Бойчук, С.О. Коваленко
ДУ «ННЦ Інститут кардіології ім. М.Д.Стражеска» НАМН України», Київ
Мета: оцінка проявів суглобового синдрому, а також діагностичної чутливості рентгенографії, магнітно-резонансної томографії та ультразвукового дослідження у хворих на псоріатичну артропатію (ПсА) для верифікації активності процесу.
Методи дослідження. У дослідження було включено 69 хворих із верифікованим ПсА. Всі пацієнти мали виражений суглобовий синдром (артрит ≥3 суглобів із негативним ревматоїдним фактором) в поєднанні з характерним ураженням шкіри, волосяної ділянки голови або псоріатичної оніходистрофії. Локальну активність запалення в суглобах оцінювали відповідно до модифікованого індексу активності синовіту з урахуванням таких клінічних проявів, як гіпертермія, набряк та болючість. При аналізі клінічного матеріалу враховувалися характер псоріазу і стадія його розвитку, поширеність, тип, а також давність захворювання.
Усім хворим на ПсА, включеним у дослідження, призначали рентгенологічне (РД), ультразвукове дослідження (УЗД) та магнітно-резонансну томографію (МРТ) суглобів.
За результатами РД, УЗД та МРТ у хворих на ПсА реєструвалися (за принципом «так» або «ні») такі зміни: наявність рідини в суглобах, проліферація синовіальної оболонки, зміни хряща, кісткові ерозії, остеофіти, дегенеративні зміни сухожиль, тендосиновіт.
Результати дослідження. Середній вік пацієнтів, включених у дослідження, становив 47,2±14,1 року, тривалість захворювання на псоріаз (Пс) була 17,5±9,7 року, ПсА в анамнезі зареєстрований в середньому впродовж 11,0±5,2 року. Кількість уражених суглобів на момент огляду становила 13,9±9, а число суглобів з активним запальним процесом і ознаками запалення досягало 9,0±6,7. Згідно з гендерним розподілом у дослідження було включено 46 жінок та 23 чоловіки. Індекс площі ураження і тяжкості Пс за шкалою PASI становив 25,0±9,3 бала.
Для оцінки суглобового синдрому та порівняння діагностичної чутливості вибрано три методи візуалізації: МРТ, УЗД та РД. За даними різних методів візуалізації рідина була частим симптомом і виявлялася у 137 (26,6%) суглобів за даними МРТ, 132 (25,6%) випадках при УЗД та 95 (18,5%) випадках при РД. Таким чином, чутливість щодо цього симптому МРТ переважала метод РД на 8,1%, чутливість УЗД була на 7,1% більша РД (p<0,05). Дифузне потовщення синовіальної оболонки виявлено в 192 (37,4%) суглобах за даними МРТ, 175 (34,0%) — за результатами УЗД та 120 (23,3%) випадках РД з вірогідною перевагою чутливості перших двох методів візуалізації (p<0,05). Відносно проліферації синовіальної оболонки отримані результати представлені як 7,2% (МРТ), 6,8% (УЗД) та 4,7% (РД); p>0,05. Вірогідна різниця діагностичної чутливості була отримана при дослідженні змін хрящової тканини: відносно потовщення — 62,3% (МРТ), 56,4% (УЗД), 33,1% (РД; p<0,05) та потоншення (7,6; 6,8 та 3,7% відповідно; p<0,05). Тендосиновіт виявлений у 18,3% випадках на МРТ, 12,6% суглобів — на УЗД та 7,6% — при РД; p<0,05. Відмічено дегенеративні зміни сухожилок: потовщення — в 5,1% (МРТ), 4,7% (УЗД) та 1,6% (РД) випадках (p<0,05). Відносно кісткових ерозій та остеофітів діагностична чутливість запропонованих методів вірогідно не відрізнялася (p>0,05).
Таким чином, у результаті проведеного дослідження верифіковані основні прояви суглобового синдрому та проаналізована діагностична чутливість РД, МРТ та УЗД у пацієнтів із ПсА.
Висновки. 1.Серед проявів суглобового синдрому при ПсА найчастішим є ураження дистальних відділів кистей і стоп та поліартрит. 2. З початком захворювання на Пс переважає частота моно- та олігоартриту та ураження дистальних відділів кистей і стоп, надалі підвищується вірогідність поліартритичного варіанта. 3. За оцінки діагностичної цінності різних методів візуалізації найчутливішим методом є МРТ, чутливість УЗД вірогідно не відрізнялася, чутливість РД була вірогідно менша щодо оцінки наявності рідини, дифузного потовщення синовіальної оболонки, змін хряща та оцінки стану сухожилля.
ОЦЕНКА ПОРАЖЕНИЯ ДУГООТРОСЧАТЫХ СУСТАВОВ И СВЯЗЬ С ФУНКЦИОНАЛЬНЫМИ ИЗМЕНЕНИЯ У БОЛЬНЫХ АНКИЛОЗИРУЮЩИМ СПОНДИЛИТОМ
Г.А. Проценко, С.А.Коваленко, В.В. Качур, Е.А. Иванова
ДУ «Национальный научный центр «Институт кардиологии им. Н.Д. Стражеско» НАМН Украины», Киев
Анкилозирующий спондилоартрит (АС) является хроническим воспалительным ревматическим заболеванием. Поражение дугоотростчатых суставов характеризуется более неблагоприятным течением заболевания.
Цель: оценить частоту поражения дугоотростчатых суставов с помощью магнитно-резонансной томографии (МРТ) и его влияние на функцию позвоночника у пациентов с АС.
Методы исследования. В исследовании приняли участие 53 мужчины с AС и длительностью заболевания ≤10 лет. Пациенты были распределены на две группы: 1-я группа — пациенты без поражения дугоотростчатых суставов, но имеющих синдесмофиты (n=18), 2-я группа — пациенты с поражением дугоотростчатых суставов (n=35). Все оценки проводили по 10-балльным шкалам оценки мобильности позвоночника в шейном, грудном, поясничном отделе позвоночника.
Результаты. Поражение дугоотростчатых суставов имеет высокую распространенность в начале заболевания (61,40%) и предшествует в большинстве случаев поражению тел позвонков и связок. Поражение такого рода отмечали чаще всего у пациентов с периферической формой заболевания: у 25 (71,42%) пациентов.
Подвижность позвоночника у пациентов без поражения дугоотростчатых суставов но с наличием синдесмофитов: ротация шеи 1,94±0,70 балла, экскурсия грудной клетки — 4,32±0,57 см, боковое сгибание — 2,88±0,85 балла, модифицированный тест Шобера — 5,33±0,83 балла.
Подвижность позвоночника у больных с поражениями дугоотростчатых суставов: ротация шеи — 4,57±0,38 балла, экскурсия грудной клетки — 2,79±0,27 см, боковое сгибание — 5,22±0,41 балла, модифицированный тест Шобера — 7,87±0,35 балла.
Также выявлена связь между количеством пораженных суставов и выраженностью функциональных изменений в позвоночнике.
Выводы. Выявлена связь между тяжестью функциональных нарушений в шейном и поясничном отделах позвоночника, экскурсии грудной клетки и наличием поражения дугоотростчатых суставов. Различия между группами с и без поражения дугоотростчатых суставов статистически достоверны, что указывает на более неблагоприятный прогноз для клинического течения заболевания.
РОЛЬ АНТИГЕННОГО ВПЛИВУ В АНТЕНАТАЛЬНИЙ ПЕРІОД У ФОРМУВАННІ ПАТОЛОГІЇ СЕРЦЕВО-СУДИННОЇ СИСТЕМИ У ДІТЕЙ
Ю.Г. Резніченко, О.М. Лебединець, М.А. Волошин
Запорізький державний медичний університет
Формування патології серцево-судинної системи у дітей залишається однією з актуальних проблем. Однак вплив патології в антенатальний період та внутрішньоутробних інфекцій на стан серцево-судинної у дітей вивчені недостатньо.
Мета: охарактеризувати стан серцево-судинної системи у дітей з патологією антенатального періоду та внутрішньоутробними інфекціями й морфогенез серця у експериментальних тварин після введення антигенів в антенатальний період.
Методи дослідження. Під спостереженням перебували 133 дитини раннього віку: 20 дітей із вродженим токсоплазмозом без вроджених вад серця, кардиту, 20 здорових на момент обстеження дітей, у матерів яких під час вагітності були прояви прееклампсії легкого ступеня, 45 дітей, хворих на кардит на тлі вродженого токсоплазмозу, 20 дітей, хворих на кардит на тлі інфекцій вірусно-бактеріальної етіології, 28 здорових дітей (контрольна група). Усім дітям проведено комплексне клініко-інструментальне обстеження із включенням допплерехокардіографії, холтерівського моніторування ЕКГ, визначення метаболітів оксиду азоту, активності синтази оксиду азоту, середніх молекул, циркулюючих імунних комплексів у сироватці крові, катехоламінів та інсуліну в еритроцитах. В експерименті вивчено особливості постнатального морфогенезу серця щурів лінії Вістар після внутрішньоутробного введення антигенів різної природи (імуноглобулін людський, вакцина Ваксигрип) за методом М.А. Волошина, що моделює порушення бар’єрної функції плаценти з проникненням до плода чужорідних білкових антигенів наприкінці вагітності.
Результати. У дітей обох груп, хворих на кардит, у дебюті захворювання виявлено концентричне ремоделювання міокарда лівого шлуночка серця з достовірним підвищенням показників абсолютної та відносної товщини стінок, маси та індексу маси міокарда лівого шлуночка, порушення серцевого ритму, провідності та реполяризації, напруженості регуляції серцевого ритму з достовірною перевагою симпатичних впливів, ознаки ендотеліальної дисфункції та ендотоксикозу, підвищення депонування катехоламінів та зниження інсуліну в еритроцитах. У дітей з кардитами на тлі вірусно-бактеріальних інфекцій через 12 міс більшість показників наближалась до показників здорових дітей. У дітей із вродженим токсоплазмозом вищенаведені достовірні зміни зберігалися тривало та реєструвалися і через 12 міс від початку терапії. У дітей від матерів із прееклампсією легкого ступеня у період вагітності відзначали прояви ендотоксикозу, порушення ритму, провідності та реполяризації, активацію симпатичної ланки вегетативної нервової системи. Більш виражені зміни, включаючи морфологічні зміни з концентричним ремоделюванням міокарда лівого шлуночка, встановлені у дітей із токсоплазмозом без кардитів. Вірогідно, ці зміни є наслідком антигенного впливу в антенатальний період та свідчать про зміни морфогенезу міокарда та його провідної системи. На цьому тлі значно частіше можуть розвиватися патологічні процеси в міокарді.
У тварин після введення антигенів виявлені достовірні зміни порівняно з показниками інтактної та контрольної груп: підвищення маси тіла з 14-ї по 60-ту добу життя з одночасним зниженням відносної маси серця з 7-ї по 60-ту добу, зниження вмісту кардіоміоцитів та підвищення частки сполучнотканинного компонента в міокарді шлуночків серця з 1-ї по 60-ту добу життя, зниження на 1-шу добу та підвищення на 60-ту добу вмісту глікогену в кардіоміоцитах. Виявлені зміни не залежали від природи антигену, носили однотипний характер, свідчили про зміну процесів морфогенезу серця після впливу антигенів в антенатальний період.
Висновки. На підставі отриманих даних обґрунтована загальнобіологічна закономірність впливу антигенного навантаження в антенатальний період на формування метаболічних порушень, патології серцево-судинної системи в майбутньому житті.
РАННИЙ РЕВМАТОИДНЫЙ АРТРИТ: СОВРЕМЕННЫЙ ВЗГЛЯД НА ИНДИВИДУАЛИЗАЦИЮ ПРОГРАМЫ ТЕРАПИИ
Д.Г. Рекалов, М.В. Шевченко
Запорожский государственный медицинский университет
Лечение пациентов с ревматоидным артритом (РА) остается одной из наиболее сложных проблем клинической ревматологии. У большинства пациентов раннее начало моно- (метотрексат (МТХ)) или комбинированной терапии традиционными базисными противоревматическими препаратами (БПРП) не всегда замедляет деструкцию суставных поверхностей, несмотря на положительную динамику клинических показателей активности воспаления.
Цель: изучить динамику провоспалительных цитокинов у больных РА на фоне терапии БПРП (МТХ) в комбинации с ингибиторами фактора некроза опухоли (иФНО)-α (инфликсимаб (ИНФ) и адалимумаб (АДА)).
Методы исследования. Представлены данные обследованных 156 пациентов в возрасте старше 18 лет с ранним РА (продолжительностью симптомов заболевания не более 12 мес) или подозрением на наличие РА, которые имели менее 1 припухший сустав, продолжительность симптомов заболевания не менее 6 нед (суставной синдром носил устойчивый характер с тенденцией к хронизации) и соответственно требовали назначения МТХ в качестве БПРП. Из общего числа были отобраны 40 пациентов, которым проводилась терапия с иФНО-α: ИНФ (20 пациентов) и АДА (20 пациентов).
Среди лабораторных показателей, учитывая цель исследования, мы определили: уровень С-реактивного протеина (СРП), ревматоидного фактора (РФ), уровень антител к циклическому цитруллинированному пептиду (антиЦЦП).
Результаты. При оценке динамики показателей, до и после проведенной терапии выявлены значительные вариации в показателях СРП и РФ. В группе АДА + МТХ снижение СРП составило 40,25%, в группе ИНФ + МТХ — 19,71% соответственно. Подобные изменения СРП выявлены и в группе, в которой проводилась монотерапия МТХ (моноМТХ) — снижение на 37,65%, однако при анализе содержания РФ — тенденция уже несколько иная. При сравнении начальных значений РФ и после проведенного лечения в группах АДА + МТХ — снижение составило 38,17%, в группе ИНФ + МТХ — 29,68%, а у пациентов с моноМТХ — 36,94%. Еще один показатель, который мы оценили в динамике — антиЦЦП. Динамика начальных и конечных результатов составила: в группах АДА + МТХ — 40,85%; у пациентов с ИНФ + МТХ — 46,19%, а в группе моноМТХ — 37,75% соответственно (р<0,001).
Выводы. При применении адекватной фармакотерапии у большинства пациентов наблюдалась нормализация клинико-лабораторных показателей, но наиболее значимо на фоне добавления к стандартной терапии иФНО-α (ИНФ, АДА).
Программа терапии АДА + МТХ является предпочтительной в терапии при раннем РА.
ГЕПАТОТОКСИЧНІСТЬ ТА ШЛЯХИ ЇЇ ПОДОЛАННЯ ПРИ ЗАСТОСУВАННІ НЕСТЕРОЇДНИХ ПРОТИЗАПАЛЬНИХ ПРЕПАРАТІВ
А.С. Свінціцький
Національний медичний університет ім. О.О. Богомольця, Київ
Основна негативна властивість усіх нестероїдних протизапальних препаратів (НПЗП) — високий ризик розвитку побічних реакцій з боку органів травлення. У 30–40% пацієнтів, які застосовують НПЗП, відзначають диспептичні розлади, у 10–20% — ерозії та виразки шлунка і дванадцятипалої кишки, у 2–5% — кровотечі та перфорації, у 1–5% хворих виявляється гепатотоксичний ефект; при цьому серйозні (клінічно виражені) гепатотоксичні реакції відзначаються суттєво рідше — близько 1 випадку на 10 000 осіб, які регулярно застосовують НПЗП.
Як свідчать дані літературі та наші власні дослідження, НПЗП-асоційовані гепатопатії значно частіше розвиваються при тривалому прийомі НПЗП у високих дозах, у осіб із супутніми захворюваннями гепатобіліарної системи, метаболічними порушеннями тощо, особливо в разі поєднаного застосування НПЗП з іншими гепатотоксичними медикаментами, прийомом алкогольних напоїв. При цьому патологічні зміни з боку печінки частіше виникають на фоні прийому суліндаку, диклофенаку і німесуліду, рідше — целекоксибу і мелоксикаму.
До чинників, які сприяють розвитку НПЗП-асоційованих гепатопатій, відносять жіночу стать, похилий вік, патологію гепатобіліарної системи, наявність тяжких захворювань, що призводять до погіршення кровотоку в печінці, одночасний прийом медикаментів, які впливають на метаболізм НПЗП, генетичні аномалії активності ферментів, що визначають біотрансформацію НПЗП та їх метаболітів, гіпоальбумінемію, зростання рівнів трансаміназ в анамнезі на фоні лікування НПЗП.
Гепатотоксична дія НПЗП розвивається за імуноалергічним, токсичним або змішаним механізмами. Для імуноалергічного гепатиту характерні розвиток на початку прийому НПЗП та відсутність зв’язку між дозою та клінічною симптоматикою. Токсичний гепатит розвивається на фоні тривалого прийому НПЗП (декілька місяців) і, як правило, проявляється жовтяницею, що пов’язане з утворенням цитотоксичних метаболітів, які не можуть бути знешкоджені за умов виснаження глутатіонових резервів печінки (при хронічній інтоксикації, алкоголізмі тощо).
Ймовірність виникнення уражень печінки підтверджується тим, що більшість НПЗП проходять етап біотрансформації з утворенням небезпечних метаболітів саме в печінці. Подальше виснаження запасів глутатіону призводить до накопичення вільнорадикального метаболіту та ініціації перекисного окиснення ліпідів, що відіграє вирішальну роль в невротизації гепатоцитів при хронічному отруєнні.
Усі НПЗП, включаючи ЦОГ-2-селективні, можуть викликати розвиток серйозних гепатотоксичних реакцій (холестатична жовтяниця, фульмінантна печінкова недостатність). Гепатотоксичний ефект НПЗП може проявлятися й гепатогенною енцефалопатією — синдромом Рея (поєднання гострого ураження печінки, гіпоглікемії, ацидозу, вираженої енцефалопатії у дітей і підлітків).
Деякі препарати здатні взаємодіяти з НПЗП, впливаючи на їх фармакокінетику. В осіб літнього віку та в разі наявності гепатобіліарної патології цей процес виражений сильніше.
Дані літератури та наш досвід застосування НПЗП, особливо у пацієнтів похилого віку, свідчить про те, що для зниження ризику розвитку побічних реакцій, в тому числі й НПЗП-гепатопатій, потрібно:
• призначати НПЗП лише за суворими показаннями, проводити повний рекомендований курс лікування і дотримуватися режиму дозування;
• починати прийом НПЗП з низьких доз, контролюючи протягом 1 міс стан хворого і підвищуючи дозу НПЗП поступово;
• за можливості уникати призначення високотоксичних НПЗП;
• не призначати НПЗП амбулаторно (особливо за наявності в анамнезі у хворих пептичної виразки чи після тривалого лікування їх глюкокортикоїдами або антикоагулянтами);
• щомісячно визначати рівні АлАТ і АсАТ впродовж 1-го року лікування НПЗП; при появі клінічних чи лабораторних ознак ураження печінки слід негайно відмінити препарат;
• з обережністю необхідно підходити до призначення НПЗП за наявності супутніх захворювань, схильності до зловживання алкоголем тощо;
• слід мати на увазі, що при повторному призначенні препарату, що викликав гепатотоксичний ефект в анамнезі, ураження печінки часто розвивається швидше і перебіг його важчий;
• при перехресній гепатотоксичності різних НПЗП одного хімічного класу слід уникати їх застосування, якщо в анамнезі є вказівки на гепатотоксичність хоча б одного з них.
Таким чином, незважаючи на те, що передбачити розвиток гепатотоксичного ефекту при призначенні НПЗП в кожному конкретному випадку важко, детальний аналіз анамнестичних даних, клінічної картини, результатів інструментальних методів дослідження, регулярний біохімічний контроль печінкових ферментів дозволяє провести необхідні заходи.
ПОДАГРА: У ФОКУСІ КОМОРБІДНИЙ СТАН та ЛІКУВАННЯ
Н.М. Середюк, М.О. Вацеба
Івано-Франківський національний медичний університет
Існує достатня доказова база поширеності коморбідних станів, зокрема поєднання подагри, ожиріння, артеріальної гіпертензії (АГ) та ішемічної хвороби серця (ІХС).
Мета: встановити особливості коморбідного стану при поєднанні подагри, ожиріння, АГ та ІХС.
Методи дослідження. Обстежено 70 хворих на подагру, в поєднанні з есенціальною АГ ІІ ступеня, ІХС (СС І–ІІ ФК) та ожирінням (І, ІІ та ІІІ ступеня). Середній вік обстежених хворих становив 60,2±1,2 року. 15 здорових осіб слугували контролем норми показників. Учасників рандомізовано в чотири групи: 1-ша група — 17 хворих, які отримували базову терапію (БТ) — пролонговані нітрати, блокатори β-адренорецепторів, інгібітори ангіотензинперетворювального ферменту (АПФ), ацетилсаліцилову кислоту та статини; 2-га група — 18 хворих, які окрім БТ, отримували додатково блокатор рецепторів ангіотензину II (лозартан) (Л) в дозі 50–100 мг/добу; 3-тя група — 18 хворих, які, окрім БТ, отримували додатково мельдонію дигідрат (М) по 5 мл 10% розчину в 20 мл 0,9% розчину натрію хлориду внутрішньовенно струминно протягом 10 днів з подальшим переходом на пероральну форму (250 мг 2 рази на добу); 4-та група — 17 хворих, які, окрім БТ, додатково отримували Л та М. До і після лікування визначали індекс жорсткості аорти (ІЖА) (за відношенням пульсовий артеріальний тиск/ударний об’єм мм рт. ст./мл), товщину інтима–медіа комплексу (ТІМК, мм), CAVI (cardio-ankle vascular index), ендотелін-1 (ЕТ-1), значення ендотелійзалежної вазодилатації (ЕЗВД).
Результати. Найбільш ефективним виявилося лікування у 4-й групі хворих, в яких після лікування рівень ЕТ-1 знизився на 60,1% (p<0,001), ІЖА — на 40,3% (p<0,001), швидкості поширення пульсової хвилі — на 21,48% (p<0,001), CAVI — 9,8% (p<0,001), ТІМК — на 5,0% (p<0,001), ЕЗВД збільшилася на 75,5% (p<0,001). В інших (2-й і 3-й) группах ефект був нижчим (p<0,05) або недостатнім (1-ша група) (p>0,05).
Висновки. 1. Подагра суттєво погіршує перебіг ожиріння, АГ, ІХС; посилюється жорсткість артеріальної стінки та ендотеліальна дисфункція. 2. Мельдонію дигідрат та блокатор рецепторів ангіотензину II (Л) на тлі БТ стимулюють ЕЗВД та підвищують пружно-еластичні властивості судин м’язового типу. 3. Хворим із коморбідною кардіоревматологічною патологією (АГ, ІХС, подагра та ожиріння) необхідно використовувати дослідження CAVI-маркера, ЕТ-1, ЕЗВД та ТІМК.
РЕВМАТИЧЕСКИЕ ЗАБОЛЕВАНИЯ И ЭКОЛОГИЯ
О.В. Синяченко
Национальный медицинский университет им. Максима Горького, Донецк
Цель — изучение распространенности и клинико-патогенетических особенностей отдельных ревматических заболеваний в зависимости от различных неблагоприятных экологических воздействий на организм человека. Характер течения ревматизма и развитие его отдельных проявлений тесно связаны с негативными экологическими факторами внешней среды, что, в первую очередь, характерно для пациентов с хронической ревматической болезнью сердца, у которых заболевание началось в детском возрасте, и что мало влияет на возникновение острой ревматической лихорадки у детей, причем имеется прямая корреляционная связь параметров индекса прогрессирования ревматизма (Y) от интегрального экологического индекса, влияние на Y степеней загрязнения воздуха, воды и почвы ксенобиотиками и токсичными микроэлементами (МЭ) отдельными отраслями промышленности, транспортом и сельским хозяйством. Распространенность остеоартроза среди городского населения в 1,8 раза выше, чем среди сельского, на что влияют интегральные экологические факторы. К тому же, существуют корреляционные связи эпидемиологического показателя с выраженностью ксенобиотической нагрузки на атмосферу регионов проживания больных химической промышленности, параметров во вдыхаемом воздухе 3,4-бензпирена, различных диоксидов и сероводорода, с содержанием в почве Ва и Hg, с уровнями в питьевой воде хлоридов и нитратов (прямая корреляция), со степенью минерализации и жесткости воды, с концентрациями сульфатов и фосфатов (обратная). Клиническая манифестация болезни в городах наступает в среднем на 7 лет раньше, в 2 раза чаще регистрируется лигаментоз, а степень выраженности реактивного синовита в 1,6 раза больше. Распространенность ревматоидного артрита зависит от уровня загрязнения окружающей среды крупными промышленными предприятиями, сельским хозяйством, автомобильным и железнодорожным транспортом, а интегральный региональный эпидемиологический показатель болезни определяется уровнем в атмосфере аммиака и фенола, степенью минерализации питьевой воды и концентрацией в ней сульфатов, содержанием в грунте и грунтовых водах токсичных (Ba, Bi, Sn, Li, Ti) и эссенциальных (Mn, Zn) МЭ. Уровень загрязнения атмосферы ксенобиотиками влияет на интегральные сонографические признаки артикулярного синдрома, частоту формирования тендовагинитов, энтезопатий, лигаментоза, внутрисуставных кальцинатов, системного остеопороза, хондромных тел, изменений рогов менисков при гоните, на поражение периферической нервной системы и темпы прогрессирования заболевания. В изменениях периартикулярных тканей первостепенное значение отводится развитию в регионе производства строительных материалов, угледобывающей и машиностроительной отраслей промышленности. Низкое гигиеническое качество питьевой воды в регионах проживания таких больных оказывает влияние на темпы прогрессирования артрита, развитие серопозитивности по ревматоидному фактору, частоту поражения периферической нервной системы, формирование системного остеопороза, причем от минерализации, жесткости, химического состава и микроэлементного состава воды зависят структурные изменения суставов, а содержание МЭ в грунтовых водах коррелируют с концентрациями токсичных МЭ в волосах пациентов. Изменения МЭ-состава почвы способствуют развитию энтезопатий, кист Бейкера, дигитального артериита и синдрома Шегрена, что взаимосвязано с тяжестью загрязнения отдельными отраслями промышленности воздуха и воды аммиаком, 3,4-бензпиреном, фенолом, нитратами, фосфатами, Ba, Mn и Ti. Содержание Со, Cu, Fe, Li, Sr и Zn в крови больных подагрой зависит от изученных в почве и грунтовых водах МЭ, тогда как концентрации в крови B, Ba, Mn, Pb и S с микроэлементным составов в окружающей среде не связаны. В свою очередь, показатели в волосах B, Li и Sr определяются уровнями в почве и грунтовых водах регионов проживания пациентов Ba, Ni и Ti. На степень активности псориатического артрита оказывают дисперсионное влияние уровни в почве зон проживания больных Cu и V, на частоту поражения лучезапястных сочленений — содержание Bi, суставов стоп — Co, Cu, Ni, Pb и V, позвоночника — Ва и Ве, на степень сужения суставных щелей — Ba, Be, Hg, Mo, Sn и Zn, развитие субхондрального склероза — Ti, остеокистоза и эпифизарного остеопороза — Ba и Ti. У таких больных активность заболевания регрессионно зависит от содержания в грунтовых водах Li, распространенность суставного воспаления — от концентраци Zn, степень узураций поверхностей костей определяется Ni. Распространенность системной красной волчанки в регионах связана с развитием химической промышленности и динасового производства, с уровнями в атмосфере диоксида углерода и 3,4-бензпирена, с содержанием в почве Bi и Со, а в грунтовых водах Ва и Ni. Интегральные значения неблагоприятной экологической ситуации воздушного пространства влияют на развитие и тяжесть поражения кожи, сердца и почек, отдельные отрасли промышленности, транспорта и сельского хозяйства — на изменения щитовидной железы, возникновение асептических остеонекрозов, легочной гипертензии и диастолической дисфункции левого желудочка сердца. Показатели в окружающей среде Ba, Be, Li, Ti, V определяют формирование антиядерных аутоантител, воздействуя на содержание Ba и Li в волосах и крови пациентов, от которых зависит течение патологического процесса. Существует связь распространенности системных васкулитов с развитием в регионе проживания людей угледобывающей отрасли промышленности и с такими факторами окружающей среды, как степень накопления в атмосфере промышленных отходов, содержание в воздухе фенола и диоксида серы, концентрация в питьевой воде фосфатов, параметры в почве и грунтовых водах Hg, Pb и Zn, причем наблюдаются особенности зависимости эпидемиологического показателя от экологических при неспецифическом аортоартериите Такаясу, гранулематозном полиангиите Вегенера и криоглобулинемическом васкулите, но не геморрагическом васкулите, узелковом панартериите и эозинофильном васкулите Черджа — Стросс.
ОСОБЛИВОСТІ СТОМАТОЛОГІЧНОГО СТАТУСУ У ПАЦІЄНТІВ іЗ РЕВМАТОЇДНИМ АРТРИТОМ і ГЛЮКОКОРТИКОЇД-ІНДУКОВАНИМ ОСТЕОПОРОЗОМ
С.І. Сміян, І.І. Білозецький
ДВНЗ «Тернопільський державний медичний університет ім. І.Я. Горбачевського МОЗ України»
Виникнення остеопорозу за умов ревматоїдного артритузумовлено прискоренням процесів ремоделювання кісткової тканини, що призводить до дисбалансу між резорбцією та формуванням і створює передумови до системних структурно-функціональних порушень. З іншого боку, генералізований парадонтит, будучи вогнищем інфекції сприяє поглибленню аутоімунних процесів, погіршує перебіг основного захворювання. Застосування в лікуванні при ревматоїдному артриті хворобо-одифікуючих препаратів, таких як метотрексат у поєднанні з глюкокортикоїдами також негативно впливає на стоматологічний статус, а роль біфосфонатів, які використовуються з метою корекції мінеральної щільності кісткової системи у пацієнтів із глюкокортикоїдним остеопорозом також до кінця не з’ясована.
Мета: вивчення стоматологічного статусу у пацієнтів із ревматоїдним артритом і глюкокортикоїд-індукованим остеопорозом залежно від активності основного захворювання.
Методи дослідження. Для реалізації мети обстежено 23 пацієнтки з ревматоїдним артритом, середній вік яких становив 34±7,8 року. Діагноз ревматоїдного артриту веріфікований згідно з критеріями діагнозу ACR/EULAR, 2010. В усіх обстежених виявлено явища остеопорозу за даними рентгенівської денситометрії (DPX-A «Lunar») з кількісним вираженням мінеральної щільності кісткової тканини за показником Т <–2,5 ум. од. Всі пацієнтки були розподілені на дві групи — 1-ша група — серопозитивний ревматоїдний артрит, 2-га — серонегативний. Стоматологічне обстеження хворих включало огляд, визначення інтенсивності кровоточивості ясен, глибини пародонтальних кишеней (ПК), наявності та характеру ексудату в ПК, рухливості зубів. Стан гігієни порожнини рота оцінювали за допомогою індексу Гріна — Вермільона.
Результати. Аналіз стоматологічного статусу пацієнток із серопозитивним ревматоїдним артритом свідчив про наявність гіперемії ясен та помірного набряку, тоді як у хворих 2-ї групи констатували незначний набряк та гіперемію. Відповідно показники РМА достовірно різнилися між собою і становили 2,81±0,34 і 1,23±0,17. Аналогічно було змінено й кількісне вираження показника кровоточивості (2,67±0,23 і 1,22±0,15), Гріна — Вермільйона (2,94±0,41 і 1,35±0,18), глибини ПК (4,62±0,31 і 3,35±0,26 мм). Одночасно слід зазначити, що у пацієнтів 1-ї групи констатовано серозно-гнійні виділення з ПК, тоді як за умов серонегативного ревматоїдного артриту — лише серозного. Серед 12 обстежених 1-ї групи встановлено, що 8 мали рухливість зубів ІІ ступеня і 4 — і ступеня, тоді як у обстежених 2-ї групи рухомість зубів і ступеня констатована у 7. Індекс КПВ за умов наявності серопозитивного ревматоїдного артриту був достовірно вищим.
Висновки. Встановлено зростання усіх досліджуваних клінічних показників стану пародонта у хворих на ревматоїдний артрит із глюкокортикоїд-індукованим остеопорозом залежно від інтенсивності запального процесу, що потребує оптимізації підходів до оцінки стоматологічного статусу і розробки підходів до лікування хворих цієї категорії. Перспективою подальших досліджень є вивчення стоматологічного статусу залежно від видів і тривалості остеопротекторної терапії.
АРТЕРІАЛЬНА ГІПЕРТЕНЗІЯ та МЕТАБОЛІЧНИЙ СИНДРОМ ПРИ ПОДАГРІ: ОЦІНКА КАРДІОВАСКУЛЯРНОГО РИЗИКУ
С.І. Сміян, Р.Р. Коморовський, Ж.О. Антюк, У.С. Слаба
Тернопільський державний медичний університет ім. І.Я. Горбачевського
Тернопільська університетська лікарня
Мета: оцінити кардіоваскулярний ризик у хворих на подагру залежно від наявності або відсутності метаболічного синдрому і артеріальної гіпертензії.
Методи дослідження. Обстежено 165 хворих на подагру (усі чоловіки) віком від 41 до 74 років. До 1-ї групи увійшли пацієнти без супутньої патології, до 2-ї — хворі з артеріальною гіпертензією, до 3-ї — з супутнім метаболічним синдромом. Верифікацію подагри проводили згідно з діагностичними критеріями Американської колегії ревматологів. Метаболічний синдром діагностували згідно з Європейськими рекомендаціями (2003). Пуриновий обмін оцінювали на підставі концентрації сечової кислоти. Ризик смерті від серцево-судинних захворювань протягом наступних 10 років оцінювали за шкалою EuroSCORE, класифікуючи ризик фатальних ускладнень як низький (<5%), високий (5–10%), та дуже високий (>10%).
Результати. Оцінка відомих факторів кардіоваскулярного ризику свідчила про те, що більше половини хворих на подагру курять, ведуть малорухомий спосіб життя, причому кількість таких пацієнтів достовірно зростає у групі з метаболічним синдромом. Крім того, хворі на подагру та артеріальну гіпертензію із метаболічним синдромом мають вищі рівні сечової кислоти в поєднанні з більш тяжким перебігом основного захворювання. Ризик фатальних серцево-судинних ускладнень у хворих на подагру в поєднанні з метаболічним синдромом значно вищий, ніж у пацієнтів без супутньої патології.
Висновки. Стратифікація кардіоваскулярного ризику необхідна у пацієнтів з подагрою. У разі поєднання метаболічного синдрому і подагри доцільно звертати особливу увагу на профілактику серцево-судинних ускладнень, оскільки успішне лікування лише подагри не знижує кардіоваскулярного ризику.
ЧАСТОТА ВИНИКНЕННЯ та ПЕРЕБІГ ПОДАГРИЧНОЇ НЕФРОПАТІЇ У ХВОРИХ на ПОДАГРУ
С.І. Сміян, М.В. Франчук, У.С. Слаба, О.С. Маховська, У.Я. Франчук
Тернопільський державний медичний університет ім. І.Я. Горбачевського
В останні роки зросла частка ревматичних захворювань у світі, проте навіть не цей факт зумовлює актуальність вивчення проблеми, а перш за все варіабельність клінічних форм, поява нових факторів ризику та зміни в особливостях перебігу хвороб, що ускладнює діагностику, потребує розробки сучасних методів лікування та удосконалення тактики ведення пацієнтів із патологією кістково-суглобової системи. Подагра як хронічне захворювання не обмежується лише ураженням суглобів, а становить практично системне захворювання, особливою мішенню якого є ураження нирок, яке за умов пізньої діагностики та неадекватного лікування може бути причиною підвищення смертності. На сьогодні частка хворих з подагричною нефропатією зростає, тому актуальним є дослідження, що проводяться в ракурсі стратифікації факторів ризику розвитку ураження нирок при подагрі.
Мета: визначити частоту виникнення та перебіг подагричної нефропатії у хворих на подагру.
Методи дослідження. Для реалізації поставленої мети обстежено 100 хворих на подагру (усі чоловічої статі) віком від 39 до 72 років. Учасників дослідження розподілили на дві групи: до 1-ї увійшли пацієнти з подагричною нефропатією (32%), до 2-ї — хворі на подагру без ураження нирок (68%). Отримані дані оброблені за допомогою персонального комп’ютера та програми Microsoft Office Excel 2003. Верифікацію подагри проводили згідно з діагностичними критеріями Американської колегії ревматологів.
Результати. Встановлено, що при тривалості захворювання >10 років ризик ураження нирок зростає в 4 рази порівняно з тривалістю захворювання ≤10 років. У хворих із подагричною нефропатією втрата працездатності відзначалася на 11% частіше. Тяжкий перебіг хвороби в 2 рази частіше асоціювався з ураженням сечостатевої системи. Поряд із тим, констатовано, що артеріальна гіпертензія та ішемічна хвороба серця в 2 рази частіше були у хворих із подагричною нефропатією та сечокам’яною хворобою. У пацієнтів, які взяли участь у дослідженні та мали ознаки ураження нирок, на 12% частіше виявляли тофусну подагру і достовірно (р<0,05) вищий рівень сечової кислоти та більш виражений прояв дисліпідемії.
Висновки. При тривалості захворювання >10 років ризик ураження нирок становить 78%. У хворих на подагру із супутнім ураженням нирок відзначають високий рівень гіперурикемії в поєднанні з більш тяжким перебігом основного захворювання та великою часткою супутньої патології, що потребує мультидисциплінарного підходу до ведення цієї когорти пацієнтів.
ОТДАЛЕННЫЕ РЕЗУЛЬТАТЫ ЛЕЧЕНИЯ ПОЛИАРТРИТИЧЕСКОГО ВАРИАНТА РЕАКТИВНОГО ХЛАМИДИО-ИНДУЦИРОВАННОГО АРТРИТА
Н.Ф. Сорока, И.А. Варонько
УО «Белорусский государственный медицинский университет», Минск, Республика Беларусь
Реактивный хламидио-индуцированный артрит (РХА) протекает по нескольким клиническим вариантами: моно-, олиго-, поли-, артрит со спондилоартритом, энтезопатия с полиартралгией. Прогноз и исходы разных клинических вариантов РХА отличаются друг от друга. Наиболее неблагоприятный прогноз имеют полиартритический вариант и артрит со спондилоартритом.
Цель: анализ отдаленных исходов РХА, протекающего по полиартритическому варианту.
Методы исследования. Пациенты с РХА, отобранные согласно международным диагностическим критериям, выработанным экспертами по итогам рабочего совещания (Берлин, 1999). Из общей группы пациентов были выделены 38 человек, страдающих РХА с поражением более чем 4 суставов. Соотношение мужчин и женщин было 1:1,4. Возраст пациентов варьировал от 15 до 58 лет (средний возраст — 34±11 лет). Продолжительность суставного синдрома до включения в исследование в среднем составила 1±0,5 года. Хламидийная инфекция методом полимеразной цепной реакции (ПЦР) или культуральным способом (культура клеток McCoy) подтверждена у всех (100%) пациентов, включенных в исследование. Изначально пациенты с полиартритами не соответствовали критериям ревматоидного артрита 1987 и 2010 г. Суставной синдром носил асимметричный характер с преимущественным поражением суставов нижних конечностей, ренгенологические изменения в суставах отсутствовали либо были нетипичными для ревматоидного артрита. В сыворотке крови ни у одного пациента не выявляли ревматоидный фактор и анти-ССР.
Всем пациентам с РХА применяли одинаковую схему антибактериальной терапии: тетрациклины — 10 дней, фторхинолоны — 10 дней, антибиотики макролидного ряда — 10 дней. Вся схема лечения антибиотиками занимала в общей сложности 30 дней. С учетом суставного синдрома пациенты принимали внутрь нестероидные противовоспалительные препараты (НПВП) в терапевтических дозах: диклофенак — 150 мг/сут или мелоксикам 15 мг/сут нимесулид — 200 мг/сут. Все пациенты данной группы принимали также глюкокортикоиды (ГК) в дозе от 5 до 15 мг/сут в пересчете на преднизолон. После курса антибактериальной терапии всем пациентам был назначен сульфасалазин 2 г/сут не менее чем на 6 мес.
Результаты исследования. Длительность последующего наблюдения пациентов данной группы составила от 2 до 10 лет. На протяжении этого периода больные находились под наблюдением одного специалиста. По показаниям им назначали антибактериальную и/или противовоспалительную терапию. Только 2 (5%) пациента выздоровели. Течение их заболевания было острым (продолжительность суставного синдрома — до 6 мес), по мере эрадикации Chl. trachomatis они избавились от суставного синдрома. У остальных (36 (95%)) участников к моменту наблюдения заболевание имело хроническое течение (длительность суставного синдрома >6 мес). При анализе отдаленных результатов установлено, что независимо от наличия ассоциации с хламидийной инфекцией или ее полной эрадикацией у таких пациентов постепенно развивается ревматоидный артрит, соответствующий всем критериям заболевания, в том числе в крови появляется ревматоидный фактор и выявляют анти-ССР.
Выводы. Полиартритический вариант РХА в большинстве случаев трасформируется в достоверный ревматоидный артрит без ассоциации, либо в ассоциации с хламидийной инфекцией. Наличие у пациента подобного варианта РХА требует более агрессивной терапии и тщательного мониторирования пациента для своевременной диагностики возможного ревматоидного артрита.
Остается нерешенным вопрос: является ли Chl. trachomatis этиологическим фактором развития не только РХА, но и особого варианта ревматоидного артрита, либо Chl. trachomatis, как это сегодня общепринято, остается лишь триггерным фактором развития заболевания?
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ АНКИЛОЗИРУЮЩЕГО СПОНДИЛИТА
Н.Ф. Сорока, А.А. Тетерюков
УО «Белорусский государственный медицинский университет», Минск, Республика Беларусь
Анкилозирующий спондилит (АС) является наиболее изученным и самым типичным представителем группы заболеваний, обозначаемой как спондилоартриты. При этой болезни могут отмечаться практически все проявления, описанные для спондилоартрита, и любые их сочетания. Как правило, АС среди всех спондилоартритов характеризуется самым неблагоприятным прогнозом в отношении качества жизни и трудоспособности пациентов, а также развития осложнений. Поэтому так важна своевременная диагностика АС, вычленение его из общей группы спондилоартритов. Дифференциальная диагностика АС с другими формами спондилоартрита может быть непростой задачей.
Цель: выявить клинические и лабораторно-инструментальные особенности, наиболее типичные для «классического» АС, позволяющие проводить дифференциальную диагностику с другими формами спондилоартрита и другими ревматическими заболеваниями.
Методы исследования. На базе Белорусского республиканского центра ревматологии нами обследовано100 пациентов со спондилоартритом (опрос, объективные данные, лабораторно-инструментальное обследование). В группе обследованных были пациенты с АС (средняя продолжительность заболевания — 7,6 года), недифференцированным спондилоартритом (средняя продолжительность заболевания — 7,4 мес), псориатическим спондилоартритом и хламидиоиндуцированным спондилоартритом (средняя продолжительность заболевания — 2,3 года). Средний возраст пациентов — 39,8 [22, 71] года. Мужчин — 86%, женщин — 14%.
Результаты. Из 100 пациентов со спондилоартритом диагноз АС был установлен у 31 (31%) пациента, из которых 30 (97%) — мужчины. Среди этих 31 пациентов у 27 (87%) заболевание имело строго центральную форму, а у 4 (13%) — в патологический процесс вовлекались и периферические суставы. При этом у всех 4 (100%) пациентов с периферической формой, а также у 2 (7%) пациентов с центральный формой заболевания АС в патологический процесс вовлекались тазобедренные суставы. Кроме того, поражались коленные, голеностопные суставы и мелкие суставы кистей. У 25 (93%) из 27 пациентов с центральной формой заболевания и у 2 (50%) из 4 пациентов с периферической формой заболевание дебютировало с воспалительной боли в нижней части спины. У оставшихся 2 (7%) пациентов с центральной формой спондилита болезнь начиналась с боли и скованности в шейном отделе позвоночника. У 2 (2%) пациентов с периферической формой заболевание дебютировало с синовита голеностопного сустава. Средний промежуток времени от появления первых симптомов до установления диагноза АС у пациентов с центральной формой заболевания составил 9,3 года, у пациентов с периферической — 2,9 года. Выраженные воспалительные изменения (повышение СОЭ по Вестергрену >30 мм/ч и СРБ > 3 верхних границ нормы) отмечались у 5 (18,5%) пациентов с центральной и 4 (100%) — с периферической формой заболевания. Антиген HLA-B27 отмечался у 25 (93%) пациентов с центральной формой заболевания и 4 (100%) с периферической. Далеко зашедшие рентгенологические изменения (сакроилеит 3–4 стадии, выраженные синдесмофиты в позвоночнике, значительное сужение суставной щели тазобедренных суставов) отмечались у всех 31 (100%) пациентов.
Выводы. Таким образом, «истинный» или «классический» АС, по нашим наблюдениям, протекает с весьма характерными проявлениями. В абсолютном большинстве случаев заболевание носит строго центральный характер, при котором поражение осевого скелета (боль, скованность, ограничение подвижности) доминирует над периферическими проявлениями. АС характеризуется умеренными воспалительными изменениями со стороны лабораторных показателей. Трудности для диагностики АС в общей врачебной практике возникают в связи с отсутствием типичных конституциональных изменений, выраженного воспалительного синдрома и характерных рентгенологических проявлений на начальных стадиях заболевания. При длительном течении болезни у всех пациентов наблюдаются стойкие и необратимые рентгенологические изменения позвоночника и тазобедренных суставов. АС имеет четкую ассоциацию с антигеном HLA-B27.
ОСОБЕННОСТИ СИСТОЛЫ И ДИАСТОЛЫ ЖЕЛУДОЧКОВ СЕРДЦА У БОЛЬНЫХ С РЕАКТИВНЫМ АРТРИТОМ
А.А. Спасская
Центральный госпиталь военно-медицинского управления Службы безопасности Украины, Киев
Реактивный артрит (РеА) является одной из наиболее актуальных проблем современной медицины, что связано с его возрастающей распространенностью, значительными трудопотерями вследствие этой патологии, трудностями его диагностики и лечения.
Частота поражения сердца у таких пациентов по данным различных исследований колеблется от 10,0 до 63,8%. Несмотря на его важное значение в определении прогноза больных с РеА, комплексная оценка функционального состояния желудочков сердца у таких больных отсутствует.
Цель: изучить особенности систолы и диастолы желудочков сердца у больных РеА с целью улучшения диагностики и профилактики у них сердечной недостаточности.
Методы исследования. Работа основывается на результатах обследования 510 больных с РеА в возрасте от 17 до 54 лет (в среднем — 30,4±0,5 года), находившихся на лечении в отделении кардиоревматологии Главного военно-медицинского клинического центра «Главный военный клинический госпиталь» Министерства обороны Украины в 2002–2010 гг. Среди обследованных преобладали мужчины — 453 (88,8%) больных). У большинства пациентов отмечалось острое течение заболевания (427 (83,7%)) и І степень его активности (466 (91,4%) больных, случаев).
Всем больным выполняли общеклиническое и инструментальное обследование с последующей статистической обработкой полученных результатов. Диагноз РеА устанавливали на основании критериев Немецкого ревматологического общества (1995).
Функциональное состояние левого (ЛЖ) и правого (ПЖ) желудочков сердца и оценивали при помощи ультразвукового исследования сердца на аппарате «LOGIQ 500» («General Electric», США) датчиком 3,5 МГц с определением параметров их систолической и диастолической функций по общепринятой методике.
Результаты. У больных РеА в сравнении с нормой отмечено повышение частоты сердечных сокращений (ЧСС), ударного индекса (УИ) и сердечного индекса (СИ) соответственно на 10,5; 18,7 и 22,9% (во всех случаях р<0,001). Повышенной была и величина фракции выброса ЛЖ (ФВЛЖ) на 4,1% (р<0,001), что в сочетании с вышеизложенными изменениями отражало наличие гиперкинетического типа гемодинамики.
Анализ скоростных показателей трансмитрального кровотока показал снижение пиковой скорости потока раннего наполнения ЛЖ (pVE, м/с) на 6,5% (р<0,001), повышение пиковой скорости потока предсердного наполнения ЛЖ (pVА, м/с) на 8,5% (р<0,001) и как результат — уменьшение величины их соотношения (Е/А, единиц) на 21,5% (р<0,001).
Исследование его временных параметров показало уменьшение времени диастазиса (Д, с) на 32,0% (р<0,001) и увеличение общего времени потока предсердного наполнения ЛЖ (ТА, с) на 12,0% в сравнении с нормой (р<0,05).
Изменения егообъемных показателей заключались в увеличении интеграла линейной скорости потока раннего наполнения ЛЖ (ViE, см) на 4,9% (р<0,05) и значительно в большей мере — интеграла линейной скорости потока предсердного наполнения ЛЖ (ViА, см) (на 44,3%, р<0,001), вследствие чего увеличился вклад систолы левого предсердия (ЛП) в диастолическое наполнение ЛЖ (AFF ЛЖ,%) на 29,0% (р<0,001).
Описанные изменения отражали наличие у больных с РеА диастолической дисфункции ЛЖ по гипертрофическому типу по классификации R.A. Nishimura и A.J. Tajik (1994) с изменением соотношения пиковых скоростей его раннего и предсердного наполнения и увеличением вклада систолы ЛП в диастолическое наполнение ЛЖ.Это было следствием как нарушения активной релаксации ЛЖ, так и повышения жесткости его камеры, о чем свидетельствовало увеличение средних величин конечно-диастолического давления в ЛЖ (КДД ЛЖ, мм рт. ст.) на 4,1% и соотношения конечно-диастолическое давление/конечно-диастолический объем в ЛЖ (КДД/КДО ЛЖ) на 19,6% (в обоих случаях р<0,001).
Исследование скоростных параметров транстрикуспидального кровотока показало снижение пиковой скорости потока раннего наполнения ПЖ (рVЕТК, м/с) на 19,9% (р<0,001), за счет чего уменьшилась по сравнению с нормой величина соотношения пиковых скоростей потоков раннего и предсердного наполнения ПЖ (Е/АТК, ед.) на 18,0% (р<0,001).
Изменения временных показателей транстрикуспидального кровотока заключались в увеличении по сравнению с нормой общего времени потока раннего наполнения ПЖ (ТЕТК, с) на 8,3% (р<0,001) за счет увеличения времени его замедления (ДТТК, с) на 7,6% (р<0,001), уменьшения диастазиса (ДТК, с) на 31,8% (р<0,001) и увеличения общего времени потока предсердного наполнения ПЖ (ТАТК, с) на 15,4% (р<0,01).
Анализ его объемных параметров показал уменьшение интеграла линейной скорости потока быстрого наполнения ПЖ (ViETK, см) на 7,3% (р<0,001) и увеличение интеграла линейной скорости потока предсердного наполнения ПЖ (ViАTK, см) на 16,9% (р<0,001). Как следствие указанных изменений в сравнении с нормой вклад систолы правого предсердия (ПП) в диастолическое наполнение ПЖ (AFF ПЖ,%) увеличился на 15,2% (р<0,001). Отмечено также увеличение конечно-диастолического давления в ПЖ (КДД ПЖ мм рт. ст.) на 28,4% (р<0,001).
Таким образом, у больных РеА отмечалась диастолическая дисфункция ПЖ по гипертрофическому типу, аналогичная таковой в ЛЖ. Ее возникновение было связано с увеличением КДД ПЖ, причинами которого могли быть как ухудшение условий опорожнения ПЖ вследствие дисфункции ЛЖ, так и нарушения процессов активного расслабления миокарда ПЖ и ухудшение его диастолической податливости.
Выводы. Для пациентов с РеА характерен гиперкинетический тип гемодинамики, а также однонаправленные изменения диастолического наполнения обоих желудочков сердца по гипертрофическому типу с признаками нарушения их активной релаксации и повышения жесткости камер, что, вероятно, свидетельствует о развитии у них воспалительной кардиопатии и является предпосылкой для развития сердечной недостаточности.
НЕЙРОПАТИЧНИЙ КОМПОНЕНТ БОЛЬОВОГО СИНДРОМУ У ХВОРИХ НА АНКІЛОЗИВНИЙ СПОНДИЛОАРТРИТ
М.А. Станіславчук, І.І. Андрушко, І.О. Кедик
Вінницький національний медичний університет ім. М.І. Пирогова
На сьогодні встановлено, що механізм болю при анкілозивному спондилоартриті (АС) досить складним і формується індивідуально балансом між запальним компонентом болю та нейропатичним. Найбільш вивченим є запальний компонент болю, який полягає у виділенні медіаторів запалення та подальшому подразненні ними больових рецепторів. За останні 10 років з’явилися дані про наявність нейропатичного компонента при багатьох захворюваннях, зокрема ревматичних. Нейропатичний біль досить часто відзначають у лікарській практиці — ним страждає приблизно 3–6% населення.
Мета: оцінити частоту виявлення нейропатичного компонента больового синдрому у хворих на АС.
Методи. У дослідження включено 16 чоловіків з діагнозом АС, середній вік яких становив 38,3±9,8 року. Діагноз АС встановлювали згідно з модифікованими Нью-Йоркськими критеріями (1984). У 13 пацієнтів діагностовано центральну форму АС, у 3 хворих — із залученням периферичних суглобів. Середня тривалість захворювання становила 11,3±7,6 року. При обстеженні пацієнтів оцінювали індекс активності BASDAI та функціональний індекс BASFI. Для діагностики та об’єктивізації нейропатичного болю в роботі використані спеціальні анкети та шкали, а саме: PainDETECT, діагностичний опитувальник нейропатичного болю — Douleur Neuropathiqueen 4 questions (DN4), Лідська шкала оцінки нейропатичного болю — The Leeds assessment of neuropathic symptoms and signs (LANSS). Для визначення сенсорних, афективно-емоційних аспектів нейропатичного болю застосовували коротку форму больового опитувальника МакГілл — Short form McGill Pain Questionnaire (SF-MPQ). Наявність нейропатичного компонента в больовому синдромі визначалася при значенні ≥12 за шкалами PainDETECT і LANSS та/або ≥4 — за опитувальником DN4.
Результати. Аналіз результатів дослідження свідчить, що у хворих на АС нейропатичний компонент больового синдрому за опитувальником PainDETECT діагностовано у 6(37,5%) пацієнтів, з них у 6,2% сума балів становила 15, а у 31,2% — сума балів була >19. За анкетою DN4 нейропатичну складову болю діагностовано у 8 (50%) хворих на АС, при цьому значення цього показника у всіх пацієнтів становило ≥4.
Висновки. Таким чином, у значної частини хворих на АС виявляється нейропатичний компонент больового синдрому, який потребує інших (на відміну від ноцицептивного) підходу до лікування. Отримані дані свідчать про необхідність використання при обстеженні хворих на АС діагностичних тестів, що дозволяють виявляти нейропатичний біль у цієї категорії хворих.
ЗВ’ЯЗОК АКТИВНОСТІ ЗАХВОРЮВАННЯ З РІВНЯМИ АДИПОКІНІВ У ХВОРИХ НА РЕВМАТОЇДНИЙ АРТРИТ
М.В. Стигар, М.А. Станіславчук
Вінницький національний медичний університет ім. М.І. Пирогова
На сьогодні актуальне питання вивчення ролі адипокінів у розвитку аутоімунних захворювань. Лептин і адипонектин беруть участь у регуляції як імунних, так і запальних процесів при ревматоїдному артриті (РА). З урахуванням цих даних можна припустити, що дисадипокінемія може бути обтяжувальним чинником перебігу РА.
Мета: вивчити рівні лептину та адипонектину в крові хворих на РА та їх зв’язок з активністю і тяжкістю захворювання.
Методи дослідження. Рівні лептину та адипонектину у зразках крові у 78 пацієнтів жіночої статі з РА визначали методом імуноферментного аналізу (ELISA) з використанням стандартних наборів фірми «DRG», Німеччина (лептину) і «Orgenium», Фінляндія (адипонектину). Зразки крові 30 здорових осіб служили контролем.
Результати. Встановлено, що у хворих на РА реєструється дисбаланс гормонів жирової тканини. У більшості пацієнтів захворювання супроводжується гіперлептинемією на тлі вираженої гіпоадипонектинемії. Рівень лептину у пацієнтів із РА в цілому по групі був майже у 4 рази вищим порівняно з особами групи контролю. Водночас реєстрували 2-разове зниження рівня адипонектину в крові. При цьому виявлено прямий кореляційний зв’язок між рівнем лептину в крові та основними показниками активності РА. Між рівнем адипонектину в крові та активністю захворювання встановлено зворотний кореляційний зв’язок.
Висновки. У хворих на РА наявне значне збільшення продукції лептину та зменшення продукції адипонектину порівняно з особами контрольної групи. Отримані дані свідчать про можливу патогенетичну роль дисадипокинемії при РА.
ВНУТРІШНЬОСУГЛОБОВІ МАНІПУЛЯЦІЇ у ПРАКТИЦІ ЛІКАРЯ-РЕВМАТОЛОГА ПОЛІКЛІНІКИ
О.М. Суліма
КЗ «Дніпропетровська міська поліклініка № 2»
Мета: впровадження ефективного комплексу діагностичних і лікувальних методик для підвищення якості лікування хворих за рахунок застосування внутрішньосуглобових маніпуляцій. Це викликано тим, що число хворих на дифузні хвороби сполучної тканини, ревматоїдний артрит та хворобу Бехтєрева за останні роки в Україні збільшилося майже до 250 тис., подвоїлась чисельність хворих на остеоартроз і сольову артропатію, виникла стійка тенденція до зростання захворюваності з тимчасовою втратою працездатності та інвалідності при ревматичних хворобах, насамперед ураженнях кістково-м’язової системи і сполучної тканини.
Методи дослідження. До таких методик належать внутрішньосуглобові маніпуляції хворим ревматологічного профілю, що можуть не потребувати їх госпіталізації у стаціонар при виконанні та дотриманні визначеного алгоритму.
До внутрішньосуглобових маніпуляцій належать: пункція суглоба з метою витягу синовіальної рідини, внутрішньосуглобові ін’єкції лікарських препаратів (кортикостероїдів, радіоізотопів та ін.). Внутрішньосуглобові маніпуляції проводилися лікарем-ревматологом у чистій операційній поліклініки. У день внутрішньосуглобових маніпуляцій в операційній виконувалося вологе прибирання і за 2 год до маніпуляції — опромінення кварцевою лампою.
Для внутрішньосуглобових маніпуляцій виділено спеціальний інструментарій, який забороняється використовувати для інших цілей: шприци 10 мл — 2–5 штуки, голки типу Дюфо для набирання лікарських препаратів, ін’єкційні голки різного калібру довжиною від 2 до 8 см, що використовуються для внутрішньовенних, підшкірних та внутрішньошкірних ін’єкцій, корнцанги, пінцети.
Лікар-ревматолог суворо дотримується правил асептики та антисептики, має володіти технікою пункції суглобів (тематичні курси, тренінги та майстер-класи).
Кожен хворий безпосередньо перед пункцією оглядався лікарем з метою встановлення загальних та місцевих показань і протипоказань до цієї процедури.
Протипоказаннями є грип, гострі респіраторні захворювання, катаральні стани очей, ротоносової порожнини, гострі інфекції ясен та зубів, менструація.
Місцевими протипоказаннями є гноячкові ураження шкіри, шкірочки поблизу суглоба, який підлягає пункції, опіки II та I ступеня або лущення шкіри суглоба, викликані попередніми лікувальними процедурами.
У поліклініці категорично заборонені внутрішньосуглобові маніпуляції ділянки гомілковостопного суглоба, суглобів стоп та ділянки стопи, оскільки це потребує спеціальної підготовки шкіри і виконується лише в умовах стаціонару.
Після проведення внутрішньосуглобових маніпуляцій на колінних суглобах хворий не менше ніж 2 год перебуває під наглядом лікаря в сидячому положенні, уникаючи рухів у суглобі. Після пункції суглобів верхніх кінцівок перебування хворого в поліклініці не потрібне. Створення відносного спокою суглоба досягається накладенням косинкової пов’язки на відповідну руку, хворим рекомендовано її зняти самостійно через 2 год.
Результати. П’ятнадцятирічний досвід внутрішньосуглобових маніпуляцій у поліклініці при суворому дотриманні закріпленого алгоритму свідчить про відсутність ускладнень та значний лікувальний ефект.
Висновки. Метод внутрішньосуглобових маніпуляцій в умовах поліклініки дієвийта ефективний, можливе його використання в подальшому для поліпшення якості лікування хворих ревматологічного профілю без госпіталізації до стаціонару.
ЗАСТОСУВАННЯ L-АРГІНІНУ ГІДРОХЛОРИДУ У КОМПЛЕКСНОМУ ЛІКУВАННІ ХВОРИХ НА ОСТЕОАРТРОЗ ПРИ ПОЄДНАННІ ЙОГО З МЕТАБОЛІЧНИМ СИНДРОМОМ
М.Я. Сухоребська, Р.І. Яцишин, Ю.В. Дельва, Я.В. Сандурська, О.І. Олійник
ДВНЗ «Івано-Франківський національний медичний університет»
Остеоартроз (ОА) — хронічне захворювання суглобів дегенеративно-запального характеру, яке характеризується ураженням хрящів, ремоделюванням епіфізів кісток, розвитком остеофітів, а в пізніх стадіях — стійкою деформацією суглобів. Серед факторів ризику виникнення ОА особливе місце посідає ожиріння. Збільшення маси тіла є одним із компонентів метаболічного синдрому (МС).
Мета: вивчення особливостей клінічного перебігу ОА при поєднанні його з МС та застосування L-аргініну гідрохлориду в комплексному лікуванні.
Методи дослідження. Обстежено 90 хворих на ОА при його поєднанні з МС. Середній вік пацієнтів становив (59,18±1,26) року. Пацієнтів розподілили на дві групи: контрольну та досліджувану. Пацієнти контрольної групи — хворі на ОА (n=40), отримували традиційне лікування. З метою оцінки ефективності лікування досліджувану групу (n=50), в яку включено пацієнтів з ОА у поєднанні з МС, поділено на підгрупи: 1-ша підгрупа — хворі, які отримували традиційне лікування цього захворювання; 2-га підгрупа — хворі, які, крім базової терапії, отримували L-аргініну гідрохлорид у дозі 100 мл 1 раз на добу 5 днів із переходом на пероральну його форму у вигляді сиропу по 5 мл 3 рази на добу протягом 1 міс. Оцінку ефективності терапії здійснювали за визначенням ступеня інтенсивності больового синдрому за візуальною аналоговою шкалою, даними біохімічних показників вуглеводного та ліпідного обмінів. Статистичну обробку показників проводили із використанням прикладного пакета комп’ютерних програм «Microsoft Exel».
Результати. У пацієнтів, яким проводили лікування L-аргініном гідрохлоридом, спостерігалася більш позитивна динаміка показників ліпідного та вуглеводного обмінів, що проявлялася достовірним зниженням рівня тригліцеридів до (1,1±0,08) ммоль/л (p<0,05), рівня глюкози сироватки крові до (4,59±0,08) ммоль/л (p<0,05). Тривалість больового синдрому у досліджуваній групі, що отримувала L-аргініну гідрохлорид, була достовірно нижчою (p<0,001) та становила (4,6±0,1) днів лікування, тоді як у групі, що отримували тільки базовий лікувальний комплекс, больовий синдром спостерігався протягом (8,3±0,12) днів (р>0,05).
Висновки. Використання L-аргініну гідрохлорид в комплексному лікуванні ОА у поєднанні з МС сприяє швидшому регресу больового синдрому та покращанню ліпідного і вуглеводного обміну.
ДИАГНОСТИЧЕСКАЯ ЦЕННОСТЬ ВЫЯВЛЕНИЯ ПРОТИВОХЛАМИДИЙНЫХ АНТИТЕЛ В КРОВИ ПАЦИЕНТОВ С РЕВМАТОИДНЫМ АРТРИТОМ, АССОЦИИРОВАННЫМ С ХЛАМИДИЙНОЙ ИНФЕКЦИЕЙ
Т.М. Талако1, И.И. Буторина2, И.А. Варонько1, Д.А. Дейкун3, А.Н. Асташонок3, Л.В. Рубаник3, Н.Н. Полещук3, Н.Ф. Сорока1
1 УО «Белорусский государственный медицинский университет»
2 УЗ «9-я Городская клиническая больница»
3 ГУ «Республиканский научно-практический центр эпидемиологии и микробиологии»
У пациентов с ревматоидным артритом (РА) нередко выявляется сопутствующая хламидийная инфекция, что заметно меняет клиническую картину течения артрита и требует изменения лечебной тактики. Сегодня подходы к диагностике ассоциированной с РА хламидийной инфекции также требуют изменений.
Цель: оценить информативность выявления антител к Chlamydia trachomatis в крови пациентов с РА, ассоциированным с хламидийной инфекцией.
Методы исследования. Пациенты с клинической картиной РА, ассоциированного с хламидийной инфекцией, (n=23) были обследованы на наличие Chl. trachomatis различными методами: соскоб из урогенитального тракта (УГТ) с последующим анализом на хламидийную инфекцию методом полимеразной цепной реакции (ПЦР); периферическая кровь — определение антител методом иммуноферментного анализа (ИФА). Синовиальная жидкость (СЖ) получена у 16 пациентов и исследована методом ПЦР, культуры клеток McCoy и ИФА.
Результаты. У 18 пациентов из 22 при исследовании соскоба из УГТ методом ПЦР выявлена ДНК Chl. trachomatis. При исследовании СЖ наличие хламидийной инфекции методом ПЦР подтверждено в 10 случаях, методом ИФА — в 13 случаях из 16 образцов. Культуральное исследование СЖ выявило характерное для Chl. trachomatis цитопатическое действие в 12 (75%) образцах из 16. Исследование периферической крови методом ИФА для определения противохламидийных антител выявило антитела класса М лишь в 4 (18,2%) случаях из 22. Антитела класса G не выявлены ни у одного пациента.
Выводы. При наличии клинической картины РА, ассоциированного с хламидийной инфекцией, положительных результатов культурального и/или ПЦР-исследования на Chl. trachomatis, определение уровня противохламидийных антител в крови в качестве диагностического маркера представляется малоинформативным, учитывая низкую выявляемость противохламидийных антител.
ВЫЯВЛЕНИЕ АНТИФОСФОЛИПИДНЫХ АНТИТЕЛ В СКРИНИНГОВЫХ ТЕСТАХ У ПАЦИЕНТОВ С АНТИФОСФОЛИПИДНЫМ СИНДРОМОМ
Т.М. Талако, Н.Ф. Сорока
УО «Белорусский государственный медицинский университет», Минск, Республика Беларусь
Определение уровня антифосфолипидных антител (АФЛА) является важным фактором в установлении диагноза, мониторинге активности и оценке эффективности лечения при антифосфолипидном синдроме (АФС). В клинической практике для диагностики АФС используют так называемые скриниговые тесты, характеризующиеся одномоментным определением антител классов G, M, A суммарно. В случае положительного результата выполняют повторное исследование антител к кардиолипину (анти-КЛ) и к β2-гликопротеину-1 (анти-β2-ГП-1) классов G и М по отдельности. Такой подход позволяет снизить стоимость обследования пациентов с подозрением на АФС.
Цель: сравнить выявляемость АФЛА в скрининговых и специфических тестах для иммуноглобулинов (Иг) классов G и М у пациентов с АФС.
Методы исследования. Пациенты с достоверным АФС (n=28) были распределены на две группы: 1-я группа — с первичным АФС (n=13), 2-я группа — с АФС на фоне системной красной волчанки (СКВ) (n=15). Анти-КЛ и анти-β2-ГП-1 классов G и М по отдельности, а также классов G, M, A суммарно (скрининговый тест) определяли методом твердофазного иммуноферментного анализа.
Результаты. У пациентов 1-й группы уровень анти-КЛ Иг (GMA) составил 92,83 [76,65; 61,98] Ед/мл, анти-КЛ ИгG — 9,29 [5,80; 23,54] Ед/мл, анти-КЛ ИгМ — 45,9 [27,32; 79,74] Ед/мл. Во 2-й группе — анти-КЛ Иг (GMА) — 399,29 [94,5; 629,9] Ед/мл, анти-КЛ ИгG — 57,74 [47,5; 79,86] Ед/мл, анти-КЛ ИгМ — 60,36 [34,15; 92,38] Ед/мл. У пациентов с АФС на фоне СКВ установлена корреляционная связь величины анти-КЛ (GAM) с aнти-КЛ ИгG (p<0,05, R=0,78) и с aнти-КЛ ИгМ (p<0,05, R=0,66). В 1-й группе уровень анти-β2-ГП-1 Иг (GMA) составил 13,62 [12,06; 16,54] Ед/мл, анти-β2-ГП-1 ИгG — 12,03 [9,43; 30,64] Ед/мл, анти-β2-ГП-1 ИгМ — 17,86 [6,24; 42,11] Ед/мл. У данных пациентов величина анти-β2-ГП-1 (GAM) коррелировала с aнти-β2-ГП-1 ИгG (p<0,05, R=0,72) и с aнти-β2-ГП-1 ИгМ ((p<0,05, R=0,75). Во 2-й группе уровень анти-β2-ГП-1 Иг (GMA) составил 57,23 [10,52; 110,49] Ед/мл, анти-β2-ГП-1 ИгG — 53,75 [44,32; 133,90] Ед/мл, анти-β2-ГП-1 ИгМ — 16,19 [6,89; 338,1] Ед/мл. В исследуемой группе выявлена корреляция количества анти-β2-ГП-1 (GAM) с aнти-β2-ГП-1 ИгG (p<0,05, R=0,72) и с aнти-β2-ГП-1 ИгМ (p<0,05, R=0,68).
Вывод. У пациентов с АФС на фоне СКВ выявление повышенного уровня АФЛА в скрининговых тестах соответствует повышению уровня соответствующих антител классов G и М, определяемых по отдельности. При первичном же АФС скрининговые тесты не всегда отражают величины антител класса G и М, и их использование для диагностики этой патологии сомнительно.
ДИНАМИКА РАСПРОСТРАНЕННОСТИ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ СУСТАВОВ СРЕДИ ДЕТЕЙ ХАРЬКОВА
Т.А. Филонова, В.М. Савво, Е.Н. Зайцева
Харьковская медицинская академия последипломного образования
Болезни костно-мышечной системы у детей, а среди них воспалительные заболевания суставов, рассматриваются как одна из значимых медицинских и социально-экономических проблем общества, что обусловлено их распространенностью, поражением детей различного возраста. Заболевания суставов у детей могут иметь склонность к прогрессированию, хроническому течению со снижением качества жизни ребенка, вплоть до развития инвалидности. Структура их за последние годы претерпела определенные изменения.
Цель: изучение динамики распространенности и заболеваемости воспалительных заболеваний суставов у детей Харькова.
Методы исследования. Проведен анализ статистических данных детской кардиоревматологической службы города за истекшие 5 лет.
Анализ статистических данных показал, что в течение последних лет прослеживается отчетливая тенденция к повышению распространенности реактивных артропатий (РеА). Эта группа охватывает воспалительные артропатии, вызванные различными микробиологическими агентами, спектр которых с каждым годом увеличивается. За 5-летний период зафиксирован достоверный рост распространенности РеА: по данным за 2012 г. она составила 1,66 по сравнению с 1,29 на 1000 детского населения в 2007 г., то есть отмечено повышение на 22,3%. Причем достоверный рост распространенности РеА у детей зарегистрирован во всех районах города. Показатели заболеваемости также повысились с 0,3 в 2007 г. до 0,54 на 1000 детей в 2012 г. Среди этиологических факторов РеА сохранялось преобладание артрита, связанного с носоглоточной инфекцией, а также ассоциированных со смешанной вирусной и вирусно-бактериальной (преимущественно хламидийной и микоплазменой) флорой. Участие различных инфекционных агентов в развитии воспалительных заболеваний суставов у детей обусловливает важность обследования пациентов на артритогенные инфекции в дебюте артрита с целью оптимизации лечения и профилактики затяжного течения и хронизации процесса.
Результаты. Заболеваемость детей ювенильным ревматоидным артритом (ЮРА) в истекшем году составили 0,03 на 1000 детского населения, что ниже среднестатистического показателя по Украине. Однако при анализе указанных данных за 5-летний период отмечено повышение распространенности и заболеваемости ЮРА. Так, число впервые заболевших детей увеличилось в 3 раза, а общая заболеваемость за последние 3 года возросла на 70%. Среди больных ЮРА большинство — дети с полиартритом, серонегативные по ревматоидному фактору (РФ–) — 60%; полиартрит с РФ+ — 5%. Больные системной формой ЮРА составляют 25% всей группы пациентов. В то же время отмечено снижение заболеваемости ювенильным хроническим артритом при повышении его распространенности с 0,01 в 2007 г. до 0,05 на 1000 детского населения в 2012 г. Это свидетельствует о накоплении данной патологии в детской популяции и, по-видимому, о более ранней верификации диагноза с учетом новых нормативных документов и унифицированного протокола МОЗ Украины о медицинской помощи детям, больным ювенильным артритом.
Выводы. Таким образом, за последние 5 лет отмечается рост заболеваемости и распространенности наиболее частых воспалительных заболеваний суставов у детей — РеА, ассоциированной с инфекциями, и ювенильного артрита, в том числе ЮРА, что подчеркивает значимость данной проблемы не только для педиатрической, но и общеврачебной практики.
СИНДРОМ ЭНДОГЕННОЙ ИНТОКСИКАЦИИ ПРИ СИСТЕМНОЙ КРАСНОЙ ВОЛЧАНКЕ
К.С. Фомичева, Е.В. Ливенцова, Е.Г. Игнатенко, П.О. Синяченко
Национальный медицинский университет им. Максима Горького, Донецк
Синдром лабораторной эндогенной интоксикации (СЭИ) развивается у 73% больных системной красной волчанкой (СКВ) и тесно связан со степенью активности заболевания, поражением почек, печени, легких, асептическими остеонекрозом, легочной гипертензией, антифосфолипидным синдромом, антителами к нативной дезоксирибонуклеиновой кислоте (аДНК) и кардиолипину (аКЛ), сопровождается повышением в крови активности ксантиноксидазы, уровня нитритов, свинца, молекул средней массы (МСМ) фракций МСМ238, МСМ254 и МСМ260, а от клинико-лабораторных признаков течения патологического процесса зависят параметры в крови диеновых конъюгатов, ксантиноксидазы, аммиака, мочевины, креатинина, мочевой кислоты, нитритов, МСМ280, бария, лития, свинца и стронция, но не малонового диальдегида, аминопептидной, пептидной и нуклеотидной фракций МСМ, а также содержания кадмия. У больных СКВ статистически достоверно повышаются показатели в крови иммуноглобулин G- и М-эндотоксиновых антител (IgG-ЭТА и IgM-ЭТА), соответственно в 2,6 раза и на 23% по сравнению со здоровыми людьми, что констатируется в 100 и 81% наблюдений заболевания, зависит от степени активности патологического процесса, содержания аКЛ, наличия и тяжести асептических остеонекрозов, поражений суставов, почек и печени, нуклеотидной фракции МСМ, межфазной активности в зоне средних времен существования поверхности сыворотки крови, параметров аммонемии и урикемии, а эндотоксический индекс тесно связан с аДНК, с небелковыми азотистыми продуктами, МСМ238, МСМ254, МСМ260, МСМ280 и стронцием. СКВ сопровождается достоверным повышением концентрации в крови токсичных лития в 2,7 раза и свинца — на 77%, что соответственно наблюдается у 94 и 71% больных, причем интегральное состояние микроэлементоза зависит от возраста пациента, длительности манифестации и степени активности патологического процесса, тяжести поражения печени и клапанов сердца, нарушений возбудимости миокарда и диастолической функции левого желудочка, а содержание бария и стронция соотносится с формированием противоядерных аутоантител и эндотоксического индекса, уровни бария, кадмия, лития и стронция — с параметрами продуктов перекисного окисления липидов, небелковых азотистых соединений и МСМ разных фракций. СЭИ оказывает достоверное влияние на степень активности СКВ, появление аДНК, серозитов, нефрита, антифосфолипидного синдрома и легочной гипертензии, причем, по данным ANOVA/MANOVA, на интегральные признаки течения заболевания воздействуют концентрации небелковых азотистых продуктов (аммиака, мочевины, креатинина, нитритов), а, как cвидетельствует однофакторный дисперсионный анализ, повышенное перекисное окисление липидов участвует в патогенетических построениях поражения сердца и легких, азотистых соединений — лимфоузлов и почек (чем замыкается порочный круг), МСМ — остеонекрозов, серозных оболочек (плеврита, перикардита) и скелетных мышц, токсичных микроэлементов — алопеции и патологии периферической нервной системы. Интегральный характер маркеров эндогенной интоксикации при СКВ зависит от применения на предыдущих этапах глюкокортикоидных гормонов, антикоагулянтов, антиагрегантов, нестероидных противовоспалительных препаратов и иммунодепрессантов цитотоксического действия, а однофакторный дисперсионный анализ демонстрирует связь уровня малонового диальдегида, креатинина и эндотоксинового индекса с применением гормонов, мочевины — циклофосфамида и циклоспорина, МСМ238 — метотрексата, МСМ254, — азатиоприна, МСМ260 — антиагрегантов, IgM-ЭТА — микофенолата мофетила, а наличие СЭИ достоверно ухудшает эффективность лечебных мероприятий, на которую влияют исходные уровни в крови токсичного кадмия, параметры нитритемии и активность ксантиноксидазы, показатели которой имеют прогностическую значимость.
СОЧЕТАННАЯ ТЕРАПИЯ ХОНДРОПРОТЕКТОРАМИ С ПРЕФОРМИРУЮЩИМИ ФАКТОРАМИ ПРИ ДЕФОРМИРУЮЩЕМ ОСТЕОАРТРОЗЕ В СОЧЕТАНИИ Со ВТОРИЧНЫМ СИНОВИТоМ У ЖЕНЩИН С ИЗБЫТОЧНОЙ МАССОЙ ТЕЛА
М.Д. Хасан
Одесский национальный медицинский университет
В настоящее время деформирующий остеоартроз (ДОА) является распространенной патологией. Одним из факторов, влияющих на возникновение ДОА, является повышенная нагрузка на суставы, что отмечают у лиц с избыточной массой тела. Лечение ДОА коленных суставов представляет серьезную проблему и не всегда сопровождается положительным эффектом. Прогрессирование ДОА коленных суставов со временем приводит к инвалидизации. Особенно тяжело ДОА коленных суставов протекает у женщин с избыточной массой тела в связи с дисгормональными расстройствами (в постменопаузальный период), у которых происходит изменение метаболизма субхондральной части кости.
Цель: изучение влияния сочетанной терапии хондропротекторами с преформирующими факторами на течение ДОА коленных суставов у женщин с избыточной массой тела.
Методы исседования. Под динамическим наблюдением находились 30 женщин с диагностированным ДОА коленных суставов со вторичным синовитом в возрасте от 50 до 60 лет с ожирением II–III степени.
Для верификации диагноза и последующего наблюдения за динамикой процесса всем пациенткам проведены рентгенологическое исследование, УЗИ коленных суставов, биохимическое исследование крови, измерение активной и пассивной подвижности коленных суставов и оценка выраженности болевого синдрома по аналоговой шкале ВАШ.
Результаты. Проведена терапия в таблетированной форме глюкозамином гидрохлоридом в дозе 500 мг, хондроитином сульфатом натрия в дозе 300 мг, мелилсульфаниламилметаном в дозе 250 мг 3 раза в сутки в течении 6 нед в сочетании с воздействием преформирующих факторов, таких как магнитотерапия на область коленных суставов и фонофарез с нимесулидом на область коленных суставов в количестве 15 процедур с дальнейшим контролем показателей объективного, инструментального и лабораторного исследования.
Выводы. В результате проведенного исследования и дальнейшего динамического наблюдения отмечается положительная динамика: увеличение объема двигательной активности коленных суставов, отсутствие болевого синдрома, позитивная динамика лабораторных показателей и приостановка прогрессирования сужения пателофеморальных щелей. Наблюдается стойкая ремиссия и возобновление утраченной или частично утраченной трудоспособности.
ПОШИРЕНІСТЬ МЕТАБОЛІЧНОГО СИНДРОМУ У ХВОРИХ НА РЕВМАТОЇДНИЙ АРТРИТ
Л.В. Хіміон, І.В. Климась
Інститут сімейної медицини
Національної медичної академії післядипломної освіти ім. П.Л. Шупика, Київ
Ревматоїдний артрит (РА) та метаболічний синдром (МС) — одні з найбільш поширених захворювань, їх поєднання має несприятливий прогноз. МС може бути однією з патогенетичних причин зростання смертності та зумовлювати зменшення тривалості життя серед хворих на РА.
Мета: дослідити поширеність МС відповідно до критеріїв ВООЗ (1998) та Міжнародної діабетичної федерації (IDF, 2005) серед хворих на РА.
Методи дослідження. Нами проведено обстеження 126 хворих на РА — 102 жінки та 24 чоловіки, середній вік — 43,82±7,8 року. Контрольна група — 30 осіб без аутоімунної патології, запальних станів та захворювань, 25 жінок та 5 чоловіків, середній вік — 42,4±8,6 року. Середня тривалість РА — 7,2±5,4 року. Діагноз РА встановлювали на основі критеріїв АРА (1987). Оцінку МС у хворих на РА проведено відповідно до критеріїв МС ВООЗ (1998) та критеріїв МС IDF (2005). Набір та обстеження хворих проводили на кафедрі сімейної медицини Національної медичної академії післядипломної освіти ім. П.Л. Шупика на базі КЗ КОР «Київська обласна клінічна лікарня». Статистичну обробку результатів дослідження проводили за допомогою програми «Microsoft Excel». Оцінювали середні значення, їх похибки і достовірність статистичних показників (р), достовірними вважали показники при р<0,05.
Результати. Основний патогенетичний критерій МС — інсулінорезистентність (ІР) — спостерігалась у 22,2% хворих на РА та у 3,3% — у групі контролю (р<0,001). Підвищення рівня глюкози крові >5,6ммоль/л виявлено у 21,4% хворих на РА та у 3,3% осіб групи контролю (р<0,001). Цукровий діабет ІІ типу зареєстровано лише у групі хворих на РА у 2,4%. Збільшення окружності талії у жінок >80 см, у чоловіків >94 см виявлено у 35,29% жінок та у 37,5% чоловіків, хворих на РА. Серед осіб групи контролю — 20,83 та 33,3% відповідно. Підвищення рівня артеріального тиску (АТ) та/чи застосування гіпотензивної терапії відзначали у 37,3% хворих на РА та у 10,0% осіб групи контролю. Підвищення рівня тригліцеридів у сироватці крові у 26,98% хворих на РА та у 3,33% — групи контролю. Низький рівень загального холестерину ліпопротеїдів високої щільності (ХС ЛПВЩ) (<1,29 ммоль/л у жінок, <1,03 ммоль/л — у чоловіків) виявлено у 58,82 та 33,33% відповідно у хворих на РА та 8,33 і 0% осіб групи контролю (р<0,001). Поєднання ≥3 ознак МС за класифікацією ВООЗ встановлено у 28% хворих на РА, в осіб групи контролю — у 6,7% (р<0,001); 2 ознаки МС — у 12,7% хворих на РА та у 3,3% осіб групи контролю (р<0,05); 1 ознака ризику розвитку МС — у 18% хворих на РА та у 13% осіб групи контролю (р<0,5). Частота виявлення критеріїв МС за класифікацією ІDF практично не відрізнялася у обстежених пацієнтів. Поєднання ≥3 ознак МС у хворих на РА виявлено у 28,57 та 10,0% осіб групи контролю (р<0,01). Поєднання 2 критеріїв МС спостерігалося у 15,08% хворих на РА та у 3,3% осіб групи контролю (р<0,2). 1 критерій ризику розвитку МС у 21,43% хворих на РА та у 10,0% осіб групи контролю (р<0,01).
Висновки. МС у хворих на РА віком до 55 років відзначають достовірно частіше, ніж серед осіб контрольної групи, зіставних за віком. Відповідно до критеріїв ВООЗ (1998) МС діагностовано у 27,78% хворих на РА та у 6,67% осіб контрольної групи (р<0,001). За критеріями IDF (2005) МС відзначають у 28,57% хворих на РА та у 10,0% осіб контрольної групи (р<0,01). Серед критеріїв МС у хворих на РА достовірно частіше, ніж серед осіб контрольної групи, спостерігається підвищення рівня АТ та/чи застосування гіпотензивної терапії (37,3 та 10,0%; р<0,001), зниження рівня ХС ЛПВЩ (53,97 та 6,67%; р<0,001), підвищення рівня тригліцеридів (26,98 та 3,33%; р<0,001), ІР (22,22 та 3,33%; р<0,001), підвищення рівня глюкози крові (21,43 та 3,33%; р<0,001).
ЭВОЛЮЦИЯ РЕВМАТИЗМА, НАЧАВШЕГОСЯ В ДЕТСКОМ ВОЗРАСТЕ
Л.Л. Челпан, И.А. Мильнер,
Е.Д. Егудина, Е.М. Лаушкина
Национальный медицинский университет
им. Максима Горького, Донецк
Проанализированы результаты наблюдения пациентов с хронической ревматической болезнью сердца (ХРБС), у которых заболевание началось в детском возрасте. В 81% наблюдений до сформирования порока сердца дети перенесли острую ревматическую лихорадку (ОРЛ) — 1-я (основная группа), а остальные 19% составили 2-ю (контрольную группу). Мальчиков в 1-й группе было 28%, а во 2-й — 44%. Порок сердца еще в детском возрасте сформировался у 61% больных, а уже во взрослом — у 39%, средний возраст в этих подгруппах составил соответственно 12±0,4 и 24±1,0 года. Необходимо отметить, что в детском возрасте порок сердца сформировался у 41% мальчиков и 59% девочек, во врослом — у 16% мужчин и 84% женщин (р=0,001). После ОРЛ порок сердца в детском возрасте развился у 52% обследованных, а во взрослом — у 48% (во всех остальных случаях — в детском). ОРЛ в детском возрасте способствует более позднему формированию пороков. После ОРЛ индекс прогрессирования ревматизма как сумма квадратов функционального класса сердечной недостаточности (ФКСН) и суммы клинических проявлений (нарушений возбудимости, проводимости, изменения камер, систолической и диастолической дисфункций левого желудочка сердца), деленная на ½ длительности порока сердца, составляет 2,48±0,229 о.е., а без ОРЛ — 2,04±0,338. Среди лиц с ХРБС с пороком в детском возрасте этот показатель составляет 1,76±0,192 о.е., а у остальных пациентов — 3,40±0,351 о.е. (p<0,001). Следовательно, развитие порока сердца во взрослом организме является прогнознегативным критерием течения ХРБС. По данным многофакторного дисперсионного анализа Уилкоксона — Рао, перенесенная ОРЛ мало влияет на последующие интегральные признаки течения болезни. Однофакторный дисперсионный анализ свидетельствует о слабом воздействии ОРЛ на дальнейшие варианты пороков сердца, хотя по результатам непараметрической статистики Макнемара — Фишера различия по разнообразию пороков у больных 1-й и 2-й групп имеются (p=0,012). В 1-й группе развитие митрального стеноза формируется в 1,7 раза чаще (р=0,026). В этой связи можно говорить в том, что ОРЛ является предиктором стенозирования левого атриовентрикулярного отверстия. Основная и контрольная подгруппы больных мало отличаются между собой по среднему числу пороков сердца, но в 1-й группе ФКСН в 1,4 раза превышает таковой у больных, не перенесших ОРЛ (р<0,001). Если комбинированные и сочетанные пороки сердца в 1-й группе имеют место у 18 и 70% обследованных, то во 2-й — у 17 и 72% соответственно. Как показывает ANOVA/MANOVA, перенесенная ОРЛ не оказывает достоверного влияния на интегральные электро- и эхокардиографические признаки ХРБС, в том числе на нарушения возбудимости миокарда, электрической проводимости и размеры камер сердца. Масса миокарда левого желудочка у представителей 1-й группы (то есть после перенесенной ОРЛ) оказалась на 22% меньшей (p=0,034). Возраст больных ХРБС оказывает значительное влияние на интегральные признаки течения заболевания (p=0,006) и характер пороков сердца (p=0,006). Если заболевание развилось в детском возрасте, то среднее количество пороков сердца на одного больного составляет 2,39±0,113, тогда как во взрослом возрасте — 1,73±0,136 (p<0,001). По среднему ФКСН эти подгруппы между собой не отличаются, но, по данным непараметрической статистики, интегральный ФКСН в случаях развития пороков сердца во взрослом возрасте выше (р=0,017). У больных с дебютом болезни в детском возрасте реже частота развития митрального стеноза в 1,8 раза (p<0,001), нарушений возбудимости миокарда — в 1,6 раза (p=0,045), диастолической дисфункции левого желудочка — в 1,6 раза (p=0,038). Полученные результаты исследований свидетельствуют о том, что в случаях дебютирования ХРБС у взрослых дальнейшее течение патологического процесса менее благоприятно. Отметим, что гипотетически негативная роль перенесенной ОРЛ в детском возрасте незначительна.
ХАРАКТЕР ПОРАЖЕНИЯ ПОЧЕК У ПАЦИЕНТОВ РЕВМАТОЛОГИЧЕСКОГО ПРОФИЛЯ ПО ДАННЫМ ПРИЖИЗНЕННОГО МОРФОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ
К.А. Чиж1, М.В. Дмитриева2, А.М. Федорук3, А.Л. Рекун2, Н.Ф. Сорока1
1Белорусский государственный медицинский университет, Минск, Республика Беларусь
2УЗ «9-я Клиническая больница г. Минска»
3РНПЦ трансплантации органов и тканей, Минск, Республика Беларусь
Патология почек при ревматических заболеваниях является значимым фактором в выборе лечебной тактики и во многом определяет характер течения и прогноз болезни. Этот тезис приобретает еще большее звучание с учетом внедрения в клиническую практику концепции хронической болезни почек (ХБП), согласно которой даже минимальные, но стойкие, изменения функционального состояния почек существенно повышают риск серьезных осложнений. Наличие хронических повреждений почечной ткани является одним из критериев установления диагноза ХБП. В связи с этим все больше расширяются показания к проведению прижизненной пункционной биопсии почек. Многообразие нефрологической патологии делает необходимым проведение биопсии для уточнения характера почечных повреждений, и их тщательной оценке с помощью световой, иммунофлуоресцентной и электронной микроскопии с целью назначения адекватной терапии.
Цель: исследовать характер почечных повреждений и изучить их удельный вес у пациентов ревматологического отделения.
Методы исследования. Прижизненная пункционная биопсия почек (ПБ) выполнена за период с 2004 по 2012 г. 146 пациентам ревматологического отделения УЗ «9-я Клиническая больница г. Минска» (Республика Беларусь). Среди них было 27 мужчин и 119 женщин. Средний возраст составил 40,9 года (от 18 лет до 71 года). Полученный при биопсии материал исследовали с помощью световой и иммунофлуоресцентной микроскопии. Во всех случаях проводили окраску на амилоидоз.
Результаты. Чаще выявлялся волчаночный нефрит (66 случаев), вторичный амилоидоз почек (35) и хронический гломерулонефрит (ХГН) (5) как осложнения ревматоидного артрита, реже — малоиммунный нефрит (7) на фоне системных васкулитов (гранулематоз Вегенера, микроскопический полиангиит) и IgA-нефропатия (2) вследствие пурпуры Шенлейна — Геноха. У 2 пациентов со спондилоартритом установлен диагноз амилоидоза почек, у 1 — IgA-нефропатия. В единичных случаях выявлены различные формы вторичного ХГН и тубуло-интерстициальный нефрит (болезнь Шегрена, системный склероз, псориатический артрит), криоглобулинемический нефрит, миеломная почка и диабетическая нефропатия, а также тромботическая микроангиопатия у пациентки с антифосфолипидным синдромом. Первичный ХГН установлен в 7 случаях. Неинформативными оказались 6 результатов биопсии, 4 пациентам исследование выполнено повторно. В 5 случаях проведение ПБ позволило изменить первоначальный диагноз.
У пациентов с системной красной волчанкой в 70% случаев установлены пролиферативные (III и IV) морфологические классы люпус-нефрита. Среди первичных и вторичных гломерулонефритов, кроме волчаночного, примерно с одинаковой частотой отмечали фокально-сегментарный гломерулосклероз и мезангиопролиферативный гломерулонефрит.
Серьезных осложнений при проведении ПБ не выявлено. В 5% случаев при контрольном ультразвуковом исследовании определяли подкапсульные гематомы небольших размеров, не требующие медицинского вмешательства и разрешавшиеся в короткие сроки.
Выводы. Патология почек является частым и тяжелым клиническим проявлением или осложнением у пациентов ревматологического профиля. Разнообразие характера нефрологических повреждений и однотипность их клинических и лабораторных проявлений требует широкого применения прижизненной пункционной биопсии почек с целью раннего выявления серьезных осложнений. Особого внимания в связи с потенциальной тяжестью требуют пациенты с наличием активных форм волчаночного нефрита и лица с ревматоидным артритом с изменениями в анализах мочи для исключения вторичного амилоидоза почек.
РІВНІ С-РЕАКТИВНОГО БІЛКА ТА ФАКТОРА НЕКРОЗУ ПУХЛИНИ-α В СИРОВАТЦІ КРОВІ ХВОРИХ ІЗ РІЗНИМИ ВАРІАНТАМИ АНТИФОСФОЛІПІДНОГО СИНДРОМУ
С.В. Шевчук, І.П. Кувікова
Вінницький національний медичний університет ім. М.І. Пирогова
Науково-дослідний інститут реабілітації інвалідів Вінницького національного медичного університету ім. М.І. Пирогова, Вінниця
Кардіоваскулярні захворювання — найчастіша причина смерті хворих на антифосфоліпідний синдром (АФС). Щонайменше 18,9% хворих на АФС помирають від інфаркту міокарда (ІМ) і ще 13,2% — від інсульту. Причина підвищеної серцево-судинної смертності при АФС залишається до кінця не з’ясованою. Обговорюється ціла низка причин та механізмів, серед яких найбільше значення відводиться дії системного запального процесу.
Мета: вивчити рівні С-реактивного білка (СРБ) та фактора некрозу пухлини (ФНП)-α в сироватці крові хворих із різними варіантами АФС та оцінити їх зв’язок із клінічними проявами атеросклеротичного ураження судин.
Методи дослідження.Проведене дослідження включало 82 хворих, 34 (41,6%) з яких із первинним АФС (ПАФС), 48 (58,4%) — із вторинним АФС (ВАФС), на фоні системного червоного вовчаку. Контрольну групу становили 37 практично здорових особи, репрезентативних за віком і статтю. Діагноз АФС встановлювався на основі міжнародних класифікаційних критеріїв (2006) (Myakis S. et al., 2006). ПАФС верифікувався у пацієнтів за відсутності ознак інших захворювань. Діагноз СЧВ встановлювали за допомогою діагностичних критеріїв Американської колегії ревматологів (1997) (Hochberg M.C., 1997).
Лабораторна оцінка, окрім рутинних методів дослідження активності запального процесу, включала визначення в сироватці крові імуноферментним методом вмісту СРБ та інтерлейкіну-6 із використанням стандартних наборів фірм «ИМТЕК» (Росія), «IMMUNOTECH» (Франція).
Результати. Вміст СРБ у здорових осіб в середньому становив 5,04±0,23 мг/л і у 70,3% осіб його рівень був нормальним. У хворих із ПАФС реєстрували більш високі рівні СРБ. Так, за середніми величинами цей показник у пацієнтів із ПАФС перевищував такий у контролі на 15%. У хворих з ВАФС середня концентрація СРБ становила 7,31±0,38 мг/л і була достовірно вищою не лише за такий у контрольній групі, а також і в групі пацієнтів із ПАФС (на 45 та 26% відповідно). В цілому в групі пацієнтів із ВАФС лише третина (33,3%) пацієнтів мали нормальний рівень СРБ, 18,7% — помірно високий і 47,9% — високий. Серед пацієнтів з АФС з ураженням серцево-судинної системи лише у 36,9% осіб вміст СРБ був <5,9 мг/л, а у 50,6% пацієнтів — >7,0 мг/л, тоді як серед хворих без клінічних проявів атеросклеротичного ураження судин нормальний рівень СРБ був у 70,6% обстежених, високий — у 29,4% осіб. Детальний аналіз концентрації СРБ показав, що у хворих з ішемічним інсультом та ІМ середній рівень СРБ достовірно на 21% був вищим, ніж у хворих із транзиторною ішемічною атакою (ТІА) та стенокардією. Серед хворих з інсультами та ІМ частка осіб з нормальним рівнем СРБ була на 29% меншою, ніж серед хворих із ТІА та стенокардією, а частка хворих із високим рівнем цього показника — на 32,9% більшою, виявлені відмінності достовірні.
Аналіз показав, що у пацієнтів із ПАФС, а особливо з ВАФС, наявне значне підвищення середньої концентрації ФНП-α (на 27,4 та 20,0% відповідно) порівняно з контролем. Кількість осіб з нормальним рівнем ФНП-α серед здорових осіб становила 73%, в той час як серед хворих з ПАФС — 58%, а серед осіб з ВАФС — лише 27%. Частка осіб з високим рівнем цього цитокіну достовірно зростала з 10,8% у контрольній групі до 26,5% — серед хворих із ПАФС і 58% — серед хворих із ВАФС. Нами не виявлено достовірних відмінностей за середнім рівнем ФНП-α та при його ранжируванні між хворими без клінічних проявів ураження серцево-судинної системи та хворими з ураженнями судин, хоча кількість осіб з помірно високими та високими цифрами цього показника серед останніх була дещо більшою. Однак встановлено, що у хворих з ІМ та ішемічним інсультом вміст ФНП-α в сироватці крові був достовірно вищим (на 34,8), ніж у хворих з ТІА та стенокардією. Підвищені рівні ФНП-α в останній групі виявлялись у 36,9% і були достовірно нижчими, ніж у групі з ІМ та ішемічним інсультом, де частка пацієнтів із високим рівнем ФНП-α сягала 61%.
Висновки. У хворих із ПАФС, а особливо з ВАФС відзначено підвищення маркерів запального процесу в сироватці крові. Рівні СРБ та ФНП-α можуть бути ранніми маркерами атеросклеротичного ураження серця та судин і предикторами серцево-судинних катастроф.
ОСОБЛИВОСТІ ПОРУШЕНЬ ЛІПІДНОГО СПЕКТРА У ПАЦІЄНТІВ ІЗ АНТИФОСФОЛІПІДНИМ СИНДРОМОМ ТА ЇХ ЗВ’ЯЗОК З ІНДИВІДУАЛЬНИМ РИЗИКОМ ІШЕМІЧНИХ ПОДІЙ ЗА ШКАЛОЮ SCORE
С.В. Шевчук, Ю.С. Сегеда
Вінницький національний медичний університет ім. М.І. Пирогова
Науково-дослідний інститут реабілітації інвалідів Вінницького національного медичного університету ім. М.І. Пирогова, Вінниця
Серцево-судинні катастрофи (інфаркт міокарда, інсульт, раптова серцева смерть) — основні причини летальності у пацієнтів із антифосфоліпідним синдромом (АФС). У структурі причин смертності пацієнтів із АФС інфаркт міокарда та інсульт посідають 2-ге та 3-тє місце і становлять 18,9 та 13,2% відповідно. Основною причиною розвитку серцево-судинних ускладнень вважається порушення ліпідного обміну, тому у більшості запропонованих методик розрахунку індивідуального ризику дисліпідемія є ключовою ознакою. Однак роль дисліпідемії у прогнозуванні розвитку кардіоваскулярних ускладнень у пацієнтів із АФС не встановлена. Залишаються не з’ясованими також і особливості порушень ліпідного обміну в цієї категорії пацієнтів.
Мета: вивчити особливості порушень ліпідного обміну та встановити їх взаємозв’язок із рівнем кардіоваскулярного ризику за шкалоюSCORE у хворих на АФС.
Методи дослідження. Проведене дослідження включало 77 хворих, розподілених на дві групи: 34 (44,1%) хворих із первинним АФС (ПАФС), 43 (55,9%) хворих із вторинним АФС (ВАФС) на фоні системного червоного вовчака. До контрольної групи увійшли 37 практично здорових особи. Групи хворих були зіставні за віком і тривалістю захворювання. Діагноз АФС встановлювали на основі міжнародних класифікаційних критеріїв 2006 р. Показники загального холестерину (ЗХС), ХС ліпопротеїдів високої щільності (ХС ЛПВЩ) і тригліцеридів (ТГ) у сироватці крові визначали за стандартно прийнятою методикою. Значення ХС ліпопротеїдів низької щільності (ХС ЛПНЩ) розраховували за формулою Friedwald:
ХС ЛПНЩ = ЗХС – ХС ЛПВЩ – (0,45 · ТГ).
Для стратифікації ризику серцево-судинних подій у пацієнтів із АФС та у практично здорових осіб контрольної групи застосовували шкалу SCORE. Статистичний аналіз результатів проводили за допомогою стандартних методів із застосуванням пакета прикладних програм Microsoft «Exсel 7,0».
Результати. У ході дослідження виявлено високу поширеність дисліпідемії серед пацієнтів із АФС. Так, найвища частота дисліпідемії була в групі пацієнтів із ВАФС (67,4%). У групі з ПАФС виявлено менше (на 26,2%) осіб з дисліпідемією, ніж серед пацієнтів із ВАФС, однак їх було в 2 рази більше, ніж серед осіб контрольної групи, в останній сумарна частота порушень ліпідного обміну становила 29,7%. Найчастішими порушеннями обміну ліпідів серед пацієнтів із ВАФС були гіпертригліцеридемія (55,8%) та підвищення ХС ЛПНЩ (41,9%), у пацієнтів із ПАФС — гіпоальфахолестеринемія (35,3%).
Дані щодо високої частоти дисліпідемії підтверджуються і аналізом середніх величин. Так, найвищі середні значення ЗХС (6,19±0,16 ммоль/л), ХС ЛПНЩ (4,06±0,14 ммоль/л) та ТГ (2,39±0,11 ммоль/) і найнижчий показник ХС ЛПВЩ (1,06±0,054 ммоль/л) виявлялись у осіб з ВАФС. В осіб з ПАФС зміни в ліпідограмі були менш вираженими. Зокрема, середні концентрації ЗХС, ХС ЛПВЩ, ХС ЛПНЩ та ТГ в цій групі відповідно становили 5,66±0,16; 1,04±0,05; 3,80±0,141 та 1,84±0,17 ммоль/л. У контрольній групі середні значення ЗХС, ХС ЛПВЩ, ХС ЛПНЩ та ТГ становили 5,01±0,12; 1,58±0,09; 2,87±0,13 та 1,31±0,11 ммоль/л відповідно. Така відмінність пояснюється превалюванням серед пацієнтів з АФС осіб із субнормальним та високим рівнем ліпідів.
При проведенні стратифікації 10-річного ризику фатальних серцево-судинних ускладнень за шкалою SCORE встановлено, що рівень індивідуального ризику асоціювався зі зростанням рівнів атерогенних ліпопротеїдів — ЗХС, ТГ, ХС ЛПНЩ. У пацієнтів із високим та дуже високим ризиком реєстрували вірогідно вищі рівні ЗХС (6,29±0,30 ммоль/л) та ТГ (2,52±0,19 ммоль/л), що перевищували ці показники у пацієнтів із низьким сумарним кардіоваскулярним ризиком на 13 та 36% відповідно. Також простежувалася тенденція до підвищення ХС ЛПНЩ та зниження ХС ЛПВЩ (на 0,23 та 0,13 ммоль/л відповідно) у пацієнтів із високим ризиком за шкалою SCORE порівняно з особами із низьким ризиком.
Висновки. У хворих із АФС, особливо осіб з ВАФС, висока частота порушень ліпідного обміну. Наявність тісних взаємозв’язків між дисліпідемією, з одного боку, та сумарним індивідуальним ризиком за шкалою SCORE, з іншого, свідчить про можливість цих показників визначати тяжкість стану хворих і прогнозувати ризик фатальних серцево-судинних катастроф у хворих із АФС.
ВПЛИВ ХОНДРОЇТИН СУЛЬФАТУ НА ПОКАЗНИКИ МІНЕРАЛЬНОЇ ЩІЛЬНОСТІ КІСТКОВОЇ ТКАНИНИ У ХВОРИХ НА ГОНАРТРОЗ
Н.М. Шуба, Т.М. Тарасенко
Національна медична академія післядипломної освіти ім. П.Л. Шупика, Київ
Мета: вивчити вплив хондроїтин сульфату на мінеральну щільность кісткової тканини (МЩКТ) у хворих на гонартроз.
Методи дослідження. На базі Дніпропетровської обласної консультативної поліклініки пройшли дослідження 120 хворих на гонартроз віком від 37 до 78 років (108 жінок, 12 чоловіків), у яких діагностовано ІІ–ІІІ рентгенологічну стадію за Kellgren — Lawrence. Пацієнтів залежно від проведеної терапії розподілили на дві групи по 60 осіб. Групи хворих були ідентичними за віком і статтю, клінічними проявами захворювання. Пацієнти основної групи приймали хондроїтин сульфат по 500 мг 2 рази на добу протягом 6 міс та нестероїдні протизапальні препарати (НПЗП) за потребою (німесулід у гранульованій формі 100 мг 2 рази на добу протягом до 15 днів, або диклофенак 50 мг 3 рази на добу протягом до 15 днів). Пацієнти контрольної групи приймали лише вищезазначені НПЗП. При вираженому больовому синдромі курс терапії НПЗП повторювали з інтервалом не менше ніж 2 тиж.
Усім пацієнтам до та через 1; 3; 6 і 12 міс від початку лікування проведено комплексне обстеження. Функціональний стан хворих на остеоартроз колінних суглобів оцінювали за анкетою WOMAC та методикою M.G. Lequesne. Лабораторне дослідження включало: загальний аналіз крові, сечі, С-реактивний протеїн, сечову кислоту, АсАТ, АлАТ, креатинін. Рентгенологічне дослідження колінних суглобів виконано у стандартних проекціях до та через 12 міс від початку лікування.
Оцінку МЩКТ проводили за допомогою ультразвукової денситометрії п’яткової кістки (ультразвуковий денситометр Achilles, «LUNAR») на початку дослідження та через 6 і 12 міс.
Результати. Через півроку від початку дослідження при ультразвуковій денситометрії виявлено достовірно (p=0,0004) негативну динаміку Т-індексу в стандартних відхиленнях у контрольній групі (–0,03±0,06) порівняно з динамікою Т-індексу за 6 міс в основній групі (0,00±0,04). Показник Z-індексу в динаміці за перші 6 міс в основній групі (0,00±0,04) практично не змінився, у той час як Z-індекс у контрольній групі виявився достовірно нижчим (p=0,0017). Це свідчить про те, що втрати кісткової маси в основній групі за 6 міс дослідження майже не спостерігалося, в той час як у контрольній групі виявлено зниження МЩКТ.
Через 1 рік від початку спостереження в обох групах відзначалася негативна динаміка показників МЩКТ. Виявлено більш виражене зниження Т-критерію (р=0,0001) через 12 міс дослідження в контрольній групі (–0,08±0,08), ніж в основній (–0,03±0,05). Негативна динаміка Z-критерію за 12 міс була також достовірно більшою (р=0,0001) у контрольній групі (–0,07±0,07), ніж в основній (–0,02±0,06). Це свідчить про зниження МЩКТ в обох групах спостереження, але в групі хондроїтин сульфату це зниження було повільнішим.
Висновки. У результаті дослідження виявлено позитивний вплив хондроїтин сульфату на динаміку показників МЩКТ.
ОСОБЕННОСТИ КЛИНИЧЕСКОЙ СИМПТОМАТИКИ ОСТЕОАРТРОЗА КОЛЕННЫХ СУСТАВОВ У БОЛЬНЫХ СО СНИЖЕННОЙ МИНЕРАЛЬНОЙ ПЛОТНОСТЬЮ КОСТНОЙ ТКАНИ
Н.М. Шуба, Т.Н. Тарасенко
Национальная медицинская академия последипломного образования им. П.Л. Шупика, Киев
Цель: определение особенностей клинических проявлений гонартроза у больных со сниженной минеральной плотностью костной ткани (МПКТ).
Методы исследования. На базе Днепропетровской областной консультативной поликлиники обследованы 124 пациента (112 женщин, 12 мужчин) в возрасте от 37 до 78 лет (в среднем — 55,4±9,49 года) с остеоартрозом коленных суставов II–III рентгенологической стадии по Kellgren — Lawrence. Пациентов распределили на две группы в зависимости от показателей МПКТ. В 1-ю группу вошли пациенты со сниженной МПКТ (Т-индекс <–1 SD), во 2-ю — пациенты с нормальной МПКТ (Т-индекс ≥–1 SD). В начале исследования и через 1; 3; 6 и 12 мес всем пациентам было проведено комплексное клиническое, лабораторное и инструментальное обследование. Для оценки выраженности боли в суставах использовалась визуальная аналоговая шкала (ВАШ), оценивались альгофункциональные индексы Lequesne и WOMAC. Структурно-функциональное состояние костной ткани оценивалось в начале исследования и через 6 и 12 мес с помощью метода ультразвуковой денситометрии с использованием прибора «Achilles» («LUNAR»). У 42 (64,6%) человек 1-й группы диагностирована остеопения, у 23 (35,4%) — остеопороз.
Результаты. В результате обследования выявлено, что средний уровень боли в коленных суставах в покое по ВАШ в обеих группах не отличался. В то время как средний уровень боли при ходьбе по ВАШ в 1-й группе (68±1,1 мм) существенно превышал (р<0,001) уровень боли во 2-й (61±0,9 мм). Кроме того, уровень боли в покое и при движении по WOMAC в 1-й группе (232,±25,99 мм) также оказался значительно выше (р<0,0001), чем во 2-й (194,73±21,23 мм). Показатель ограниченности подвижности сустава утром и в течение дня по WOMAC в 1-й группе (69±15,21 мм) был несколько выше (разница недостоверна), чем во 2-й. Показатель ограничения повседневной активности по WOMAC в 1-й группе (709,78±133,29 мм) был достоверно выше (р<0,0001), чем во 2-й (557,58±115,5 мм). Это же касается и индекса Lequesne, который в 1-й группе составил 15,78±1,98, во 2-й — 12,89±1,89.
При сравнении уровней лабораторных маркеров воспаления выявлено, что СОЭ в обеих группах пациентов не отличалась друг от друга и от нормы, в то время как СРБ был существенно выше (р<0,0001) в группе пациентов со усниженной МПКТ по сравнению с нормальной (соответственно 7,32±1,67 и 4,74±0,75 мг/л, при норме 0–5 мг/л).
Выявлена обратная корреляционная связь между МПКТ (Т- и Z-индексы) и возрастом больных (r=–0,562). Наблюдалась умеренная обратная корреляционная связь показателей МПКТ и уровня боли по ВАШ (r=–0,431) и WOMAC (r=–0,433). Выявлена незначительная обратная корреляция показателей МПКТ и ограничения повседневной активности по WOMAC (r=–0,393), а также показателей МПКТ и индекса Lequesne (r=–0,315). Отмечена обратная корреляционная связь показателей МПКТ и рентгенологической стадии гонартроза (r=–0,314), а также показателей МПКТ и уровня СРБ (r=–0,402).
Выводы. Клиническая симптоматика гонартроза у пациентов с уменьшенной МПКТ характеризуется более высоким уровнем боли и нарушения функции сустава согласно показателям альгофункциональных индексов Lequesne и WOMAC, а также более высоким уровнем маркеров воспаления (СРБ).
АНАЛИЗ КЛИНИЧЕСКОЙ КАРТИНЫ, РЕНТГЕНОЛОГИЧЕСКИХ ИЗМЕНЕНИЙ И ФУНКЦИОНАЛЬНЫХ НАРУШЕНИЙ У БОЛЬНЫХ ПОДАГРИЧЕСКИМ АРТРИТОМ
Е.А. Якименко, Л.В. Закатова, В.В. Тбилели, Н.Н. Антипова, Н.С. Тихончук, А.А. Серебрякова, И.А. Добровольская, Ю.В. Каневская, Т.Д. Рудинская
Одесский национальный медицинский университет
Цель: выявление анамнестических особенностей, степени рентгенологических изменений, активности воспаления, функциональных нарушений суставов у больных первичным подагрическим артритом.
Методы исследования. Под нашим наблюдением находились 125 больных подагрой, которые проходили курс лечения на базе ревматологического отделения Городской клинической больницы № 9 им. А.И. Минакова г. Одессы в возрасте от 35 до 72 лет, из них мужчин — 116 (93%), женщин — 9 (7%). Больных распределили на группы в зависимости от возраста. В 1-ю группу вошли 19 (16,4%) пациентов молодого возраста (32–44 года), во 2-ю группу — 62 (53,4%) пациента среднего возраста (45–59 лет), в 3-ю группу — 35 (30,2%) старшего возраста (60–72 года), 4-ю группу составили 9 женщин в возрасте от 54 до 64 лет. Проводили общепринятые клинико-лабораторные исследования для верификации диагноза подагры.
Результаты. Дебют заболевания наблюдался у 4 (3,4%) пациентов (1 — в 1-й группе, 3 — во 2-й). Длительность болезни до 1 года наблюдалась у 10 мужчин, в том числе в 1-й группе — у 1 (5%) человека, во 2-й — у 7 (11,3%), в 3-й — у 2 (5,7%) и у 1 (11,1%) женщины. Длительность болезни от 1 года до 5 лет у мужчин составляла в 1-й группе — 13 (68,4%) человек, во 2-й группе — 16 (25,8%), в 3-й группе — 12 (34,3%), у женщин — 5 (55,6%). Длительность болезни от 6 до 10 лет у мужчин в 1-й группе — 4 (21%) человека, во 2-й группе — 13 (21%), в 3-й группе — 6 (17,1%), женщины — 2 (22,2%). Длительность болезни более 11 лет выявлена у 23 (37,1%) мужчин 2-й группы и у 15 (43%) — 3-й группы, у женщин — у 1 (11,1%). Хроническое течение подагрического артрита отмечено у 95% пациентов 1-й группы, у 95,2% — 2-й, у 100% — 3-й и 4-й групп. Тофусная форма подагры выявлена в 1-й группе у 3 (15,8%) человек, во 2-й — у 22 (35%), в 3-й — у 16 (45,7%), в 4-й — у 3 (33,3%) человек. Рентгенологические стадии у обследованных больных: I ст. — в 1-й группе у 31,6% (из них ⅓ с «пробойниками»), во 2-й — у 13% (⅓ с «пробойниками»), в 3-й — у 20% (½ — с «пробойниками»), в 4-й — у 22,2% (½ — «с пробойниками»); II ст. — по группам соответственно — у 63,2–78–65,7–77,8% (с «пробойниками» — у ½–¾–¾–⅔); III ст. — по группам (1-я, 2-я, 3-я группы) — 5,2–8,1–14,3%. Активность воспалительного процесса I ст. по группам больных была следующей: у 36,8–24,2–25,7–22,2%; II ст. — 57,9–58,1–51,4–77,8%; III ст. — 5,3–17,7–22,9% (1-я, 2-я, 3-я группы). СФН суставов I был только у 5,3% пациентов 1-я группы, СФН II был соответственно по группам — у 89,5–95,2–48,6–77,8%, СФН III по группам — у 10,5–4,8–14,3% (1-я, 2-я, 3-я группы). Подагрическая нефропатия отмечалась по группам соответственно — у 5 (26,3%) (из них хроническая почечная недостатоность (ХПН) II ст. — у 2); у 40 (64,5%) (из них ХПН — у 21, в том числе I ст. — 18, II ст. — 1, III ст. — 1); у 26 (74,3%) (из них ХПН — у 18, в том числе I ст. — 15, II ст. — 3). Повышение уровня мочевой кислоты до лечения по группам больных было у 84,2–90,3–94,2–88,9%.
Выводы. Отмечается некоторое увеличение числа женщин по сравнению с данными литературы (7% по сравнению с 4–5%), прежнее преобладание мужчин среди больных подагрой (93%). У большей части пациентов диагноз устанавливали несвоевременно. Больные в возрасте младше 40 лет составили 1/10. Преобладала продолжительность заболевания от 1 года–5 лет и более 11 лет. Во всех возрастных группах преобладала II степень активности воспалительного процесса, II рентгенологическая стадия изменений, с наличием «пробойников» в костях, СФН II. По мере увеличения возраста пациентов и продолжительности заболевания увеличивается количество осложнений — поражение почек с развитием ХПН. До начала терапии у значительной части обследуемых выявлена гиперурикемия. Полученные данные свидетельствуют о необходимости своевременной диагностики подагры, предотвращения тяжелых рентгенологических изменений, ведущих к утрате трудоспособности и требующих травматического хирургического лечения, проведения своевременного профилактического лечения, санпросветработы.
ВОПРОСЫ ДЕЗАГРЕГАНТНОЙ ТЕРАПИИ ПРИ СОЧЕТАНИИ ПОДАГРЫ И СЕРДЕЧНО-СОСУДИСТОЙ ПАТОЛОГИИ
Е.А. Якименко, Л.В. Закатова, В.В. Тбилели, Н.Н. Антипова, Н.С. Тихончук, А.А. Серебрякова
Одесский национальный медицинский университет
Цель: изучить особенности применяемой дезагрегантной и антикоагулянтной терапии у больных подагрой в сочетании с сердечно-сосудистой патологией.
Методы исследования. Проведен анализ случайной выборки 125 историй болезни пациентов с подагрой, лечившихся в Одесском городском ревматологическом центре. Среди пациентов преобладали мужчины — 116 (93%) человек, женщин было 9 (7%), возраст обследованных — 35–72 (в среднем — 53,3±0,75) года. Больных распределили на группы в зависимости от возраста и пола: 1-я группа — мужчины молодого возраста (32–44 года) — 19 (16,4%) человек, 2-я группа — мужчины среднего возраста (45–59 лет) — 62 (53,4%), 3-я группа — мужчины пожилого (старшего) возраста (60–74 года) — 35 (30,2%), 4-я группа — 9 женщин в возрасте 54–64 лет. Проводились общепринятые клинико-лабораторные исследования для верификации подагры, также коагулограмма, липидограмма, ЭКГ, эхокардиоскопия.
Результаты. 25% обследуемых пациентов в комплексной терапии получали дезагрегантную либо антикоагулянтную терапию, преимущественно ацетилсалициловую кислоту — 59 (61%). У 25 (26%) пациентов применяли клопидогрель, в 10% случаев — варфарин, в 3 (3%) — сочетание клопидогреля и ацетилсалициловой кислоты.
Выводы. Полученные результаты свидетельствуют о необходимости коррекции дезагрегантной терапии у больных подагрой в сочетании с сердечно-сосудистой патологией в связи с возможным снижением экскреции мочевой кислоты на ее фоне и провоцированием обострения заболевания, изучения преимуществ и недостатков, безопасности препаратов данной группы. Учитывая частую сердечно-сосудистую патологию при подагре, необходимо включить в план обследования таких больных методы изучения функции эндотелия. Применение дезагрегантной терапии при сочетании подагры и сердечно-сосудистой патологии, вероятно, снизит риск развития сосудистых катастроф, будет способствовать повышению толерантности к физическим нагрузкам, улучшению качества жизни пациентов.
ОСОБЕННОСТИ
СЕРДЕЧНО-СОСУДИСТОЙ ПАТОЛОГИИ НА ФОНЕ ПОДАГРЫ
Е.А. Якименко, Л.В. Закатова, В.В. Тбилели, Н.Н. Антипова, Н.С. Тихончук, А.А. Серебрякова
Одесский национальный медицинский университет
Цель: изучить клинические особенности сердечно-сосудистой патологии на фоне подагры.
Методы исследования. В исследование были включены 125 больных подагрой, из них мужчин — 116 (93%) человек — 9 (7%). Возраст больных — 35–72 (в среднем — 53,3±0,75) года. Больных мужчин распределили на три группы в зависимости от возраста: 1-я группа — 19 (16,4%) пациентов молодого возраста (32–44 года), 2-я группа — 62 (53,4%) пациента среднего возраста (45–59 лет), 3-я группа — 35 (30,2%) — старшего возраста (60–72 года). В 4-ю группу вошли 9 женщин в возрасте от 54 до 64 лет. Использованы общепринятые клинико-лабораторные исследования для верификации подагры, также коагулограмма, липидограмма, ЭКГ, эхокардиоскопия.
Результаты. Артериальная гипертензия (АГ) диагностирована у 97 (73,6%) обследуемых пациентов, ишемическая болезнь сердца (ИБС) — у 29 (23,2%). АГ выявлена у 7 (37%) больных 1-й группы, у 53 (85,5%) — 2-й группы, у 23 (67%) — 3-й группы и у 8 (89%) — 4-й группы. ИБС в 1-й группе диагностирована не была, во 2-й — диагностирована у 12 (19,4%), в 3-й — у 16 (46%), в 4-й — у 1 (11,1%) больного. Основными эхокардиоскопическими признаками патологии сердца были: гипертрофия левого желудочка, диастолическая дисфункция левого желудочка, уплотнение корня аорты (50% случаев во 2-й группе, 11% — в 4-й группе), атеросклероз аорты с кальцинозом кольца аортального клапана — 50% во 2-й группе, 100% — в 3-й группе, кальцинозом митрального клапана — в 18% случаев.
Выводы. Полученные результатысвидетельствуют о частом сочетании подагры и АГ. Появление АГ при подагре увеличивается с возрастом и наиболее распространено в среднем возрасте. Отмечено одинаковое соотношение мужчин и женщин (приблизительно 1:1) среди пациентов с АГ и подагрой в среднем возрасте. Сочетание подагры и ИБС отмечается менее часто, чем подагры и АГ. Увеличение количества случаев ИБС при подагре, также как и АГ, отмечается с возрастом. ИБС и подагра преобладают у мужчин.
ЛІКУВАННЯ ПРИ БОЛЮ В СПИНІ У ЖІНОК, ХВОРИХ НА ОСТЕОПОРОЗ, У МЕНОПАУЗАЛЬНИЙ ПЕРІОД
О.О. Якименко, О.Є. Кравчук, М.Д. Хасан
Одеський національний медичний університет
Остеопороз займає особливе місце у групі захворювань кістково-м’язової системи у зв’язку з високою поширеністю, тривалим безсимптомним перебігом і подальшим розвитком серйозних ускладнень. Особливої актуальності проблема остеопорозу набуває у жінок в менопаузальний період, коли втрата мінеральної щільності кісткової тканини провокується гормональними змінами. У цей період остеопороз є частою причиною болю в різних ділянках опорно-рухового апарату.
Мета: вивчення впливу стронцію ранелату на больовий синдром у спині у жінок, які страждають на остеопороз.
Методи дослідження. Під динамічним спостереженням перебували 120 жінок віком 48–62 роки. Усім хворим було проведено об’єктивне та інструментальне дослідження, в тому числі рентгенологічне дослідження всіх відділів хребта, остеоденситометрію.
Результати. У результаті проведеного дослідження виявлено, що 80% жінок у менопаузальний період мають біль у спині, 20% — біль іншої локалізації (колінний, тазостегновий, плечових суглобів).
Висновки. За даними остеоденситометрії у 58% жінок виявилась остеопенія і у 42% — остеопороз різного ступеня. Після безпрерервного прийому стронцію ранелату в дозі 2 г/добу впродовж 6 міс інтенсивність і тривалість болю зменшилась у 88% жінок, які перебували під спостереженням. За контрольними даними остеоденситометрії відзначається ущільнення кісткової тканини, що обґрунтовує доцільність прийому стронцію ранелату у жінок у менопаузальний період, що страждають на систематичний біль у спині та суглобах.
ПОРІВНЯЛЬНА ЕФЕКТИВНІСТЬ ОСНОВНИХ НЕБІОЛОГІЧНИХ БАЗИСНИХ ПРЕПАРАТІВ У ХВОРИХ НА РЕВМАТОЇДНИЙ АРТРИТ ІЗ СИСТЕМНИМИ ПРОЯВАМИ
О.Б. Яременко, Г.М. Микитенко
Національний медичний університет ім. О.О. Богомольця, Київ
Мета: оцінити ефективність метотрексату (МТ), лефлуноміду (ЛФ), сульфасалазину (СС) та комбінованої базисної терапії (КБТ) у хворих на ревматоїдний артрит (РА) із системними проявами.
Методи дослідження. Обстежено 402 хворих на РА (з них 84,1% жінок), середній вік — 49,6±0,58 року, із середньою тривалістю хвороби 52,3±3,15 міс. Ранній РА (до 2 років) спостерігався у 50,0% осіб. 63,2% хворих були серопозитивними за ревматоїдним фактором, 75,2% — за анти-ЦЦП. У 175 (43,5%) хворих спостерігалися позасуглобові прояви РА, найчастіше — ревматоїдні вузлики (РВ) — 22,1%, лімфаденопатія (ЛАП) — 13,3% та загальнотрофічний синдром — 10,1%, рідше — синдром Шегрена, синдром Рейно, дигітальний артеріїт, виразки гомілок, склерит та ін. Методом підбору пар було сформовано чотири групи пацієнтів залежно від призначеної БТ: МТ у середній дозі 11,6±0,29 мг/тиж (n=157), ЛФ — 19,2±0,28 мг/добу (n=95), СС — 2,0 г/добу (n=76) чи КБТ (n=74). У всіх групах глюкокортикоїди отримували 72,4–80,3% хворих. Підсумкову ефективність лікування оцінювали через 2 роки за динамікою (∆) DAS28 та рентгенологічного рахунку за модифікованою шкалою Шарпа — ван дер Хейде (РРШХ).
Результати. До лікування кількість хворих із системними проявами у досліджуваних групах достовірно не відрізнялась і варіювала від 41,7 до 50,0% осіб. На фоні лікування ЛФ зменшення/зникнення РВ відбувалося вірогідно частіше (у 65,2% осіб) порівняно з МТ (у 34,4%), СС (у 15,4%) чи КБТ (у 31,2%) (р<0,05). Поява нових РВ спостерігалась у 19 хворих, які приймали МТ, у 3 хворих груп СС та КБТ та в жодного хворого групи ЛФ (р<0,01 vs МТ). Зникнення ЛАП на фоні лікування МТ, ЛФ, СС та КБТ відбувалося відповідно у 25; 56,2% (р<0,01 vs МТ), 30,7 та 30,7% осіб. Усі варіанти БТ однаковою мірою сприяли зниженню активності (∆DAS28) та рентгенологічного прогресування (∆РРШХ) через 2 роки у хворих без системних проявів РА (р>0,05) (таблиця).
За наявності позасуглобових проявів зміни DAS28 були найменшими у хворих, які приймали СС (р<0,05 vs МТ, ЛФ та КБТ). Рентгенологічне прогресування у хворих із системними проявами при застосуванні МТ та СС було більш вираженим порівняно з групою без системних проявів, тоді як для ЛФ та КБТ — не відрізнялося. За наявності позасуглобових проявів найшвидше рентгенологічне прогресування спостерігалося у хворих, які приймали СС чи МТ (р<0,05 vs ЛФ та КБТ).
Таблиця. Динаміка DAS28 та рентгенологічного рахунку через 2 роки БТ у хворих із наявністю та відсутністю системних проявів РА
| БТ | МТ | ЛФ | СС | КБТ |
| ∆ DAS28 | ||||
| Без системних проявів | 1,99±0,31(n=53) | 2,0±0,17(n=51) | 1,79±0,22(n=38) | 1,98±0,25(n=42) |
| Із системними проявами | 2,34±0,23(n=38) | 2,55±0,25(n=44) | 1,50±0,27(n=38)* | 2,57±0,23(n=32) |
| ∆ рентгенологічного рахунку | ||||
| Без системних проявів | 7,41±1,27(n=30) | 6,11±1,45(n=14) | 7,84±2,03(n=15) | 6,37±1,45(n=17) |
| Із системними проявами | 13,7±1,84(n=22)#1 | 7,33±2,0(n=11) | 15,9±2,27(n=12)#1 | 8,08±1,56(n=12) |
*р<0,05 порівняно з усіма іншими групами; # р<0,05 порівняно з групою ЛФ та КБТ; 1р<0,05 порівняно з групою хворих без системних проявів.
Висновки. 1. Застосування ЛФ супроводжується зменшенням вираженості чи зникненням найчастіших системних проявів РА у більшої кількості осіб порівняно з МТ, СС та КБТ; поява нових РВ спостерігається у 12,1% хворих на фоні лікування МТ та в жодному випадку — при застосуванні ЛФ (р<0,05 порівняно з МТ), у 4,1 та 3,9% при лікуванні СС та КБТ. 2. Ефективність усіх варіантів БТ у хворих без системних проявів вірогідно не відрізняється. 3. У хворих із системними проявами РА рентгенологічне прогресування при застосуванні СС чи МТ є більш вираженим порівняно з ЛФ чи КБТ та порівняно із хворими без системних проявів, які отримували СС чи МТ.
РИТУКСИМАБ У ЛІКУВАННІ ПРИ ГРАНУЛЕМАТОЗІ З ПОЛІАНГІЇТОМ
(ГРАНУЛЕМАТОЗІ ВЕГЕНЕРА)
О.Б. Яременко, Л.Б. Петелицька, Д.Л. Федьков
Національний медичний університет ім. О.О. Богомольця, Київ
За даними літератури та згідно з рекомендаціями ACR (2011), найбільш перспективним альтернативним методом індукційного та протирецидивного лікування хворих на гранулематоз з поліангіїтом (ГПА) є анти-В-клітинна терапія із застосуванням ритуксимабу.
Мета: оцінити ефективність та безпеку застосування ритуксимабу у хворих на ГПА.
Методи дослідження. Проведена робота — аналіз клінічних випадків застосування ритуксимабу у хворих із рефрактерним, рецидивним перебігом ГПА. У дослідження включено 3 хворих з ГПА, у яких, незважаючи на стандартну терапію циклофосфамідом і глюкокортикоїдами (ГК) у високих дозах, не вдавалося досягти стійкої ремісії. Схема лікування: 2 інфузії ритуксимабу по 1000 мг з інтервалом у 2 тиж. Ефективність лікування оцінювали за індексом клінічної активності васкуліту — Birmingham vasculitis activity score (BVAS), динамікою рівня антитіл до протеїнази-3 (ц-АНЦА), швидкості осідання еритроцитів (ШОЕ) та відновленням пулу CD19+-B-лімфоцитів. Тривалість спостереження — від 6 до 18 міс.
Рис. 1. Динаміка BVAS
Рис. 2. Динаміка рівнів CD19+ B-лімфоцитів
Результати. Зміни BVAS та рівнів CD19+ B-лімфоцитів під впливом лікування ритуксимабом представлено на рис. 1, 2. Упродовж перших місяців після введення ритуксимабу спостерігали зниження клінічної активності, яке корелювало зі зниженням рівня CD19+-B-лімфоцитів. У всіх 3 хворих відзначали нормалізацію рівня ШОЕ, ц-АНЦА, зниження дози ГК до 5 мг за преднізолоном та можливість відміни цитостатиків. Одній хворій через 8 міс проведено повторний цикл інфузій ритуксимабу у зв’язку з відновленням рівня СD19+-В-лімфоцитів та погіршенням клінічної симптоматики з подальшим досягненням тривалої (10 міс) клініко-лабораторної ремісії. Серед побічних проявів зафіксовано активацію хронічної герпетичної інфекції у двох хворих.
Висновки. Застосування ритуксимабу ефективне та відносно безпечне у хворих із рефрактерним перебігом ГПА. Клініко-лабораторна активність васкуліту на фоні терапії ритуксимабом в цілому синхронізована з рівнем В-клітин та ц-АНЦА. Для визначення довготривалої ефективності та безпеки терапії ритуксимабом, виявлення маркерів-предикторів рецидиву захворювання необхідне проведення рандомізованих контрольованих клінічних досліджень.
ТЕЗИ НАУКОВИХ ДОПОВІДЕЙ • 2013
АЛФАВІТНИЙ ПОКАЖЧИК
- Андруша А.Б. 102
- Андрушко І.І. 159
- Антипова Н.Н. 169, 170
- Антончук Т.М. 105
- Антюк Ж.О. 156
- Апанасович В.Г. 102
- Асташонок А.Н. 161
- Ашихмін А.В. 109
- Бабинец О.М. 103, 116
- Бакалюк Т.Г. 103
- Балацька Н.І. 146, 147
- Бевзенко Т.Б. 104
- Безродний Б.В. 105
- Беляєва Н.М. 105
- Бичков О.А. 140
- Білозецький І.І. 155
- Бірець Н.М. 127
- Благініна І.І. 106
- Благодаренко Г.Б. 129
- Блудова Н.Г. 129
- Бойко В.В. 105
- Бойко Я.Є. 106
- Бойчук Н.С. 150
- Боровик А.П. 122
- Боярчук О.Р. 107, 108
- Брыжатая Ю.О. 138
- Буторина И.И. 161
- Былино В.В. 128
- Варонько И.А. 157, 161
- Ватутин Н.Т. 108
- Вацеба М.О. 154
- Веліканович Р.Ю. 109
- Вершиніна Д.В. 109, 110, 113
- Вижга Ю.В. 121, 122
- Віннічук Л.Л. 121
- Вітцівська О.І. 110
- Вознюк Л.А. 111
- Волошин М.А. 152
- Волошин М.М. 142
- Волошина О.А. 135
- Волощук М.В. 129
- Галицька А.К. 111
- Галютіна О.Ю. 112
- Гаріян Т.В. 107
- Герасименко А.М. 112
- Гетман М.Г. 118
- Головач І.Ю. 109, 113
- Головкина Е.С. 114
- Голяченко А.О. 103
- Гончар Г.А. 115
- Гончарук І.В. 129
- Горчакова Н.О. 111
- Грабовецький С.А. 109
- Гретчин О.В. 109
- Григор’єва Н.В. 132
- Грималюк Н.В. 117
- Гришина Е.И. 103, 116
- Гріненко Т.Ю. 110, 116
- Гуменюк О.В. 117
- Гумінська Г.С. 121
- Даньчак С.В. 117
- Дейкун Д.А. 161
- Дельва Ю.В. 142, 161
- Дзекан О.В. 118
- Дзерович Н.И. 148, 149
- Дзяк Г.В. 118
- Дмитриева М.В. 166
- Добровольская И.А. 169
- Дорогой А.П. 119, 120, 121
- Дубецька Г.С. 148
- Дубкова А.Г. 128
- Дудій П.Ф. 109
- Дудник В.М. 121, 122
- Егудина Е.Д. 104, 165
- Ермолаева М.В. 112, 114
- Єфременкова Л.Н. 122
- Заворітна Р.М. 123
- Заворотная Р.М. 124
- Задорожна Л.В. 117
- Заздравнов А.А. 124
- Зайцева Е.Н. 162
- Закатова Л.В. 169, 170
- Залявська О.В. 125
- Зарудна О.І. 117
- Зімба О.О. 126
- Зоря Л.В. 139
- Иванова Е.А. 151
- Игнатенко Е.Г. 163
- Іваницька Л.М. 128
- Іванова Г.П. 128
- Іванова К.А. 150, 151
- Івашківський О.І. 146
- Іпатов А.В. 127
- Казимирко В.К. 128
- Каневская Ю.В. 169
- Карасевская Т.А. 149
- Кармазін Я.О. 142, 143, 144
- Кармазіна О.М. 141, 142, 143, 144
- Карпенко О.О. 131
- Карпович Л.Г. 132
- Касинец С.С. 128, 130
- Качур В.В. 150, 151
- Кедик І.О. 159
- Климась І.В. 164
- Климовицький Ф.В. 146
- Клочко В.В. 122
- Князєва А.К. 129
- Ковалевська К.С. 122
- Коваленко С.А. 151
- Коваленко С.О. 150, 151
- Коваль В.Б. 103
- Ковганич Т.О. 131
- Козлюк А.С. 129
- Кольцова І.Г. 122
- Комарова Е.Б. 128, 130
- Коморовський Р.Р. 156
- Кондратюк В.Є. 131, 132
- Коржук В.О. 131
- Корнієнко О.Б. 131
- Костюченко Т.М. 128
- Кравчук О.Є. 171
- Крочак С.П. 132
- Кувікова І.П. 166
- Кузьміна А.П. 133, 134
- Кульчевич Л.В. 105
- Купчинская Е.Г. 135
- Куриленко І.В. 105, 135
- Курята О.В. 136
- Лавріненко О.М. 103
- Лазоренко О.О. 113
- Лаушкина Е.М. 104, 165
- Лебединець О.М. 152
- Левада И.Н. 104, 112
- Легка Л.Л. 117
- Легконогов А.В. 137
- Легконогова Л.Г. 137
- Ливенцова Е.В. 163
- Лизогуб И.В. 135
- Лисунець О.М. 127
- Лисунець Т.К. 136
- Лукашенко Л.В. 138
- Марчук О.І. 121
- Маховська О.С. 156
- Машталяр Н.Я. 107
- Менкус Е.В. 116
- Микитенко Г.М. 171
- Микукстс В.Я. 104
- Мильнер И.А. 165
- Мисула І.Р. 103
- Михайлів Л.М. 139
- Михальченко О.М. 109, 113
- Михальчишин В.П. 126
- Мойсеєнко В.О. 140
- Мурадян О.В. 103
- Муц В.Я. 146
- Науменко Н.В. 114
- Некрасова Н.Б. 139
- Никула Т.Д. 140, 141
- Нишкумай О.И. 139
- Новикова Ю.В. 115
- Новоселецький В.О. 141
- Нода О.Ю. 136
- Олійник О.І. 142, 161
- Омельченко Л.І. 106
- Орел О.С. 107
- Павлюченко А.К. 138
- Палієнко І.А. 142, 143, 144
- Пасієшвілі Л.М. 144
- Пелешенко Г.М. 113
- Перебетюк Л.С. 145
- Петелицька Л.Б. 146, 172
- Поворознюк В.В. 132, 146, 147,
- 148, 149
- Покришка І.І. 106
- Полещук Н.Н. 161
- Присяжна В.С. 129
- Проценко Г.А 151
- Проценко Г.О. 150, 151
- Ребров Б.А. 130
- Реброва О.О. 106
- Резніченко Ю.Г. 152
- Рекалов Д.Г. 153
- Рекун А.Л. 166
- Рижик В.М. 109
- Рубаник Л.В. 161
- Рудинская Т.Д. 169
- Рудько Л.Я. 107
- Савво В.М. 162
- Сагаль І.Р. 108
- Салайда І.М. 103
- Сандурська Я.В. 142, 161
- Свистун І.Я. 107
- Свінціцький А.С. 153
- Сегеда Ю.С. 167
- Семенів І.П. 109, 113
- Серебрякова А.А. 169, 170
- Середюк Н.М. 154
- Симонова Т.А. 118
- Синенко Т.М. 128
- Синенький О.В. 146
- Синиця Ю.П. 141, 142, 144
- Синяченко О.В. 112, 138, 154
- Синяченко П.О. 163
- Сілантьєва Т.С. 128
- Слаба У.С. 156
- Сметанюк І.А. 109
- Смирнова А.С. 108
- Сміян С.І. 155, 156
- Соколовская Е.А. 136, 137
- Соліляк О.В. 117
- Сорока Н.Ф. 157, 158, 161, 162, 166
- Сосновская Е.А. 137
- Спасская А.А. 158
- Станіславчук М.А. 117, 118, 141,
- 145, 159, 160
- Старостина А.В. 102
- Стигар М.В. 160
- Суліма О.М. 160
- Сухоребська М.Я. 142, 161
- Талако Т.М. 161, 162
- Танцура О.В 127
- Тарасенко О.М. 143, 144
- Тарасенко Т.М. 168
- Тарасенко Т.Н. 168
- Тбилели В.В. 169, 170
- Тер-Вартаньян С.Х. 132, 146
- Тетерюков А.А. 158
- Тихончук Н.С. 169, 170
- Ткаченко Ю.В. 127
- ТкачукА А. 132
- Толстой В.А. 112, 115
- Толстой Д.В. 138
- Федорук А.М. 166
- Федьков Д.Л. 172
- Фельдман О.В. 106
- Филонова Т.А. 162
- Фомичева К.С. 163
- Франчук М.В. 156
- Франчук У.Я. 156
- Хакімова Т.В. 133
- Ханюкова І.Я 127
- Хасан М.Д. 164, 171
- Хидченко С.В. 102
- Хіміон Л.В. 164
- Хухліна О.С. 125
- Целая И.А. 130
- Цуцаріна О.П. 128
- Челпан Л.Л. 165
- Черепінська О.П. 109
- Чернишов В.П. 106
- Чиж К.А. 166
- Чіпко Т.М. 113
- Швед М.І. 139
- Шебеко Н.В. 132
- Шевченко М.В. 153
- Шевчук О.В. 135
- Шевчук О.С. 109
- Шевчук С.В. 105, 135, 166, 167
- Шепетько І.С. 143, 144
- Шуба Н.М. 168
- Ютовець Т.С. 114
- Яворовенко О.Б. 105
- Якименко Е.А. 169, 170
- Якименко О.О. 171
- Яковленко А.Ю. 115
- Яременко О.Б. 171, 172
- Яцишин Р.І. 142, 161

Leave a comment