Остеоартроз у підлітків: взаємозв’язок метаболічних порушень та змін імунологічного гомеостазу в його формуванні
Резюме. Дослідження носило клінічний характер, було присвячено виявленню взаємодії компонентів метаболізму сполучної тканини та основних макроелементів з окремими ланками імунітету в умовах формування вторинного остеоартрозу (ОА) у підлітків віком 12–18 років на тлі системної дисплазії сполучної тканини (СДСТ) чи після перенесеного реактивного артриту (РеА) колінних суглобів. До аналізу увійшли 142 підлітки віком 12–18 років, хворих на ОА колінних суглобів, серед яких захворювання розвинулося у 109 — на тлі СДСТ (1-ша група) та на тлі перенесеного РеА — 33 (2-га група). Досліджено окремі показники обміну сполучної тканини та імунологічного гомеостазу. Отримані результати дозволили виявити кореляційний взаємозв’язок змін у клітинній і гуморальній ланках імунітету, продукції основних прозапальних цитокінів та порушень метаболізму колагену і протеогліканів, вмісту макроелементів (кальцію, фосфору, магнію). Виявлено однаково направлені відхилення зазначених параметрів у пацієнтів із різним фоном формування ОА. Отримані дані свідчать, що ініціація розвитку дистрофічного процесу в молодому віці відбувається за наявності комплексу взаємозалежних та посилюючих одне одного зсувів у різних системах гомеостазу, кількість яких переважає у осіб 1-ї групи. Багатокомпонентність виявлених порушень диктує необхідність призначення комплексної терапії для їх корекції з метою запобігання подальшому прогресуванню змін в уражених суглобах.
Вступ
Остеоартроз (ОА) поряд із болем у нижній ділянці спини та остеопорозом названо основною медико-соціальною проблемою серед захворювань опорно-рухового апарату, яким було присвячено Всесвітню декаду ВООЗ 2001–2010 рр. [1–4]. Результати численних досліджень, що проводились у ці роки, значно розширили уявлення про складний патогенез захворювання, структурні зміни у тканинах суглоба, причини їх виникнення і прогресування, участь активації імунологічних факторів та складних біохімічних порушень [3–5]. Вчені та клініцисти стали розцінювати це захворювання не стільки як дегенеративний, а здебільшого як дистрофічний процес, в основі якого лежать комплексні імунопатологічні порушення у відповідь на надмірне навантаження суглобових поверхонь, супутній розвиток запалення, що призводить до поглиблення метаболічних зсувів у функціонуванні сполучної тканини (СТ) [6–11].
Модернізація наукового підходу при вивченні дистрофічних реакцій у синовіальному середовищі та навколосуглобових тканинах сприяла розробці нових, патогенетично спрямованих, методик консервативного впливу на патологічний процес із застосуванням хондро- і остеопротекторів та біологічно активних засобів. Завдяки новому поколінню препаратів для лікування пацієнтів із ОА, що були віднесені до класу патогенетичних або таких, що модифікують хворобу, через їх властивості поліпшувати структуру суглобового хряща (structure modifying or disease modifying antiosteoarthritis drugs — DMOADs), з’явилася можливість запобігання втраті хрящової тканини з одночасним поліпшенням функціонального статусу опорно-рухового апарату [12, 13].
Водночас акцент у цій проблемі змістився на визначення строків початку патологічних змін, ознак доклінічних і ранніх стадій захворювання, необхідної тривалості запропонованої терапії, показань до застосування специфічних імунопригнічуючих препаратів із симптоматичною повільною дією [14]. Найважливішим стає можливість впливу на перебіг хвороби на ранніх стадіях її розвитку: первинна профілактика, скринінг асимптомної стадії та профілактичне лікування чи лікування на початкових стадіях хвороби [15]. Однак на сьогодні, незважаючи на епідеміологічні, біомеханічні та молекулярні дослідження і наявність суттєвих досягнень у розумінні патофізіологічних процесів при ОА, лікарське втручання у патологічний процес відбувається не на ранній стадії захворювання, а при появі клінічної та рентгенологічної симптоматики.
Об’єктивна захворюваність на ОА великих суглобів нижніх кінцівок значно більша, ніж отримана за показниками звернення населення за медичною допомогою, а діагностика на ранніх стадіях в амбулаторно-поліклінічних закладах загального профілю має низький рівень. Серед причин такої ситуації, на наш погляд, є загальноприйнята думка, що зазначений патологічний стан притаманний лише для пацієнтів старшої вікової групи. Відомо, що в онтогенезі людини відбувається вікове зниження функції хондроцитів, розвиток протеогліканової недостатності — важливої ланки у формуванні ОА. Тому поширеність ОА в популяції корелює з віком і досягає максимальних показників у осіб віком старше 45 років. Рентгенологічні ознаки ОА виявляють у більше ніж 85% людей віком старше 60 років, а частота клінічних ознак сягає лише 27–44% населення того ж віку [16–19]. Однак все більше досліджень підтверджують, що відзначається «омолодження» хвороби [3, 20]. На тлі інформації щодо збільшення випадків захворювання у людей середнього віку зростає його частота і у молодих, а у осіб до 25 років ОА становить близько 5%. Тому згідно з сучасними алгоритмами ранньої діагностики захворювання виявлення дорентгенологічних, сонографічних, біохімічних та імунологічних ознак є показанням для проведення комплексного, патогенетично спрямованого, консервативного лікування. Тому метою нашого дослідження було вивчення стану окремих систем гомеостазу в підлітків із наявністю ознак ураження суглобів незапального характеру, які відповідали критеріям ОА у дорослих.
Об’єкт і методи дослідження
Під спостереженням у клініці ДУ «Інститут охорони здоров’я дітей та підлітків НАМН України» перебували 142 підлітки віком 12–18 років, хворих на ОА колінних суглобів, серед яких захворювання розвинулося у 109 на тлі системної дисплазії сполучної тканини (СДСТ) (1-ша група), у 33 — на тлі перенесеного реактивного артриту (РеА) (2-га група). Осіб жіночої статі було 84 (59,15%), чоловічої — 58 (40,84%), віком 12–14 років — 74 (52,11%) хворих, 15–18 років — 68 (47,88%). Для встановлення діагнозу керувалися сучасною Міжнародною класифікацією ревматичних захворювань (РЗ). У діагностиці захворювання використовували критерії РЗ згідно з протоколами діагностики та лікування, затвердженими Асоціацією ревматологів України. У всіх хворих вивчена клінічна симптоматика з ретельним обстеженням опорно-рухового апарату, яке включало огляд, пальпацію суглобів, оцінку їх функціональної спроможності, визначення ступеня та стадії розвитку запального процесу. Оцінку рентгенологічних відхилень проводили за даними рентгенограм уражених суглобів, які виконували у прямій проекції. Променеве навантаження не перевищувало 0,01 Мзв.
Ультразвукове дослідження (УЗД) структур суглобів проводили на апаратах SIEMENS, Logic, SLE у В-режимі поліпозиційного сканування в умовах реального часу датчиками від 7,5 до 12 МГц. При УЗД колінних суглобів оцінювали товщину суглобового хряща та його якість, розміри суглобової щілини, стан синовіальної оболонки і наявність ознак синовіту, форму та зміни поверхонь стегнової та великогомілкової кісток. Товщину суглобової щілини вимірювали у медіальному та латеральному відділах колінного суглоба.
Показники обміну сполучної тканини (СТ), що вивчалися, включали сумарні глікозаміноглікани (ГАГ) та їх фракції, хондроїтин сульфат (ХС) у крові та рівень уронових кислот у добовій сечі, активність кислої (КФ) та лужної фосфатаз (ЛФ), добову екскреція оксипроліну (ОКП), концентрації кальцію, фосфору, магнію в сироватці крові та кальцію і фосфору в сечі з використанням унiфiкованих методик. Стан катаболізму колагену та еластину визначали за рівнем колагенолітичної активності крові, активності еластази та її інгібіторів.
Серед імунологічних параметрів досліджували показники клітинного, гуморальної, фагоцитарної ланок імунітету, вміст цитокінів (інтерлейкіну (ІЛ)-1β, ІЛ-6, фактора некрозу пухлини (ФНП)-α). У клітинній ланці імунітету визначали субпопуляції лімфоцитів (СD, СD, СD, СD); у гуморальній — рівень сироваткових імуноглобулінів класів А, М, G, концентрацію циркулюючих імунних комплексів (ЦІК), вміст комплементу; у фагоцитарній — фагоцитарне число (Фч), фагоцитарний індекс (Фі), спонтанний (НСТс) та індукований (НСТі) НСТ-тест.
Статистичну обробку отриманих результатів виконано на персональному комп’ютері IBM PC. Використано пакети програм Microsoft Office, Statgraphics Plus 3.0, табличні процесори «SPSS Statistics 17,0». Для визначення достовірності відмінностей показників використовували параметричні й непараметричні критерії Стьюдента, Фішера, Вілкоксона — Манна — Уїтні.
Результати та їх обговорення
У дітей підліткового віку серед причин, які могли провокувати формування ОА, зазначено: гіпермобільність суглобів (ГМС) (73,3%), у тому числі при недиференційованих синдромах сполучнотканинної дисплазії (41,9%), сколіоз (26,7%), перенесений у минулому РеА (19,8%), плоскостопість (17,4%), заняття спортом із можливою мікротравматизацією суглобів (25,6%), травму суглоба (2,4%). Обтяжену спадковість щодо ОА встановлено у 45,4% випадків, причому більше ніж у половини з них хворіли ОА батьки молодого віку (35–42 років). Різні комбінації факторів ризику визначено у 19,8% хворих. Клінічна симптоматика ОА в підлітків проявлялася характерними для цього віку ознаками. Захворювання дебютувало у 59,3% хворих у віці 12–14 років, у 40,7% — у віці 15–18 років, переважали хворі жіночої статі (59,2%). Аналіз супутньої патології за анамнестичними даними виявив високу частоту респіраторних (48,2%) та алергічних (9,3%) захворювань. У підлітків із ОА, який розвинувся після перенесеного РеА, частота зазначеної патології статистично не відрізнялася. Більшість хворих на ОА (83,8%) були гармонійно розвинуті, але близько 10,0% підлітків мали надмірну масу тіла. У клінічній симптоматиці ОА основним проявом був больовий синдром, переважно щоденний, після фізичного навантаження чи при перших рухах після стану спокою (59,6%), метеозалежний (74,5%). Больовий синдром у хворих на ОА, який розвинувся після РеА, виникав переважно вранці (рφ<0,01), зберігався протягом дня (рφ<0,05), завжди супроводжував фізичне навантаження. У хворих на тлі СДСТ найчастіше прояви артралгії спостерігалися надвечір і після фізичних вправ, а в 2-й групі переважно (40,0%) відзначалася сезонність больового синдрому (виникнення його весною чи восени), порівняно із загальною частотою (25,5%) цієї ознаки. Решта осіб відзначали прояви хвороби рівномірно впродовж усього року. У всіх досліджуваних незалежно від наявності СДСТ або РеА при обстеженні виявлено різний за характером хрускіт у суглобах. Крепітація в уражених ОА суглобах, атрофії периферичних м’язів були відсутні.
Підтвердження діагнозу здійснювали при виявленні у підлітків обох груп типових для цього захворювання рентгенологічних змін. Найчастішими серед них були: загостреність та подовження міжвиросткових підвищень великогомілкових кісток та звуження рентгенологічних суглобових щілин, незалежно від наявності СДСТ і РеА. Основною ознакою формування ОА у підлітків при УЗД було виявлення недостатньої УЗ-товщини суглобового хрящу, частота якої сягала 47,1% (у хворих 1-ї групи — 60,0%, що значно перевищувало частоту у осіб, які перенесли РеА — 18,5%; р<0,001). Зміни цих показників не відрізнялися залежно від статі та віку обстежених хворих. Другою УЗ-ознакою захворювання були зміни у структурі хряща, його прозорості, цілісності (39,1%). Виявлялися різноманітні, у тому числі у вигляді поперекових смуг, гіперехогенні включення в товщі хряща, розмитість його країв і нерівність поверхонь. Такі порушення здебільшого були характерними для осіб, які мали в анамнезі запальні ураження суглобів (55,6% проти 31,7% на тлі СДСТ; р<0,01). Збільшення ехогенності субхондрального шару кісток, переважно в середній частині суглобового хряща, а також у місцях його найменшої товщини, діагностувалося у 22,9%. Зміни з боку виростків стегнової та великогомілкової кісток виявлялися у 32,2% підлітків з ОА та проявлялися потовщенням, посиленням ехогенності, нерівномірністю, загостреннями кісткової поверхні як на тлі СДСТ (30,0%), так і в дітей із перенесеним РеА (37,0%), що підтверджувало однакову спрямованість патологічних процесів при формуванні дегенеративних змін.
Ознаки синовіту у вигляді потовщення синовіальної оболонки та наявності рідини в супрапателярній сумці виявлялись у 21,8% обстежених — частіше у групі підлітків з ОА на тлі РеА (40,7%), ніж у дітей, які мали СДСТ (13,3; р<0,05). Незважаючи на те що всі підлітки мали скарги на біль у суглобах, залежності щодо наявності синовіту від больового синдрому не відзначалося.
Оцінка метаболізму сполучнотканинних структур у підлітків, хворих на ОА, показала наявність значних порушень. Основними серед них були зміни загальної кількості ГАГ та їх якісного складу. У більшості хворих (80,5%; р<0,05) відзначалося зниження рівня загальних ГАГ (84,8 та 76,0% відповідно у 1-й та 2-й групах), вираженість якого була більшою у підлітків 1-ї групи порівняно як із дітьми здорового контролю (р<0,01), так і підлітками 2-ї групи (р<0,05) (табл. 1). У всіх хворих зменшення загальних ГАГ відбувалося за рахунок ІІ та ІІІ фракцій (р<0,05). Визначений перерозподіл фракцій відображав, на нашу думку, наявність протеогліканової недостатності й, відповідно, загальний дефіцит основних структурних складових хряща. Низькі значення загальних ГАГ у підлітків з ОА супроводжувалися підвищенням у більшості з них (74,3%; р<0,05) вмісту в крові ХС, що відповідало підвищенням першої фракції ГАГ (глюкозаміноглікуроном) (р<0,05) і свідчило про втрату ХС у хворих на ОА. Це супроводжувалося й підвищенням рівня екскреції ГАГ із сечею у вигляді уронових кислот у 30,4% хворих (29,1 та 32,0% відповідно у 1-й та 2-й групах). Більш значущими зміни ХС крові були в дівчаток, ніж у хлопчиків (0,17 г/л проти 0,15 г/л; р<0,05), особливо на тлі перенесеного РеА (0,23 г/л у дівчаток проти 0,11 г/л у хлопчиків; р<0,05). Незалежно від фонового стану, на якому розвинувся ОА, рівень ХС був достовірно вищим за наявності вторинного синовіту (0,19 г/л проти 0,15 г/л; р<0,05).
| Показник | Усього | 1-ша група | 2-га група | Здорові |
|---|---|---|---|---|
| ГАГ загальні, од. | 9,51±0,13* | 9,60±0,30 | 10,05±0,0,25 | 12,10±0,42 |
| ГАГ І фракція, од. | 6,81±0,10 | 6,66±0,12 | 7,25±0,17 | 5,85±0,45 |
| ГАГ ІІ фракція, од. | 1,56±0,05* | 1,54±0,05** | 1,64±0,11 | 3,90±0,40 |
| ГАГІІІ фракція, од. | 1,13±0,03* | 1,12±0,04** | 1,14±0,07 | 2,80±0,40 |
| ХС загальний, г/л | 0,17±0,01* | 0,16±0,01** | 0,18±0,01 | 0,09±0,01 |
| Уронові кислоти, мг/добу | 5,38±0,33 | 5,27±0,27 | 5,72±1,04 | 4,50±1,00 |
| ОКП, мг/добу | 66,35±4,61* | 69,98±5,43** | 55,28±8,31 | 27,30±16,50 |
| ЛФ, од. | 9,91±0,61* | 10,69±0,74** | 7,58±0,90 | 5,25 ± 0,24 |
| КФ, од. | 3,85±0,0,24* | 4,06±0,29** | 3,26±0,39 | 1,35±0,65 |
*р<0,05 — відмінності показників у хворих загальної групи і здорових; **р<0,05; р<0,01 — відмінності показників у хворих 1-ї групи і здорових;
р<0,05 — відмінності показників у хворих 2-ї групи і здорових; р<0,05 — відмінності показників у хворих 1-ї та 2-ї груп.
Аналіз біохімічних параметрів визначив достовірне підвищення екскреції ОКП у більшості хворих загальної групи (61,48%; р<0,05) та за наявності СДСТ (67,08% порівняно із 44,00% серед підлітків 2-ї групи; р<0,05). При цьому відзначалися достовірно менші її значення у підлітків із ОА на тлі РеА (р<0,05). Вік хворих істотно не впливав на метаболічні процеси у СТ та обмін колагену, найбільшою вона виявилась у 1-й групі хворих незалежно від віку (відповідно за групами: 70,7 та 33,6 мг/добу у віці до 14 років; 75,4 та 56,3 мг/добу — у хворих 15–18 років; р<0,05) та у осіб чоловічої статі порівняно з жіночою як у загальній (90,7 проти 47,5 мг/добу; р<0,05), так і в 1-й (96,3 проти 47,2 мг/добу; р<0,05) групах хворих. Зі збільшенням запального процесу (синовіту) інтенсивність екскреції ОКП зростала (71,4 порівняно з 61,9 мг/добу; р<0,05), особливо у підлітків 1-ї групи (80,0 порівняно з 59,6 мг/добу; р<0,05).
Порушення в обміні колагену, відображенням якого була надмірна екскреція ОКП, проявлялись і значними змінами колагенолітичної активності крові та активності еластази у підлітків із ОА. Порівняно з контрольними значеннями активність колагенази у обстежених хворих підвищувалась у >2 рази (18,76 проти 8,06 мкмоль/л/год; р<0,05). Аналізуючи зміни протеолітичних ферментів у підлітків з ОА залежно від факторів ризику, визначено, що у хворих на РеА колагенолітична активність сироватки крові на 43,1% вище порівняно з підлітками із СДСТ (р<0,05). Одночасно з цим у підлітків 2-ї групи підвищувався вміст інгібіторів еластази на 22,5% (р<0,05), що, можливо, свідчило про активацію компенсаторних механізмів у пацієнтів цієї групи та не відзначалось у пацієнтів із ОА на тлі СДСТ. Порушення у структурі матриксу хряща супроводжувалися вивільненням лізосомальних ферментів, що підтверджувалось їх підвищенням у переважної більшості хворих (КФ у 78,37%; р<0,05, та ЛФ у 77,03% хворих; р<0,05). Виявлено чітке підвищення активності КФ за середніми значеннями (р<0,05) порівняно зі здоровим контролем, ЛФ — порівняно як зі здоровими (р<0,05), так і між хворими залежно від факторів формування ОА (р<0,05). Показники ЛФ при РеА були достовірно нижчими як серед усіх хворих, так і у різних вікових групах порівняно з підлітками з СДСТ (р<0,05).
Вміст кальцію і фосфору в крові у підлітків, хворих на ОА, коливався в межах норми. Це стосувалося також їх екскреції, незалежно від факторів формування ОА, що аналізувалися. Разом із тим за наявності СДСТ порівняно з 2-ю групою хворих виведення кальцію було вищим (193,9 та 182,8 мг/добу; р<0,01), перш за все у дівчат, ніж у хлопців (відповідно 194,3 і 133,7 мг/добу; р<0,05), та пацієнтів віком 15–18 років, ніж у підлітків віком 11–14 років (відповідно 234,5 і 181,8 мг/добу; р<0,01). Стосовно фосфору спостерігалася також більш виражена його екскреція у підлітків із СДСТ порівняно із хворими 2-ї групи (0,77 проти 0,67 г/добу; р<0,01), особливо в осіб жіночої статі (0,73 проти 0,58 г/добу; р<0,001). Вміст магнію у хворих обох груп значно перевищував показники у здорових осіб, незалежно від віку, статі, наявності СДСТ.
| Показник | Група | Стать | Вік, років | Наявність синовіту | Здорові | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| загальна | 1-ша | 2-га | ||||||||
| дівчата | юнаки | 12–14 | 15–18 | є | немає | |||||
| CD, % | 47,6±1,3 | 46,4±0,9** | 41,8±2,03 | 45,4±1,4 | 44,8±1,2 | 45,7±1,5 | 47,4±1,2 | 42,6±1,6 | 47,6±1,0 | 61,1±1,0 |
| CD, % | 34,8±0,8* | 35,4±0,9 | 32,6±2,1 | 34,8±1,3 | 34,7±1,2 | 34,0±1,2 | 35,8±1,1 | 33,4±1,5 | 35,5±1,0 | 37,0±0,8 |
| CD, % | 10,6±0,5 | 10,9±0,6** | 9,7±1,1 | 10,2±0,4 | 11,4±0,9 | 10,0±0,7 | 11,2±0,6 | 10,0±0,7 | 10,9±0,6 | 23,1±0,6 |
| CD, % | 23,3±0,4 | 23,9±0,6* | 22,4±1,0** | 23,9±0,6 | 22,7±0,5 | 23,2±0,4 | 23,2±0,7 | 23,3±0,8 | 23,0±0,4 | 19,7±0,7 |
| Фч, % | 61,9±1,2 | 62,0±1,4** | 61,6±2,2** | 62,8±1,5 | 60,8±2,4 | 61,5±1,8 | 62,4±1,6 | 59,2±1,9 | 63,5±1,5 | 48,8±2,1 |
| Фі, абс. | 5,2±0,5 | 6,1±0,5 | 4,9±0,3 | 5,0±0,5 | 5,4±1,0 | 5,2±0,5 | 5,2±0,7 | 5,0±1,0 | 5,4±0,4 | 4,1±0,2 |
| НСТс, % | 23,0±0,7 | 22,8±0,9** | 22,5±1,1 | 22,0±1,0 | 24,2±1,3 | 23,0±0,8 | 22,4±1,2 | 23,1±1,5 | 22,5±0,8 | 14,2±0,9 |
| НСТі, % | 32,0±0,9 | 30,8±0,9** | 35,1±1,5 | 31,7±1,0 | 30,5±1,5 | 31,2±1,1 | 32,4±1,2 | 32,1±1,5 | 31,7±1,0 | 21,7±1,0 |
| IgА, г/л | 2,4±0,2** | 2,3±0,1** | 1,9±0,2 | 2,0±0,2 | 2,5±0,2 | 2,1±0,2 | 2,2±0,2 | 2,2±0,2 | 2,2±0,1 | 1,9±0,1 |
| IgМ, г/л | 1,5±0,1 | 1,6±0,2 | 1,2±0,1 | 1,4±0,1 | 1,8±0,3 | 1,6±0,3 | 1,4±0,1 | 1,3±0,1 | 1,4±0,2 | 1,2±0,1 |
| IgG, г/л | 13,2±0,5* | 13,0±0,6 | 12,2±0,8 * | 13,0±0,8 | 12,6±0,8 | 12,6±0,7 | 13,4±0,7 | 13,3±0,9 | 12,8±0,6 | 11,9±0,5 |
| ЦІК, г/л | 1,1±0,1 | 1,1±0,1 | 1,6±0,1 | 1,25±0,1 | 1,0±0,1 | 1,1±0,1 | 1,2±0,1 | 1,0±0,1 | 1,2±0,1 | 1,14±0,1 |
| Комплемент, ум. од. | 1,2±0,1 | 1,2±0,1 | 1,1±0,1 | 1,2±0,1 | 1,2±0,1 | 1,2±0,1 | 1,1±0,1 | 1,1±0,1 | 1,2±0,1 | 1,1±0,1 |
| ІЛ-1β, пг/мл | 28,5±21 | 31,1±2,5 | 24,2±2,2 | 26,3±2,5 | 32,4±2,4* | – | – | – | – | 2,3±0,4 |
| ІЛ-6, пг/мл | 16,0±2,0 | 18,5±2,1 | 14,5±2,2 | 15,8±2,3 | 16,7±2,2 | – | – | – | – | 2,4±0,3 |
| ФНП-α, пг/мл | 12,2±1,0 | 13,6±1,2 | 8,9±2,1 | 14,0±2,1 | 10,1±1,9 | – | – | – | – | 3,6±0,3 |
*p<0,05; **p<0,01; p<0,001– відмінності між показниками хворих та здорових підлітків; p<0,001 — відмінності між показниками залежно від наявності синовіту; p<0,05 — відмінності між показниками залежно від причинного фактора розвитку.
Імунологічний гомеостаз у дітей та підлітків, хворих на ОА, порівняно зі здоровими однолітками, характеризувався такими зсувами: у Т-ланці імунітету — зниження відносної кількості Т-загальних лімфоцитів (р<0,001) як за рахунок Т-хелперів, так і Т-супресорів/цитотоксичних (табл. 2). При цьому рівень Т-активних лімфоцитів був підвищеним (р<0,05). Вміст Т-загальних клітин був нижчим у хворих із синовітом (р<0,001). У В-ланці імунітету встановлено ознаки її активації: підвищення вмісту В-лімфоцитів (р<0,001), IgA (р<0,001) та IgG (р<0,05). Стан фагоцитарної ланки характеризувався підвищенням метаболічної активності фагоцитуючих клітин (за показниками НСТ-тесту спонтанного та індукованого; р<0,001). При дослідженні цитокінового статусу встановлено гіперпродукцію прозапальних цитокінів — ІЛ-1β, ІЛ-6 та ФНП-α (р<0,001), частота їх підвищених показників у хворих із синовітом була значно вищою, ніж у хворих без синовіту. Так, для ІЛ-1β вона становила 48,5 та 19,5%, для ІЛ-6 — 48, 9 та 25,1% і для ФНП-α — 48,7 і 34,2% відповідно (р<0,01).
За даними аналізу стану імунологічної реактивності у хворих на ОА залежно від причинного фактора розвитку захворювання на тлі СДСТ порівняно із хворими, які перенесли РеА, виявлено менш виражене зниження вмісту Т-загальних лімфоцитів (р<0,001), при цьому більший вміст Т-хелперів та Т-супресорів/цитотоксичних (р<0,001). При цьому підвищення їх рівня виявлялось як у хворих із синовітом, так і без нього, але дещо частіше підвищені показники цитокінів реєстрували у хворих із синовітом. Слід зауважити, що рівень ІЛ-1β у дівчат був дещо вищим, ніж у хворих чоловічої статі (р<0,05), що свідчить про більш несприятливий прогноз ОА у осіб жіночої статі. Дослідження імунних показників у хворих на ОА після РеА порівняно з показниками у хворих на ОА, що розвинувся на тлі СДСТ, виявило такі особливості: більш значне зниження вмісту Т-загальних лімфоцитів і Т-хелперів у хворих на РеА в анамнезі (р<0,05); вища активація В-ланки імунітету, що проявилася у вигляді більш високого рівня IgA у хворих зі СДСТ (р<0,05).
Для встановлення стану окремих складових гомеостазу організму підлітків із ОА важливо дослідження їх взаємозв’язків при розвитку захворювання (рисунок). Кореляційний аналіз було проведено також у контрольній групі підлітків без ознак ураження суглобів, в якій виявлено незначну кількість вірогідних взаємозв’язків за участю комплементу та ФНП-α з боку імунної системи та ІІ фракції ГАГ, рівня екскреції ОКП та активності КФ серед біохімічних показників.
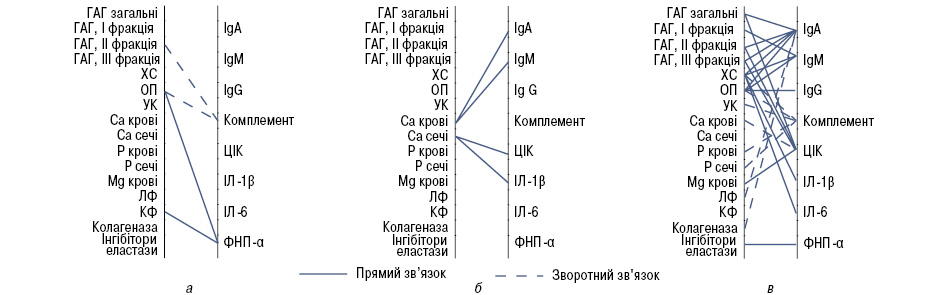
У групі хворих на ОА на тлі перенесеного РеА також відзначено низький рівень кореляційних зв’язків, що, в свою чергу, свідчить про достатньо високий рівень стабільності систем гомеостазу в умовах виникнення патологічних змін. У цьому разі відзначено взаємозалежність відмінних від контрольної групи параметрів. Імунологічними ланками, що мають спільний вплив у розвитку хвороби, стають гуморальні фактори імунітету (ІgА, ІgМ), підвищення рівня ЦІК і такого прозапального цитокіну, як ІЛ-1β — основного ІЛ у розвитку ОА. З боку метаболічних параметрів найбільш впливовим став вміст кальцію крові та рівень його добової екскреції. Ці параметри безпосередньо є відображенням запального процесу, що підтверджує роль перенесеного РеА в ініціації розвитку ОА — дистрофічного за своєю природою стану.
Проведення множинного кореляційного аналізу в групі підлітків із ОА, розвиток якого відбувається на тлі СДСТ, виявило наявність великої множини взаємозв’язків між компонентами сполучнотканинного метаболізму та імунологічного гомеостазу. Практично всі параметри, що вивчалися, пов’язані між собою, що підкреслює багатокомпонентність патологічного процесу, наявність біохімічно-імунологічної інтеграції в розвитку захворювання. Найбільш впливовими параметрами з боку імунної системи були концентрації ІgА, комплементу та ЦІК. Серед біохімічних параметрів у створенні зв’язків домінували компоненти, що характеризують вміст протеогліканів і метаболізм колагену, що свідчить про важливість саме цих відхилень у початку патологічних змін. З іншого боку, велика кількість множинних кореляційних залежностей підкреслює нестабільність систем організму в умовах розвитку захворювання, що може свідчити також про відсутність достатнього рівня компенсації при виникненні змін окремих параметрів метаболізму.
Таким чином, у підлітковому віці виникають патологічні зміни в імунологічних та біохімічних процесах, що на тлі наявності морфологічних особливостей суглобів (зниження товщини суглобового хряща, порушення його структури) внаслідок СДСТ або перенесеного РеА призводить до змінення функціонування систем гомеостазу і появи клінічних та інструментальних проявів, що характеризують ОА.
На основі кореляційного аналізу при розвитку ОА в підлітковому віці виявлено багатогранну структуру взаємозв’язків не лише між окремими показниками, але й між різними системами організму, що визначає їх вплив на розвиток дистрофічних процесів у суглобах. Зазначене робить певний внесок в уточнення механізмів формування ОА в підлітків, що сприятиме більш ранній діагностиці та призначенню своєчасної адекватної терапії. При розробці профілактичних заходів необхідно враховувати отримані дані, надавати увагу саме компенсації метаболічних порушень, перш за все — протеогліканової недостатності, та пригніченню субклінічного запального компонента.
Список використаної літератури
1. Насонова В.А. (2000) Проблема остеоартроза в начале XXI века. Consilium medicum, 2: 6.
2. Вялков А.И., Гусев Е.И., Зборовский А.Б. и др. (2001) Основные задачи Международной Декады (The Bone and Joint Decade 2000–2010) в совершенствовании борьбы с наиболее распространенными заболеваниями опорно-двигательного аппарата в России. Науч.-практ. ревматол.; 2: 4–11.
3. Коваленко В.Н., Борткевич О.П. (2003) Остеоартроз: практическое руководство. Морион, Киев, 448 с.
4. Алексеева Л.И. (2000) Современные представления о диагностике, лечении и профилактике остеоартроза. РМЖ, 8(9): 377–382.
5. Насонова В.А. (2003) Остеоартроз коленного сустава: причины развития, диагностика и профилактика. Consilium medicum, 5(2): 46–51.
6. Павлова А.Б., Доронина И.В., Заводовский Б.В. и др. (2010) Диагностическое значение маркеров метаболического синдрома при дегенеративно-дистрофических заболеваниях суставов. Сб. науч. работ. Актуальные проблемы современной ревматологии. Волгоград. Вып. 27: 38–39.
7. Garnero P., Piperno M., Gineyts E. еt al. (2001) Cross sectional evaluation of biochemical markers of bone, cartilage, and synovial tissue metabolism in patients with knee osteoarthritis: relations with disease activity and joint damage. Ann. Rheum. Dis., 60: 619–626.
8. Penninx B.W.J.H., Abbas H., Ambrosius W. еt al. (2004) Inflammatory Markers and Physical Function Among Older Adults with Knee Osteoarthritis. J. Rheum., 31: 2027–2031.
9. Ferrucci L., Penninx B.W., Volpato S. et al. (2002) Change in muscle strength explains accelerated decline of physical function in older women with high interleukin-6 serum levels. J. Am. Geriatr. Soc., 50: 1947–1954.
10. Penninx B.W., Kritchevsky S.B., Newman A.B. et al. (2004) Inflammatory markers and incident mobility limitation in the elderly. J. Am. Geriatr. Soc., 52: 1105–1113.
11. Saxne T., Lindell M., Mansson B. et al. (2003) Inflammation is a feature of the disease process in early knee joint osteoarthritis. Rheumatology (Oxford); 42: 903–904.
12. Felson D.T. (2006) Osteoarthritis of the knee. Clin. Pract., 354: 841–848.
13. Miller G.D., Rejeski W.J., Williamson J.D. et al. (2003) The Arthritis, Diet and Activity Promotion Trial (ADAPT): design, rationale, and baseline results. Control Clin. Trials., 24: 462–480.
14. Durmawan J. (2007) World Health Organisation — International League of Associations for Rheumatology Community. Orientece Program for Control of Rheumatic Disease. Clin. Rheum., 26(6): 853–857.
15. Jones R.K., Chapman G.J., Findlow A.H. еt al. (2007) A New Approach to Prevention of Knee Osteoarthritis: Reducing Medial Load in the Contralateral Knee. J. Rheum., 40(3): 309–315.
16. Felson D.T. (1988) Epidemiology of hip and knee osteoarthritis. Epid. Rev., 10: 1–28.
17. Fautrel В., Hilliguin Р., Rozenberg S. et al. (2005) Impact of osteoarthritis: results of nationwide survey of 10000 patients consuling for OA. J. Bone Spine, 72(3): 235–240.
18. Jinks C., Jordan K., Croft P. (2007) Osteoarthritis as a public health problem: the impact of developing knee pain on physical function in adults living in the community: (KNEST3). Rheumatology (Oxford); 46(5): 877–881.
19. Peat G., Thomas E., Duncan R. et al. (2006) Clinical classification criteria for knee osteoarthritis; performance in the general population and primary care. Ann. Rheum. Dis., 65: 1363–1367.
20. Burbine S.A., Weinstein A.M., Reichmann W.M. еt al. (2006) Knee Osteoarthritis to Increase in Younger Age Groups in Next Ten Years (http://www.rheumatology.org/ about/newsroom).
ОСТЕОАРТРОЗ У ПОДРОСТКОВ: ВЗАИМОСВЯЗЬ МЕТАБОЛИЧЕСКИХ НАРУШЕНИЙ И ИЗМЕНЕНИЙ ИММУНОЛОГИЧЕСКОГО ГОМЕОСТАЗА В ЕГО ФОРМИРОВАНИИ
Резюме. Исследование носило клинический характер, было посвящено выявлению взаимодействия компонентов метаболизма соединительной ткани и основных макроэлементов с отдельными звеньями иммунитета в условиях формирования вторичного остеоартроза (ОА) у подростков в возрасте 12–18 лет на фоне дисплазии соединительной ткани (СДСТ) или после перенесенного реактивного артрита (РеА) коленных суставов. В анализ были включены 142 подростка в возрасте 12–18 лет, больных ОА коленных суставов, среди которых у 109 человек заболевание развилось на фоне СДСТ (1-я группа), у остальных 33 — на фоне перенесенного РеА (2-я группа). Исследованы отдельные показатели обмена соединительной ткани и иммунологического гомеостаза. Полученные результаты позволили выявить корреляционную взаимосвязь изменений в клеточном и гуморальном звеньях иммунитета, продукции основных провоспалительных цитокинов и нарушений метаболизма коллагена и протеогликанов, содержания макроэлементов (кальция, фосфора, магния). Выявлены одинаково направленные отклонения указанных параметров у пациентов с различным фоном формирования ОА. Полученные данные свидетельствуют, что инициация развития дистрофического процесса в молодом возрасте происходит при наличии комплекса взаимосвязанных и усиливающих друг друга сдвигов в разных системах гомеостаза, количество которых преобладает у лиц 1-й группы. Многокомпонентность выявленных нарушений диктует необходимость назначения комплексной терапии для их коррекции с целью предупреждения дальнейшего прогрессирования изменений в пораженных суставах.
остеоартроз, подростки, иммунологические показатели, метаболизм, протеогликаны, коллаген, кальций, фосфор, магний.
Адреса для листування:
Шевченко Наталя Станіславівна
61153, Харків, просп. 50-річчя ВЛКСМ, 52 А
«Інститут охорони здоров’я дітей та підлітків НАМН України»
E-mail: nshevchenko_kh@mail.ru
E-mail: iozdp@iozdp.org.ua

Leave a comment