Гіперурикемія — мультиморбідна патологія в ревматології
Резюме. Резюме. У статті обговорюються сучасні аспекти етіопатогенезу подагричного артриту, висвітлено нові погляди на патофізіологічні значення сечової кислоти, наведено останні клінічні рекомендації (EULAR, 2011) з лікування пацієнтів із подагрою та гіперурикемією. Також містяться дані щодо останніх сучасних методів фармакотерапії при гіперурикемії.
Подагра (pos, podis — нога, agra — капкан) — «нога в капкане» — системное заболевание, развивающееся в связи с воспалением в местах отложения кристаллов моноурата натрия у людей с гиперурикемией, обусловленной внешнесредовыми и/или генетическими факторами. (код по МКБ-10 — М10 Подагра). Согласно эпидемиологии, подагрой страдают не менее 1–3% взрослого населения. По экспертным оценкам, соотношение мужчин и женщин составляет 7:1. Пик заболеваемости отмечают в возрасте 40–50 лет у мужчин, ≥60 лет — у женщин (Насонова В.А., Барскова В.Г., 2004).
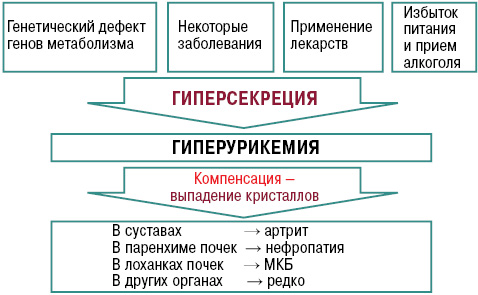
Причины подагры разнообразны. Среди них выделяют дефекты генов, отвечающих за активность ферментов, влияющих как на синтез мочевой кислоты (МК) (гиперпродукция), так и на ее транспорт в почках (гипоэкскреция). Причинами могут быть заболевания, сопровождающиеся массивным распадом нуклеотидов из клеточных ядер (гиперурикемия), а именно: болезни крови, лимфпролиферативные заболевания, тяжелый псориаз, саркоидоз и другие заболевания, нарушающие почечную экскрецию, то есть — болезни накопления, гипотиреоз, гиперпаратиреоз, хроническая почечная недостаточность, застойная сердечная недостаточность, гестозы, ожирение, а также химио- и лучевая терапия. Кроме того, гиперурикемию может вызывать загрязнение окружающей среды (работа бензиновых двигателей) и токсические вещества (свинец), которые нарушают экскрецию уратов почками (Насонова В.А., Барскова В.Г., 2004).
Существуют также факторы риска возникновения подагры, такие как высокопуриновые продукты питания, которые вызывают в организме избыток субстрата для синтеза МК. Кроме того, следует помнить, что жирная пища нарушает экскрецию уратов почками, а алкоголь, метаболизируясь до молочной кислоты, препятствует экскреции уратов. Наибольшую опасность представляют крепкие алкогольные напитки и пиво. Аналогично могут влиять и большие физические нагрузки.
Не менее важным фактором является применение препаратов, вызывающих гиперурикемию. К ним относятся противотуберкулезные лекарственные средства (пиразинамид и этамбутол), которые способны вызывать гиперурикемию и обострение подагры, боль в суставах (как на фоне гиперурикемии, так и без нее). Аналогичным эффектом обладает диданозин, применяемый при ВИЧ. Для этих препаратов гиперурикемия является ожидаемым побочным эффектом, вызванным конкуренцией с уратами на пути элиминации.
Иммуносупрессор циклоспорин А может увеличивать урикемию, снижать экскрецию уратов почками и вызывать их дисфункцию. Через несколько лет иммуносупрессивной терапии тяжелая подагра развивается у 10% пациентов. Кроме того, салицилаты (ацетилсалициловая кислота в низких дозах) вызывают нарушение выделения уратов почками. Никотиновая кислота, рибоксин метаболизируются до нуклеотидов и далее — до МК. Сходным метаболизмом обладает противовирусное средство изопринозин.
С осторожностью при гиперурикемии и подагре назначают комплексный церебропротекторный препарат цитофлавин, содержащий инозин, мононуклеотид рибофлавина, никотинамид, янтарную кислоту.
Рутин при длительном применении может способствовать образованию уратов в почках. Поэтому применение таких препаратов, как аскорутин, иммуновит С, у пациентов с нарушениями пуринового обмена требует осторожности. Нарушение пуринового обмена вызывают также силденафил, статины и даже ингибиторы ангиотензинпревращающего фермента.
В настоящее время выделяют подагру и синдром гиперурикемии. По этиологии они могут быть: первичными (генетически детерминированными) и вторичными (вследствие заболеваний, действия лекарственных средств, токсинов, питания и др.).
В зависимости от механизмов патогенеза выделяют: метаболический (гиперпродуктивный), почечный (гипоэкскреторный) и смешанный типы.
По клиническим проявлениям выделяют (Насонова В.А., Барскова В.Г., 2004):
- бессимптомную гиперурикемию;
- острый/интермиттирующий артрит;
- межприступный период;
- хроническую тофусную подагру.
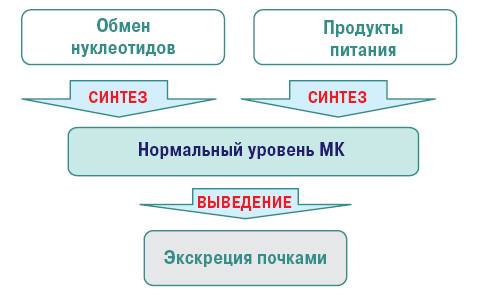
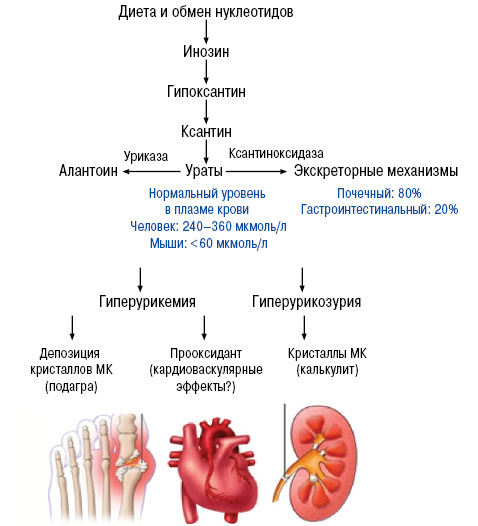
Нормальный уровень МК — важный фактор гомеостаза. МК — конечный продукт обмена пуриновых нуклеотидов аденина и гуанина (компонентов ДНК и РНК). В норме содержание ее в крови 200–360 и 160–320 мкмоль/л — у мужчин и женщин соответственно.
Нормальный метаболизм МК осуществляется следующим путем (рис. 1).
Нарушение пуринового обмена и развитие гиперурикемии представлено на рис. 2 и 3.
Клиническая классификация подагры
1. Клинические стадии:
а) острый подагрический артрит;
б) межприступная (интервальная) подагра;
в) хроническая тофусная подагра (хронический подагрический артрит, нефролитиаз, подагрическая нефропатия и др.):
- обострение;
- ремиссия.
2. Рентгенологические стадии поражения суставов (рис. 4):
I — крупные кисты (тофусы) в субхондральной кости и в более глубоких слоях, иногда уплотнения мягких тканей;
II — крупные кисты вблизи сустава и мелкие эрозии суставных поверхностей, постоянное уплотнение околосуставных мягких тканей, иногда с кальцификатами;
III — обширные эрозии не менее чем на ⅓ суставной поверхности, остеолиз эпифиза, значительное уплотнение мягких тканей с кальциевыми депозитам.
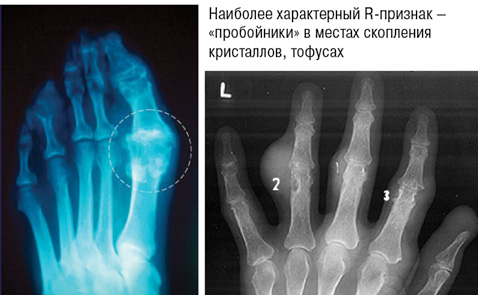
3. Степень функциональной недостаточности:
0 — сохранена;
I — сохранена профессиональная способность;
II — утрачена профессиональная способность;
III — утрачена способность к самообслуживанию.
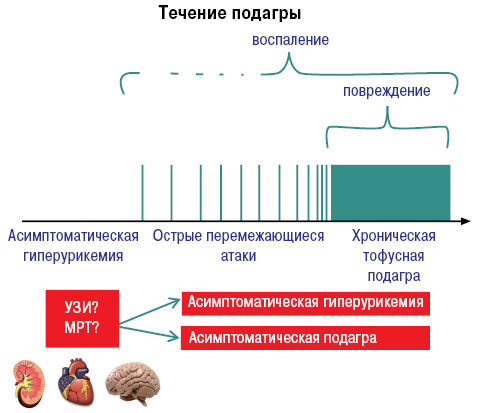
Развитие и течение подагры можно представить следующим образом (рис. 5).
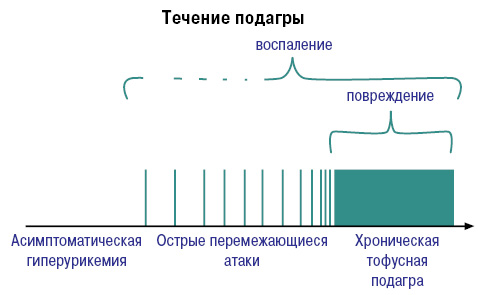
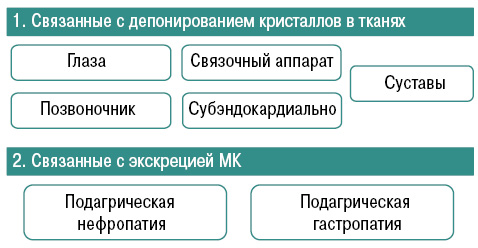
Характерны системные проявления подагры как тофусной болезни, связанные с депонированием кристаллов в тканях (суставы, связочный аппарат, субэндокардиально, позвоночник, глаза) и связанные с экскрецией МК (подагрическая нефропатия, гастропатия) (рис. 6).
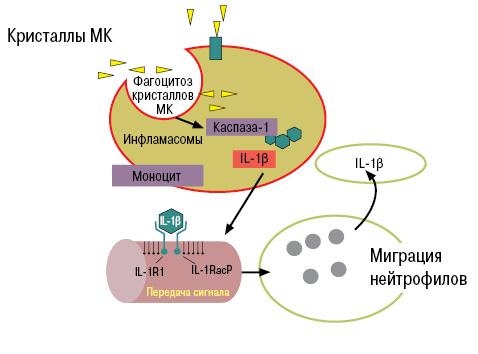
Образовавшиеся кристаллы МК фагоцитируются макрофагами (моноцитами), в результате чего идет активация инфламасом, каспазы-1, ИЛ-1β, что приводит к развитию воспалительного процесса в местах отложения кристаллов МК, в том числе в эндотелии сосудов (рис. 7).
Что такое инфламасомы? Это цитоплазматический комплекс протеинов, который приводит к трансформации провоспалительных цитокинов в их активное состояние.
На сегодняшний день идентифицированы 4 типа инфламасом (рис. 8) (Martinon F., 2009; 2010):
- NLRP1
- NLRP2
- AIM2
- IPAF
Кристаллы моноурата натрия являются триггерами других воспалительных медиаторов:
- Цитокины: интерлейкин (IL)-1α и -β, IL-6, фактор некроза опухоли (ФНО)
- Хемокины: IL-8
- Мини-молекулы: простагландины (ПГ), гистамин
- Жирные кислоты выступают как вторичный сигнал и необходимы для развития подагрического артрита
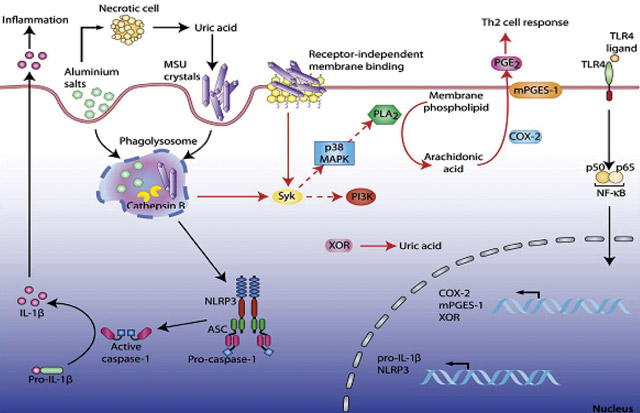
Кроме того, кристаллы МК активируют циклооксигеназу (COX)-2, киназы (Syk, p38 MAPK) (рис. 9). Очень важная роль в развитии подагры принадлежит IL-1β, что и представлено на рис. 10.
Рис. 9. Кристаллы МК активируют COX-2
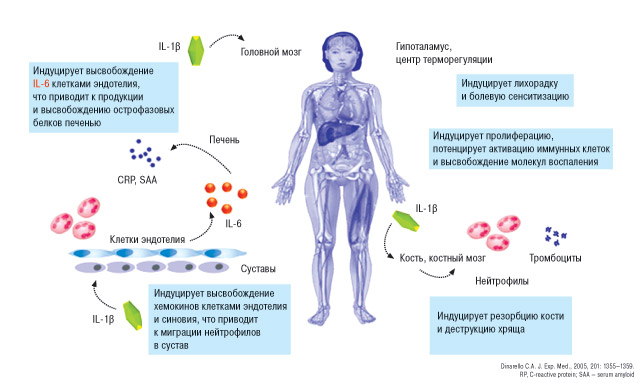
Рис. 10. IL-1 как плейотропный воспалительный цитокин
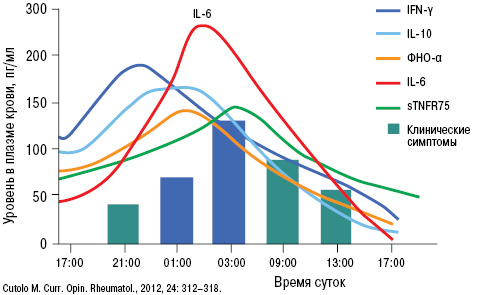
Возникновение и течение подагрического артрита четко кореллирует с уровнем провоспалительных цитокинов в ранние утренние часы (рис. 11).
Важное место в клинике подагры занимает поражение почек. И гиперурикемия, и подагра связаны с развитием уратного нефролитиаза. Поражение почек при подагре условно разделяют на обусловленные собственно гиперурикемией и кристаллообразованием и являющиеся атрибутом сопутствующих болезней (рис. 12).
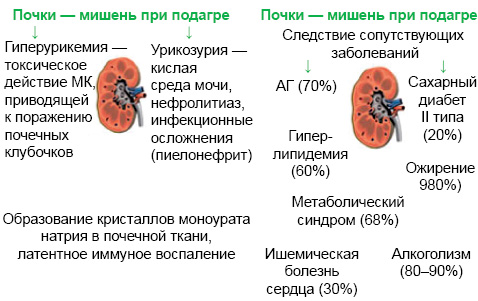
Классическими факторами риска уратного нефролитиаза считаются гиперурикозурия, низкий диурез и низкий рН мочи. Рассмотрим особенности указанных факторов риска при подагре.
Гиперурикозурия — специфичный признак при подагре, отмечаемый в ряде случаев: у больных молодого возраста, при неконтролируемом сахарном диабете ІІ типа (высокая гипергликемия), синдроме Леша — Нихена, а также может быть вызвана медикаментозно при лечении урикозоуриками (бензбромароном). Среди других причин гиперурикозурии чаще всего отмечаются миелопролиферативные болезни и химиотерапия, приводящая в ряде случаев к острому уратному кризу при отсутствии надлежащей профилактики. Почками экскретируется до 70% МК, кишечником — 15–20%, кожа, волосы и ногти берут на себя остаточный объем. При этом МК полностью фильтруется клубочками, но при этом 99% реабсорбируется в проксимальных канальцах. Громадный объем реабсорбции МК генетически детерминирован. Таким образом, один из классических факторов уратного нефролитиаза — гиперурикозурия — не подходит для объяснения нефролитиаза при подагре. При гипоурикемической гиперурикозурии (дефект транспортера URAT1) — подагры не бывает, поскольку для подагры нужна гиперурикемия, то есть супернасыщение крови, а не мочи.
Низкий диурез не является ведущим симптомом при подагре, поскольку подагра не сопровождается диареей (за исключением нежелательных явлений в результате применения колхицина в высоких дозах), а также другими видами потери жидкости.
В моче МК присутствует в двух формах: растворимой в виде урата (ионизированная форма, не связанная с транспортными белками) и нерастворимой в виде собственно МК. Их различает всего лишь один ион водорода, который приобретает способность соединяться с растворимым уратом при рН<5,5. Показано, что у больных подагрой количество ионов водорода повышено, что дает предпосылку к активному соединению с уратом. Большое количество ионов водорода связывают с дефектом экскреции аммония (NH4) (уринарного буфера), что, в свою очередь, может происходить в результате дефекта синтеза глютаминазы и/или глютаматдегидрогеназы, которые метаболизируют глютамин в аммоний и α-кетоглютарат.
Среди других факторов риска также обсуждаются генетические детерминанты нефролитиаза: ZNF365 на хромосоме 10q21-q22 и опять же ген SLC2A9, кодирующий URAT1.
Кроме того, ряд симптомокомплексов и болезней (табл. 1) связывают с развитием нефролитиаза. Отметим, что при подагре частота указанных сопутствующих болезней стабильно высокая во всех популяциях. Например, ожирение считается независимым фактором развития нефролитиаза и масса тела обратно коррелирует с рН. При инсулинорезистентности (помимо наличия ожирения) продемонстрировано снижение аммониогенеза и экскреции аммония.
| Сопутствующие состояния | Частота при подагре, % | Особенности |
|---|---|---|
| Ожирение | 80 | РН обратно коррелирует с массой тела. Независимый фактор нефролитиаза |
| Инсулинорезистентность | 60 | Снижение аммониогенеза и экскреции аммония, что приводит к снижению рН |
| Сахарный диабет ІІ типа | 20 | При сочетании сахарного диабета ІІ типа с подагрой — риск развития нефролитиаза выше. Независимый фактор нефролитиаза |
| Высокопуриновый стереотип питания | 100 | Транзиторное повышение экскреции МК |
Гиперурикемия является междисциплинарной патологией и одним из компонентов метаболического синдрома. Основное место в структуре метаболического синдрома занимают абдоминальное ожирение, инсулинорезистентность, дислипидемия и АГ.
Инсулинорезистентность приводит к уменьшению экскреции почками МК (что связано с повышением канальцевой реабсорбции натрия, индуцированной инсулином) и впоследствии — к гиперурикемии, которая, в свою очередь, приводит к повышению уровня гликозилированного гемоглобина (НbА1с) — предиктора развития сахарного диабета ІІ типа (Братусь В.В. и соавт., 2009).
Мнение о том, что гиперурикемия может свидетельствовать об инсулинорезистентности, подтверждено в 8-летнем исследовании, доказавшем связь между уровнем МК и инсулинорезистентностью (Kekäläinen P. et al., 2000).
Кроме того, в последние годы в ряде крупных клинических исследований доказано важное место гиперурикемии и в патогенезе артериальной гипертензии, ишемической болезни сердца, хронической сердечной недостаточности (Бильченко А.В., 2009).
Уровень МК коррелирует с экскрецией альбуминов с мочой, что является предвестником развития нефросклероза, а нарушение почечной гемодинамики предшествует нарушению метаболизма МК у пациентов с нефропатией. Таким образом, гиперурикемия у пациентов с АГ наиболее вероятно отражает нарушение почечной гемодинамики, вызывает микроальбуминурию и дисфункцию эндотелия (Братусь В.В. и соавт., 2009).
К числу провоспалительных и проатерогенных эффектов МК относятся стимуляция пролиферации гладкомышечных клеток эндотелия, активация макрофагов с высвобождением хемокинов и провоспалительных медиаторов (IL-1, -6, -8; ФНО-α, фосфолипазы А2, эйкозаноидов, кининов и т.д.). Также установлено, что аллопуринол способен не только тормозить действие ксантиноксидазы, но и улучшать эндотелийзависимую сосудистую релаксацию, замедлять процесс гипертрофии левого желудочка.
Таким образом, нормальный уровень МК — важный фактор гомеостаза.
У больных АГ повышение уровня МК является независимым предиктором повышения частоты кардиоваскулярных событий, фатальных кардиоваскулярных событий и общей смертности (Lottmann K. et al., 2012). Применение тиазидных и тиазидоподобных диуретиков у 50% больных АГ вызывает повышение уровня МК (Насонова В.А., Барскова В.Г., 2004) (рис. 13).
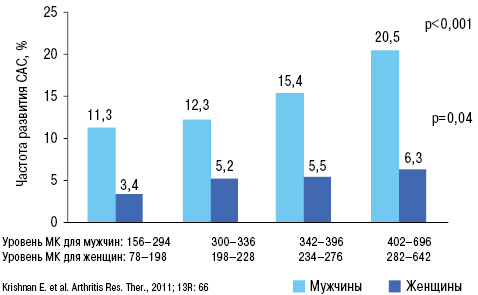
Аналогичные свидетельства получены и в отношении каротидных артерий (Pacifico L. et al., 2009; Takayama S. et al., 2012).
Гиперурикемия обусловливает развитие:
- Гипертензии (повышение риска в 2–3 раза за 5–7 лет)
- Повреждения почек (повышение риска в 5 раз за 2 года при уровне МК в плазме крови >330 мкмоль/л)
- Прогрессирования IgA-нефропатии
Таким образом, при лечении пациентов терапевтической целью становится снижение МК <360 мкмоль/л. Ибо чем ниже уровень МК, тем быстрее уменьшаются тофусы. Наблюдается более быстрое растворение кристаллов МК при низком уровне МК. И вследствие этого можно говорить о том, что подагра — один из немногих артритов, который можно вылечить.
В то же время следует отметить, что чрезмерное снижение уровня МК или низкий ее уровень является риском развития дегенеративно-дистрофических процессов центральной нервной системы, таких как болезнь Паркинсона или болезнь Альцгеймера (Spitsin S., Koprowski H., 2010; Zhang H.N. et al., 2012).
Понимание механизмов патогенеза при развитии данной патологии является очень важным, поскольку медикаментозная терапия направлена на разные этапы метаболизма МК (рис. 14).
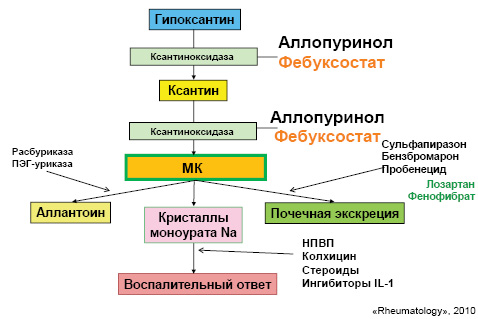
Кроме того, учитывая важную роль цитокинов при развитии подагры на данный момент, проводятся исследования по применению таких препаратов, как ингибиторы IL-1 (табл. 2).
| Заболевание | Ингибитор | Количество пациентов, n |
Ссылки |
|---|---|---|---|
| Подагра | Анакинра | 10 | So A. et al., ART, 2007 Simpkin P., A&R abstract 2010 |
| Подагра | Рилонацепт | 20100 | Terkeltaub R., ARD, 2009 Schumacher H., Abstract A&R, 2010 |
| Подагра | Канакинумаб | 200 | So A. et al., A&R, 2010 Schlesinger N., ART, 2010 |
Лечение больных подагрой на сегодня остается актуальным вопросом и было освещено в последних рекомендациях (EULAR) 2011 г. (Hamburger M. et al., 2011). Рекомендации предоставлены в табл. 3а–г.
Отметим, что колхицин и/или НПВП являются препаратами первой линии для лечения пациентов с острым подагрическим артритом. Но необходимо помнить, что колхицин в высоких дозах приводит к побочным эффектам.
| № п/п | Рекомендации | Сила рекомендации, ВАШ 100 |
|---|---|---|
| 1 | Оптимальное лечение подагры должно включать как фармакологические, так и нефармакологические методы, подобранные с учетом: – специфических факторов риска (уровня уратов в плазме крови, предшествующих атак, рентгенологических признаков); – клинической фазы (острая подагра, межприступный период, или хроническая тофусная подагра); – общих факторов риска: возраст, пол, ожирение, стиль питания, употребление алкоголя, уратповышающих лекарств, функции почек и коморбидность |
97 (96–98) |
| 2 | Образовательные программы для пациентов, направленные на улучшение образа жизни, повышение приверженности длительной терапии, а также возможность/необходимость предупреждения приступов подагры за счет уратснижающей терапии (УСТ) — ключевой момент лечения подагры | 94 (93–95) |
| 3 | Особое внимание в лечении подагры следует уделять сочетанию образа жизни и модифицируемых факторов риска, таких как гиперлипидемия, гипертензия, гипергликемия, ожирение и курение | 96 (95–97) |
| 4 | Колхицин, НПВП и ГК являются терапией первой линии у пациентов с острой подагрой. Выбор препарата основывается на предпочтениях пациента и врача и с учетом коморбидности (особенно наличия хронических заболеваний почек и желудочно-кишечного тракта). Возможно, будет необходимым продолжать лечение до 7–10 дней | 97 (96–98) |
| 5 | Для острой подагры низкие дозы колхицина (1,2 мг назначать как можно раньше с последующим применением 0,6 мг через 1 ч) эффективны и хорошо переносятся. Лечение колхицином должно быть продолжено до 7–10 дней или до полного купирования приступа подагры. Высокие дозы колхицина не показаны и не должны назначаться | 93 (92–94) |
Удаление синовиальной жидкости и введение внутрисуставно ГК может быть эффективным и безопасным лечением при острой атаке.
Несмотря на широкое применение на практике, рандомизированных контролируемых исследований не проводилось. Отмечена высокая частота синдрома отмены (rebound-синдрома).
| № п/п | Рекомендации | Сила рекомендации, ВАШ 100 |
|---|---|---|
| 6 | При остром приступе подагры после соблюдения всех мер предосторожности эффективной является внутрисуставная аспирация с последующим введением ГК длительного действия. Процедура хорошо переносится пациентами | 95 (93–96) |
| 7 | Показания для УСТ: количество атак >1 в год, хроническая артропатия, наличие тофусов, нефролитиаз или рентгенологические признаки подагры. Рекомендована пожизненная УСТ | 97 (96–98) |
| 8 | Терапевтические задачи УСТ: предупреждение приступов подагры, предупреждение образования тофусов, уменьшение тофусов и предупреждение развития хронической подагрической артропатии. Эти цели достигаются снижением уровня МК в плазме крови <360 мкмоль/л, что ниже точки кристаллизации урата натрия (408 мкмоль/л) | 97 (96–98) |
| 9 | Ингибиторы ксантиноксидазы (аллопуринол или фебуксостат) являются препаратами выбора для УСТ и достижения целевого уровня МК в плазме крови <360 мкмоль/л. Дозу следует титровать с учетом безопасности препарата и одновременно — со снижением частоты развития приступов подагры. Уровень МК требуется постоянно мониторировать. Также необходимо проводить соответствующий мониторинг токсичности | 95 (94–96) |
| 10 | Аллопуринол следует назначать с низкой дозы (100 мг/сут) с шагом титрации в 100 мг каждые 2–4 нед (до максимально разрешенной дозы в 800 мг/сут) по необходимости для достижения целевого уровня МК <360 мкмоль/л. При развитии токсических эффектов аллопуринол необходимо отменить немедленно и рассмотреть другие препараты для УСТ: фебуксостат или пробенецид | 95 (94–96) |
| 11 | Фебуксостат: стартовая доза 40 мг/сут, следующее повышение дозы до 80 мг /сут возможно не ранее чем через 2 нед, если это необходимо для достижения целевого уровня МК <360 мкмоль/л. При развитии побочных эффектов требуется рассмотреть другие варианты лечения: аллопуринол или пробеницид. В любом случае недопустимо одновременное применение аллопуринола и фебуксостата | 97 (96–98) |
Фебуксостат
- Селективный ингибитор ксантиноксидазы
- Естественный печеночный метаболизм: глюкуронизация и оксидация
- Почечная экскреция фебуксостата и активных метаболитов <10% дозы
- Мощное гипоурикемическое действие
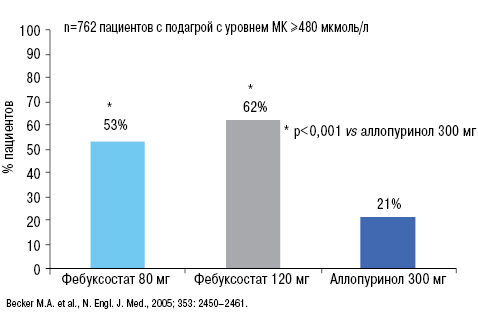
В исследовании M.A. Becker и соавторов (2005), в котором оценивали эффективность аллопуринола 300 мг и фебуксостата 80 и 120 мг у пациентов с начальным уровнем МК >480 мкмоль/л, после 52-недельной терапии соответствующими препаратами, было четко показано, что целевого уровня МК достигло 53% пациентов на фоне лечения фебуксостатом, в отличие от аллопуринола (только 21%) (рис. 15). При этом степень достоверности различий была очень высокой — р<0,001.
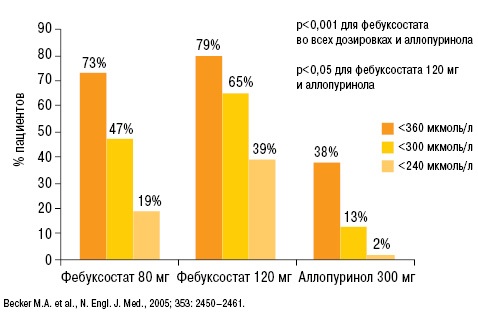
Более детальный анализ результатов исследования свидетельствует, что на фоне лечения фебуксостатом 80 и 120 мг уровень МК <360 мкмоль/л был достигнут у 73 и 79% пациентов соответственно (38% применявших аллопуринол), <300 мкмоль/л — у 47 и 65% соответственно (13% — аллопуринол) и <240 мкмоль/л у 19 и 39% соответственно (2% — аллопуринол) (рис. 16). Таким образом, на фоне лечения фебуксостатом статистически достоверно большее количество пациентов достигали целевых и более низких уровней МК в сравнении с аллопуринолом.
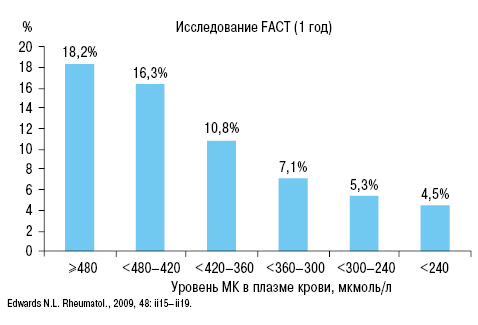
Также в исследовании N.L. Edward (2009) четко доказана связь приступов подагры с уровнем МК (рис. 17).
Фебуксостат на сегодняшний день рассматривается как альтернатива УСТ у пациентов с приступом подагры и профилактике повторных приступов подагры. Клинические исследования показали высокую эффективность этого препарата в сравнении с аллопуринолом, при этом профиль безопасности и переносимости фебуксостата значительно превосходит таковой аллопуринола. Отдельно следует отметить, что при лечении фебуксостатом не требуется коррекции дозирования у пациентов пожилого возраста и его применение не противопоказано у пациентов с хронической почечной недостаточностью. Согласно рекомендациям Европейского агентства по лекарственным средствам (European Medicines Agency — EMEA) (2013), с некоторой осторожностью следует применять фебуксостат у пациентов с уже имеющейся ишемической болезнью сердца и хронической сердечной недостаточностью, хотя в исследованиях показано значительное снижение общей и кардиальной смертности у пациентов с гиперурикемией на фоне лечения фебуксостатом. Управление по контролю за пищевыми продуктами и лекарственными средствами США (Food and Drug Administration — FDA) не указывает на подобные ограничения при применении фебуксостата. Более того, согласно рекомендациям FDA начинать лечение УСТ препаратами следует немедленно после констатации/подтверждения высокого уровня МК, не дожидаясь его клинических манифестаций.
| № п/п | Рекомендации | Сила рекомен-дации, ВАШ 100 |
|---|---|---|
| 12 | Пробеницид (урикозурик) можно применять как альтернативу ингибиторам ксантиноксидазы у пациентов с нормальной функцией почек, но он относительно противопоказан пациентам с нефролитиазом и неэффективен у лиц с почечной недостаточностью. Пробеницид можно назначать сочетанно с аллопуринолом или фебуксостатом, если необходимо, для достижения целевого уровня МК. Доза — 500 мг/сут, с ежемесячной титрацией до максимальной 3 г/сут | 93 (92–94) |
Применение цитратных препаратов (калий-натрий-тригидропентацитратный комплекс) дополнительно к ингибиторам ксантиноксидазы у пациентов с гиперурикемией снижает уровень МК в крови, увеличивает скорость клубочковой фильтрации и улучшает функцию почек. А при уратной нефропатии длительное лечение частично восстанавливает функцию почек (Saito J. et al., 2010).
| № п/п | Рекомендации | Сила рекомен-дации, ВАШ 100 |
|---|---|---|
| 13 | Профилактику острого приступа подагры в течение первых 6–12 мес УСТ можно проводить с применением колхицина (с учетом переносимости, 0,6 мг однократно или 2 раза в сутки) или НПВП (с гастропротекторами по показаниям). Профилактику следует начинать за 2 нед до начала УСТ | 97 (96–98) |
| 14 | Некоторые диуретики способны повышать риск острого приступа подагры. С учетом этого применение и дозу диуретиков необходимо пересмотреть. У некоторых больных (например у пациентов с сердечной недостаточностью) применение диуретиков является необходимым. В таких случаях возможно развитие приступов подагры, которые требуют лечения в соответствии с общими рекомендациями | 91 (90–92) |
| 15 | У пациентов с рефрактерной подагрой и/или резистентной тофусной болезнью препаратом выбора может быть пеглотиказа. Пеглотиказа применяется внутривенно и имеет крайне неблагоприятный профиль безопасности. Пациентов, которым показана пеглотиказа, следует направлять к специалистам, имеющим опыт ее применения | 94 (93–95) |
Таким образом, «Подагра — как спички»: НПВП — гасят огонь, колхицин (профилактически) — держит спички мокрыми, ингибиторы ксантиноксидазы — удаляют спички (M.A. Becker).
Список использованной литературы
- Бильченко А.В. (2009) Гиперурикемия как фактор риска развития сердечно-сосудистых заболеваний и смертности. Здоров’я України, 10(1): 46–48.
- Братусь В.В., Талаева Т.В., Шумаков В.А. (2009) Ожирение, инсулинорезестентность, метаболический синдром: фундаментальные и клиничные аспекты. Четверта хвиля, Київ, 413 с.
- Коваленко В.Н., Шуба Н.М. (2008) Практические навыки в ревматологии: Учеб. пособие. МОРИОН, Киев, 255 с.
- Насонова В.А., Барскова В.Г. (2004) Лекции для практикующих врачей, Москва, 2004. Рос. нац. конгресс «Человек и лекарство».
- Becker M.A., Schumacher H.R.Jr., Wortmann R.L. et al. (2005) Febuxostat compared with allopurinol in patients with hyperuricemia and gout. N. Engl. J. Med., 353(23): 2450–2461.
- Cutolo M. (2012) Chronobiology and the treatment of rheumatoid arthritis. Curr. Opin. Rheumatol., 24: 312–318.
- Dinarello C.A. (2005) Blocking IL-1 in systemic inflammation. J. Exp. Med., 201(9): 1355–1359.
- Edwards N.L. (2009) Febuxostat: a new treatment for hyperuricaemia in gout. Rheumatology (Oxford). 48(Suppl. 2): ii15–ii19.
- Hamburger M., Baraf H.S., Adamson T.C. 3 et al. (2011) 2011 recommendations for the diagnosis and management of gout and hyperuricemia. Phys. Sportsmed., 39(4): 98–123.
- Kekäläinen P., Sarlund H., Laakso M. (2000) Long-term association of cardiovascular risk factors with impaired insulin secretion and insulin resistance. Metabolism, 49(10): 1247–1254.
- Krishnan E., Pandya B.J., Chung L. et al. (2011) Hyperuricemia and the risk for subclinical coronary atherosclerosis-data from a prospective observational cohort study. Arthritis Res. Ther., 13(2): R66.
- Lottmann K., Chen X., Schädlich P.K. (2012) Association between gout and all-cause as well as cardiovascular mortality: a systematic review. Curr. Rheumatol. Rep., 14(2): 195–203.
- Martinon F., Mayor A., Tschopp J. (2009) The inflammasomes: guardians of the body. Ann. Rev. Immunol., 27: 229–265.
- Martinon F. (2010) Signaling by ROS drives inflammasome activation. Eur. J. Immunol., 40(3): 616–619.
- Pacifico L., Cantisani V., Anania C. et al. (2009) Serum uric acid and its association with metabolic syndrome and carotid atherosclerosis in obese children. Eur. J. Endocrinol.,160(1): 45–52.
- Saito J., Matsuzawa Y., Ito H. et al. (2010) The alkalizer citrate reduces serum uric Acid levels and improves renal function in hyperuricemic patients treated with the xanthine oxidase inhibitor allopurinol. Endocr. Res., 35(4): 145–154.
- Spitsin S., Koprowski H. (2010) Role of uric acid in Alzheimer’s disease. J. Alzheimers Dis. 19(4): 1337–1338.
- Takayama S., Kawamoto R., Kusunoki T. et al. (2012) Uric acid is an independent risk factor for carotid atherosclerosis in a Japanese elderly population without metabolic syndrome. Cardiovasc. Diabetol., 11: 2.
- Zhang H.N., Guo J.F., He D. et al. (2012) Lower serum UA levels in Parkinson’s disease patients in the Chinese population. Neurosci Lett., 514(2): 152–155.
Адрес для переписки:
Шуба Неонила Михайловна
04112, Киев, ул. Дорогожицкая, 9
Национальная медицинская академия
последипломного образования
им. П.Л. Шупика

Leave a comment