Вплив дозованого індивідуалізованого ізометричного навантаження на силу м’язів, функціональний стан хворих і показники активності ревматоїдного артриту
Резюме. Вивчено ефективність застосування дозованого індивідуалізованого ізометричного навантаження (ДІІМН), його вплив на масу та композицію тіла, силу м'язів, функціональні можливості пацієнтів, активність хвороби у пацієнток із ревматодним атритом (РА) жіночої статі. Встановлено, що при РА відбувається зменшення маси тіла переважно за рахунок м'язової маси, що зменшується на 35%, при цьому збільшується частка жиру в масі тіла до 41% порівняно з 33,7% у контролі. Втрата м 'язовоїмаси супроводжується зменшенням сили м 'язів на 65% порівняно з контролем. Застосування дозованого ізометричного навантаження поступово сприяє покращанню композиції тіла хворих, збільшенню сили м'язів, підвищенню функціональної здатності пацієнтів, зниженню активності хвороби. Вірогідно, позитивний вплив ізометричного навантаження пов 'язаний з його здатністю знижувати активність прозапальнихцитокінів у крові. Впровадження ізометричного навантаження у практику дозволить підвищити ефективність реабілітації хворих на РА.
Ефективність використання методів фізичної реабілітації пацієнтів із ревматоїдним артритом (РА) оцінювали у ряді наукових досліджень (van den Ende C.H.M. et. a!., 2000; de Jong Z. et a!., 2004; de Jong Z., V!ie!and V., 2005). Більшість авторів погоджуються з думкою про значні обмеження у використанні фізичних динамічних вправ при високій активності запального процесу та значних деструктивних змінах у суглобах. (Jivoff L., 1975; Scott D.L., Wo!man R.L., 1992; Semb!e E.L., 1995). Американська колегія ревматології в останніх рекомендаціях ^CR, 2002) щодо лікування та реабілітації хворих на РА пропонує динамічні вправи лише помірної інтенсивності. Альтернативою цим вправам може бути ізометричне навантаження, що за своїми особливостями та за умов адекватного індивідуального дозування може мати менше обмежень.
У зв’язку з цим мета нашого дослідження – оцінка ефективності використання дозованого індивідуалізованого ізометричного навантаження (ДШН) у хворих на РА.
ОБ’ЄКТ І МЕТОДИ ДОСЛІДЖЕННЯ
Відповідно до мети дослідження нами обстежено 120 пацієнток з РА. З них 60 були включені в основну групу та 60 – у контрольну. Пацієнтки контрольної групи отримували стандартну терапію: як базисний засіб – метотрексат по 7,5-15 мг/тиж разом із фолієвою кислотою (до 10 мг/тиж), за показниками призначали нестероїдні протизапальні препарати; окремі хворі отримували преднізолон 2,5-10 мг/добу, причому доза його до дослідження була стабільною не
менше 1 міс. Хворим основної групи, крім стандартної терапії, призначали комплекс ДІІМН. Контрольними термінами спостереження були 4, 12, та 24 тиж.
Для кожного пацієнта проводили попереднє тестування з визначенням сили максимального скорочення (СМС) основних груп м’язів. Після цього хворим пропонували виконати комплекс вправ для згиначів і розгиначів передпліччя та гомілки на рівні 75% СМС. При цьому пацієнти здійснювали 4 підходи по 5 повторів на кожну групу м’язів. Тривалість утримання на рівні 75% СМС відповідної групи м’язів становила 5 с. Інтервали між підходами становили 2-3 хв. Комплекс вправ виконували не рідше 2-3 разів/тиж. Корекцію на зростання СМС у процесі тренування здійснювали 1 раз/міс.
Вивчали зміни у композиції тіла хворих у динаміці. Масу м’язів визначали за допомогою методу, запропонованого K.E. Yarasheski та співавторами (1999). Для визначення частки жирового компонента в масі тіла використовували метод W.E. Siri (1961), для чого спочатку вираховували щільність тіла за формулою J. Durnin, J. Womersley (1974).
Функціональний стан м’язової системи у хворих на РА оцінювали за показниками сили їх скорочення (кг), індексом м’язової сили (ІМС,%), загальним ІМС (%), питомою силою м’язів (кг/кг) (Stucki G. et al., 1998; Урсол Н.Б., Станіславчук М.А, 2005). Вміст цитокінів — ІЛ-1Р, ІЛ-6 та ТНФ-а — визначали імуноферментними методами (Smith R., Bagloni S., 1987; Brailly H.et al., 1994).
Активність хвороби оцінювали за шкалою активності (ШАХ), як описано D.M. van der Heijde
та співавторами (199В). Функціональну здатність пацієнтів визначали за анкетою здоров’я (HAQ) -стандартною для оцінки функціонального стану пацієнтів із РА (Fries J.F. et al., 19BG).
РЕЗУЛЬТАТИ ТА ЇХ ОБГОВОРЕННЯ
Клінічну характеристику хворих наведено в табл. 1.
Таблиця І
Клінічна характеристика обстежених хворих на РА (M±a)
| Характеристика | Група | |
| контрольна | основна | |
| Вік, років | 50,9±10,4 | 49,9±10,1 |
| Давність захворювання, років | 7,6±5,7 | 8,2±5,2 |
| Ревматоїдний фактор (+), п (%) | 40 (66) | 38 (63) |
| ШОЕ, мм/год | 30,5±8,1 | 30,8±6,4 |
| Кількість болісних суглобів (максимум 28) | 14,1±3,1 | 14,3±3,7 |
| Кількість набряклих суглобів (максимум 28) | 8,0±1,7 | 8,3±1,9 |
| ШАХ | 4,44±0,28 | 4,48±0,26 |
| ИДО | 1,93±0,35 | 1,98±0,33 |
| Отримували преднізолон, п (%) | 14 (23) | 16 (27) |
Дані свідчать, що на початку дослідження основні показники у хворих досліджуваних груп не відрізнялись. Однаковою у групах порівняння була давність захворювання (близько 8 років), активність запального процесу, що підтверджують значення швидкості осідання еритроцитів (ШОЕ) і ШАХ, кількість болісних і набряклих суглобів. Не зареєстровано різниці у функціональній здатності хворих контрольної та основної груп, оскільки значення НАО були практично однаковими (1,93±0,35 та 1,98±0,33 відповідно). Преднізолон у дозі до 10 мг/добу до включення у дослідження та впродовж усього терміну спостереження в обох групах приймали 14 (23%) та 16 (27%) пацієнтів відповідно.
У пацієнтів обох груп була приблизно однакова композиція тіла. В усіх хворих виявляли помірне зменшення маси тіла (табл 2). Індекс маси тіла (ІМТ) був нижчим 23 кг/м. При цьому маса м’язів не перевищувала 15 кг, тоді як у здорових цей показник становив 22,6±3,2 кг. Частка м’язів у масі тіла хворих на РА в обох групах становила нижче 24%, при аналогічному показнику у здорових — 32,7±3,64%.
Таблиця 2
Порівняльні показники композиції тіла у хворих на РА та здорових (М±о)
| Характеристика | Здорові (n=97) | Хворі на РА | |
| Контрольна група (n=60) | Основна група (n=60) | ||
| Зріст, см | 165±5,1 | 164±4,8 | 164±5,5 |
| Маса тіла, кг | 68,0±8,5 | 60,9±6,0 | 61,9±7,7 |
| ІМТ, кг/ м | 25,1±2,8 | 22,7±2 | 22,8±2,1 |
| Маса м’язів, кг | 22,6±3,2 | 14,5±2,0 | 14,6±2,7 |
| Частка м’язів у масі тіла,% | 32,7±3,64 | 23,8±2,5 | 23,6±3,0 |
| Маса жиру, кг | 22,8±2,8 | 25,3±1,9 | 25,5±2,7 |
| Частка жиру в масі тіла, % | 33,7±3,5 | 41,7±2,4 | 41,4±3,2 |
За розподілом жирової тканини показники у хворих обох груп на початку лікування були ідентичні. У пацієнтів обох груп виявлено, що їх показник маси жиру вищий за такий у здорових майже на 3 кг, а відсоток жиру в загальній масі тіла >40, тоді як у здорових 33,7±3,5%. Наведені вище дані свідчать про репрезентативність обох груп хворих.
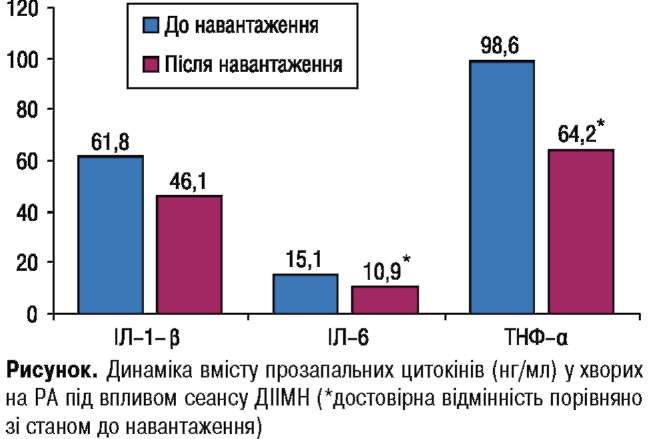
Для вивчення можливих механізмів впливу фізичного навантаження на хворих з РА нами оцінено динаміку вмісту в крові прозапальних цитокінів — основних патогенетичних чинників РА. Для цього було відібрано 14 пацієнтів з високою активністю запального процесу. До та через 1 год після сеансу ДІІМН визначили рівень ІЛ-ір, ІЛ-6 та ТНФ-а у крові цих пацієнтів. Встановлено (рисунок), що під впливом ДІІМН у хворих відбулося суттєве зниження вмісту в крові прозапальних ци-токінів. При цьому максимальну чутливість до сеансу ДІІМН виявив ТНФ-а. Його вміст при навантаженні знизився більше ніж на третину (35,0±10,7%).
Менше знижувався вміст у крові ІЛ-6 (з 15,1 ±5,63 до 10,9±4,78 нг/л) — на 27,8±10,1 %. Динаміка ІЛ-1 в була значною, однак через суттєві індивідуальні коливання концентрації різниця зі станом до навантаження не була достовірною. При цьому зниження динаміки становило 25,5±11,4%.
Здатність ДІІМН знижувати вміст у крові прозапальних цитокінів, очевидно, була одним із механізмів впливу фізичного навантаження на композицію тіла у хворих на РА й активність захворювання. Динаміку показників композиції тіла наведено в табл. 3. Результати дослідження свідчать, що 4-тижневий курс стандартної терапії практично не змінював масу тіла, тоді як при включенні ДІІМН середня маса тіла за цей час збільшилася на 0,16 кг. Виявлено збільшення середньої маси тіла хворих контрольної групи на 0,4±0,7 кг за 6 міс. Фізичне навантаження не лише не зменшило загальну масу тіла, але й забезпечило її збільшення майже на 1 кг (0,9±0,8 кг). Відповідно змінювався й ІМТ.
У досліджуваних групах динаміка маси м’язів і жиру була різною. Так, у пацієнтів контрольної групи протягом 4 тиж маса м’язів залишалася незмінною, а в основній — збільшилася на 0,19±0, кг, а за 12 тиж — у середньому на 0,7±0,4 кг. До кінця спостереження динаміка м’язової маси у хворих основної групи становила+1,2±0,8 кг, а у хворих контрольної групи +0,2±0,5. Це забезпечило збільшення частки м’язів у масі тіла з 23,6±3,0 до 25,2±2,9%. Як бачимо, у дослідній групі приріст маси м’язів перевищував приріст загальної маси тіла, що свідчить про очевидне зменшення частки жиру в масі тіла, що й було нами встановлено.
Показник маси жиру у пацієнтів обох груп на початку лікування був однаковим, а під впливом терапії відбулися значні зміни. Так, у хворих контрольної
групи зареєстровано поступове підвищення цього показника, що до кінця спостереження становило +0,25±0,67 кг, а в основній групі — зниження цього показника. За 12 тиж у хворих цієї групи маса жиру зменшилась на 0,35±0,31 кг, а через 24 тиж — на 0,66±0,56 кг, що забезпечило зменшення частки жиру в масі тіла з 41,4±3,2 до 39,7±3,0%, тоді як у хворих контрольної групи цей показник дещо зріс.
Таблиця з
Динаміка показників композиції тіла у хворих на РА під впливом різних варіантів лікування (М±а)
| Показник | Група | Р | |
| контрольна | основна | |||
| Маса тіла, кг | |||
| До лікування | 60,9±6,0 | 61,9±7,7 | >0,05 |
| 4 тиж | 60,9±6,0 | 62,1±7,5 | >0,05 |
| Динаміка, кг | +0,06±0,2 | +0,16±0,26 | |
| 12 тиж | 61,0±6,9 | 62,4±7,4 | >0,05 |
| Динаміка, кг | +0,2±0,5 | +0,4±0,5 | |
| 24 тиж | 61,2±5,7 | 62,8±7,1 | >0,05 |
| Динаміка, кг | +0,4±0,7 | +0,9±0,8 | |
| Маса м’язів, кг | |||
| До лікування | 14,5±2,0 | 14,6±2,7 | >0,05 |
| 4 тиж | 14,6±2,0 | 14,8±2,6 | >0,05 |
| Динаміка,% | +0,08±0,2 | +0,19±0,23 | |
| 12 тиж | 14,6±2,0 | 15,3±2,5 | >0,05 |
| Динаміка, кг | +0,08±0,2 | +0,7±0,4 | |
| 24 тиж | 14,7±1,9 | 15,8±2,4 | |
| Динаміка,% | +0,2±0,5 | + 1,2±0,8 | |
| М’язи,% | |||
| До лікування | 23,8±2,5 | 23,6±3,0 | >0,05 |
| 4 тиж | 24,0±2,5 | 23,9±3,0 | >0,05 |
| 12 тиж | 23,9±2,5 | 24,6±3,0 | >0,05 |
| 24 тиж | 24,0±2,5 | 25,2±2,9 | |
| Маса жиру, кг | |||
| До лікування | 25,3±1,9 | 25,5±2,7 | >0,05 |
| 4 тиж | 25,3±1,9 | 25,3±2,7 | >0,05 |
| Динаміка, кг | -0,02±0,15 | -0,19±0,27 | |
| 12 тиж | 25,4±1,9 | 25,1±1,6 | >0,05 |
| Динаміка, кг | +0,11±0,41 | -0,35±0,31 | |
| 24 тиж | 25,6±1,9 | 24,8±2,6 | >0,05 |
| Динаміка, кг | +0,25±0,67 | -0,66±0,56 | |
| Жир,% | |||
| До лікування | 41,7±2,4 | 41,4±3,2 | >0,05 |
| 4 тиж | 41,7±2,3 | 40,9±3,1 | >0,05 |
| 12 тиж | 41,8±2,5 | 40,4±2,9 | |
| 24 тиж | 41,9±2,6 | 39,7±3,0 | |
р — достовірність відмінностей порівняно з контрольною групою.
Такі суттєві зміни в композиції тіла під впливом ДІІМН відобразилися на силі м’язових скорочень (табл. 4). Застосування комплексу ДІІМН сприяло суттєвому збільшенню сили усіх груп м’язів. Так, сила згинання у ліктьовому суглобі у хворих, які виконували комплекс вправ починаючи з 4-го тижня спостереження, була значно більша, ніж у хворих контрольної групи, і продовжувала зростати до кінця спостереження. На 24-й тиждень лікування сила згинання в ліктьовому суглобі при застосуванні ДІІМН була у 1,5 раза більша, ніж у хворих контрольної групи (6,5±1,07 та 4,4±0,74 кг відповідно). Аналогічною була динаміка сили розгинання у ліктьовому суглобі. Якщо на початку лікування цей показник був у обох групах однаковим, то на кінець спостереження в контрольній групі — підвищився у 1,15 раза, а в основній — у 1,58 раза. Достовірні відмінності між групами реєстрували з 4-го тижня спостереження.
*Достовірна відмінність порівняно з контрольною групою.
В основній групі виявлено збільшення сили м’язів згиначів і розгиначів гомілки під впливом фізичного навантаження більше ніж в 1,6 раза, тоді як в контрольній — збільшення сили згинання у колінному суглобі в 1,16 раза, а розгинання — у 1,13 раза.
Загальний індекс м’язової сили у хворих на РА в обох групах становив трохи більше третини (35,3%) такого у здорових. Відзначали поступове підвищення цього показника під впливом лікування. Так, за умов застосування ДІІМН загальний індекс м’язової сили підвищився на кінець спостереження до 57,7±8,4%, а у хворих із традиційним лікуванням — лише до 40,8±5,7%.
Виявляли більш інтенсивне зростання питомої сили м’язів, що виражає силу одиниці маси м’язів, під впливом ДІІМН, особливо у перші 4-12 тиж лікування. До 24-го тижня відзначено зниження темпу приросту питомої сили за рахунок збільшення м’язової маси. Це свідчить про те, що збільшення сили м’язів випереджає збільшення м’язової маси. До кінця спостереження питома сила м’язів у основній групі підвищилася на 33,5% порівняно з 11,7% у контролі.
Включення до комплексу лікування хворих на РА розробленого нами комплексу ДІІМН виявили ефективним і щодо показників активності захворювання та функціонального стану хворих. У динаміці ШОЕ не реєстрували достовірних відмінностей, а вміст С-реактивного білка (СРБ) у хворих, які виконували ДІІМН починаючи з 12-го тижня спостереження, був значно нижчим. Виявляли більш суттєву позитивну динаміку вмісту в крові прозапальних цитокінів під

впливом ДІІМН (табл. 5). Так, у хворих, які отримали стандартне лікування, за 24 тиж достовірно знизився лише вміст ТНФ-а. Динаміка двох інших цитокінів була на рівні тенденції. Водночас за умов застосування ДІІМН зниження усіх трьох цитокінів було достовірним. Виявили достовірно швидшу динаміку інтегрального показника активності РА-ШАХ у хворих цієї групи. Якщо у контролі за 24 тиж спостереження зареєстровано лише 10% зниження цього показника, то у хворих із ДІІМН — майже на 20%.
Таблиця 5
|
Динаміка показників здатності під вплив
Показник |
активності хвороби та функціональної ом різних варіантів лікування (М±а)
Група |
|
| контрольна основна | ||
| ШОЕ, мм/год | ||
| До лікування | 30,5±8,1 | 30,8±6,4 |
| 4 тиж | 28,4±6,7 | 27,9±5,7 |
| 12 тиж | 25,5±6,5 | 25,2±4,8 |
| 24 тиж | 24,7±6,2 | 23,3±3,8 |
| СРБ, мкмоль/л | ||
| До лікування | 54,3±48,8 | 54,7±55,7 |
| 4 тиж | 45,7±38,0 | 37,4±29,5 |
| 12 тиж | 36,4±24,8 | 28,5±14,3* |
| 24 тиж | 32,4±21,3 | 24,7±13,7* |
| ТНФ-а, нг/мл | ||
| До лікування | 101,0±55,2 | 102,8±56,6 |
| 24 тиж | 73,4±40,4 | 65,3±34,6 |
| Динаміка,% | 27,4±14,0 | 36,5±11,2* |
| ШАХ, балів | ||
| До лікування | 4,44±0,28 | 4,48±0,26 |
| 4 тиж | 4,29±0,29 | 4,31±0,26 |
| 12 тиж | 4,13±0,29 | 3,99±0,29* |
| 24 тиж | 4,01±0,30 | 3,62±0,27* |
| ИДО, балів | ||
| До лікування | 1,93±0,35 | 1,98±0,33 |
| 4 тиж | 1,74±0,32 | 1,78±0,30 |
| 12 тиж | 1,73±0,32 | 1,53±0,26* |
| 24 тиж | 1,66±0,29 | 1,42±0,30* |
•Достовірна відмінність порівняно з контрольною групою.
Під впливом лікування спостерігали поступове поліпшення функціональної здатності хворих, яку визначали за НАС У пацієнток, які отримували стандартне лікування, виявляли поступове зниження індекса НАС), що до кінця спостереження становив 1,66±0,29 порівняно з 1,93±0,35 на початку (динаміка — 14%). Визначили зниження НАС) з 1,98±0,33 до 1,42±0,30 (на 28%) під впливом ДІІМН.
ВИСНОВКИ
Таким чином результати проведеного нами дослідження свідчать про значну втрату м’язової тканини з відносним накопиченням жирової тканини у хворих на РА жіночої статі. При цьому відзначено зменшення сили м’язів і зниження функціональної здатності пацієнтів. Розроблений нами метод дозованого індивідуалізованого ізометричного навантаження дозволяє не лише призупинити втрату, але й збільшити м’язову масу з одночасним зменшенням маси жиру, тим самим нормалізуючи композицію тіла хворих. Встановлено, що комплекс ДІІМН суттєво збільшує силу м’язів, функціональні можливості пацієнтів, знижує активність хвороби. Впровадження цього комплексу в широку клінічну практику сприятиме поліпшенню результатів фізичної реабілітації хворих на РА.
ЛІТЕРАТУРА
Урсол Н.Б., Станіславчук М.А. (2005) Ревматоїдна міопатія: зв’язок з активністю захворювання та функціональною здатністю пацієнтів. Укр. ревматол. журн., 3(21): 56-60.
ACR (2002) Guidelines for the management of rheumatoid arthritis
(2002) update. Arthr. Rheum, 46: 328-346.
Braiiiy H., Montero-Juiian F.A., Zuber C., Fiawetta S., Grassi J., Houssiau F., Van Snick J. (1994) Total interleukin 6 in plasma measured by immunoassay. Clin. Chem., 40: 116-123.
de Jong Z., Munneke M., Jansen L.M., Ronday K., van Schaardenburg D.J., Brand R., van den Ende C.H., Viiet
Viieiand T.P., Zuijderduin W.M., Hazes J.M. (2004) Differences
between participants and nonparticipants in an exercise trial for adults with rheumatoid arthritis. Arthr. Rheum., 15, 51(4): 593-600.
de Jong Z., Viieiand T.P. (2005) Safety of exercise in patients with rheumatoid arthritis. Curr. Opin. Rheumatol., 17(2): 177-182.
Fries J.F., Spitz P., Kraines G., Hoiman H. (1980) Measurement of Patient Outcome in Arthritis. Arthr. Rheum., 23: 137-145.
Durnin J., Womersiey J. (1974) Body fat assessed from total body density and its estimation from skinfold thickness: measurements on 481 men and women aged 16 to 72 years. Br. J. Nutr., 32: 77-97.
Jivoff L. (1975) Rehabilitation and rheumatoid arthritis. Bul. Rheum. Dis., 26: 838-841.
Scott D.L., Woiman R.L. (1992) Rest or exercise in inflammatory arthritis? Br. J. Hosp. Med., 48: 445-447.
Sembie E.L. (1995) Rheumatoid arthritis: new approaches for its evaluation and management. Arch. Phys. Med. Rehabil., 76: 190-201[Medline].
Siri W.E. (1961) Body composition from liquids spaces and density: analysis of two methods. In: Brozec J., Henschel A. (Eds.) Techniques for Measuring Body Composition. National Research Council, Washington,
DC, р. 223-244.
Smith R., Bagioni S. (1987) The active form of Tumor Necrosis Factor is a trimer. J. Biol. Chem., 262: 6951-6954.
Stucki G., Bruhimann P., Stucki S., Michei B.A. (1998) Isometric muscle strength is an indicator of self-reported physical functional disability in patients with rheumatoid arthritis. Br. J. Rheumatol., 37: 643-648.
van den Ende C.H.M., Breedveid F.C., ie Cessieb S., Dijk-mansc B.A.C., de Mugd A.W., Hazesa J.M.W. (2000) Effect of intensive exercise on patients with active rheumatoid arthritis: a randomised clinical trial. Ann. Rheum. Dis., 59: 615-621.
van der Heijde D.M., Jacobs J.W. (1998) The original ‘DAS’ and the ‘DAS28’ are not interchangeable: comment on the articles by Prevoo et al. Arthr. Rheum., 41: 942-943.
Yarasheski K.E., Pak-Loduca J., Hasten D.L., Obert K.A., Brown M.B., Sinacore, D.R. (1999) Resistance exercise training increases mixed muscle protein synthesis rate in frail women and men >76 yr old. Am. J. Physiol., 277: 118-125.
Адреса для листування:
Станіславчук М. А. 21018, Вінниця, вул. Пирогова, 56 Вінницький національний медичний університет, кафедра факультетської терапії
РЕФЕРАТИВИА
Многоцентровое плацебо-контролированное рандомизированное исследование по изучению фиброзирующего альвеолита у пациентов при склеродермии Hoyles R.K., Ellis R.W., Herrick A.L., McHugh N.J., Foley N.M., Pearson S.B., Emery P., Veale D.J., Denton C.P., Wells A.U., Black C.M., du Bois R.M. (2005) Abstract L29: Fibrosing Alveolitis in Scleroderma Trial (FAST) — a Multi-Centre Prospective Randomised Double-Blind Placebo-Controlled Tria. American College of Rheumatology Annual Meeting.
В 5 центрах по изучению склеродермии в Британии изучали эффект циклофосфамида (ЦФ) у больных с альвеолитом. Испытание было рандомизированным и плацебо-контролируемым и продолжалось 12 мес. Плацебо получали 23 больных, 22 пациента вошли в основную группу. Схема их лечения включала преднизолон по 20 мг/сут. Один раз в месяц им вводили ЦФ внутривенно в дозе 600 мг/м площади тела в течение 6 мес, после чего они продолжали ежедневно принимать азатиоприн в таблетках (2,5 мг/кг/сут) еще 6 мес. Оценка эффективности проведена по изменению ожидаемого процента форсированной жизненной емкости легких (% FVC) и DLCO. Закончили испытание только 62% больных, в том числе 9 человек выбыли из-за существенного ухудшения функции легких (в т.ч. 6 из группы плацебо) и 2 больных
ІНФОРМАЦІЯ
(группа леченных) – из-за побочных эффектов. По окончании лечения отмечены статистически значимые различия по % FVD, который был на 4,7% лучше у получавших лечение по сравнению с больными из группы плацебо (p=0,04). В то же время не было различий по DLCO, данным компьютерной томографии и индексу одышки.
Первичная альвеолярная гиповентиляция
на фоне антифосфолипидного синдрома Hara J., Fujimura M., Myou S., Oribe Y., Furusho S.,
Yamazaki M., Nakao S. (2005) Initial alveolaer
hypoventilation in patients with antiphosfolipid syndrome. Intern. Med., 44(9): 987-989.
32-летняя женщина была доставлена бригадой скорой медицинской помощи в госпиталь г. Ка-надзава (Япония) с потерей сознания и острой дыхательной недостаточностью.
После стабилизации состояния был исследован газовый состав артериальной крови пациентки, результат: гиперкапния и гипоксемия на фоне ги-повентиляции. После исключения легочных и ней-ромышечных заболеваний, патологии центральной нервной системы у пациентки диагностирован первичный альвеолярный гиповентиляционный синдром на фоне антифосфолипидного синдрома. Вероятнее всего пациентка перенесла множественные микроинсульты ствола мозга, слишком маленькие для регистрации компьютерной или магнитно-резонансной томографией, которые могли вызвать повреждение дыхательного центра.
ИНДИВИДУАЛИЗИРОВАННОЙ ИЗОМЕТРИЧЕСКОЙ НАГРУЗКИ НА МЫШЕЧНУЮ СИЛУ, ФУНКЦИОНАЛЬНОЕ
СОСТОЯНИЕ БОЛЬНЫХ И ПОКАЗАТЕЛИ АКТИВНОСТИ РЕВМАТОИДНОГО АРТРИТА
Н.Б. Урсол, М.А. Станиславчук
Изучена эффективность применения дозированной индивидуализированной изометрической нагрузки (ДИИМН), ее влияние на массу и композицию тела, мышечную силу, функциональные возможности пациентов, активность заболевания у пациенток с ревматоидным артритом. Установлено, что при РА происходит уменьшение массы тела преимущественно за счет мышечной массы, которая уменьшается на 35%, при этом увеличивается доля жира в массе тела до 41%
при 33,7% в контроле. Потеря мышечной массы сопровождается уменьшением мышечной силы на 65% по сравнению с контролем. Применение дозированной изометрической нагрузки постепенно способствует улучшению композиции тела больных, увеличению мышечной силы, повышению функциональной возможности пациентов, снижению активности болезни. Вероятно, положительное влияние изометрической нагрузки связано с ее способностью подавлять активность провоспалительных цитокинов в крови. Внедрение изометрических упражнений в практику лечения больных РА позволит улучшить эффективность реабилитации.
Ключевые слова: ревматоидный артрит, мышечная сила, изометрическая нагрузка.

Leave a comment