Діагностика та лікування клапанних вад серця. Рекомендації Асоціації кардіологів України
Резюме. У рекомендаціях висвітлені основні положення щодо тактики ведення хворих із вадами серця відповідно до стандартів сучасної доказової медицини. Порівняно з попередніми рекомендаціями переглянуто алгоритми ведення хворих, розширено спектр показань і протипоказань, відкориговано класи рекомендацій та рівні доказовості до тих чи інших методів лікування згідно з результатами останніх досліджень. Зокрема принципово оновлено алгоритм ведення хворих з аортальним стенозом, рекомендації щодо проведення транскатетерної імплантації аортального клапана та черезшкірної пластики клапана «край до краю». Окрім цього, в нових рекомендаціях зроблено акцент на стратифікації ризику і комплексному підході до ведення хворих із клапанною патологією із врахуванням узгодженої думки кількох спеціалістів щодо подальшої тактики лікування.
Категорії рекомендацій
Клас I — наявність доказів і/або єдності думок експертів відносно того, що цей метод діагностики чи вид лікування доцільні й ефективні.
Клас II — наявність суперечливих доказів і/або відмінності в думках експертів про користь/ефективність методу діагностики чи лікування.
ІІа — переважають докази і/або думки експертів про користь і ефективність.
ІІb — користь і ефективність недостатньо підтверджені доказами і/або думками експертів.
Клас III — наявність доказів і/або єдності думок експертів відносно того, що цей метод діагностики або вид лікування не є корисним і ефективним, а у ряді випадків може бути шкідливим.
Рівні доказовості рекомендацій
А — рекомендації базуються на результатах не менше двох рандомізованих клінічних досліджень.
В — рекомендації базуються на результатах одного рандомізованого клінічного дослідження і/або метааналізу нерандомізованих досліджень.
С — рекомендації базуються на загальній думці експертів і/або результатах невеликих досліджень, ретроспективних досліджень і регістрів.
1. Вступ
Клапанна хвороба серця (КХС) — поширене захворювання і часто потребує оперативного втручання. Зважаючи на те що на сьогодні домінує дегенеративне ураження клапанів, найбільш розповсюдженими є кальцинуючий аортальний стеноз (АС) та мітральна регургітація (МР), в той час як аортальна регургітація (АР) та мітральний стеноз (МС) стали діагностуватися рідше. Збільшення середнього віку пацієнтів із КХС асоціюється із вищою частотою коморбідної патології, що зумовлює високий ризик при оперативному втручанні й потребує прийняття рішення про проведення комплексного хірургічного лікування. Іншим важливим аспектом сучасної КХС є зростання кількості пацієнтів, у яких проблема зберігається і після проведення операції.
Наведені рекомендації фокусуються на КХС у дорослих і підлітків, орієнтовані на алгоритми ведення хворих і не стосуються випадків інфекційного ендокардиту та вроджених вад серця у дорослих і підлітків.
Оновлення рекомендацій, опублікованих у 531 грн., стало необхідним внаслідок двох основних причин:
- По-перше, отримано нові дані відносно, зокрема, стратифікації ризику, використання діагностичних методів — ехокардіографії, методики лікування також змінилися внаслідок подальшого розвитку хірургічної пластики клапанів і технологій проведення перкутанних втручань, в основному транскатетерної імплантації аортального клапана (ТІАК) та черезшкірної пластики клапана «край до краю».
- По-друге, важливість комплексного підходу, який враховує думки кардіологів та кардіохірургів щодо ведення пацієнтів із КХС, привела до розробки нового документа спільно з Європейським товариством кардіологів та Європейською асоціацією кардіоторакальної хірургії.
Комітет наголошує на тому, що велика кількість факторів зумовлює вибір оптимального способу лікування у конкретного пацієнта із урахуванням коморбідної патології. Більше того, з огляду на недостатню доказову базу щодо КХС, більшість рекомендацій є результатом консенсусу експертів. Тому в конкретних клінічних ситуаціях можливі певні розбіжності між цими рекомендаціями.
2. Діагностика КХС
Обстеження пацієнта
Основна мета обстеження пацієнта з КХС — діагностика та оцінка механізмів і наслідків КХС. Оптимальним є прийняття рішень «командою експертів», що включає кардіологів, кардіохірургів, спеціалістів із методів візуалізації, анестезіологів та за необхідності — лікарів загальної практики, геріатрів, або спеціалістів з догляду за хворим. Висновок цієї «команди експертів» має цінність для тактики подальшої курації як пацієнтів високого ризику, так і інших хворих, зокрема безсимптомних, у яких оцінка можливості реконструкції клапана є ключовим компонентом прийняття рішення (табл. 1).
| Чи є КХС тяжкою? |
| Чи є у хворого симптоми? |
| Чи пов’язані симптоми з КХС? |
| Яка очікувана тривалість* і якість життя? |
| Чи переважають очікувані позитивні результати оперативного втручання пов’язані із ним ризики? |
| Яка думка самого пацієнта? |
| Чи вистачить наявних ресурсів для втручання, що планується? |
*Розраховується з урахуванням віку, статі, коморбідної патології та показника очікуваної тривалості життя у відповідній країні.
Клінічне обстеження є першим кроком у діагностиці КХС та оцінці її тяжкості.
Ехокардіографія — ключовий метод як для підтвердження діагнозу КХС, так і для оцінки тяжкості і прогнозу КХС.
При оцінці ступеня тяжкості КХС необхідно перевіряти відповідність результатів ехокардіографічного обстеження анатомічним змінам та механізмам виникнення КХС. Також слід оцінювати відповідність результатів ехокардіографії даним клінічного обстеження.
Оцінка тяжкості стенотичної КХС має складатися з вимірювання площі отвору клапана і характеристики потоку крові. АС із площею отвору клапана <1,0 см² або <0,6 см²/м² площі поверхні тіла (ППТ) розглядається як тяжкий. Тяжкий АС вважається сумнівним при нормальному серцевому викиді та градієнті тиску на аортальному клапані (АК) <50 мм рт. ст. (табл. 2).
| Показник | АС | МС | Трикуспідальний стеноз |
|---|---|---|---|
| Площа отвор, см² | <1,0 | <1,0 | – |
| Індекс площі отвору, см²/м² ППТ | <0,6 | – | – |
| Середній градієнт, мм рт. ст. | >40* | >10** | ≥5 |
| Максимальна швидкість току, м/с | >4,0* | – | – |
| Відношення швидкості | <0,25 | – | – |
*У хворих із нормальним серцевим викидом/трансклапанним потоком.
**Має цінність у хворих із синусовим ритмом, інтерпретуються залежно від частоти серцевих скорочень.
При МС методом вибору є планіметрія. МС зазвичай не має клінічних проявів при площі отвору клапана >1,5 см².
Загальноприйнятого підходу до оцінки ступеня трикуспідального стенозу досі не існує. Середній градієнт тиску >5 мм рт. ст. розглядається як клінічно значимий трикуспідальний стеноз.
Кількісна оцінка тяжкості регургітації не має ґрунтуватися на одному єдиному показнику, а потребує інтегративного підходу (табл. 3, 4).
Таблиця 3
Критерії визначення вираженої клапанної регургітації. Інтегративний підхід
| Ознаки | АР | МР | ТР |
|---|---|---|---|
| Специфічні ознаки тяжкої регургітації |
— центральний потік регургітації ≥65% ширини виносного тракту ЛШ*— ширина vena contracta >0,6 см* | — розмір vena contracta ≥0,7 см з великим центральним потоком МР (площею >40% ЛП) або пристінковим потоком будь-якого розміру в ЛП*— значна конвергенція потоку***— систолічний реверсний потік у легеневих венах— виражена рухливість МК або розрив папілярного м’яза | — розмір vena contracta >0,7 см— значна конвергенція потоку***— систолічний реверсний потік у печінкових венах |
| Додаткові ознаки | — час напівспаду тиску <200 мс— голодіастолічний реверсивний аортальний потік в низхідну аорту— помірне чи значне збільшення ЛШ** | — щільний трикутний потік МР при постійнохвильовій допплерографії— превалювання піка Е мітрального потоку (Е>1,2 м/с)****— збільшення розміру ЛП і ЛШ***** (у тому числі при нормальній функції ЛШ) | — щільний трикутний потік ТР при постійнохвильовій допплерографії— розширення нижньої порожнистої вени з діаметром на вдосі <50%— виражений потік Е особливо >1 м/с— дилатація ПШ і ПП |
| Кількісні параметри | |||
| Об’єм регургітації, мл за скорочення |
≥60 | ≥60 | – |
| Фракція регургітації, % | ≥50 | ≥50 | – |
| Ефективна площа отвору регургітації, см | ≥0,30 | ≥0,40 | – |
ТР — трикуспідальна регургітація, ЛП — ліве передсердя, ПШ — правий шлуночок, ПП — праве передсердя. Тут і далі: ЛШ — лівий шлуночок.
*У разі ліміту Найквіста у 50–60 см/с.
**У разі відсутності дилатації ЛШ іншої етіології.
***Значна конвергенція потоку визначається при радіусі конвергенції потоку ≥0,9 см для центральних потоків в разі показника ліміту Найквіста 40 см/с, зрізи для ексцентричних потоків більші й мають розглядатися під правильним кутом.
****Зазвичай у осіб віком >50 років або у разі порушення релаксації за відсутності МС або інших причин підвищеного тиску в ЛП.
*****За відсутності дилатації ЛШ і ЛП іншої етіології чи гострої МР.
| Показник | АР | МР | Трикуспідальна регургітація | |
|---|---|---|---|---|
| Кількісні | Первинна | Вторинна | ||
| ЕПОР, мм² | ≥30 | ≥40 | ≥20 | ≥40 |
| ОР, мл/скорочення | ≥60 | ≥60 | ≥30 | ≥45 |
| + збільшення порожнин серця/судин |
ЛШ | ЛШ, ЛП | – | ПШ, ПП, нижня порожниста вена |
ЕПОР — ефективна площа отвору регургітації; ОР — об’єм регургітації; ПШ — правий шлуночок; ЛП — ліве передсердя; ПП — праве передсердя.
При МР та МС трансторакальна ехокардіографія (ТТЕ) забезпечує адекватну оцінку морфології клапана, що важливо для відбору пацієнтів для хірургічного лікування та проведення перкутанної мітральної комісуротомії (ПМК).
Ехокардіографічне дослідження має включати стандартне дослідження всіх клапанів, висхідної аорти, визначення індексів функціональних та морфологічних параметрів ЛШ.
Черезстравохідну ехокардіографю (ЧСЕ) необхідно проводити при недостатній якості ТТЕ або для виключення тромбоутворення в передсердях перед проведенням ПМК, або при виявленні дисфункції протезованих клапанів чи виникненні підозри на ендокардит. Дослідження слід проводити інтраоперативно для моніторингу результатів операції на клапанах або при проведенні комплексних хірургічних процедур. ЧСЕ також відіграє важливу роль у моніторингу результатів ПМК під час проведення втручання.
Тест із фізичним навантаженням доцільний для виявлення клінічних ознак захворювання у безсимптомних пацієнтів, його проведення рекомендується у хворих із безсимптомним АС.
Добутамінова стрес-ехокардіографія доцільна при АС зі зниженою систолічною функцією ЛШ для диференційної діагностики у рідких випадках псевдотяжкого АС від справжнього тяжкого АС. Окрім цього, цей метод допомагає виявити резерв скоротності (збільшення ударного об’єму >20%).
Використання стрес-тестів для виявлення ішемічної хвороби серця (ІХС) у пацієнтів із тяжкою КХС недоцільне, оскільки їх діагностична цінність у цьому разі низька.
У спеціалізованих центрах мультиспіральну комп’ютерну томографію можна використовувати для виключення ІХС у пацієнтів із низьким ризиком розвитку атеросклерозу.
Магнітно-резонансна томографія не показана при КХС у рутинній клінічній практиці. Вона може бути використана як альтернативний метод діагностики у разі неможливості проведення ехокардіографії.
Визначення рівня натрійуретичного пептиду типу В (BNP) може мати цінність для стратифікації ризику при АС або МР.
Коронаровазографія (КВГ) широко використовується для виявлення супутньої ІХС, якщо планується оперативне втручання (табл. 5). Дослідження не слід проводити при гострій аневризмі аорти, великих вегетаціях на АК чи оклюзивному тромбозі протезованих клапанів, що призводить до нестабільної гемодинаміки.
| Діагностика ІХС |
Клас/ Рівеньдоказовості |
|---|---|
| КВГ перед хірургічним втручанням на клапанах у хворих із тяжкою КХС і будь-яким із нижченаведеного:— наявність ІХС в анамнезі— підозра на ішемію міокарда— систолічна дисфункція ЛШ— у чоловіків віком >40 і жінок у період постменопаузи— наявність ≥1 серцево-судинного фактора ризику | IC |
| Якщо підозрюється, що ІХС є причиною тяжкої МР (ішемічна МР) | IC |
| Показання до реваскуляризації | |
| Аортокоронарне шунтування (АКШ) рекомендується у хворих із первинними показаннями до оперативного втручання на АК/мітральному клапані та при стенозі коронарних артерій ≥70% | IC |
| Можливість проведення АКШ необхідно розглядати у хворих із первинними показаннями до оперативного втручання на АК/мітральному клапані та при стенозі коронарних артерій ≥50–70% | IIaC |
Показання до проведення катетеризації серця мають бути звужені до тих випадків, коли результати неінвазивних методів дослідження не відповідають або суперечать клінічному стану пацієнта.
Оцінка коморбідних захворювань проводиться за допомогою клінічних методів дослідження.
Профілактику ендокардиту необхідно проводити усім пацієнтам із КХС відповідно до індивідуального ризику хворого.
Рішення щодо необхідності оперативного втручання у пацієнта із КХС має бути основане на аналізі індивідуального ризику/користі для конкретного хворого. Для цього розроблено спеціальні шкали, такі як Euroscore. Прийняття рішення про проведення оперативного втручання має також враховувати рішення поінформованого пацієнта і його подальшу якість життя. У пацієнтів похилого віку вік сам по собі не має розглядатися як протипоказання до оперативного втручання.
Ведення хворих із наявністю асоційованих із клапанною патологією захворювань
Ішемічна хвороба серця
Використання стрес-тестів для верифікації ІХС, асоційованої із тяжкою КХС, не є доцільним внаслідок їх низької діагностичної цінності та потенційних ризиків.
Див. табл. 5 — рекомендації щодо ведення пацієнтів із наявністю ІХС, асоційованою з клапанною патологією.
Порушення ритму
За винятком випадків, коли фібриляція передсердь (ФП) призводить до розладів гемодинаміки, кардіоверсія перед проведенням втручання у хворих із тяжкою КХС не показана.
Пероральна терапія антикоагулянтами з цільовим рівнем міжнародного нормалізаційного відношення (МНВ) (2–3) рекомендується у хворих із вродженою КХС і будь-яким типом ФП. При МС цільовий рівень МНВ має бути вищим.
3. Показання до лікування вад серця
3.1. Аортальна регургітація
Показання для хірургічного лікування
При хронічній АР мета хірургічного втручання — запобігання розвитку систолічної дисфункції шлуночків та/чи аортальних ускладнень.
Вибір хірургічного втручання залежить від досвіду «команди експертів», наявності аневризми кореня аорти, характеристики стулок, очікуваної тривалості життя й антикоагулянтного статусу (табл. 6).
| Показання | Клас/ Рівень доказовості |
|---|---|
| Симптомні хворі (задишка, II–IV ФК NYHA або стенокардія) | IB |
| Безсимптомні хворі з фракцією викиду (ФВ) ЛШ у спокої ≤50% | IB |
| Хворі, яким проводиться АКШ або операція на висхідній аорті чи на іншому клапані | IC |
| Безсимптомні хворі з ФВ ЛШ у спокої >50% і значною дилатацією ЛШ:– кінцево-діастолічний розмір ЛШ >70 мм або– кінцево-систолічний розмір ЛШ >50 мм (або >25 мм/м² ППТ)* | IIaCIIaC |
| Хворі з ураженням кореня аорти з максимальним діаметром кореня аорти** | |
| ≥45 мм із синдромом Марфана | IC |
| ≥50 ммі з двостулковим АК | IIaC |
| ≥55 мм у всіх інших хворих | IIaC |
Тяжкість враховується за допомогою загальноклінічного та ехокардіографічного обстеження. У безсимптомних хворих перед оперативним втручанням необхідні повторні обстеження.
*Необхідно також враховувати статуру пацієнта, для цього використовується індексування показників. Зміни при повторних обстеженнях слід брати до уваги.
**При прийнятті рішення необхідно враховувати форму і товщину висхідної аорти та інших частин аорти.
Медикаментозна терапія
Роль вазодилататорів у безсимптомних пацієнтів без наявності гіпертонічної хвороби та застійної серцевої недостатності не доведена. У осіб із синдромом Марфана блокатори β-адренорецепторів необхідно призначати як перед, так і після оперативного втручання.
Повторні обстеження
Усі хворі з тяжкою АР і збереженою скоротною функцією ЛШ потребують повторного обстеження через 6 міс після первинного обстеження. Пацієнти зі стабільними параметрами мають обстежуватися 1 раз на рік. У хворих із дилатацією аорти, особливо у пацієнтів із синдромом Марфана чи двостулковим АК, щорічно слід проводити ехокардіографічне обстеження (рис. 1).
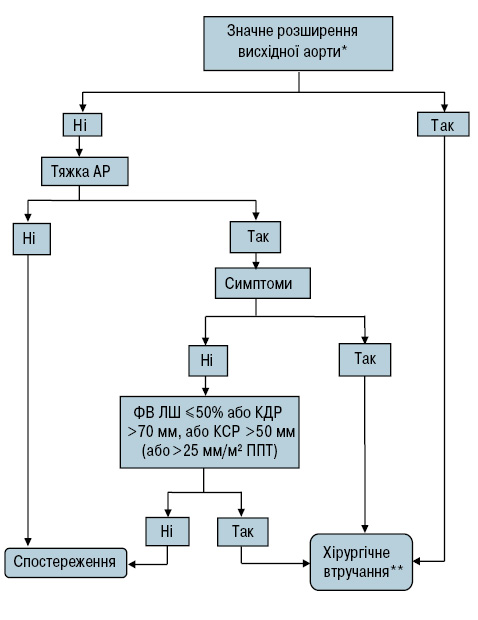
Рис. 1. Алгоритм ведення хворих із АР
КДР — кінцево-діастолічний розмір, КСР — кінцево-систолічний розмір
*Див. табл. 3.
**Хірургічне втручання необхідно проводити і в разі виявлення суттєвих змін у період спостереження.
3.2. Аортальний стеноз
Показання до хірургічного втручання
Протезування АК необхідно виконувати усім симптомним пацієнтам із тяжким АС, які є кандидатами на проведення операції. При середньому градієнті тиску >40 мм рт. ст. величина ФВ не є протипоказанням до проведення втручання.
Алгоритм ведення пацієнтів із АС і низьким градієнтом тиску (у разі значного зниження ФВ та градієнті тиску на АК <40 мм рт. ст.) є більш суперечливим. Хірургічне лікування рекомендовано хворим із наявністю контрактильного резерву. Однак у хворих із невеликим контрактильним резервом оперативне втручання також може бути проведене з урахуванням клінічного стану пацієнта і можливості реваскуляризації.
Нещодавно описаний феномен АС із парадоксальним низьким током і низьким градієнтом із нормальною ФВ потребує особливої уваги у зв’язку з недостатньою кількістю даних щодо подальшого перебігу та прогнозу після хірургічного втручання. У таких випадках хірургічне втручання слід проводити лише за наявності симптомів або вираженої клапанної обструкції, виявленої при поглибленому обстеженні.
Алгоритм ведення безсимптомних хворих із тяжким АС залишається контраверсійним. Раннє оперативне втручання може бути проведене у пацієнтів із низьким операційним ризиком (табл. 7).
| Показання | Клас/Рівень доказовості |
|---|---|
| Тяжкий АС при будь-яких симптомах | IB |
| Тяжкий АС при проведенні АКШ, операції на висхідному відділі аорти чи іншому клапані | ІС |
| Безсимптомні пацієнти із тяжким АС і систолічною дисфункцією ЛШ (ФВ ЛШ <50%) іншого генезу | ІС |
| Безсимптомні пацієнти із тяжким АС і позитивним тестом із фізичним навантаженням | ІС |
| Пацієнти з високим ризиком із наявністю безсимптомного АС, у яких можливе проведення ТІАК, однак більш доцільним, на думку «команди експертів», є хірургічне втручання, зумовлене індивідуальними факторами ризику та анатомічними особливостями | ІІаВ |
| Безсимптомні пацієнти з тяжким АС та позитивним тестом із фізичним навантаженням, що характеризується зниженням артеріального тиску нижче вихідних параметрів | ІІаС |
| Помірний АС* при показаннях до АКШ, оперативному втручанні на висхідному відділі аорти чи іншому клапані | IIaC |
| У пацієнтів із наявністю симптомів і АС, що характеризується низьким током і низьким градієнтом (<40 мм рт. ст.) з нормальною ФВ — тільки після достовірного підтвердження тяжкості АС | IIaC |
| У пацієнтів з наявністю симптомів із тяжким АС, що характеризується низьким током і низьким градієнтом, зі зниженою ФВ і наявністю потокового резерву** | ІІаС |
| У безсимптомних хворих із нормальною ФВ і відсутністю порушень при проведенні тесту із фізичним навантаженням у разі низького операційного ризику і наявності хоча б одного із нижченаведеного:— дуже тяжкий АС, що характеризується піковою швидкістю трансклапанного потоку ≥5,5 м/с— наявність ознак помірної чи вираженої кальцифікації АК та прогресуванням пікової швидкості ≥0,3 м/с/рік | ІІаС |
| У пацієнтів із наявністю симптомів із тяжким АС, що характеризується низьким током і низьким градієнтом, з дисфункцією ЛШ і без наявності потокового резерву | IIbC |
| Безсимптомні пацієнти із тяжким АС, нормальною ФВ і відсутністю порушень при проведенні тесту з фізичним навантаженням у разі низького операційного ризику і наявності хоча б одного із нижченаведеного:— значне підвищення рівня BNP при повторних обстеженнях— при збільшенні середнього градієнта тиску >20 мм рт. ст. при фізичному навантаженні— вираженої гіпертрофії ЛШ за відсутності гіпертензії | ІІbС |
*При помірному АС із площею аортального отвору 1,0—1,5 см² (0,6—0,9 см²/м² ППТ) або середнім градієнтом тиску на АК 30—50 мм рт. ст. при незміненому кровотоку через клапан. Необхідно враховувати також дані клінічного обстеження.
**Також використовується термін «контрактильний резерв».
Показання до проведення транскатетерної імплантації аортального клапана
ТІАК слід проводити лише в кардіохірургічних лікарнях. «Команда експертів», що робить висновок з приводу індивідуальних факторів ризику в конкретного пацієнта і технічних можливостей проведення ТІАК, має бути оптимально підібраною для прийняття рішення щодо певної популяції пацієнтів (табл. 8, 9).
Необхідно ідентифікувати як клінічні, так і анатомічні протипоказання. Очікувана тривалість життя пацієнтів, яким планується проведення ТІАК, має становити >1 року, крім того, необхідно враховувати можливість покращання якості життя. Прийняття рішення про проведення ТІАК, засноване на об’єктивних даних та думці «команди експертів», рекомендоване у пацієнтів із тяжким АС з наявністю симптомів і неможливості проведення традиційного хірургічного втручання (рис. 2). ТІАК може проводитися у хворих із високим ризиком, які є кандидатами на хірургічне втручання, із врахуванням переваг/недоліків обох методів лікування.
| Абсолютні протипоказання |
| Відсутність «команди експертів» або кардіохірургічного стаціонару |
| Відсутність підтвердження «командою експертів» пріоритетності ТІАК перед хірургічним втручанням |
| Клінічні протипоказання |
| Очікувана тривалість життя <1 рокуСумніви щодо покращання якості життя після проведення ТІАК внаслідок наявності коморбідної патологіїТяжкі первинні захворювання інших клапанів, що можуть бути виліковані тільки за допомогою хірургічного втручання |
|
Анатомічні протипоказання Неадекватний розмір кільця АК (<18 мм, >29 мм*)Наявність тромбів у порожнині ЛШАктивний ендокардитВисокий ризик обструкції коронарного вістя (асиметрична кальцифікація клапана, коротка відстань між кільцем і коронарним вістям, малі аортальні синуси)Бляшки з мобільними тромбами у висхідній аорті чи дузі аорти
Для феморального/підключичного доступу: неадекватний доступ до судин (розмір судин, кальцифікація, звивистість) |
| Відносні протипоказання |
| Двостулковий або некальцифікований клапан |
| Нелікована ІХС, що потребує реваскуляризації |
| Гемодинамічна нестабільність |
| ФВ ЛШ <20% |
| Для трансапікального доступу: тяжка легенева патологія, відсутність доступу до верхівки ЛШ |
*Протипоказання до використання цих пристроїв.
| Рекомендації | Клас/Рівень доказовості |
|---|---|
| ТІАК може проводитися лише під моніторингом «команди експертів», що включає кардіологів і кардіохірургів, а також інших спеціалістів при необхідності | ІС |
| ТІАК необхідно проводити лише у стаціонарах кардіохірургічного профілю | ІС |
| Проведення ТІАК показане у пацієнтів із тяжким АС з наявністю симптомів і неможливістю проведення хірургічного втручання, що оцінюється «командою експертів». При цьому враховується також можливість покращання якості життя і очікувана тривалість життя повинна перевищувати 1 рік | ІВ |
| ТІАК може бути рекомендована у пацієнтів високого ризику з тяжким АС і наявністю симптомів, у яких можливе проведення хірургічного втручання, однак, на думку «команди експертів», що заснована на вивченні індивідуальних факторів ризику і анатомічних особливостей, ТІАК є більш доцільною | ІІаВ |
Балонна вальвулопластика
Ця маніпуляція може розглядатися як альтернативне втручання для пацієнтів із нестабільною гемодинамікою і високим ризиком при проведенні хірургічного втручання (клас рекомендацій ІІb, рівень доказовості С) або для пацієнтів із тяжким АС з наявністю симптомів, які потребують проведення ургентного некардіального оперативного втручання (клас рекомендацій ІІb, рівень доказовості С).
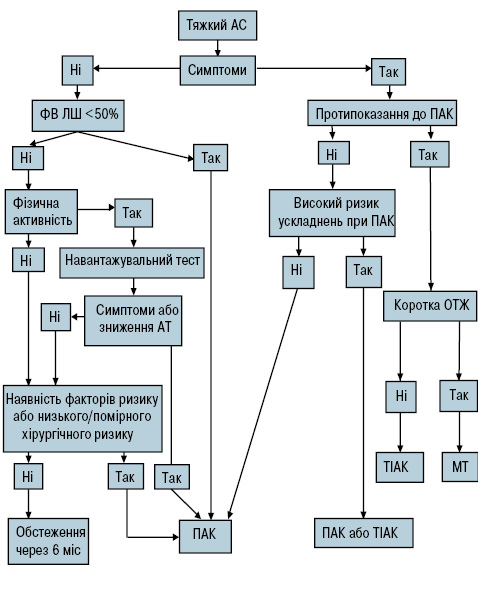
Рис. 2. Алгоритм ведення хворих із тяжким АС
ПАК — протезування АК; ОТЖ — очікувана тривалість життя; МТ — медикаментозна терапія.
Медикаментозна терапія
Для уповільнення прогресування захворювання у пацієнтів з АС слід використовувати терапію статинами. Модифікація факторів ризику атеросклерозу, згідно з рекомендаціями із вторинної профілактики атеросклерозу, настійно рекомендована.
Повторні обстеження
Пацієнти без наявності симптомів повинні бути детально поінформовані про важливість спостереження за станом здоров’я та необхідність звернення при появі симптомів.
У разі помірної чи вираженої кальцифікації клапана та при піковій швидкості потоку на АК >4 м/с при первинному обстеженні — повторні обстеження необхідно проводити кожні 6 міс при появі клінічних симптомів, зміні толерантності до тесту з фізичним навантаженням або ехокардіографічних параметрів. Якщо пікова швидкість потоку на АК збільшується порівняно з останнім візитом (>0,3 м/с/рік), необхідне проведення оперативного втручання. Якщо змін не виявлено і пацієнт залишається безсимптомним, рекомендується спостереження з клінічним обстеженням кожні 6 міс та проведенням ехокардіографії кожні 12 міс.
Пацієнтам, які не відповідають цим критеріям, клінічне обстеження необхідно проводити 1 раз на рік, а за наявності пограничних значень показників рекомендується частіше обстеження.
За наявності вираженої кальцифікації, незначного чи помірного АС пацієнтам необхідно проходити обстеження щорічно. У осіб молодого віку із незначним АС і без вираженої кальцифікації інтервали між обстеженнями можуть бути збільшені до 2–3 років.
3.3. Мітральна регургітація
Цей розділ стосується окремо первинної та вторинної МР згідно з механізмом МР.
Первинна мітральна регургітація
Первинна МР включає всі захворювання, при яких первинною причиною є патологічні зміни апарату клапана.
Показання до хірургічного втручання
Прийняття рішення про протезування клапана чи реконструктивну операцію в основному залежить від анатомічних особливостей клапана, результатів хірургічної експертизи та стану хворого.
Хірургічне втручання показане у хворих із наявністю симптомів, пов’язаних із хронічною МР і відсутністю протипоказань. При ФВ ЛШ <30% довготривалий ефект від втручання може полегшити симптоми, однак досі залишаються нез’ясованими ефекти хірургічного лікування на виживаність. Черезшкірна процедура «край до краю» може бути проведена у хворих із тяжкою первинною МР і наявністю симптомів за сприятливих результатів ехокардіографії в разі неможливості проведення оперативного втручання або при високому операційному ризику за оцінкою «команди експертів» і в разі очікуваної тривалості життя >1 року.
Алгоритм ведення безсимптомних пацієнтів є контраверсійним. Показання до хірургічного лікування залежать від результатів стратифікації ризику, можливості довготривалого ефекту від реконструкції клапана і бажання поінформованого пацієнта (табл. 10).
| Показання | Клас/Рівень доказовості |
|---|---|
| Реконструктивна операція на МК є пріоритетною, якщо очікується довготривале втручання | ІС |
| Симптомні пацієнти з ФВ ЛШ >30% і КСР <55 мм | IB |
| Безсимптомні пацієнти з дисфункцією ЛШ (КСР >45 мм та/чи ФВ ЛШ ≤60%) | IC |
| Безсимптомні пацієнти зі збереженою функцією ЛШ та ФП або ЛГ (СТЛА >50 мм рт. ст. у спокої) | IIaC |
| Безсимптомні пацієнти зі збереженою систолічною функцією ЛШ великою вірогідністю довготривалого ефекту від втручання, низьким операційним ризиком, спаяними стулками і КСР ≥40 мм | ІІаС |
| Пацієнти з тяжкою дисфункцією ЛШ (ФВ <30% та/чи КСР >55 мм), рефрактерною до медикаментозної терапії з високою вірогідністю довготривалого ефекту від реконструктивної операції та низькою супутньою захворюваністю | IIaC |
| Пацієнти з тяжкою дисфункцією ЛШ (ФВ <30% та/чи КСР >55 мм), рефрактерною до медикаментозної терапії з низькою вірогідністю довготривалого ефекту від реконструктивної операції та низькою супутньою захворюваністю | IIbС |
| У безсимптомних хворих зі збереженою систолічною функцією ЛШ з високою вірогідністю довготривалого ефекту від втручання, низьким операційним ризиком і наявністю:— дилатації лівого передсердя (індекс об’єму ≥60 мл/м² ППТ) і синусового ритму— ЛГ при навантаженні (СТЛА ≥60 мм рт. ст.) |
IIbC |
КСР — кінцево-систолічний розмір; ЛГ — легенева гіпертензія; СТЛА — систолічний тиск в легеневій артерії.
Алгоритм ведення безсимптомних пацієнтів суперечливий і залежить від стратифікації ризику, вірогідності проведення ефективної операції та рішення самого пацієнта (рис. 3).
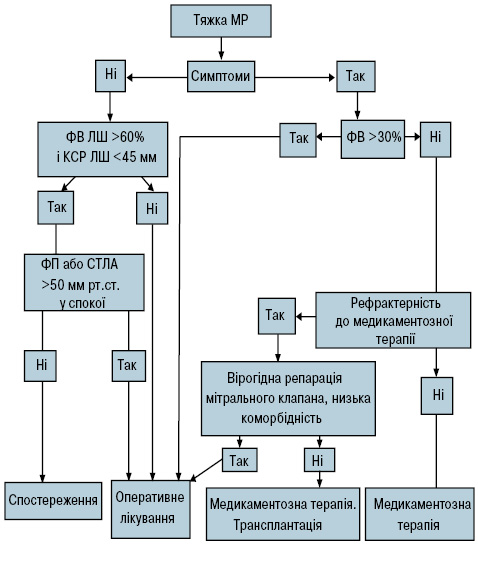
Рис. 3. Алгоритм ведення хворих із тяжкою МР
СТЛА — систолічний тиск у легеневій артерії; КСР — кінцево-систолічний розмір.
Медикаментозна терапія
Антикоагулянтну терапію з цільовим показником МНВ на рівні 2–3 необхідно проводити пацієнтам із постійною чи персистуючою формою ФП або в разі тромбоемболії та тромбоутворення в порожнині передсердь в анамнезі та протягом 3 міс після оперативного втручання на мітральному клапані.
Вазодилататори, включаючи інгібітори ангіотензинперетворювального фермента (АПФ), не рекомендовані у хворих без наявності серцевої недостатності та артеріальної гіпертензії.
Повторне обстеження
Безсимптомні пацієнти із помірною МР та збереженою систолічною функцією ЛШ повинні проходити клінічне обстеження 1 раз на рік, ехокардіографічне обстеження — 1 раз на 2 роки.
Безсимптомні пацієнти з тяжкою МР та збереженою функцією ЛШ повинні проходити клінічне обстеження 1 раз на 6 міс із щорічним ехокардіографічним дослідженням, періоди між обстеженнями можуть бути скорочені в разі першого повторного обстеження, у хворих із граничними показниками та при значних змінах порівняно з попереднім візитом.
Вторинна мітральна регургітація
При вторинній МР, для якої також використовується термін «функціональна», стулки клапана і хорди є структурно нормальними, але причиною регургітації є порушення геометрії підклапанного апарату, що відбувається як наслідок дилатації та ремоделювання ЛШ, пов’язаних з ідіопатичною кардіоміопатією чи ІХС.
Показання до хірургічного лікування
Отримано різноманітні дані щодо алгоритму ведення хворих із вторинною МР, однак вони мають нижчий рівень доказовості, ніж при первинній МР. При тяжкій МР корекція необхідна при проведенні АКШ. У інших пацієнтів доцільність проведення оперативного втручання може залежати від операційного ризику, можливості реваскуляризації, функції ЛШ, життєздатності міокарда і в деяких випадках — результатів тесту з фізичним навантаженням.
Перкутанна процедура «край до краю» може бути доцільна у хворих із тяжкою вторинною МР з наявністю симптомів, незважаючи на оптимально підібрану медикаментозну терапію (табл. 11).
| Показання | Клас/ Рівень доказовості |
|---|---|
| Пацієнти з тяжкою МР і ФВ ЛШ >30%, які підлягають АКШ | IC |
| Пацієнти з помірною МР, які підлягають АКШ, при можливій пластиці клапана | IIaC |
| Симптомні пацієнти з тяжкою МР, ФВ ЛШ <30% з можливістю проведення реваскуляризації | IIaC |
| Пацієнти з тяжкою МР, ФВ ЛШ >30%, без можливості проведення реваскуляризації, рефрактерні до медикаментозного лікування та без тяжкої супутньої патології | IIbC |
Функціональна мітральна регургітація
Функціональна МР спостерігається при кардіоміопатії та ІХС із вираженою дисфункцією ЛШ.
Ізольоване оперативне втручання на мітральному клапані в комбінації з реконструктивною операцією на ЛШ може проводитися в разі тяжкої функціональної МР із тяжкою дисфункцією ЛШ, включаючи випадки, коли не показане АКШ при збереженні симптомів на фоні медикаментозного лікування у разі нетяжких коморбідних захворювань з метою уникнення чи відстрочення трансґ-плантації серця.
Медикаментозна терапія є оптимальним способом лікування, який необхідно застосовувати перед проведенням оперативного втручання при функціональній МР. Показані інгібітори АПФ та блокатори β-адренорецепторів. Можливе застосування нітратів та діуретиків.
Ресинхронізуюча терапія та імплантація кардіовертера-дефібрилятора може бути рекомендована за наявності відповідних показань.
Медикаментозна терапія
Оптимальна стратегія ведення хворого, що включає медикаментозну терапію, ресинхронізаційну терапію та імплантацію кардіовертерів, за необхідності має бути першим кроком у веденні пацієнтів із вторинною МР і повинна відповідати рекомендаціям із серцевої недостатності.
3.4. Мітральний стеноз
Показання до хірургічного втручання (табл. 12, 13).
| Показання | Клас/Рівень доказововсті |
|---|---|
| Симптомні пацієнти зі сприятливим прогнозом проведення ПМК | IB |
| Симптомні пацієнти з протипоказаннями або високим ризиком хірургічного втручання | IC |
| Як первинне лікування у симптомних пацієнтів з несприятливими анатомічними особливостями МК, але без клінічних факторів ризику | IIaC |
| Безсимптомні пацієнти із високим ризиком розвитку тромбоемболії або декомпенсації: | |
| — при емболії в анамнезі | IIaC |
| — за наявності щільного спонтанного ехоконтрастування в ЛП | IIaC |
| — при персистуючій або пароксизмальній формі ФП | IIaC |
| — при систолічному тиску в легеневій артерії >50 мм рт. ст.у стані спокою | IIaC |
| — при необхідності виконання серйозних некардіальних хірургічних операцій | IIaC |
| — при планованій вагітності | IIaC |
МК — мітральний клапан; ЛП — ліве передсердя.
| Площа мітрального отвору >1,5 см² |
| Тромб у лівому передсерді |
| Більша ніж помірна МР |
| Виражена чи двокомісурна кальцифікація |
| Відсутність спаяності комісур |
| Тяжка супутня аортальна патологія чи тяжкий комбінований трикуспідальний стеноз та регургітація |
| Супутнє ураження коронарних судин, що потребує АКШ |
Хірургічне втручання необхідно проводити за наявності симптомів захворювання. При сприятливій анатомічній будові МК більшості пацієнтів проводять ПМК. Для хворих із несприятливою анатомічною будовою МК показання до ПМК залишаються суперечливими, і для прийняття рішення необхідно враховувати багатофакторну природу прогнозування ПМК та хірургічний досвід лікувального закладу.
У зв’язку з низьким, але вірогідним ризиком вродженого МР, дійсно безсимптомні пацієнти зазвичай не є кандидатами для проведення ПМК, за винятком випадків високого ризику тромбоемболічних ускладнень, тяжких гемодинамічних порушень, легеневої гіпертензії, планування вагітності. ПМК у цих пацієнтів мають проводити досвідчені спеціалісти за наявності сприятливих обставин.
У безсимптомних пацієнтів із МС оперативне втручання дуже рідко є доцільним і може проводитися при високому ризику ускладнень та за наявності протипоказань до ПМК (рис. 4).
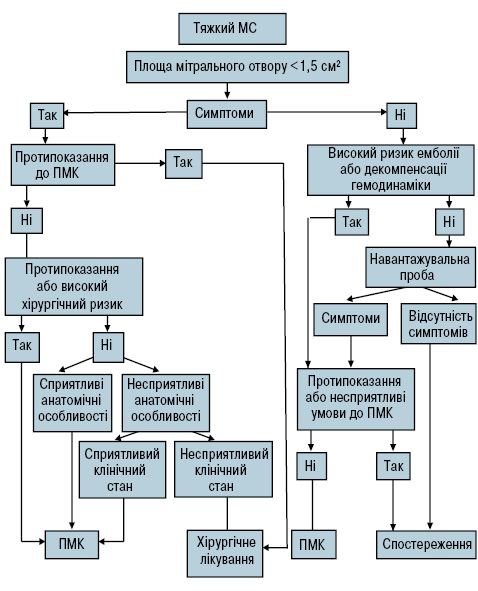
Рис. 4. Алгоритм ведення пацієнтів із тяжким МС
Медикаментозна терапія
Доцільне застосування діуретиків, блокаторів β-адренорецепторів, та блокаторів кальцієвих каналів, що впливають на частоту серцевих скорочень.
Антикоагулянтна терапія з цільовим рівнем МНВ 2–3 на верхній межі показана пацієнтам із постійною чи персистуючою формою ФП. У пацієнтів із синусовим ритмом антикоагулянти застосовують за наявності тромбоемболії в анамнезі або тромбів у лівому передсерді (клас рекомендацій І, рівень доказовості С) та рекомендовані, якщо при трансезофагеальній ехокардіографії візуалізується щільне контрастування або у хворих зі збільшеним лівим передсердям (клас рекомендацій ІІа, рівень доказовості С).
Антикоагулянти також показані при виявленні щільного спонтанного контрастування при ехокардіографічному обстеженні або у разі збільшення лівого передсердя (діаметр у М-режимі >50 мм, або індекс об’єму лівого передсердя >60 мл/м²).
Кардіоверсія не показана для проведення оперативного втручання у пацієнтів із тяжким МС, оскільки зазвичай з її допомогою не вдається стійке відновлення синусового ритму на тривалий час. Якщо пароксизм ФП нетривалий і ліве передсердя помірно збільшене, кардіоверсія має бути проведена після вдалого оперативного втручання.
Повторні обстеження
Безсимптомні пацієнти з клінічно значимим МС, яким не було проведене оперативне втручання, мають спостерігатися 1 раз на рік із проведенням клінічного та ехокардіографічного обстеження, при меншій вираженості стенозу обстеження слід проводити рідше.
Алгоритм ведення хворих після вдалого виконання мітральної комісуротомії є однаковим із таким у безсимптомних пацієнтів. При невдалій ПМК і збереженні симптомів рекомендоване раннє хірургічне втручання за відсутності протипоказань.
Окремі популяції хворих
При невдалій ПМК і збереженні симптомів необхідно проводити хірургічне втручання у разі відсутності конкретних протипоказань.
Якщо з’являються симптоми рестенозу після проведення хірургічної комісуротомії, ПМК може бути рекомендована при сприятливих обставинах і відсутності протипоказань та у разі, якщо основним механізмом рестенозу є зрощення комісур. Також повторна ПМК може бути запропонована пацієнтам зі схожими характеристиками в разі успішної ПМК кілька років тому.
У пацієнтів з МС, поєднаним із помірно вираженою патологією АК, ПМК може бути проведена з метою відстрочення оперативного лікування патології обох клапанів.
3.5. Захворювання трикуспідального клапана
Виявлення патології тристулкового клапана потребує детального обстеження, оскільки найчастіше відбувається його лівостороннє ураження.
Показання до оперативного втручання
При технічній можливості більш доцільне проведення консервативної операції, ніж заміна клапана, для здійснення якої потрібні біопротези.
Хірургічне втручання слід проводити на достатньо ранніх стадіях захворювання з метою уникнення розвитку необоротної дисфункції правого шлуночка (табл. 14).
| Показання | Клас/Рівень доказовості |
|---|---|
| Тяжкий ТС з наявністю симптомів | ІС |
| Тяжкий ТС, якщо планується проведення оперативного втручання на клапанах лівих відділів серця | IC |
| Тяжка первинна чи вторинна ТР, якщо планується проведення оперативного втручання на клапанах лівих відділів серця | IC |
| Тяжкий ТС з наявністю симптомів із тяжкою первинною ізольованою ТР без тяжкої дисфункції правого шлуночка | IC |
| Помірно виражена первинна ТР у пацієнтів, яким планується проведення оперативного втручання на клапанах лівих відділів серця | IІаC |
| Помірна вторинна ТР із дилатацією кільця (>40 мм, або >21 мм/м²) у пацієнтів, які підлягають хірургічному лікуванню клапанів лівих відділів серця | ІІаС |
| Помірна первинна ТР у пацієнтів, які підлягають хірургічному лікуванню клапанів лівих відділів серця | ІІаС |
| Після оперативного втручання на клапанах лівих відділів серця при тяжкій ТР із наявністю симптомів або в разі прогресуючої правошлуночкової дилатації/дисфункції за відсутності дисфункції клапанів лівих відділів серця, дисфункції ЛШ або патології легеневих судин | ІІаС |
ТР — трикуспідальна регургітація; ТС — трикуспідальний стеноз.
У пацієнтів із трикуспідальним стенозом без наявності регургітації можливе проведення перкутанної балонної вальвулопластики при ізольованому ураженні трикуспідального клапана чи при одночасному проведенні ПМК.
4. Протезовані клапани
4.1. Вибір клапанного протеза
Ідеальних протезів серцевих клапанів не існує. Будь-які протези, механічні або біологічні, є своєрідним компромісом, їх встановлення може бути пов’язане з розвитком нових патологічних станів. При прийнятті рішення, як правило, необхідно враховувати декілька взаємопов’язаних факторів. Рішення приймається на підставі наявності декількох аргументів, наведених у табл. 15 та 16.
| Аргумент | Клас/Рівень доказовості |
|---|---|
| Власне бажання поінформованого пацієнта та відсутність протипоказань до антикоагулянтної терапії | ІС |
| Пацієнти з ризиком швидкого розвитку структурних порушень клапана* | ІС |
| Пацієнти, які перебувають на антикоагулянтій терапії внаслідок вже встановлених механічних протезів | ІС |
| Вік <60 років для протезування АК і <65 років — для протезування мітрального клапана | ІІаС |
| При великій очікуваній тривалості життя* у разі високого ризику оперативного втручання на клапанах в майбутньому | ІІаС |
| Пацієнти, які тривалий час застосовують антикоагулянти внаслідок високого ризику тромбоемболії** | ІІbС |
*Очікувана тривалість життя має становити >10 років і вираховуватися на підставі віку, статі, наявності коморбідної патології та показника очікуваної тривалості життя в конкретній країні.
**Факторами ризику тромбоемболії є ФП, тромбоемболії в анамнезі, гіперкоагулянтний статус, виражена дисфункція ЛШ.
| Аргумент | Клас/Рівень доказовості |
|---|---|
| Власне бажання поінформованого пацієнта | ІС |
| Неможливість адекватного контролю антикоагулянтної терапії (наявність протипоказань або високого ризику, несвідомість, низька прихильність до лікування, стиль життя, рід занять) | ІС |
| Повторна операція з приводу тромбозу механічного клапана у пацієнта із неадекватним контролем антикоагулянтної терапії | ІС |
| Пацієнти з низьким ризиком проведення повторної операції в майбутньому | ІІаС |
| У пацієнтів віком >65 років при протезуванні АК і >70 років — при протезуванні мітрального клапана або у хворих з очікуваною тривалістю життя меншою ніж строк адекватного функціонування протеза* | ІІаС |
| Молоді жінки, які планують вагітність | ІІаС |
*У хворих віком 60–65 років, яким планується протезування АК і у хворих віком 65–70 років, яким планується протезування мітрального клапана, вибір тактики також потребує детального аналізу інших, окрім віку, факторів.
4.2. Ведення хворих після трансплантації клапана
Основні обстеження та моделі спостереження
Повне базове обстеження необхідно проводити протягомі 6–12 тиж після хірургічного втручання чи наприкінці післяопераційного періоду. Воно повинно включати клінічне обстеження, рентгенографію грудної порожнини, ЕКГ, ТТЕ, дослідження крові.
Клінічне обстеження слід проводити щороку або при появі кардіальної симптоматики якнайшвидше. ТТЕ необхідно проводити при появі нових симптомів після трансплантації клапана чи при очікуванні ускладнень. У пацієнтів із біологічними протезами через 5 років після операції ехокардіографічне обстеження рекомендовано щороку. Транспротезні градієнти під час спостереження найкраще порівнювати з базовими показниками у того самого пацієнта, аніж із теоретичними показниками відповідного протеза.
Трансезофагеальну ехокардіографію необхідно проводити при низькій якості ТТЕ та при підозрі на дисфункцію протезованих клапанів або ендокардит. Флуороскопія може надати додаткову інформацію при підозрі на клапанний тромбоз або паннус.
Антитромботична терапія
Пероральні антикоагулянти рекомендуються в таких ситуаціях:
- пожиттєво для всіх пацієнтів із механічними протезами та для пацієнтів із біопротезами, які мають інші показання до антикоагулянтів;
- протягом 3 міс у всіх пацієнтів після встановлення біопротеза із цільовим рівнем МНВ — 2,5 (табл. 17).
| Рекомендації | Клас/Рівень доказовості |
|---|---|
| Пожиттєвий прийом пероральних антикоагулянтів рекомендується всім хворим із механічними протезами | ІС |
| Пожиттєвий прийом пероральних антикоагулянтів рекомендується пацієнтам із механічними протезами, які мають інші показання до антикоагулянтів | ІВ |
| Додавання ацетилсаліцилової кислоти в низьких дозах рекомендується пацієнтам із механічними протезами і супутнім атеросклерозом | ІІаС |
| Додавання ацетилсаліцилової кислоти в низьких дозах рекомендується у хворих із механічними протезами після тромбоемболій, незважаючи на адекватний контроль МНВ | ІІаС |
| Застосування пероральних антикоагулянтів необхідне протягом перших 3 міс після імплантації мітрального/трикуспідального біопротеза | ІІаС |
| Застосування пероральних антикоагулянтів рекомендується в перші 3 міс після реконструктивної операції на мітральному клапані | ІІаС |
| Додавання ацетилсаліцилової кислоти в низьких дозах рекомендується в перші 3 міс після імплантації біопротеза АК | ІІаС |
| Пероральні антикоагулянти рекомендовано в перші 3 міс після імплантації біопротеза АК | ІІbC |
Цільові рівні МНВ
При виборі оптимального рівня МНВ необхідно враховувати фактори ризику і тромбогенні властивості конкретного протеза (табл. 18).
| Тромбогенність протеза* | Фактори ризику в конкретного пацієнта** | |
|---|---|---|
| відсутність факторів ризику | наявність ≥1 факторів ризику | |
| Низька | 2,5 | 3,0 |
| Помірна | 3,0 | 3,5 |
| Висока | 3,5 | 4,0 |
*Тромбогенність протеза:
– низька — Carbomedics (аортальна позиція), Medtronic Hale, St. Jude Medical (без Silzone);
– помірна — Bjork-Shiley, інші двостулкові клапани;
– висока — Lillehey-Kaster, Omniscience, Starr-Edwards.
**Фактори ризику:
— трансплантація мітрального і трикуспідального клапана, або клапана легеневої артерії;
— тромбоемболії в анамнезі;
— ФП;
— діаметр лівого передсердя >50 мм;
— щільне контрастування в порожнині лівого передсердя;
— МС будь-якого ступеня;
— ФВ ЛШ <35%;
— гіперкоагулянтні стани.
Антикоагулянтна терапія
Показання до призначення антикоагулянтів з метою зменшення коагуляції крові включають супутні захворювання артерій, у тому числі коронарних, та інші значимі атеросклеротичні ураження. Антитромбоцитарна терапія може також додаватися при рецидивуючій емболії чи після одного підтвердженого епізоду емболії при адекватному рівні МНВ.
Додавання антитромбоцитарної терапії необхідно проводити разом із повноцінним обстеженням і лікуванням з урахуванням виявлених факторів ризику та оптимізацією алгоритму терапії антикоагулянтами (клас рекомендацій ІІа, рівень доказовості С).
Використання елютинг-стентів має бути обмежене у пацієнтів із механічними протезами з метою максимального скорочення періоду прийому потрійної антитромботичної терапії. Протягом цього періоду рекомендуються щотижневий контроль МНВ.
Переривання антикоагулянтної терапії
Застосування антикоагулянтів при проведенні некардіальних оперативних втручань потребує обережного підходу, заснованого на оцінці ризику згідно з тромбогенними характеристиками протезів і факторів ризику, залежних від пацієнта. У пацієнтів дуже високого ризику за можливості необхідно уникати переривання прийому антикоагулянтів. Незначні хірургічні втручання (включаючи екстракцію зуба), а також оперативні втручання, при яких кровотечу легко контролювати, не потребують переривання антикоагулянтної терапії. МНВ слід знижувати до цільового рівня 2 (клас рекомендацій І, рівень доказовості В).
При великих оперативних втручаннях, коли є необхідність у перериванні антикоагулянтної терапії (МНВ <1,5), потрібна попередня госпіталізація пацієнта і внутрішньовенне введення нефракціонованого гепарину (клас рекомендацій І, рівень доказовості В).
Введення гепарину припиняється за 6 год до операції та відновлюється через 6–12 год після її проведення. Альтернативним методом передопераційної підготовки може бути підшкірне введення низькомолекулярного гепарину (клас рекомендацій ІІb, рівень доказовості С).
При використанні низькомолекулярного гепарину необхідне введення препарату 2 рази на добу в терапевтичних, а не у профілактичних дозах з урахуванням маси тіла та за можливості — проведення моніторингу активності Ха-фактора коагуляції.
Ефективну антикоагулянтну терапію необхідно відновити якнайшвидше після проведення хірургічного втручання для досягнення попереднього терапевтичного рівня МНВ.
Ведення хворих із клапанним тромбозом
Підозра на обструктивний клапанний тромбоз має виникати стосовно будь-якого пацієнта з протезованим клапаном при появі задишки та емболії.
При аналізі ризику/користі від проведення фібринолізу необхідно враховувати індивідуальні особливості пацієнта та можливості конкретної клініки (рис. 5).
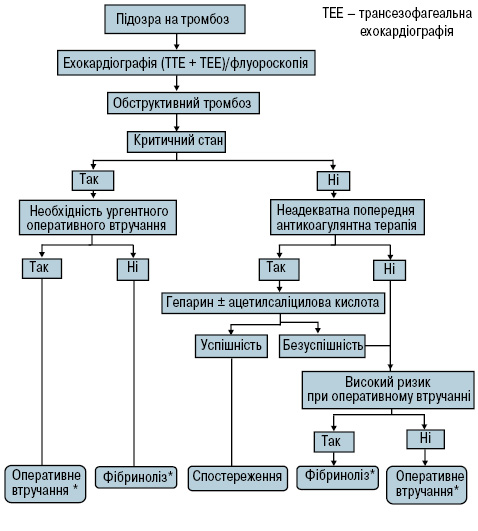
Рис. 5. Алгоритм ведення хворих із лівостороннім обструктивним тромбозом протезованого клапана
*Ризик/користь обох способів лікування необхідно оцінювати індивідуально. За наявності протезів першого покоління слід проводити хірургічне лікування.
При обструктивному клапанному тромбозі у пацієнтів у критичному стані за відсутності тяжких супутніх захворювань лікувальною тактикою вибору є ургентна чи невідкладна трансплантація клапана (клас рекомендацій І, рівень доказовості С).
Фібриноліз слід проводити в таких ситуаціях:
- критичний стан хворого при низькій вірогідності виживання під час оперативного втручання;
- ситуації, при яких ургентне хірургічне втручання неможливе;
- тромбоз трансплантованого клапана легеневої артерії чи тристулкового клапана.
При проведенні фібринолізу у нестабільних пацієнтів рекомендується використання короткого протоколу, що передбачає внутрішньовенне введення рекомбінантного активатора плазміногену в дозі 10 мг болюсно + 90 мг за 90 хв у комбінації з UFH або стрептокіназою в дозі 1 500 000 ОД за 60 хв без UFH. Більш тривалі інфузії можна використовуватися у стабільних пацієнтів.
Алгоритм ведення хворих із необструктивним тромбозом протезованого клапана залежить в основному від розміру тромбозу та виникнення тромбоемболій. Необхідно проводити докладний ехокардіографічний та флуороскопічний моніторинг. При невеликих тромбах (довжиною <10 мм) прогноз сприятливий у більшості випадків при застосуванні медикаментозної терапії. Хороша відповідь на її проведення з поступовим розсмоктуванням тромбу дозволяє уникнути хірургічного втручання чи фібринолізу. Хірургічне втручання вважається доцільним при великих (>10 мм) необструктивних тромбозах протезованих клапанів, ускладнених тромбоемболією (клас рекомендацій ІІа, рівень доказовості С) або при персистуючому тромбозі клапана, незважаючи на оптимальну терапію антикоагулянтами. При високому ризику ускладнень оперативного втручання альтернативним методом лікування може вважатися фібриноліз. Однак використання фібринолізу при необструктивному тромбозі протезованих клапанів має бути суттєво обмежене, оскільки процедура характеризується високим ризиком розвитку тромбоемболічних ускладнень та кровотеч.
Для розробки адекватного алгоритму ведення хворих необхідне детальне вивчення кожного епізоду тромбоемболії. Профілактика подальших тромбоемболічних ускладнень включає: усунення модифікованих факторів ризику та оптимізацію антикоагулянтного контролю за можливості самим пацієнтом. Рекомендується додавання ацетилсаліцилової кислоти в низьких дозах (≥100 мг/добу).
Тактика ведення пацієнтів із гемолізом та паравальвулярною кровотечею
Повторне хірургічне втручання рекомендується при паравальвулярній кровотечі, що пов’язана з ендокардитом, або в тому разі, коли паравальвулярна кровотеча супроводжується гемолізом, що потребує повторних переливань крові, а також при тяжкій симптоматиці (клас рекомендацій І, рівень доказовості С). При протипоказаннях до проведення операції медикаментозна терапія має включати препарати заліза, блокатори β-адренорецепторів та еритропоетин при тяжкому гемолізі.
Ведення хворих із дисфункцією клапанних біопротезів
Повторне оперативне втручання рекомендується симптомним пацієнтам зі значною дисфункцією протезів (значне зростання транспротезного градієнта чи виражена регургітація) (клас рекомендацій І, рівень доказовості С) та безсимптомним пацієнтам при будь-якій значимій дисфункціїї протезів у разі низького ризику ускладнень при оперативному втручанні (клас рекомендацій ІІа, рівень доказовості С).
Профілактична заміна біопротезів, що були встановлені >10 років тому і не мають структурних порушень, може проводитися при операції на іншому клапані чи коронарних артеріях.
Серцева недостатність
Серцева недостатність після проведення оперативного втручання на клапанах може бути спричинена ускладненнями, пов’язаними із протезами, структурними порушеннями, дисфункцією ЛШ (у тому числі після корекції регургітації), або прогресуванням захворювання іншого клапана. Необхідно також враховувати неклапанні причини, такі як ІХС, гіпертензія, персистуючі порушення ритму.
5. Ведення пацієнтів під час некардіального оперативного втручання
Перед проведенням некардіального хірургічного втручання необхідна оцінка тяжкості КХС і клінічного стану хворих та отримання згоди пацієнта після консиліуму у складі кардіологів, хірургів та анестезіологів — тих, хто спеціалізується в кардіології.
У безсимптомних пацієнтів зі значимим МС та систолічним тиском у легеневій артерії <50 мм рт ст. некардіальне оперативне втручання може бути проведене з низьким ризиком ускладнень. У симптомних пацієнтів або у пацієнтів із систолічним тиском в легеневій артерії >50 мм рт. ст. корекція МС за допомогою ПМК за можливості має бути проведена перед некардіальним оперативним втручанням.
У безсимптомних пацієнтів із тяжким МС або АР та збереженою функцією ЛШ некардіальне хірургічне втручання може бути проведене із низьким ризиком ускладнень.
У симптомних пацієнтів або пацієнтів зі зниженою функцією ЛШ (ФВ <30%) проведення некардіальних оперативних втручань допустиме лише при однозначній необхідності.
6. Ведення хворих із Клапанною хворобою серця у період вагітності
Оптимальним є виявлення і лікування КХС до вагітності.
Ехокардіографічне обстеження необхідно проводити у кожної вагітної пацієнтки за наявності специфічних кардіальних шумів, задишки, протезованих клапанів.
При першому візиті у період вагітності раннє переривання вагітності може бути рекомендоване у таких ситуаціях: вираження дисфункція ЛШ (ФВ <40%), синдром Марфана з аневризмою висхідної аорти >40 мм, тяжка стенозуюча клапанна патологія з наявністю симптомів, що не може бути вилікована за допомогою лише перкутанних процедур.
У період вагітності необхідне проведення клінічного та ехокардіографічного спостереження на 3-му і 5-му місяці, а потім щомісяця у пацієнток із тяжким стенозуючим ураженням клапанів.
Симптомний МС слід лікувати, призначаючи постільний режим, блокатори β-адренорецепторів, допустима їх комбінація з діуретиками. β-Агоністи протипоказані. ПМК рекомендується проводити за наявності вираженої симптоматики чи збереженні систолічного тиску в легеневій артерії >50 мм рт ст., що не піддається медикаментозній корекції.
У пацієнток із тяжким АС, які залишаються симптомними, незважаючи на застосування діуретиків, необхідно вирішувати питання про проведення аортальної балонної вальвулопластики.
Пацієнтки з АР і МР, у яких з’явилися клінічні симптоми, повинні лікуватися медикаментозно із використанням діуретиків та вазодилататорів, за винятком інгібіторів АПФ і блокаторів рецепторів ангіотензину. У більшості випадків оперативне втручання може бути відкладене до післяродового періоду.
У пацієнток із синдромом Марфана блокатори β-адренорецепторів необхідно застосовувати протягом всього періоду вагітності.
У пацієнток з механічними протезами антагоністи вітаміну К рекомендуються у ІІ та ІІІ триместр вагітності до 36-го тижня, після чого їх замінюють на нефракціонований гепарин. Протягом І триместру вибір препарату має враховувати побажання поінформованої пацієнтки, прихильність до лікування та можливість застосування варфарину в низьких дозах, що є найбільш безпечним для матері. Використання варфарину до 36-го тижня вагітності рекомендовано, якщо в І триместр доза препарату становила <5 мг/добу. Застосування низькомолекулярного гепарину на сьогодні не рекомендовано.
Оперативні втручання на апараті штучного кровообігу в період вагітності можна проводити лише в ситуаціях, коли є загроза для життя матері. За необхідності трансплантації клапана у період вагітності оптимальним є біопротезування.
Алгоритм ведення пологів має бути узгоджений кардіологами, акушерами, анестезіологами і пацієнткою, також необхідне погодження зі спеціалістами при бажанні переривання прийому пероральних антикоагулянтів. Кесарів розтин рекомендується у пацієнток із синдромом Марфана і діаметром аорти >40 мм, при нестабільній гемодинаміці, у тому числі за наявності АС, та у разі пізньої вагітності при прийомі пероральних антикоагулянтів.
В інших ситуаціях за можливості рекомендуються вагінальні пологи. У жінок із тяжким МС, АС або дисфункцією ЛШ рекомендується моніторування гемодинаміки.
За необхідності проведення оперативного втручання на клапанах у період вагітності при життєздатності плода спочатку необхідно зробити Кесарів розтин.
Диагностика и лечение клапанных пороков сердца. Рекомендации Ассоциации кардиологов Украины
Резюме. В настоящих рекомендациях освещены основные положения относительно тактики ведения пациентов с пороками сердца в соответствии со стандартами современной доказательной медицины. В сравнении с предыдущими рекомендациями пересмотрены алгоритмы ведения пациентов, расширен спектр показаний и противопоказаний, откорригированы классы рекомендаций и уровни доказательности тех или иных методов лечения в соответствии с результатами последних исследований. В частности принципиально обновлен алгоритм ведения пациентов с аортальным стенозом, рекомендации относительно проведения транскатетерной имплантации аортального клапана и чрескожной пластики клапана «край к краю». Кроме того, в новых рекомендациях сделан акцент на стратификации риска и комплексном подходе к ведению пациентов с клапанной патологией с учетом согласованного мнения нескольких специалистов относительно дальнейшей тактики лечения.
Ключевые слова: клапанные пороки сердца, диагностика, лечение, рекомендации, алгоритмы.

Leave a comment