Цитокінові маркери та прогностичні фактори несприятливого перебігу ювенільного ідіопатичного артриту
- 1Львівський державний медичний університет
- 2Комунальний заклад Львівської обласної ради «Західноукраїнський спеціалізований дитячий медичний центр», Львів
Резюме. Проведено визначення рівнів цитокінів у хворих із рефрактерним перебігом ювенільного ідіопатичного артриту (ЮІА) з метою виявлення цитокінових маркерів несприятливого прогнозу ЮІА. Вибір лікування хворих на ЮІА слід проводити, ґрунтуючись на визначенні кількості клінічних прогностично несприятливих критеріїв та на результатах дослідження цитокінових маркерів несприятливого прогнозу хворих на ЮІА, якими є sCD25, інтерлейкін (IL)-6 та -1Ra, розчинний рецептор фактора некрозу пухлини (sTNF-R1).
Вступ
Ювенільний ідіопатичний артрит (ЮІА) — хронічне автоімунне захворювання з пошкодженням одного і більше суглобів у дітей віком до 16 років, яке може призводити до швидкої інвалідизації. Тому основним принципом терапії дітей з ЮІА є раннє та агресивне лікування з призначенням імуносупресивної терапії для вчасного досягнення ремісії, а також запобігання інвалідизації. Вважається, що пацієнти із ЮІА, які не відповіли на традиційну терапію метотрексатом впродовж 6 міс, мають рефрактерний перебіг хвороби та потребують застосування біологічної терапії [1]. Для раціонального вибору базової терапії визначення прогностичних маркерів перебігу захворювання доцільно проводити у дебюті хвороби. На сьогодні проведено дослідження клінічних предикторів несприятливого перебігу ЮІА [9, 3]. Обґрунтовано, що клінічні прогностичні фактори не завжди можуть передбачити перебіг ЮІА. Тому метою роботи було дослідження цитокінових маркерів за несприятливого прогнозу ЮІА шляхом визначення рівнів цитокінів у хворих із рефрактерним перебігом ЮІА.
Об’єкти і методи дослідження
У Західноукраїнському спеціалізованому дитячому медичному центрі впродовж останніх 4 років під динамічним спостереженням перебували 105 хворих на ЮІА (53 дівчинки, 52 хлопчики), середній вік яких на момент обстеження становив 11,8 року. Варіант перебігу ЮІА визначали за критеріями ILAR, Durban,1997, Edmonton, 2001 [7].
Верифікованими були такі варіанти перебігу захворювання: системний варіант у 16 (15%), поліартрит із негативним ревматоїдним фактором — у 19 (18%), поліартрит із позитивним ревматоїдним фактором — у 2 (2%), олігоартрит — у 38 (36%), ентезит-артрит — у 27 (26%), псоріатичний артрит — у 3 (3%) хворих. Рефрактерний перебіг виявлено у 15 пацієнтів із системним ЮІА (94%), у 3 (8%) хворих на олігоартикулярний ЮІА (олігоартрит), у 7 (37%) хворих на поліартикулярний ЮІА з негативним ревматоїдним фактором (поліартрит із від’ємним ревматоїдним фактором), у 1 хворого на поліартрит із позитивним ревматоїдним фактором, у 6 (22%) випадках ентезитасоційованого артриту.
Сироватку крові цих пацієнтів відбирали у різні періоди захворювання та заморожували при температурі –70 °C до моменту одноденного проведення дослідження рівнів усіх цитокінів. У хворих проведено дослідження рівнів цитокінів (інтерлейкін (IL)-1β, -4, -6, -8, -10, -17 та інтерферон (IFN)-γ) та їхніх розчинних рецепторів і антагоністів: антагоніста рецептора IL-1 (IL-1Ra), розчинного рецептора IL-2 (sCD25), розчинного рецептора IL-6 (sIL-6R), розчинного рецептора фактора некрозу пухлини (sTNF-R1). Дослідження цитокінів проводили імуноферментним методом у лабораторії імунології ДУ «Інститут педіатрії, акушерства і гінекології НАМН України» (керівник — професор В.П. Чернишов). Використовували комерційні тест-системи «BD Biosciences Pharmingen», Сан-Дієго, США. Контрольну групу становила 21 здорова дитина.
Залежно від терміну досягнення ремісії були сформовані дві групи хворих. До 1-ї групи увійшли 73 пацієнти із ЮІА, які досягли ремісії у перші 6 міс хвороби. До 2-ї групи увійшли 32 хворих на ЮІА, які не досягли ремісії за 6 міс лікування на фоні терапії метотрексатом у дозі 15 мг/м2, тобто це були пацієнти з так званим рефрактерним перебігом ЮІА (рефрактерний ЮІА).
Статистичну оцінку отриманих даних виконували за допомогою пакета «STATISTIC 8.0». Для оцінки різниці між двома незалежними вибірками застосовували U-критерій Манна — Уїтні, який не потребує перевірки на нормальність розподілу і придатний для порівняння невеликих вибірок. Для встановлення корелятивних зв’язків визначали рангову кореляцію (критерій Спірмена), що застосовується, коли закон розподілу змінних невідомий або не є нормальним.
Результати дослідження та їх обговорення
Відповідно до рекомендацій T. Beukelman (2011) проведено визначення ступеня активності та клінічних маркерів несприятливого прогнозу у пацієнтів із ЮІА на початку хвороби (табл. 1–8) [1].
Таблиця 1. Ступені активності захворювання на ЮІА, олігоартикулярний варіант
Низька активність (мають задовольнятися всі критерії)
|
Середня активність (не задовольняє критеріїв низької чи високої активності)
|
Висока активність (мають задовольнятися щонайменше 3 критерії)
|
Таблиця 2. Ступені активності захворювання на ЮІА, поліартикулярний варіант
Низька активність (мають задовольнятися всі критерії)
|
Середня активність (не задовольняє критеріїв низької чи високої активності)
|
Висока активність (мають задовольнятися щонайменше 3 критерії)
|
Таблиця 3. Ступені активності захворювання на ЮІА, ентезит-артрит
Низька активність (мають задовольнятися всі критерії)
|
Середня активність (не задовольняє критеріїв низької чи високої активності)
|
Висока активність (мають задовольнятися щонайменше 2 критерії)
|
Таблиця 4. Ступені активності захворювання на системний ЮІА з наявністю активних артритів
Низька активність (мають задовольнятися всі критерії)
|
| Середня активність (не задовольняє критеріїв низької чи високої активності)1. ≥1 критеріїв низької активності й <3 критеріїв високої активності |
Висока активність (мають задовольнятися щонайменше 3 критерії)
|
Таблиця 5. Несприятливі прогностичні фактори у хворих на ЮІА з олігоартритом у дебюті
Несприятливі прогностичні фактори (необхідний хоча б 1 фактор)
|
Таблиця 6. Несприятливі прогностичні фактори у хворих на ЮІА з поліартритом у дебюті
Несприятливі прогностичні фактори (необхідний хоча б 1 фактор)
|
Таблиця 7. Несприятливі прогностичні фактори у хворих на ЮІА з ентезитасоційованим артритом
| 1. Радіографічні ознаки пошкодження будь-яких суглобів (ерозії чи звуження суглобових щілин на рентгенограмі) |
Таблиця 8. Несприятливі прогностичні фактори у хворих на системний ЮІА з наявністю активних артритів
Несприятливі прогностичні фактори (необхідний хоча б 1 фактор)
|
При дослідженні клінічних предикторів несприятливого прогнозу у хворих на ЮІА нами виявлено, що у осіб із високою активністю хвороби у дебюті захворювання й артритами >5 суглобів на початку хвороби у подальшому розвивається рефрактерний ЮІА. Результати H.M. Albers зіставні з даними нашого дослідження, оскільки показують, що тривалість активного періоду у перші 2 роки у хворих на ЮІА визначає подальший перебіг ЮІА [13]. Тому можна вважати, що висока активність запального процесу у осіб із ЮІА на початку захворювання є предиктором тяжкого рефрактерного до традиційної базової терапії подальшого перебігу хвороби.
Важливими є отримані нами результати дослідження кореляції кількості несприятливих прогностичних критеріїв, які були визначені в дебюті хвороби, із розвитком рефрактерного перебігу ЮІА (табл. 9). Виявилося, що у хворих на ЮІА, які мають ≥2 несприятливих критеріїв у дебюті ЮІА, у подальшому з високою ймовірністю розвивається рефрактерний перебіг ЮІА. Тому доцільно враховувати розроблені T. Beukelman (2011) клінічні критерії несприятливого перебігу ЮІА для вибору оптимальної базової терапії [1].
Кількість пошкоджених суглобів у хворих на рефрактерний ЮІА у нашому дослідженні корелювала зі sCD25 та IL-6 (рис. 1, 2), що підтверджує значення цих цитокінів як маркерів активності процесу та несприятливого прогнозу ЮІА.
Таблиця 9. Клінічна характеристика хворих на ЮІА
| Показник | 1-ша група (з рефрактерним ЮІА, n=32) | 2-га група (з нерефрактерним ЮІА, n=73) |
| Середня кількість артритів на момент обстеження, n | 8,4±9,2* | 2,7±3,9* |
| Активність, кількість випадківнизька | 6* | 62* |
| середня | 33* | 21* |
| висока | 23* | 2* |
| Один несприятливий прогностичний критерій, кількість випадків | 19 | 34 |
| ≥2 несприятливих прогностичних критеріїв, кількість випадків | 40* | 14* |
У табл. 9 та 10: *р<0,05.
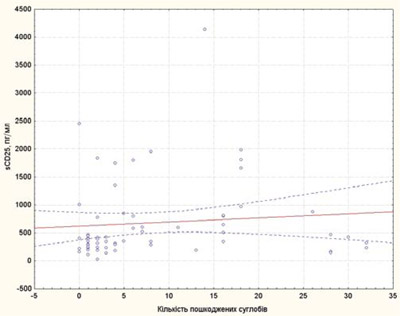
Рис. 1. Кореляційна залежність між кількістю пошкоджених суглобів і sCD25 у хворих на рефрактерний ЮІА
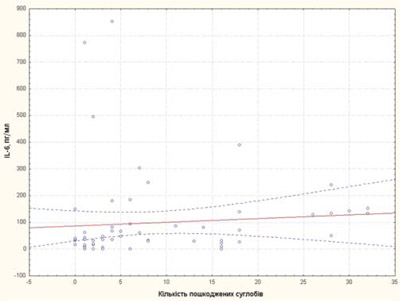
Рис. 2. Кореляційна залежність між кількістю пошкоджених суглобів та IL-6 у хворих на рефрактерний ЮІА
У проведених нами дослідженнях найчастіше спостерігався розвиток рефрактерного перебігу у хворих на системний ЮІА (15 із 16 осіб). Вивчення клінічних предикторів несприятливого перебігу системного ЮІА проводилося і раніше, зокрема його результати висвітлені у публікаціях A.M. Prieur [9]. Дослідження A.M. Prieur виявили прогностично несприятливу кореляцію перебігу системного ЮІА з такими показниками активності, як гарячка та поліартрит, які утримувалися триваліше, ніж перші 6 міс захворювання [9].
Найімовірніше, що причина високої частоти рефрактерного перебігу системного ЮІА порівняно з іншими варіантами ЮІА полягає у особливостях його патогенезу, який принципово відрізняє системний ЮІА від решти варіантів захворювання. На сьогодні системний ЮІА вважають автозапальним синдромом, а не класичним автоімунним захворюванням, у якого провідну патогенетичну роль віддають IL-6 [4]. Зараз продовжують вивчати значення IL-6 у розвитку ряду клінічних проявів системного ЮІА, зокрема гарячки, висипки, поліартриту, затримки росту. Отримані результати стали підґрунтям для впровадження успішної біологічної терапії у хворих на системний ЮІА, спрямованої на блокування IL-6 [5, 12].
Рефрактерний перебіг захворювання спостерігали у кожної 3-ї дитини, хворої на поліартикулярний ЮІА, а при ентезитасоційованому ЮІА — у кожної 5-ї дитини. За даними A.M. Prieur вищий ризик розвитку сакроілеїту у хворих на ентезитасоційований ЮІА корелює з пошкодженням суглобів нижніх кінцівок і появою тарзиту [9].
У нашому дослідженні найрідше виявляли рефрактерний перебіг ЮІА у дітей з олігоартикулярним варіантом ЮІА, а саме у 8% випадків. Згідно з дослідженнями A.M. Prieur несприятливий прогноз при олігоартриті корелював зі ступенем тяжкості артриту впродовж перших 6 міс захворювання [9]. Ураження очей у вигляді увеїту частіше розвивалося у дітей із олігоартритом, які були АНА-позитивними [9].
У дослідженнях L.S. Ou [2] виявлено, що у хворих на активний ЮІА підвищуються рівні IL-6, лейкоцитів, тромбоцитів, ШОЕ та СРБ. M. Rooney продемонстрував зростання рівнів IL-6 і IL-1Ra у хворих на системний ЮІА у період активності хвороби [6]. L.S. Ou вважає, що необхідно використовувати IL-6 для визначення ступеня активності ЮІА та для моніторингу терапевтичної відповіді [2], що доцільно впроваджувати у практику.
У нашому дослідженні виявлена достовірна кореляція ступеня підвищення рівня лейкоцитів, тромбоцитів, ШОЕ та IL-6 із рефрактерним характером перебігу ЮІА (табл. 10).
Таблиця 10. Лабораторні дослідження у хворих на ЮІА
| Показник | 1-ша група (з рефрактерним ЮІА, n=32) | 2-га група (з нерефрактерним ЮІА, n=73) |
| ШОЕ, мм/год | 32,5±16,7* | 16,0±12,6* |
| Лейкоцити, ·109/л | 10,7±4,0* | 7,8±6,1* |
| Тромбоцити, ·109/л | 386,1±143,9* | 270,9±59,3* |
| ANA (+/–) | 6/56 | 12/73 |
| sCD25, пг/мл | 680,5±713,5 | 471,4±326,3 |
| sIL-6R, пг/мл | 8411,4±1864,3 | 8678,3±1545,8 |
| IL-1, пг/мл | 5,4±14,2 | 6±13,8 |
| IL-6, пг/мл | 98±162* | 15,8±36,5* |
| IL-17, пг/мл | 362,7±1184,7 | 190,7±793,3 |
| IL-10, пг/мл | 25,7±45,8 | 22,2±33,1 |
| IL-4, пг/мл | 66,9±207,7 | 73,2±262,9 |
| IL-8, пг/мл | 27,6±83,7 | 20,8±63,6 |
| IFN-γ, пг/мл | 7,5±10,2 | 16,3±57,1 |
| TNF, пг/мл | 13,6±24,1 | 31,8±102,2 |
| IL-1Ra, пг/мл | 7698,6±13109,2* | 2426,7±3576,8* |
| sTNF-R1, пг/мл | 3947,6±5090 | 1800,4±898,4 |
У групі хворих із рефрактерним перебігом ЮІА, порівняно з групою хворих на нерефрактерний ЮІА, достовірно зростали, окрім IL-6, також sCD25, IL-1Ra, sTNF-R1. Це стало підставою вважати цитокіни sCD25, IL-6, IL-1Ra, sTNF-R1 маркерами прогностично несприятливого перебігу ЮІА. Дослідження цих цитокінів у дебюті захворювання та в динаміці хвороби дає змогу прогнозувати подальший перебіг захворювання та дає можливість вчасно вибрати обсяг терапевтичного втручання.
Ступінь активності захворювання у пацієнтів із рефрактерним ЮІА корелював із ШОЕ, тромбоцитами та sCD25, IL-6, sTNF-R1 (рис. 3–7).
Нами вивчалися корелятивні асоціації між цитокінами sCD25, IL-6, IL-1Ra, sTNF-R1. Виявлений прямий корелятивний зв’язок sCD25 із цитокінами IL-6, sTNF-R1 (рис. 8, 9) та прямий корелятивний зв’язок IL-1Ra із рівнем IL-6 (рис. 10).
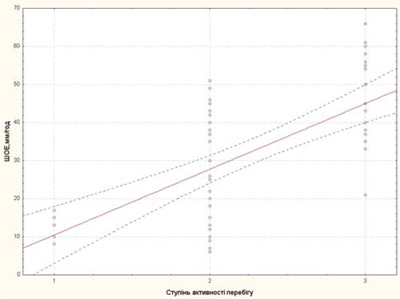
Рис. 3. Залежність рівня ШОЕ від ступеня активності перебігу хвороби у пацієнтів із рефрактерним ЮІА: 1 — низька активність; 2 — середня активність; 3 — висока активність
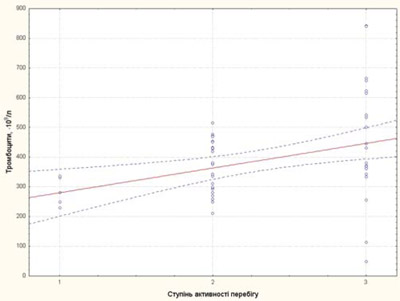
Рис. 4. Залежність рівня тромбоцитів від ступеня активності перебігу хвороби у пацієнтів із рефрактерним ЮІА: 1 — низька активність; 2 — середня активність; 3 — висока активність
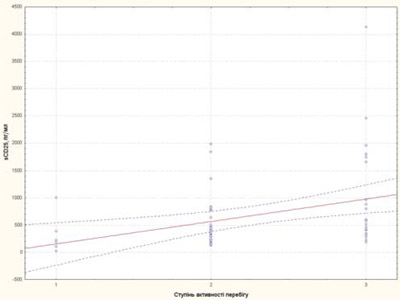
Рис. 5. Залежність рівня sCD25 від ступеня активності перебігу хвороби у пацієнтів із рефрактерним ЮІА: 1 — низька активність; 2 — середня активність; 3 — висока активність
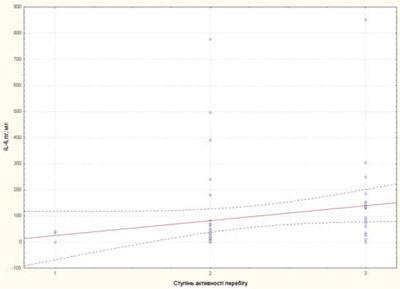
Рис. 6. Залежність рівня IL-6 від ступеня активності перебігу хвороби у пацієнтів із рефрактерним ЮІА: 1 — низька активність; 2 — середня активність; 3 — висока активність
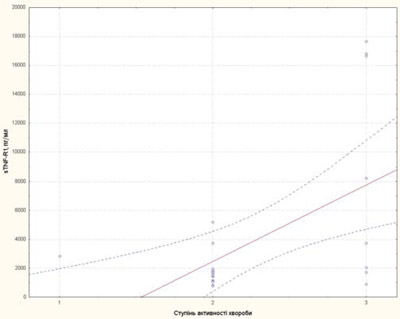
Рис. 7. Залежність рівня sTNF-R1 від ступеня активності перебігу хвороби у пацієнтів із рефрактерним ЮІА: 1 — низька активність; 2 — середня активність; 3 — висока активність
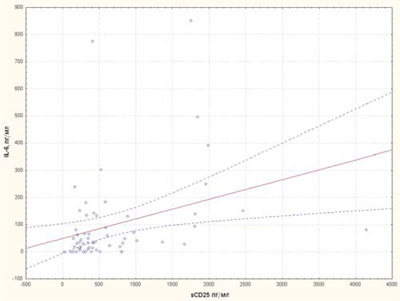
Рис. 8. Кореляційна залежність між рівнями sCD25 та IL-6 у хворих на рефрактерний ЮІА
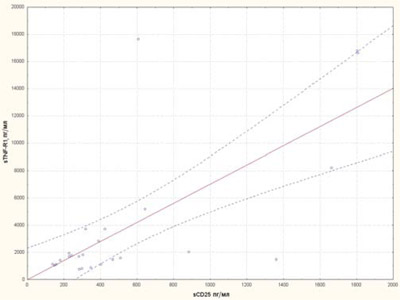
Рис. 9. Кореляційна залежність між рівнями sTNF-R1 та sCD25 у хворих на рефрактерний ЮІА
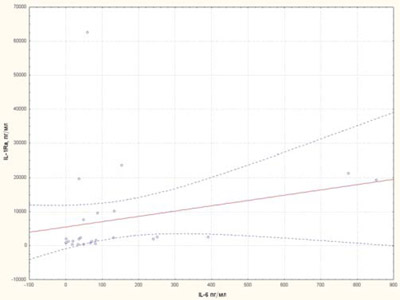
Рис. 10. Кореляційна залежність між рівнями IL-1Ra та IL-6 у хворих на рефрактерний ЮІА
Результати проведених нами досліджень зіставні з дослідженнями австрійського вченого H. Mangge, який рекомендує використовувати sTNF-R1 та sIL-2R (sCD25) для клінічного моніторингу, оскільки ці цитокіни є найбільш чутливими маркерами активності запального процесу при ЮІА [10]. У дослідженнях, проведених K. Muller, рівень sCD25 корелював із параметрами клінічної активності ЮІА, включаючи функціональний стан хворого, та з рівнем ШОЕ [8]. У роботі P. Gattorno показано, що рівні sTNFRp55 і sTNFRp75 корелюють із показниками клінічної активності, а також із ШОЕ, СРБ, IL-6, а це давало підставу авторам вважати sTNFRp55 і sTNFRp75 маркерами активності процесу у хворих на ЮІА [11]. В опублікованих дослідженнях виявлена пряма кореляція sTNF-R1 з такими маркерами лабораторної активності, як ШОЕ, СРБ, IL-6, гемоглобін [11]. Ці результати збігаються з отриманими у нашому дослідженні даними і можуть мати в подальшому важливе практичне втілення для моніторингу активності запального процесу та для визначення прогностичних факторів перебігу ЮІА.
Отримані результати свідчать, що вибір лікування у пацієнтів із ЮІА у дебюті хвороби слід проводити, ґрунтуючись на визначенні кількості клінічних прогностично несприятливих критеріїв і на результатах дослідження цитокінових маркерів несприятливого прогнозу хворих на ЮІА, якими є sCD25, IL-6, IL-1Ra, sTNF-R1.
Висновки
1. У 30% хворих на ЮІА не отримано відповіді на терапію метотрексатом впродовж перших 6 міс лікування. Рефрактерний перебіг ЮІА найчастіше відзначають у хворих із системними проявами ЮІА в дебюті. У 37% осіб із поліартикулярним перебігом ЮІА та у 22% хворих на ентезитасоційований ЮІА спостерігали рефрактерний перебіг ЮІА. Лише у 8% пацієнтів із олігоартикулярним варіантом ЮІА відзначали рефрактерний характер захворювання.
2. У хворих на ЮІА, які мають ≥2 несприятливих клінічних критеріїв перебігу у дебюті хвороби, визначених за критеріями T. Beukelman (2011), є достовірно вищим ризик розвитку рефрактерного перебігу ЮІА.
3. Дослідження рівня sCD25, IL-6, IL-1Ra, sTNF-R1 доцільно використовувати для визначення прогнозу ЮІА.
4. Кількість пошкоджених суглобів корелює з рівнями sCD25, IL-6.
Список використаної літератури
- Beukelman T., Patkar N.M., Saag K.G. et al. (2011) American college of rheumatology recommendations for the treatment juvenile idiopathic arthritis: initiation and safety monitoring of therapeutic. Arthr. Care Res. (Hoboken), 63(4): 465–482.
- Ou L.S., See L.C., Wu C.J. et al. (2002) Association between serum inflammatory cytokines and disease activity int juvenile idiopathic arthritis. Clin. Rheumatol., 21(1): 52–56.
- Albers H.M., Brinkman D.M., Kamphuis S.S. et al. (2010) Clinical course and prognostic value of disease activity in the first two years in different subtypes of juvenile idiopathic arthritis. Arthr. Care Res. (Hoboken), 62(2): 204–212.
- De Benedetti F., Martini А. (1998) Is systemic juvenile rheumatoid arthritis an interleukin-6 mediated disease? J. Rheumatol., 25: 203–207.
- De Benedetti F., Martini А. (2005) Targeting in the Interleukin-6 Receptor: A new treatment for systemic juvenile idiopathic arthritis? Arthr. Rheum., 52: 687–693.
- Rooney M., David J., Symons J. et al. (1995) Inflammatory cytokine responses in juvenile chronic arthritis. Br. J. Rheumatol., 34(5): 454–460.
- Petty R.E., Southwood T.R., Manners P. et al. (2004) International League of Associations for Rheumatology classification of juvenILe idiopathic arthritis: second revision, Edmonton, International League of Associations for Rheumatology. J. Rheumatol., 31(2): 390–392.
- Muller K., Karup Pedersen F., Wiik A. et al. (1992) Lymphokines and soluble interleukin-2 receptors in juvenile chronic arthritis. Rheumatol. Int.,12: 89–92.
- Prieur A.M., Chèdeville G. (2001) Prognostic factors in juvenile idiopathic arthritis. Curr. Rheumatol. Rep., 3(5): 371–378.
- Mangge H., Kenzian H., Gallistl S. et al. (1995) Serum cytokines in juvenile rheumatoid arthritis: correlation with conventional inflammation parameters and clinical subtypes. Arthr. Rheum., 38 (2): 211–220.
- Gattorno M., Picco P., Buoncompagni A. et al. (1996) Serum p55 and p75 tumour necrosis factor receptors as markers of disease activity in juvenile chronic arthritis. Ann. Rheum. Dis., 55(4): 243–247.
- Yokota Sh., Miyamae T., Imagawa T. et al. (2005) Therapeutic efficacy of humanized anti-interleukin-6 receptor antibody in children with systemic-onset juvenile idiopathic arthritis. Arthr. Rheum., 52: 818–825.
- Albers H.M., Wessels J.A.M., van Der Straaten R.J.H.M. et al. (2009) Time to Treatment as an Important Factor for the Response to Methotrexate in Juvenile Idiopathic Arthritis. Arthr. Rheum. (Arthr. Care & Research), 61(1): 46–51.
Цитокиновые маркеры и прогностические факторы неблагоприятного течения ювенильного идиопатического артрита
Резюме. Проведено исследование уровней цитокинов у больных с рефрактерным течением ювенильного идиопатического артрита (ЮИА) с целью определения цитокиновых маркеров неблагоприятного прогноза ЮИА. Выбор лечения больных ЮИА следует проводить, основываясь на количестве клинических прогностически неблагоприятных критериев, а также на результатах исследования цитокиновых маркеров неблагоприятного прогноза у больных ЮИА, как sCD25, интерлейкин (IL)-6 и -1Ra, растворимый рецептор фактора некроза опухоли (sTNF-R1).
ювенильный артрит, цитокины, прогноз.
Адреса для листуванння:
Бойко Ярина Євгенівна
79035, Львів, вул. Дністерська, 27
Комунальний заклад Львівської обласної ради
«Західноукраїнський спеціалізований
дитячий медичний центр»
Е-mail: jboyko@ukr.net

Leave a comment