ЦИТОКІНОВІ МАРКЕРИ АКТИВНОСТІ ЮВЕНІЛЬНОГО ІДІОПАТИЧНОГО АРТРИТУ
- 1Львівський державний медичний університет
- 2Комунальний заклад Львівської обласної ради «Західноукраїнський спеціалізований дитячий медичний центр», Львів
Резюме. Проведено порівняння рівнів цитокінів у хворих на ювенільний ідіопатичний артрит (ЮІА) з різними ступенями активності з рівнями цитокінів у них у період ремісії. Результати дослідження свідчать, що чутливими маркерами активності захворювання є інтерлейкін (IL)-6, розчинний рецептор фактора некрозу пухлини (sTNF-1R) та sCD25, які можна використовувати для моніторингу за активністю ЮІА.
Вступ
Одним із найтяжчих автоімунних захворювань дитячого віку є ювенільний ідіопатичний артрит (ЮІА) — хронічне запальне захворювання із пошкодженням суглобів, що має різні клінічні варіанти перебігу та різний прогноз [13]. Визначення показників активності є фундаментальною складовою клінічного обстеження пацієнтів із ЮІА, оскільки наявність активності захворювання зумовлює пошкодження суглобів із розвитком подальшої функціональної інвалідності хворих. Контроль активності запального процесу та досягнення ремісії хвороби — основна мета лікування хворих на ЮІА. Вибір і моніторинг терапії пацієнтів із ЮІА проводиться з огляду на показники активності захворювання. Існують різні інструменти для визначення активності ЮІА, які включають клінічні шкали оцінки загального стану хворого, на думку лікаря і пацієнта (батьків), шкалу оцінки болю, опитувальники функціонального стану пацієнта та лабораторні показники визначення гострофазової активності хвороби [3]. Лабораторні маркери запального процесу мають відображати ступінь його активності та уможливлювати прогноз перебігу захворювання і виявлення пацієнтів зі схильністю до тяжчого перебігу хвороби. Для лабораторного визначення активності запального процесу зазвичай використовують швидкість осідання еритроцитів (ШОЕ) та С-реактивний білок (СРБ) [7]. Однак дослідження E.H. Giannini, E.J. Brewer свідчать, що ШОЕ є відносно нечутливим індикатором активності при ЮІА та не відображає зміни активності запального процесу [4]. Проводять пошук чутливих біомаркерів для здійснення моніторингу за ревматичним захворюванням у хворих на ЮІА, які реагують на зміну активності запального процесу. Лабораторними кандидатами на біомаркери запального процесу у хворих на ЮІА є ферменти (наприклад матрична металопротеїназа) [9], автоімунні епіфеномени (тобто антициклічний цитруліновий пептид) [13], а також цитокіни. Відомо, що цитокіни є біологічно активними речовинами, що відіграють головну роль у патогенезі ЮІА, тому можуть відображати активність запального процесу у хворих на ЮІА.
Мета роботи — виявити зв’язок між рівнями цитокінів і клінічними показниками активності ЮІА.
Об’єкти та методи дослідження
У Західноукраїнському спеціалізованому дитячому медичному центрі впродовж останніх 4 років під динамічним спостереженням перебували 105 хворих на ЮІА із середнім віком на момент обстеження 11,8 року, з них 53 дівчинки та 52 хлопчики. Варіант перебігу ЮІА визначали за критеріями ILAR, Durban,1997, Edmonton, 2001 [6]. Верифікованими були такі варіанти перебігу захворювання: системний варіант у 16 (15%) пацієнтів, поліартрит із від’ємним ревматоїдним фактором — у 19 (18%), поліартрит із позитивним ревматоїдним фактором — у 2 (2%), олігоартрит — у 38 (36%), ентезит-артрит — у 27 (26%), псоріатичний артрит — у 3 (3%) осіб.
У проведене дослідження були включені хворі із системним перебігом ЮІА, пацієнти з олігоартикулярним ЮІА, діти з поліартикулярним варіантом із від’ємним ревматоїдним фактором та хворі на ЮІА, ентезит-артрит. Аналіз рівня цитокінів у хворих на ЮІА, поліартрит із позитивним ревматоїдним фактором та на ЮІА, псоріатичний артрит не проводили у зв’язку з невеликою кількістю обстежених пацієнтів.
Проведено визначення рівнів цитокінів та їх рецепторів і антагоністів у пацієнтів із ЮІА з різними ступенями активності захворювання та в період ремісії. Залежно від ступеня активності ревматичного захворювання були сформовані чотири групи хворих на ЮІА. До 1-ї, 2-ї, 3-ї групи увійшли хворі із запальним процесом низького, середнього, високого ступеня активності відповідно. До 4-ї групи увійшли пацієнти із ЮІА у період ремісії хвороби.
Сироватку крові цих хворих відбирали у різні періоди захворювання та заморожували при температурі –70 °C до моменту одноденного проведення дослідження рівнів усіх цитокінів. Проведено дослідження рівнів цитокінів (інтерлейкін (IL)-1β, IL-4, IL-6, IL-8, IL-10, IL-17 та інтерферон (IFN)-γ,) та їхніх розчинних рецепторів і антагоністів: антагоніста рецептора IL-1 (IL-1Ra), розчинного рецептора IL-2 (sCD25), розчинного рецептора IL-6 (soluble — sIL-6R), розчинного рецептора фактора некрозу пухлини (sTNF-R1). Дослідження цитокінів проводили імуноферментним методом у лабораторії імунології ДУ «Інститут педіатрії, акушерства і гінекології НАМН України», яку очолює професор В.П. Чернишов. Використовували комерційні тест-системи «BD Biosciences Pharmingen», Сан-Дієго, США. До контрольної групи входить 21 здорова дитина.
Статистичну оцінку отриманих даних виконували за допомогою пакета «STATISTIC 8.0». Для оцінки різниці між двома незалежними вибірками використовували U-критерій Манна — Уітні, який не потребує перевірки на нормальність розподілу і придатний для порівняння невеликих вибірок. Для з’ясування корелятивних зв’язків визначали рангову кореляцію (критерій Спірмена), що використовується, коли закон розподілу змінних невідомий або не є нормальним.
Результати дослідження та їх обговорення
У пацієнтів із ЮІА розподіл за ступенем активності захворювання проводили з огляду на варіант перебігу захворювання (табл. 1–4). Поділ на ступені активності проведено згідно з рекомендаціями T. Beukelman, 2011 [1].
Таблиця 1. Ступені активності захворювання на ЮІА, олігоартикулярний варіант
Низька активність (мають задовольнятися всі критерії)
Середня активність (не задовольняє критерії низької чи високої активності)
Висока активність (мають задовольнятися щонайменше 3 критерії)
|
Таблиця 2. Ступені активності захворювання на ЮІА, поліартикулярний варіант
Низька активність (мають задовольнятися всі критерії)
Середня активність (не задовольняє критерії низької чи високої активності)
Висока активність (мають задовольнятися щонайменше 3 критерії)
|
Таблиця 3. Ступені активності захворювання на ЮІА, ентезит-артрит
Низька активність (мають задовольнятися всі критерії)
Середня активність (не задовольняє критерії низької чи високої активності)
Висока активність (мають задовольнятися щонайменше 2 критерії)
|
Таблиця 4. Ступені активності захворювання на системний ЮІА з наявністю активного артриту
Низька активність (мають задовольнятися всі критерії)
Середня активність (не задовольняє критеріїм низької чи високої активності)
Висока активність (мають задовольнятися щонайменше 3 критерії)
|
Проведено порівняння рівнів цитокінів хворих на ЮІА у період активності з показниками контрольної групи та рівнів цитокінів у хворих на ЮІА з різними ступенями активності з рівнями цитокінів у цих осіб у періоді ремісії хвороби (табл. 5–7).
Таблиця 5. Рівень цитокінів у хворих на ЮІА в період активності та у дітей контрольної групи
| Цитокіни, пг/мл | Хворі на ЮРА в період активності | Контрольна група |
| sCD25 | 559,6±535,6 | 407,3±258,2 |
| sIL-6R | 8565,8±1692,6 | 8470,7±1183,7 |
| IL-1β | 5,8±14,0 | 1,2±0,5 |
| IL-6 | 50,4±116,1* | 1,8±4,4 |
| IL-17 | 260,7±975,5 | 4,3±12,4 |
| IL-10 | 23,7±39* | 45,8±49,5 |
| IL-4 | 70,5±241,2 | 6,6±15,2 |
| IL-8 | 23,7±72,9 | 8,1±14,6 |
| IFN-γ | 12,6±44,1 | 2,9±4,2 |
| TNF | 24,1±79,8* | 2,3±6,8 |
| IL-1Ra | 4673,7±9348 | 1155,5±789,0 |
| sTNF-R1 | 2895,9±3842,7* | 680,4±428,0 |
*р<0,05 — достовірне порівняно з контрольною групою.
Таблиця 6. Рівень цитокінів, показників гемограми та СРБ у хворих на ЮІА в період активності й у період ремісії ЮІА
| Цитокіни, показники гемограми та СРБ | Хворі на ЮІА в період | |
|
активності ремісії |
||
| sCD25, пг/мл | 559,6±535,6 | 433,4±269,2 |
| sIL-6R, пг/мл | 8565,8±1692,6 | 8385±1062,3 |
| IL-1β, пг/мл | 5,8±14,0 | 12,3±38,3 |
| IL-6, пг/мл | 50,4±116,1 | 18,1±25,7 |
| IL-17, пг/мл | 260,7±975,5 | 228,6±806,8 |
| IL-10, пг/мл | 23,7±39,0* | 19,6±26,9 |
| IL-4, пг/мл | 70,5±241,2 | 109,3±382,6 |
| IL-8, пг/мл | 23,7±72,9 | 37,9±70,9 |
| IFN-γ, пг/мл | 12,6±44,1 | 12,2±29,4 |
| TNF, пг/мл | 24,1±79,8 | 69,5±248,2 |
| IL-1Ra, пг/мл | 4673,7±9348 | 1731±1332,2 |
| sTNF-R1, пг/мл | 2895,9±3842,7* | 1242,3±539,9 |
| ШОЕ | 22,9±16,6* | 8,7±5,2 |
| Лейкоцити | 9,0±5,5* | 6,6±1,8 |
| Тромбоцити | 319,1±118,0* | 253,8±34,8 |
| Гемоглобін | 112,2±19,2* | 122,1±14,9 |
| СРБ | 0,6±0,9* | 0,1±0,4 |
*р<0,05 порівняно з групою хворих на ЮІА у період ремісії.
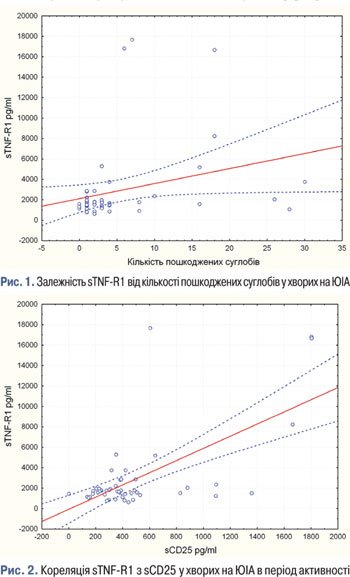
У результаті проведених досліджень виявлено, що у пацієнтів з усіма варіантами перебігу ЮІА в період активності хвороби достовірно зростає рівень sTNF-R1, ШОЕ, лейкоцитів та СРБ порівняно з групою хворих на ЮІА, що перебувають у ремісії (див. табл. 6). Достовірної різниці між рівнями TNF, IL-1β, IL-4, IL-6, IL-8, sIL-6R, IL-10, IL-17, IFN-γ, IL-1Ra, sCD25 при порівнянні груп хворих на ЮІА в період активності та ремісії не виявлено. Проведені дослідження показали пряму залежність sTNF-R1 від кількості пошкоджених суглобів (рис. 1) у хворих на ЮІА. Також встановлено пряму кореляцію sTNF-R1 з рівнем sCD25 (рис. 2). У проведеному нами дослідженні не виявлено кореляції sTNF-R1 з іншими лабораторними маркерами активності ЮІА, зокрема ШОЕ та СРБ. Однак в опублікованих дослідженнях виявляли пряму кореляцію sTNF-R1 з такими маркерами лабораторної активності, як ШОЕ, СРБ, IL-6, гемоглобін [12]. У ряді робіт обґрунтовано, що моніторингове визначення sTNF-R1 є більш чутливим маркером активності хвороби порівняно з визначенням інших цитокінів та СРБ [11]. Ці результати зіставні з отриманими у нашому дослідженні даними і можуть мати в подальшому важливе практичне значення для моніторингу активності запального процесу у хворих на ЮІА.
У роботі не виявлено зв’язку TNF зі ступенем активності у хворих на ЮІА. Однак цілком протилежні результати отримано у роботі N. Kutukculer [8]. Ці дослідження виявляли підвищення рівня TNF та IL-6 у плазмі крові хворих на ЮІА в період активності, які, на думку авторів, могли би слугувати маркерами активності ЮІА [8]. У роботі P. Gattorno вивчали рівні TNF, sTNFRp55 і sTNFRp75 у сироватці крові та синовіальній рідині хворих на ЮІА. Однак не виявлено кореляції TNF з іншими параметрами активності. Показано, що рівні sTNFRp55 і sTNFRp75 корелювали з показниками клінічної активності, ШОЕ, СРБ, IL-6, а це давало підстави авторам вважати sTNFRp55 і sTNFRp75 маркерами активності процесу [12].
Крім цього, ми вивчали зв’язок рівнів цитокінів трьох ступенів активності ЮІА порівняно з показниками у цих хворих у період ремісії.
У хворих із низьким ступенем активності ЮІА виявлено достовірне підвищення рівнів sTNF-R1, IL-6, ШОЕ порівняно з групою осіб із ЮІА, які перебувають у ремісії хвороби (див. табл. 7).
Таблиця 7. Рівень цитокінів, показників гемограми та СРБ у хворих на ЮІА з різними ступенями активності та в період ремісії ЮІА
| Цитокіни, показники гемограми та СРБ |
Хворі на ЮІА в період активності |
Хворі на ЮІА в період ремісії |
||
|
низької |
середньої |
високої |
||
| sCD25, пг/мл | 410,2±294,1 | 554,1±424,5 | 977,7±909,3* | 433,4±269,2 |
| sIL-6R, пг/мл | 8724,6±1605,2 | 8414±1503,7 | 8461,7±2196,5 | 8385±1062,3 |
| IL-1β, пг/мл | 6,2±14,5 | 5,6±14,3 | 5±11,5 | 12,3±38,3 |
| IL-6, пг/мл | 13,8±38,6* | 60,3±132,6* | 128,8±165,1* | 18,1±25,7 |
| IL-17, пг/мл | 220,5±871,1 | 146,5±494,2 | 666,4±1755,1 | 228,6±806,8 |
| IL-10**, пг/мл | 24,8±36,9 | 21,2±38,8 | 26±44,4 | 19,6±26,9 |
| IL-4, пг/мл | 57±182,2 | 95,9±327,1 | 52,6±135,9 | 109,3±382,6 |
| IL-8, пг/мл | 21,1±68,5 | 24,4±72,7 | 29,2±83,7 | 37,9±70,9 |
| IFN-γ, пг/мл | 17,6±63,3 | 9,0±13,3 | 6,7±6,4 | 12,2±29,4 |
| TNF, пг/мл | 23,1±78,4 | 27,6±95,6 | 19,6±30,8 | 69,5±248,2 |
| IL-1Ra, пг/мл | 2497,5±4927,4 | 3517,5±4634,1 | 11349,9±17164 | 1731±1332,2 |
| sTNF-R1, пг/мл | 2008,6±973,7* | 1683,3±972,4 | 8460,1±6961,4* | 1242,3±539,9 |
| ШОЕ | 11,2±6,8* | 26,9±13,8* | 46,3±11,6* | 8,7±5,2 |
| Лейкоцити | 7,9±6,9 | 8,9±2,0* | 12,4±5,2* | 6,6±1,8 |
| Тромбоцити | 258,3±47,1 | 338,5±80,7* | 443,1±187,9* | 253,8±34,8 |
| Гемоглобін | 122,4±14,1 | 110,7±12,7* | 88,0±20,0* | 122,1±14,9 |
| СРБ | 0,2±0,5 | 0,9±1,0* | 1,0±1,0* | 0,1±0,4 |
*р<0,05 порівняно з групою хворих на ЮІА у період ремісії.
У хворих із середнім ступенем активності ЮІА показано достовірне підвищення рівнів sTNF-R1, IL-6, лейкоцитів, ШОЕ порівняно з групою осіб із ЮІА у ремісії хвороби.
У хворих із високим ступенем активності ЮІА виявлено достовірне підвищення рівнів sCD25, sTNF-R1, IL-6, лейкоцитів, тромбоцитів та ШОЕ порівняно з групою пацієнтів із ЮІА у ремісії хвороби. Як бачимо, лише у хворих з високим ступенем активності ЮІА достовірно зростає рівень sCD25, що можна використовувати для прогнозування тяжкості хвороби у дітей з ЮІА.
Подібні дані знаходимо у дослідженнях інших авторів. Роль IL-6 у розвитку ЮІА добре вивчена. У дослідженнях L.S. Ou [2] виявлено, що у хворих з активним ЮІА підвищуються рівні IL-6, лейкоцитів, тромбоцитів, ШОЕ та СРБ у той час, коли не виявляється IL-1β. Автор вважає, що необхідно використовувати IL-6 для визначення ступеня активності ЮІА та для моніторингу за терапевтичною відповіддю [2]. Активно вивчається роль IL-6 у пацієнтів із системним ЮІА, при якому цей цитокін спричинює більшість клінічних проявів. M. Rooney продемонстрував зростання рівнів IL-6 і IL-1Ra у пацієнтів із системним ЮРА у період активності хвороби [5].
Результати наших досліджень збігаються з дослідженнями австрійського вченого H. Mangge, який рекомендує для клінічного моніторингу використовувати sTNF-R1, а в окремих випадках — sIL-2R (sCD25), які, на його думку, є більш чутливими маркерами активності ЮІА [11].
Як бачимо, у досліджуваних хворих рівень sCD25 достовірно зростав лише при високому ступені активності ЮІА. Однак у проведеному нами дослідженні не виявлено кореляції sCD25 з іншими параметрами активності ЮІА. У дослідженні K. Muller рівень sCD25 корелював із параметрами клінічної активності, включаючи функціональний стан і рівень ШОЕ [10]. Загалом можна бачити, що з підвищенням ступеня загострення ЮІА поширюється спектр цитокінів, рівень яких значно підвищується.
Проведені дослідження цитокінових маркерів активності запального процесу у хворих на ЮІА можуть стати підґрунтям для впровадження нових чутливих методів лабораторного моніторингу за активністю хвороби.
Висновки
1. Для проведення клінічного моніторингу за активністю ЮІА доцільно проводити визначення рівня ряду цитокінів, а саме IL-6, sTNF-R1та sCD25.
2. Чутливим маркером активності ЮІА є sTNF-R1, який підвищений у осіб з усіма варіантами перебігу ЮІА у період активності хвороби.
3. У хворих із середнім ступенем активності ЮІА виявлено підвищення IL-6 та sTNF-R1.
4. У пацієнтів із високим ступенем активності ЮІА виявлено підвищення IL-6, sTNF-R1 та sCD25. Підвищення рівня sCD25 у сироватці крові осіб із ЮІА є ознакою високого ступеня активності захворювання.
Список використаної літератури
- Beukelman T., Patkar N.M., Saag K.G. et al. (2011) American college of rheumatology recommendations for the treatment juvenile idiopatic arthritis: initiation and safety monitoring of therapeutic. Arthritis Care & Research., 63(4): 465–482.
- Ou L.S., See L.C., Wu C.J. et al. (2002) Association between serum inflammatory cytokines and disease activity int juvenile idiopathic arthritis. Clinical Rheumatology, 21(1): 52–56.
- Consolaro A., Ruperto N., Bazso A. et al. (2009) Development and Validation of a Composite Disease Activity Score for Juvenile Idiopathic Arthritis. Arthritis & Rheumatism (Arthritis Care & Research), 61(5): 658–666.
- Giannini E.H., Brewer E.J. (1987) Poor correlation between the erythrocyte sedimentation rate and clinical activity in juvenile rheumatoid arthritis. Clin. Rheumatol., 6(2): 97–201.
- Rooney M., David J., Symons J. et al. (1995) Inflammatory cytokine responses in juvenile chronic arthritis. Br. J. Rheumatol., 34(5): 454–460.
- Petty R.E., Southwood T.R., Manners P. et al. (2004) International League of Associations for Rheumatology classification of juvenile idiopathic arthritis: second revision, Edmonton, 2001. J. Rheumatol., 31(2): 390–392.
- Nordal E.B., Zak М., Berntson L. et al. (2011) Juvenile Arthritis Disease Activity Score (JADAS) based on CRP; validity and predictive ability in a Nordic population-based setting. Pediatric Rheumatology., 9(1): 155.
- Kutukculer N., Caglayan S., Aydogdu F. (1998) Study of pro-inflammatory (TNF-alpha, IL-1alpha, IL- 6) and T-cell-derived (IL-2, IL-4) cytokines in plasma and synovial fluid of patients with juvenile chronic arthritis: correlations with clinical and laboratory parameters. Clin Rheumatol., 17(4): 288–292.
- Viswanath V., Myles A., Dayal R. et al. (2011) Levels of Serum Matrix Metalloproteinase-3 Correlate with Disease Activity in the Enthesitis-related Arthritis Category of Juvenile Idiopathic Arthritis. J. Rheumatology, 38(11): 2482–2487.
- Muller K., Karup Pedersen F., Wiik A. et al. (1992) Lymphokines and soluble interleukin-2 receptors in juvenile chronic arthritis. Rheumatology International., 12: 89–92.
- Mangge H., Kenzian H., Gallistl S. et al. (1995) Serum cytokines in juvenile rheumatoid arthritis: correlation with conventional inflammation parameters and clinical subtypes. Arthritis & Rheumatism. 38(2): 211–220.
- Gattorno M., Picco P., Buoncompagni A. et al. (1996) Serum p55 and p75 tumour necrosis factor receptors as markers of disease activity in juvenile chronic arthritis. Ann. Rheum. Dis., 55(4): 243–247.
- Cassidy J.T., Petty R.E., Laxer R.M. et al. (2010) Textbook of pediatric rheumatology. Saunders Elsevier, Philadelphia, 6th edn.,794 p.
ЦИТОКИНОВЫЕ МАРКЕРЫ АКТИВНОСТИ ЮВЕНИЛЬНОГО ИДИОПАТИЧЕСКОГО АРТРИТА
Резюме. Проведено сравнение уровней цитокинов у больных ювенильным идиопатическим артритом (ЮИА) с различными степенями активности с уровнями цитокинов у них в период ремиссии. Результаты исследования свидетельствуют, что наиболее чувствительными маркерами активности заболевания являются интерлейкин (IL)-6, растворимый рецептор фактора некроза опухоли (sTNF-1R) и sCD25, которые можно использовать для мониторинга активности ЮИА.
ювенильный артрит, цитокины, активность болезни.
Адреса для листування:
Бойко Ярина Євгенівна
79035, Львів, вул. Дністерська, 27
Комунальний заклад Львівської обласної ради
«Західноукраїнський спеціалізований
дитячий медичний центр»
Е-mail: jboyko@ukr.net

Leave a comment