ЗАЛЕЖНІСТЬ ПОШИРЕНОСТІ РЕВМАТОЇДНОГО АРТРИТУ ВІД ЕКОЛОГІЧНИХ ЧИННИКІВ ЗОВНІШНЬОГО СЕРЕДОВИЩА
Синяченко О.В., Петренко Е.А. , Науменко Н.В., Гончар Г.А., Яковленко А.Ю.
Резюме. Поширеність ревматоїдного артриту в різних регіонах залежить від ступеня вираженості забруднення довкілля (повітря, ґрунту, води) ксенобіотиками, в тому числі крупними підприємствами металургійної, вугільної, хімічної та машинобудівної галузей промисловості, виробництва будівельних матеріалів, транспортом та сільським господарством, а інтегральний епідеміологічний показник розповсюдженості визначається сумарним рівнем в атмосфері аміаку й фенолу, ступенем мінералізації питної води та концентрацією в ній сульфатів, рівнем у ґрунті та ґрунтових водах таких токсичних мікроелементів, як барій, вісмут, олово, літій і титан, а також есенціальних (марганець, цинк).
Введение
Ревматоидный артрит (РА) — одно из наиболее частых воспалительных заболеваний суставов, наносящее огромный социально-экономический вред больным и государству в целом (Коваленко В.М. та співавт., 2008; Ngian G.S., 2010; Scott D.L. et al., 2010). В различных регионах земного шара распространенность РА составляет около 1% взрослого населения, причем число таких больных ежегодно увеличивается даже в странах с относительно низкой распространенностью болезни (Hakoda M., 2007). Это же касается и Украины (Борткевич О.П., Білявська Ю.В., 2008).
В течение последних лет началось обсуждение возможной связи развития и особенностей последующего течения РА с неблагоприятными факторами окружающей среды (Синяченко О.В., 2007; Holmberg S. et al., 2004; Proffitt F., Bagla P., 2009). Роль загрязняющих экологических агентов (ксенобиотиков) в развитии данного заболевания рассматривается в рамках отдельного научного направления — «геоэпидемиологии» (Shapira Y. et al., 2010; Toboіn G.J. et al., 2010). В настоящее время во многих странах обсуждается взаимодействие экологических и генетических составляющих патогенетических построений ревматоидного процесса (Engelman C.D. et al., 2009; Oliver J.E., Silman A.J., 2009; Adams D.D. et al., 2010; Trenkmann M. et al., 2010).
Гипотетически, распространенность РА определяется именно экологической ситуацией в том или ином регионе (Carmona L. et al., 2010; Markatseli T.E. et al., 2010). По данным R. Meziani и соавторов (2011), от ряда экологических составляющих проживания больных РА зависит дальнейший прогноз заболевания. Считается, что определение влияния неблагоприятных экологических факторов окружающей среды на организм больных РА будет способствовать пониманию новых звеньев патогенеза заболевания. Целью и задачами данной работы стали оценка распространенности РА в зависимости от степени развития в регионах отдельных отраслей промышленности, транспорта и сельского хозяйства, уровня загрязнения ксенобиотиками воздуха, почвы, питьевой и грунтовых вод, а также от содержания токсичных и эссенциальных микроэлементов (МЭ) в зонах проживания людей.
Объект и методы исследования
В Донецкой области сконцентрировано около 2000 промышленных предприятий черной и цветной металлургии, угледобывающей, химической (коксохимической), машиностроительной и других отраслей промышленности, а суммарная техногенная антропогенная нагрузка на единицу территории вчетверо выше средней по государству. Вот почему Донецкую область можно считать некой моделью оценки влияния неблагоприятной экологической ситуации на здоровье человека в целом и распространенность РА, в частности.
Гигиеническая оценка антропогенного загрязнения окружающей среды проводилась на основании определения ксенобиотиков в четырех ее объектах — атмосферном воздухе, почве, воде поверхностных водоемов и подземных водоисточников. Данные получены в результате лабораторных исследований санитарно-гигиенических станций, региональных отделений Государственных комитетов по гидрометеорологии, контролю природной среды и экологической безопасности. В почве 33 регионов Донецкой области исследованы уровни 16 МЭ, а в подземных водах — 8.
Оценивали интегральные показатели неблагоприятной экологической нагрузки на атмосферу (Q), воду (R) и почву (S) регионов. Все перечисленные показатели сравнивали с распространенностью РА (F) на 10 тыс. населения и с интегральным эпидемиологическим критерием в регионе (G), который подсчитывали по формуле:
G = 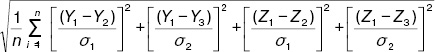 ,
,
где G — интегральный эпидемиологический критерий распространенности и заболеваемости РА в Донецком регионе (о.е.), Y1 — распространенность РА (показатель в Донецком регионе), Y2 — распространенность РА (среднегосударственный показатель), Y3 — распространенность РА (среднеобластной показатель), Z1 — заболеваемость РА (показатель в Донецком регионе), Z2 — заболеваемость РА (среднегосударственный показатель), Z3 — заболеваемость РА (среднеобластной показатель), s1 — среднеквадратическое отклонение государственного показателя, s2 — среднеквадратическое отклонение областного показателя, n — число критериев (4).
Уровень выбросов в атмосфере на площадь территории за год составляет 9683,6±598,62 т/км, на 1 больного РА человека — 1474,4±85,15 кг, соответственно показатели накопления промышленных отходов — 993,7±54,46 т/км и 738,8±34,72 т. Средняя структура выбросов в атмосферу в Донецком регионе, где проживали обследованные больные РА, следующая: металлургическая промышленность — 16,0±1,55%, угледобывающая — 35,5±2,08%, химическая — 4,2±0,43%, машиностроительная — 5,5±0,83%, энергетика — 17,6±1,93%, производство строительных материалов — 11,7±1,38%, автомобильный транспорт — 3,2±0,73%, сельское хозяйство — 2,8±0,65%. Интегральная степень загрязнения атмосферного воздуха (Q) была равна 1,04±0,031 у.е., питьевой и грунтовых вод (R) — 0,83±0,020 у.е., почвы (S) — 0,83±0,021 у.е. Первые два показателя в городах были достоверно выше, чем в сельских районах, соответственно на 58 и на 29%, а третий экологический параметр — на 21% ниже. Уровень нагрузки выбросов в атмосферу на площадь территории в городах превышал в 23,2 раза, на больного — в 9,1 раза, накоплений промышленных отходов — в 9,0 раз и 7,1 раза соответственно (все p<0,001).
Статистическая обработка полученных результатов исследований проведена с помощью компьютерного вариационного, корреляционного, одно- (ANOVA) и многофакторного (ANOVA/MANOVA) дисперсионного анализа (программы «Microsoft Excel» и «Statistica-Stat-Soft», США). Оценивали средние значения (M), их ошибки (m), среднеквадратические отклонения (s), коэффициенты корреляции (r), критерии дисперсии (D), Стьюдента (t), Уилкоксона — Рао (WR), χ Макнемара — Фишера и достоверность статистических показателей (р).
Результаты исследований и их обсуждение
По Донецкой области F составила 16,5±0,33 человека на 10 тыс. населения, заболеваемость — 1,1±0,03 о.е., а интегральный критерий G — 1,7±0,01 о.е. Увеличение G (>2 о.е.) констатировано в регионах, где проживали 5,1% больных РА. По данным дисперсионного анализа все три экологических показателя (Q, R, S) высокодостоверно влияют на F независимо от места проживания больных. В свою очередь, среди горожан на G не оказывает воздействия R, а среди представителей сельских районов G не зависит от S (табл. 1).
| Группаобследованных | Показатель | Влияние на эпидемиологические показатели (p D) | Корреляции с эпидемиологическими показателями (p r) | ||
|---|---|---|---|---|---|
| F | G | F | G | ||
| Всенаселение | QR
S |
<0,001<0,001
<0,001 |
0,1490,465
0,688 |
↓<0,001↑<0,001
↑0,020 |
↑0,007↓0,001
↑0,230 |
| Городскоенаселение | QR
S |
<0,001<0,001
<0,001 |
0,0270,085
0,030 |
↓<0,001↑<0,001
↓0,663 |
↑0,029↓<0,001
↑0,001 |
| Сельскоенаселение | QR
S |
<0,001<0,001
<0,001 |
0,0010,031
0,593 |
↑0,670↑<0,001
↑0,103 |
↑<0,001↓0,586
↓0,928 |
Показатели F у жителей городов обратно коррелируют с Q и прямо с R, тогда как в сельских районах наблюдается только позитивная корреляционная связь между F и R. Необходимо отметить, что среди городов G достоверно коррелирует и с Q, и c R, и c S, a среди сельских районов — лишь с Q.
Как свидетельствует ANOVA, на параметры G влияет степень нагрузки на атмосферу региона выбросов металлургической и химической отраслей промышленности. Результаты корреляционного анализа демонстрируют прямую связь G с деятельностью угледобывающей промышленности, с развитием энергетики и с производством строительных материалов. G зависит от нагрузки выбросов промышленных предприятий как на площадь территории, где проживают больные, так и на 1 пациента, а уровень накопления промышленных отходов определяет в первую очередь только нагрузку на отдельного больного. F РА тесно связана со всеми изученными ксенобиотиками, находящимися в атмосфере, а достоверная корреляция с их уровнем не касается только аммиака и диоксида азота. На G воздействуют концентрации в воздухе зон проживания больных аммиака, 3,4-бензпирена, диоксида углерода, оксида углерода, сероводорода и фенола, а достоверные корреляционные связи относятся к содержанию аммиака и фенола.
Значения распространенности РА F не связаны с параметрами в питьевой воде нитратов и аммонийных фосфатов. В свою очередь, на G влияют концентрации сульфатов и фосфатов (табл. 2), о чем свидетельствует дисперсионный анализ, а корреляционные (разнонаправленные) связи отмечаются с показателями минерализации воды (обратная) и содержания в ней сульфатов (прямая). Следовательно, высокий уровень солей сульфатов в питьевой воде способствует распространению в том или ином городе и районе РА.
| Объект | Показатель | Связь с показателем G | |||
|---|---|---|---|---|---|
| влияние на G | корреляции с G | ||||
| D | p D | r | p r | ||
| Воздух | АммиакБензпирен
Диоксид азота Диоксид серы Диоксид углерода Оксид углерода Сероводород Фенол |
8,0210,44
0,58 0,74 12,26 14,87 13,67 4,87 |
0,0050,001
0,446 0,390 0,001 <0,001 <0,001 0,028 |
↑0,242↓0,025
↑0,081 ↑0,014 ↑0,028 ↑0,108 ↓0,059 ↑0,163 |
<0,0010,673
0,165 0,818 0,636 0,066 0,316 0,005 |
| Вода | МинерализацияЖесткость
Хлориды Сульфаты Нитраты Фосфаты |
1,693,46
2,73 4,07 0,11 5,36 |
0,1950,064
0,100 0,045 0,741 0,021 |
↓0,144↓0,096
↓0,010 ↑0,165 ↑0,069 ↑0,075 |
0,0140,100
0,863 0,005 0,237 0,198 |
Как видно на рис. 1, показатели F РА в регионах с высокими предельно допустимыми концентрациями (ПДК) в атмосфере достоверно ниже, чем в остальных. Зависимость F от загрязнения воздуха ксенобиотиками в большей степени свойственна сельским районам. Параметры F РА повышены в регионах Донецкой области с высокой минерализацией питьевой воды и с уровнем в ней сульфатов.
Показатели G во многом зависят от ксенобиотического состава атмосферы и воды, что представлено на рис. 1. В случаях превышения ПДК в в оздухе диоксида серы достоверно снижаются значения G и сероводорода, но при этом в формировании РА «не участвуют» концентрации 3,4-бензпирена, оксида углерода, фенола и сульфатов. G в отношении ПДК аммиака не снижается, а повышается, снижается в связи с диоксидом азота и аммонийных фосфатов.
На параметры G влияют уровни в почве зон проживания больных РА таких токсичных МЭ, как Ba, Bi, Li и Sn, а также эссенциальных Cr и V, о чем свидетельствуют результаты выполненного однофакторного дисперсионного анализа. Показатели G прямо коррелируют с содержанием в почве Bi, Sn и Ti, а обратно — с концентрациями Ba, Co и Mo (рис. 2). Таким образом, наиболее влиятельными в отношении G являются уровни в почве токсичных Ba, Bi и Sn.
На G оказывают достоверное воздействие показатели в грунтовых водах Li, Mn, Ti и Zn, с которыми имеют место обратные корреляционные связи. Кроме того, наблюдается прямая корреляция G c Cu и Pb. Следовательно, повышение в грунтовых водах Li, Mn, Ti и Zn способствует уменьшению G РА или наоборот.
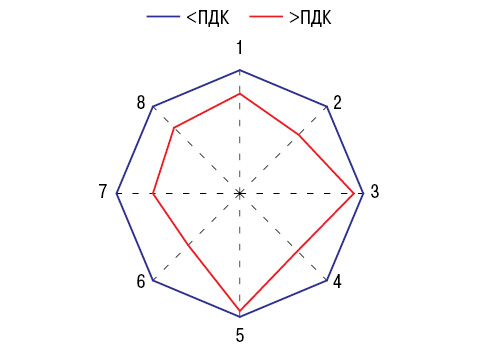
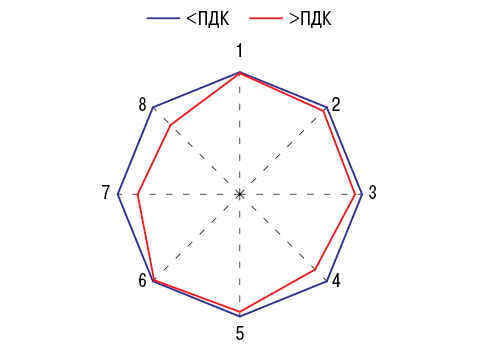
при превышении ПДК ксенобиотиков в атмосферном воздухе и нормальных значениях, которые приняты за 100%.
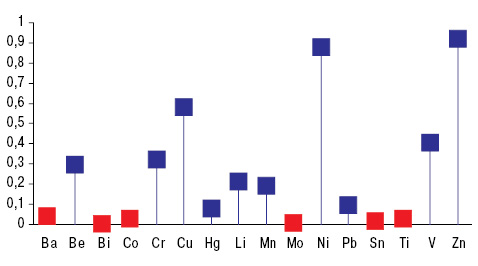
Все обследованные больные РА были распределены на две группы — с нормальными значениями G (<2 о.е.) и высокими (>2 о.е.), в которых были сопоставлены показатели МЭ в почве и грунтовых водах (табл. 3). Оказалось, что концентрация Ва в неблагоприятных по РА регионах достоверно ниже на 24%, Cr — на 43% и Li — на 42%, но Bi выше на 13%, Sn — на 47% и V — на 14%. В зонах проживания людей, неблагоприятных по распространенности и заболеваемости РА, отмечаются в 14,2 раза более низкие концентрации в грунтовых водах Li, в 24,3 раза — Mn, на 66% — Тi и в 25,5 раза — Zn. С учетом выполненного вариационного, дисперсионного и корреляционного анализа можно сделать следующие заключения:
1) распространенность РА возрастает согласно повышению в почве содержания токсичных Bi и Sn;
2) распространенность РА возрастает согласно снижению в грунтовых водах концентраций эссенциальных (жизненно необходимых) Mn и Zn;
3) неблагоприятными по отношению развития РА в Донецкой области являются города Дзержинск и Шахтерск, Володарский и Ясиноватский районы, в которых следует повысить качество первичных эпидемиологических исследований, направленных на раннее активное выявление заболевания.
| Объект | МЭ | Параметры G | Отличия | ||
|---|---|---|---|---|---|
| <2 о.е. | >2 о.е. | t | p | ||
| Почва, мг/кг | BaBe
Bi Co Cr Cu Hg Li Mn Mo Ni Pb Sn Ti V Zn |
864,74±23,1380,18±0,003
0,16±0,001 1,90±0,023 217,99±11,029 61,12±1,135 462,48±2,647 50,19±2,046 2245,00±169,618 2,55±0,038 63,18±1,179 92,08±6,320 8,49±0,437 1,11±0,093 101,77±1,258 229,93±10,928 |
658,55±57,3370,20±0,009
0,18±0,003 1,90±0,126 123,07±5,097 54,60±3,325 469,80±12,302 29,33±1,767 1196,67±49,393 2,66±0,154 70,07±5,794 126,87±35,97 13,00±4,952 1,45±0,394 115,67±14,804 183,00±20,141 |
2,051,81
4,37 0,01 2,00 1,32 0,62 2,36 1,43 0,67 1,31 1,22 2,06 0,84 2,18 0,99 |
0,0410,07
1<0,001 0,995 0,047 0,189 0,533 0,019 0,153 0,504 0,191 0,222 0,040 0,399 0,030 0,322 |
| Грунтовые воды, мг/л | BaCu
Li Mn Ni Pb Ti Zn |
2,95±0,4610,54±0,062
0,85±0,068 1,46±0,053 0,08±0,007 0,13±0,011 2,23±0,093 0,51±0,047 |
1,21±0,2270,86±0,346
0,06±0,006 0,06±0,003 0,06±0,011 0,04±0,011 0,76±0,155 0,02±0,001 |
0,881,14
2,70 6,12 0,82 1,79 3,63 2,46 |
0,3810,254
0,007 <0,001 0,415 0,074 <0,001 0,015 |
В отношении роли измененных концентраций Bi, Sn, Mn в Zn в окружающей среде для развития РА необходимы некоторые комментарии. У больных РА M. Krachler и W. Domej (2001) в сыворотке крови и синовиальной жидкости определяли уровень Bi, оказалось, что он не был связан с наличием ревматоидного фактора, с параметрами мочевой кислоты и С-реактивного протеина. У этих пациентов отмечали позитивные корреляционные соотношения между концентрациями Bi в крови и синовии, что гипотетически определяется гиперперфузией данного МЭ из крови в суставную жидкость. Результаты, полученные нами в отношении Sn, оказались несколько неожиданными, поскольку данный МЭ обладает ингибирующим действием на течение РА. К тому же, протопорфирин Sn отчетливо угнетает проявления экспериментального артрита у крыс, что проявляется уменьшением в синовиальной среде суставов лейкоцитарной инфильтрации, гиперплазии синовиоцитов, эрозий хряща и эпифизарного остеолиза (Синяченко О.В., Герасименко А.М., 2008).
Комбинированное действие Mn и Zn при длительном вдыхании металлической пыли может вызывать развитие у рабочих соответствующего производства ревматоидоподобного артрита (Leem J.H. et al., 2010). Гиперцинкемия у больных РА часто ассоциируется с развитием системных проявлений. Необходимо отметить, что как высокий, так и низкий уровень Zn в крови у пациентов с РА способствует прогрессированию течения заболевания. Через повышенный уровень Zn в синовиальной среде суставов при РА возрастает протеолитическая активность матриксных металлопротеиназ (Ram M. et al., 2006). На больных РА и в эксперименте на крысах с моделью данного заболевания показано, что для реализации провоспалительного и деструктивного действия металлопротеиназ необходимо присутствие ионов Zn.
Выводы
Распространенность РА в различных местах Донецкого региона зависит от степени выраженности загрязнения окружающей среды (воздуха, почвы, воды), в том числе крупными промышленными предприятиями, транспортом и сельским хозяйством, а интегральный эпидемиологический показатель G определяется суммарным уровнем в атмосфере ксенобиотиков, в частности аммиака и фенола, степенью минерализации питьевой воды и концентрацией в ней сульфатов, уровнем в грунте и грунтовых водах токсичных (Ba, Bi, Sn, Li, Ti) и эссенциальных (Mn, Zn) МЭ. Представленные данные необходимо учитывать при проведении эпидемиологических, профилактических и реабилитационных мероприятий в рамках изучения РА. Не исключается, что результаты проведенных исследований откроют новые звенья патогенетических построений заболевания.
Список использованной литературы
Борткевич О.П., Білявська Ю.В. (2008) Клініко-діагностичне значення антитіл до циклічного цитрулінового пептиду у пацієнтів з різною тривалістю ревматоїдного артриту. Укр. ревматол. журн., 33(3): 58–64.
Коваленко В.М., Гавриленко Т.І., Рижкова Н.О., Борткевич О.П. (2008) Визначення ролі факторів аутоімунної та імунозапальної реакції в патогенезі ревматоїдного артриту. Укр. ревматол. журн., 34(4): 42–49.
Синяченко О.В. (2007) Ревматические заболевания и экология. Укр. ревматол. журн., 30(4): 64–68.
Синяченко О.В., Герасименко А.М. (2008) Ревматоидный артрит как микроэлементоз. Міжнар. вісн. медицини, 1(3–4): 169–173.
Adams D.D., Knight J.G., Ebringer A. (2010) Autoimmune diseases: Solution of the environmental, immunological and genetic components with principles for immunotherapy and transplantation. Autoimmun. Rev., 9(8): 525–530.
Carmona L., Cross M., Williams B. et al. (2010) Rheumatoid arthritis. Best. Pract. Res. Clin. Rheumatol., 24(6): 733–745.
Engelman C.D., Baurley J.W., Chiu Y.F. et al. (2009) Detecting gene-environment interactions in genome-wide association data. Genet. Epidemiol., 33(1): 68–73.
Hakoda M. (2007) Absolute risk for fracture and WHO guideline. Epidemiology of rheumatoid arthritis. Clin. Calcium., 17(7): 1081–1087.
Holmberg S., Thelin A., Thelin N. (2004) Is there an increased risk of knee osteoarthritis among farmers? A population-based case-control study. Int. Arch. Occup. Environ Health, 77(5): 345–350.
Krachler M., Domej W. (2001) Clinical laboratory parameters in osteoarthritic knee-joint effusions correlated to trace element concentrations. Biol. Trace Elem., 79 (2): 139–148.
Leem J.H., Hong Y.C., Song J.S. (2010) Pulmonary fibrosis in a steel mill worker. J. Korean Med. Sci., 15(2): 224–228.
Markatseli T.E., Papagoras C., Drosos A.A. (2010) Prognostic factors for erosive rheumatoid arthritis. Clin. Exp. Rheumatol., 28(1): 114–123.
Meziani R., Yamada R., Takahashi M. et al. (2011) A trans-ethnic genetic study of rheumatoid arthritis identified FCGR2A as a candidate common risk factor in Japanese and European populations. Mod. Rheumatol., 24(5): 92–99.
Ngian G.S. (2010) Rheumatoid arthritis. Aust. Fam. Physician., 39(9): 626–628.
Oliver J.E., Silman A.J. (2009) What epidemiology has told us about risk factors and aetiopathogenesis in rheumatic diseases. Arthritis Res. Ther., 11(3): 223–229.
Proffitt F., Bagla P. (2009) Ecology. Circling in on a vulture killer. Science, 306(5694): 223–233.
Ram M., Sherer Y., Shoenfeld Y. (2006) Matrix metalloproteinase-9 and autoimmune diseases. J. Clin. Immunol., 26(4): 299–307.
Scott D.L., Wolfe F., Huizinga T.W. (2010) Rheumatoid arthritis. Lancet, 376(9746): 1094–1108.
Shapira Y., Agmon-Levin N., Shoenfeld Y. (2010) Geoepidemiology of autoimmune rheumatic diseases. Nat. Rev. Rheumatol., 6(8): 468–476.
Toboіn G.J., Youinou P., Saraux A. (2010) The environment, geo-epidemiology, and autoimmune disease: Rheumatoid arthritis. J. Autoimmun., 35(1): 10–14.
Trenkmann M., Brock M., Ospelt C. et al. (2010) Epigenetics in rheumatoid arthritis. Clin. Rev. Allergy Immunol., 39(1): 10–19.
Адрес для переписки:
Синяченко Олег Владимирович
83003, Донецк-3, просп. Ильича, 16
Национальный медицинский
университет им. Максима Горького,
кафедра пропедевтики внутренней медицины и общей практики — семейной медицины

Leave a comment