Дослідження впливу кверцетину на апоптоз хондроцитів в умовах розвитку експериментального остеоартрозу
Усенко В.Ф. , Зупанець І.А. , Тарасенко О.О. , Шебеко С.К.
Резюме. Досліджено вплив кверцетину на процеси апоптозу хондроцитів у щурів із системним стероїдним остеоартрозом. Для ідентифікування апоптозних клітин у тканинах суглобового хряща використовували метод TUNEL-реакції. За даними світлової мікроскопії, введення дексаметазону зумовлює проапоптотичну дію на хондроцити. У результаті проведених досліджень відмічено достовірне зниження апоптозного індексу під впливом кверцетину як у порівнянні зі щурами з групи контрольної патології, так і відносно референс-препарату диклофенаку натрію. Таким чином, за результатами проведених досліджень флавоноїдний препарат кверцетин може бути розглянутий як засіб з високою антиапоптогенною активністю з перспективою подальшого застосування у пацієнтів з дистрофічними захворюваннями суглобів, зокрема остеоартрозом.
Вступ
Існування людини в умовах сучасного світу характеризується як подовженням тривалості, так і підвищенням темпу життя. Це сприяє збільшенню навантаження на опорно-руховий апарат, зокрема на суглобовий хрящ. Остеоартроз (ОА), який є однією з основних причин тимчасової непрацездатності та інвалідності, вже сьогодні діагностують у /5 частини населення земної кулі. За прогнозами спеціалістів, розповсюдження його буде нестримно збільшуватися та вдвічі зросте до 2020 р. (Bijsma W.J. et al., 2009). Виходячи з цих показників, за соціальною та економічною значущістю лікування та профілактика розвитку ОА постають як пріоритетні напрямки медицини (Palmer T., Toombs J.D., 2004).
Для розробки нових напрямків і найбільш ефективних методів лікування ОА необхідне чітке розуміння всіх процесів розвитку даної патології. У результаті останніх досліджень у цьому напрямку було доведено роль дегенеративних процесів у хрящовій тканині, виявлено запалення в синовіальній оболонці та розвиток патологічних процесів в субхондральній кістці у патогенезі ОА (Бур’янов О.А., 2009; van den Berg W.B., 2000). Таким чином, формується патологічний процес, що супроводжується надмірною активацією процесів вільнорадикального окислення. Саме виникнення вільних радикалів у мітохондріях, наслідком якого є перекисне окислення ліпідів, що призводить до виходу цитохрому С з мітохондрій, запускає апоптоз клітин суглобового хряща (Blanco F.J. et al., 2004).
У світлі провідної ролі апоптозу у розвитку ОА, обґрунтованим є використання лікарських препаратів, які б зменшували явища перекисного окиснення, таким чином стримуючи запрограмовану загибель хондроцитів. З іншого боку, дослідження рівня апоптозу клітин суглобового хряща внаслідок терапії класичними протиартрозними препаратами (нестероїдні протизапальні препарати, хондропротектори) може слугувати одним із маркерів їх терапевтичної ефективності (Зупанец И.А., 2011).
Метою даного дослідження стало експериментальне вивчення впливу кверцетину на процеси апоптозу в суглобовому хрящі щурів із системним стероїдним ОА.
Об’єкт і методи дослідження
Дослідження проведено на моделі стероїдного ОА у щурів (Зупанец И.А. и соавт., 1999), яку відтворювали шляхом внутрішньом’язового трикратного введення дексаметазону фосфату у дозі 7 мг/кг з інтервалом 1 тиж у нашій модифікації (Зупанець К.О. та співавт., 2010). До експерименту було залучено 30 білих безпородних щурів обох статей віком 3–4 міс та масою тіла 180–200 г. Усі тварини були розподілені випадковим методом на 3 групи по 10 щурів у кожній групі:
1-ша група — інтактний контроль;
2-га група — контрольна патологія;
3-тя група — тварини, що одержували кверцетин у дозі 20,46 мг/кг;
4-та група — тварини, що одержували диклофенак натрію у дозі 8,0 мг/кг.
Обрані дози кверцетину та диклофенаку натрію обґрунтовані проведеними дослідженнями (Зупанець І.А. та співавт., 2009). Досліджувані об’єкти вводили щурам внутрішньошлунково 1 раз на добу починаючи з 4-го тижня дослідження і протягом наступних 28 діб. На 56-ту добу експерименту тварин виводили з дослідження декапітацією під ефірним наркозом та проводили забір біоматеріалу для морфологічних досліджень. Експерименти були виконані відповідно до правил «Європейської конвенції захисту хребетних тварин, що використовуються у експериментальних і інших наукових цілях» (Стефанов О. В. та співавт., 2009).
Колінні суглоби щурів фіксували в 10% нейтральному забуференому формаліні, далі піддавали декальцинації в 10% розчині ЕДТА натрію, дегідратації в спиртах зростаючої концентрації та заливали в парафін. Виготовлені зрізи монтували на стекла за допомогою розчину полі-L-лізину та депарафінували стандартними методами (Саркисов Д.С., 1996).
Ідентифікацію апоптозних клітин у тканинах суглобового хряща проводили імуногістохімічно на напівтонких парафінових зрізах методом TUNEL-реакції (TdT-mediated X-dUTP nick end labeling) за допомогою наборів «In Situ Cell Death Detection Kit, АР» виробництва «Roche Diagnostics» (Німеччина) (Redman S.N. et al., 2007; Rode H.J., 2008). Мікропрепарати поміщали до водно-гліцеринового середовища та вивчали за допомогою світлового мікроскопа. Для кількісної оцінки вираженості апоптозу хондроцитів визначали апоптозний індекс (АІ), відсоток апоптично змінених клітин у полі зору світлового мікроскопа при збільшенні у 250 разів. Згідно з інструкцією до набору було виготовлено мікропрепарати негативного та позитивного контролю апоптозного маркування клітин. Клітини, які мали темне забарвлення по периметру ядра і у цитоплазмі, реєструвалися як апоптоз-позитивні.
Отримані результати піддавали статичній обробці оригінальним методом за допомогою програми MS Exel 2007 (Доброва В.Є. та співавт., 2009).
Результати та їх обговорення
При моделюванні стероїдного ОА у досліджених суглобах екпериментальних тварин відбувалися характерні для цього захворювання патоморфологічні зміни. Найбільш значні порушення за даними світлової мікроскопіі були відмічені у проміжному та глибокому шарах хряща. Більшість клітин цієї зони мала характерні ознаки апоптозу: містили темнозабарвлені ядра з фрагментованим хроматином, темні згустки фрагментів ДНК в цитоплазмі та ін. Порушеною виявилася і зональність розташування клітин хряща. Деякі лакуни взагалі були спустошеними (рис. 1).
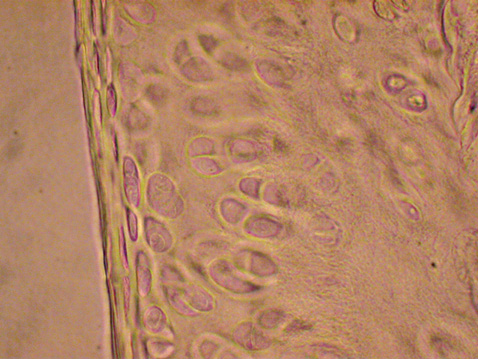
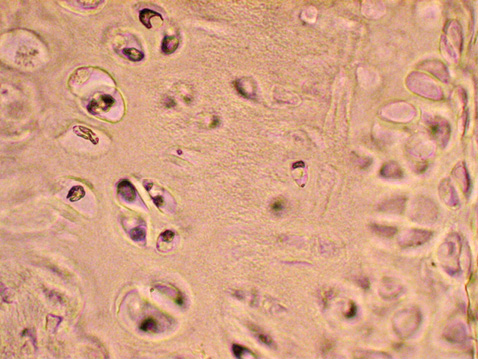
Кількісний аналіз показав, що під впливом дексаметазону у тварин групи контрольної патології АІ сягнув 55–70%. У той самий час рівень апоптозу суглобового хряща інтактних щурів не перевищував 1% (рис. 2).
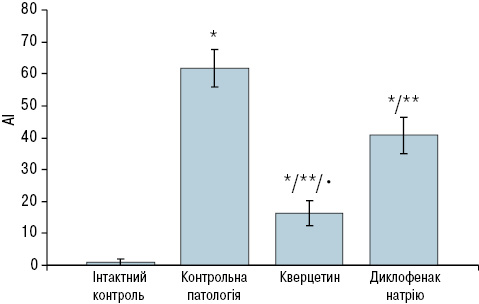
*Достовірно відносно інтактних тварин.
**Достовірно відносно контрольної патології.
Введення щурам кверцетину сприяло зниженню загибелі хондроцитів. Число TUNEL-позитивних клітин, що містять чітко профарбовані ядра та цитоплазматичні мітки, становило 16,3%, що майже у 4,5 раза менше порівняно зі щурами із групи контрольної патології (див. рис. 2). Такі хондроцити розташовувалися не тільки у найглибших шарах хряща, що є варіантом норми, а й у проміжній зоні та, навіть, у поверхневому шарі. Як правило, у полі зору відзначали не більше двох-трьох TUNEL-позитивних клітин. Ступінь забарвлення ядер таких клітин був менш виразним порівняно з позитивним контролем, що свідчить про зниження інтенсивності процесів дроблення ДНК. Структурні ознаки стану міжклітинного матриксу і хондроцитів свідчать про достатній рівень функціонування клітин. Порожні лакуни зустрічалися вкрай рідко. Щільність хондроцитів залишалася високою, практично на рівні інтактних тварин. На окремих мікропрепаратах були відмічені незначні безклітинні поля. Кількість ізогенних груп клітин та їх число мало відрізнялися від інтактних тварин. Хондроцити були великими та добре розвинутими (рис. 3).
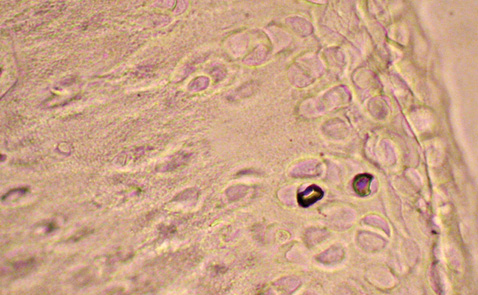
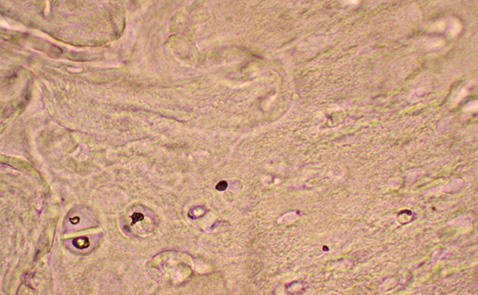
Результати дослідження показали, що в разі застосування диклофенаку натрію рівень апоптозу клітин суглобового хряща зменшується незначно. Кількість TUNEL-позитивних хондроцитів виявилася дещо нижчою порівняно з групою контрольної патології (у 1,8 раза), проте за ступенем антиапоптотичної дії диклофенак натрію значно поступається кверцетину (див. рис. 2). У мікропрепаратах нараховується більш ніж 40% TUNEL-позитивних клітин (рис. 4). На окремих ділянках виявляли цілі групи хондроцитів в стадії апоптозу. При морфометричному аналізі спостерігали структурну гетерогенність клітин хряща. Ядра апоптозних клітин чітко профарбовані по периметру, варіюють за розмірами і формою. Деякі пікнотичні та зруйновані ядра визначаються як окремі фрагменти. Багато порожніх лакун, клітини яких, імовірно, загинули ще раніше.
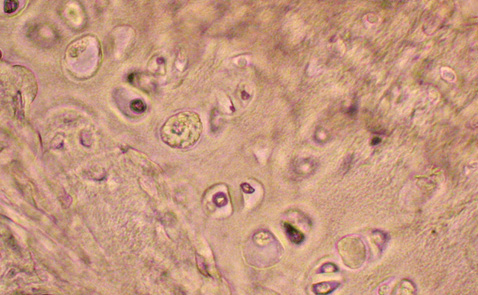
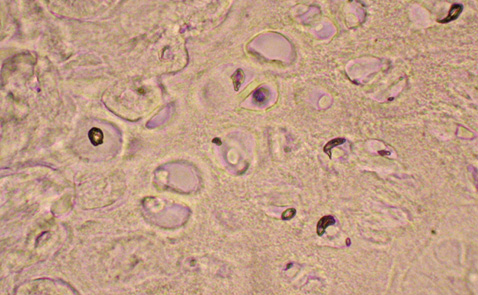
Експериментальне моделювання ОА яскраво демонструє роль апоптозу хондроцитів в патогенезі дистрофії суглобового хряща. Введення дексаметазону зрушує баланс синтетичних процесів у бік катаболізму, сприяє дегенерації хондроцитів та може вважатися відображенням патофізіологічних змін при старінні суглобового хряща (Зупанец И.А. и соавт., 1999).
Застосування для лікування ОА препаратів, що здатні зменшувати рівень апоптозу хондроцитів, може значно підвищити їх ефективність і скоротити витрати на терапію. Результати нашого дослідження демонструють наявність вираженої антиапоптотичної дії кверцетину. Відновлювальний ефект кверцетину у досліджуваній дозі зумовлений широким спектром фізіологічної та фармакологічної активності даного флавоноїду, перш за все антиоксидантними і протизапальними властивостями. Антиоксиданта дія кверцетину пов’язана з інгібуванням перекисного окиснення ліпідів, які каталізує цитохром С, та безпосередньою взаємодією з даним ферментом (Червяковский Е.М. и соавт., 2006).
Диклофенак натрію також здатен частково пригнічувати апоптоз хондроцитів, індукований дексаметазоном. Однак інтенсивність апоптичних процесів у сугобовому хрящі в разі застосування диклофенаку натрію залишається на достатньо високому рівні, що не дозволяє прогнозувати швидке відновлення хряща.
Висновки
1. Застосування дексаметазону з метою моделювання експериментального ОА призводить до значного підвищення інтенсивності апоптичних процесів у хрящовій тканині досліджуваних тварин.
2. На фоні лікування ОА кверцетином та диклофенаком натрію спостерігається зменшення кількості апоптичних хондроцитів різного ступеня вираженості.
3. За результатами кількісного аналізу найбільший антиапоптотичний вплив зумовлює кверцетин, що проявляється у вірогідному зменшенні кількості TUNEL-позитивних хондроцитів, як у порівнянні з групою контрольної патології, так і з тваринами, що отримують референс-препарат диклофенаку натрію.
Література
- Бур’янов О.А. (2009) Остеоартроз: питання патогенезу, діагностики та лікування. Здоров’я України, 23 (228): 30–32.
- Доброва В.Є., Должикова О.В., Малоштан Л.М. та ін. (2009) Вплив широкосмугового сигналу електромагнітного випромінювання міліметрового діапазону низької інтенсивності на клітини кісткового мозку щурів. Український журнал клінічної та лабораторної медицини, 4(3): 193–197.
- Зупанец И.А. (2011) Апоптоз как индикатор эффективности лечения астеоартроза. Здоров’я України, 6(259): 28.
- Зупанец И.А., Корж Н.А., Дедух Н.В. и др. (1999) Методические рекомендации по экспериментальному исследованию и клиническому изучению противоартрозных (хондромодулирующих) лекарственных средств. Киев, 56 с.
- Зупанець І.А., Попов С.Б., Усенко В.Ф. та ін. (2009) Дослідження токсичних та протизапальних властивостей композиції на основі аміноцукрів — похідних глюкозаміну та флавоноїду кверцетину. Клінічна фармація, 13(4): 50–53.
- Зупанець К.О., Шебеко С.К., Отрішко І.А. (2010) Дослідження впливу композиції на основі кверцетину та похідних глюкозаміну на процеси апоптозу хондроцитів в умовах розвитку експериментального остеоартриту. Ліки України плюс, 3(12): 47–50.
- Саркисов Д.С. (ред.) (1996) Микроскопическая техника: Руководство. Медицина, Москва, 544 с.
- Стефанов О., Бухтіарова Т., Коваленко В. та ін. (2009) Настанова СТ-Н МОЗУ 42–6.0:2008. Лікарські засоби. Належна лабораторна практика (видання офіційне). Моріон, Київ, c. 37–68.
- Червяковский Е.М., Власова Т.М., Гилеп А.А. та ін. (2006) Влияние флавоноидов на процессы перекисного окисления липидов, протекающих в присутствии цитохрома С. В кн.: Биологически активные вещества растений в медицине, сельском хозяйстве и других отраслях. Материалы. междунар. научно-практ. конф., Минск — Нарочь, с. 212–222.
- Blanco F.J., Lopez M.J., Maneiro E. (2004). Mitohondrial dysfunction in osteoarthritis. Rheumatology, 4: 715–728.
- Bijsma W.J., Burmester G.R., Antonio P. da S.i, et al. (2009) Eular Compendium on Rheumatic Diseases. BMJ Publishing Group Ltd, 840 p.
- Palmer T., Toombs J.D. (2004) Managing joint pain in primary care. J. Am. Board Fam. Pract., 17: 832–842.
- Redman S.N., Khan I.M., Tew S.R. et al. (2007) In Situ Detection of Cell Death in Articular Cartilage. In: Arthritis Research: Methods and Protocols. Humana Press Inc, Totowa, New Jersey, 183–199.
- Rode H.J. (2008) Apoptosis, Cytotoxicity and Cell Proliferation. 4-th edition. Roche Diagnostics GmbH, Mannheim, 180 p.
- van den Berg W.B. (2000) Pathophisiology of osteoarthritis. Joint Bone Spine, 67: 555–556.
ИССЛЕДОВАНИЕ ВЛИЯНИЯ кверцетина на апоптоз хондроцитов В УСЛОВИЯХ РАЗВИТИЯ ЭКСПЕРИМЕНТАЛЬНОГО ОСТЕОАРТРОЗА
Резюме. Изучено влияние кверцетина на процессы апоптоза хондроцитов у крыс с системным стероидным остеоартрозом. Для идентификации апоптозных клеток в тканях суставного хряща использовали метод TUNEL-реакции. По данным световой микроскопии, введение дексаметазона оказывает проапоптотическое действие на хондроциты. В результате проведенных исследований отмечено достоверное снижение апоптозного индекса под влиянием кверцетина как по сравнению с крысами из группы контрольной патологии, так и по отношению к референс-препарату диклофенака натрия. Таким образом, по результатам проведенных исследований флавоноидный препарат кверцетин может быть рассмотрен как средство с высокой антиапоптогенной активностью с перспективой дальнейшего применения у пациентов с дистрофическими заболеваниями суставов, в частности остеоартрозом.
кверцетин, диклофенак натрия, апоптоз хондроцитов, стероидный остеоартроз.
Адреса для листування:
Зупанець Ігор Альбертович
61057, Харків, вул. Пушкінська, 27
Національний фармацевтичний університет,
кафедра клінічної фармакології з фармацевтичною опікою НФаУ

Leave a comment