Можливості об’єктивізації активності запально-деструктивного процесу при псоріатичному артриті
Яременко О.Б.1, Федьков Д.Л. 1, Яременко К.М. 2
Резюме. Вивчено рівень лабораторних маркерів сполучнотканинної деструкції у 60 хворих із псоріатичним артритом (ПсА) і 30 хворих на недеструктивний остеоартроз (ОА) та вплив лефлуноміду (ЛФ) як монотерапії та у складі комбінованої базисної терапії (КБТ) на деструкцію сполучної тканини у пацієнтів із ПсА. У хворих із ПсА рівень маркера сполучнотканинної деструкції матриксної металопротеїнази (ММП)-3 більше ніж у 2 рази вищий порівняно з пацієнтами із недеструктивним ОА, що свідчить про участь цього ферменту в запаленні та деградації сполучної тканини хворих із ПсА. Під впливом ЛФ через 12 тиж вірогідно знижуються рівні ММП-3 і піридиноліну в сироватці крові на 19,8 і 8,7% відповідно, що свідчить про зниження активності запально-деструктивного процесу в сполучній тканині та інтенсивності руйнування кісток при ПсА. Вірогідні зміни ММП-3 паралельно зі зміною сумарних показників активності ураження суглобів та шкіри відбулися лише у групі «відповідачів» за PsARC та загальній когорті хворих із ПсА, а зміни рівня С-реактивного білка були вірогідними і в групі «невідповідачів». Рівень ММП-3 став єдиним лабораторним показником, динаміка якого вірогідно корелювала з динамікою суглобового статусу (кількість набряклих суглобів та ранкова скутість). Отримані результати свідчать про можливість використання ММП-3 для визначення ефективності лікування хворих із ПсА.
ВСТУП
Псоріатичний артрит (ПсА) — поширене запальне захворювання суглобів, що асоціюється з псоріазом та супроводжується значними деструктивними змінами сполучної тканини [11, 37]. Наприклад, руйнування кісткової тканини при дактиліті у хворих із ПсА може призводити навіть до вкорочення пальців за рахунок акролізису [21]. На відміну від ревматоїдного артриту (РА), при якому основну роль у розвитку хвороби відіграють клітини синовіальної оболонки, при ПсА насамперед уражаються місця прикріплення сухожиль [21]. Відповідно виникають специфічні лише для ПсА деструктивні зміни кісток, а саме: Ω-подібні та Т-подібні ерозії як ознака кісткової деструкції та короноподібні остеофіти — як ознака підвищеного неоостеогенезу [7]. При цьому спектр суглобових уражень при ПсА набагато ширший, ніж при РА — від аксіального ураження хребта, ентезитів, осеїтів до запалення синовіальної оболонки та м’яких тканин, що оточують суглоб, неоостеогенезу та вираженого остеолізису, з різноманітними комбінаціями будь-яких із цих проявів. Це значно ускладнює інструментальну оцінку ступеня ураження сполучної тканини при ПсА [12, 22], особливо при короткотермінових спостереженнях. Традиційні лабораторні маркери запалення (С-реактивний білок (СРБ), швидкість осідання еритроцитів (ШОЕ)) при ПсА значно гірше корелюють із тяжкістю ураження опорно-рухового апарату, ніж при РА [23]. Тому для об’єктивізації активності запально-деструктивного процесу при ПсА, у тому числі для оцінки ефективності лікування, було б доцільним моніторування показників, які є чутливими маркерами сполучнотканинної деструкції. На цю роль можуть претендувати матриксні металопротеїнази (ММП), відповідальні за розщеплення багатьох компонентів сполучної тканини, та піридинолін, рівень якого відображає деструкцію майже виключно кісткової тканини.
Серед металопротеїназ у хворих на РА та анкілозивний спондилоартрит (АСА) вірогідно підвищений лише сироватковий рівень ММП-3 та ММП-9, на відміну від ММП-1 та ММП-2. Причому саме рівень ММП-3 корелює з показниками запалення синовіальної оболонки [35]. ММП-3 відносять до групи цинк- і кальційзалежних ендопептидаз [31]. Синтезований у сполучній тканині фібробластами, макрофагами або нейтрофілами, цей фермент розщеплює фібронектин, еластин, колаген 4, 5 і 7-го типу, остеонектин, а також протеоглікани [4] та активує інші ММП (про-ММП-1 та про-ММП-9) [25, 26]. Доведено факт підвищення рівня ММП-3 у синовіальній оболонці хворих на РА [15] та здатність лефлуноміду (ЛФ) його знижувати [6]. Крім того, відомо, що рівні ММП-3 у синовіальній оболонці хворих на ПсА відповідають таким при РА [36]. При АСА рівень ММП-3 вірогідно вищий у хворих з ураженням периферичних суглобів порівняно з тими, які мали лише ураження хребта [35].
Піридинолін — це конгломерат із молекул лізину та гідроксилізину, що формують ділянку перехреснозв’язаних ковалентних зв’язків між 2 N- та 2 С-протеїдами коллагену, які стабілізують молекулу колагену. Внаслідок наявності піридинового кільця ці перехресні зв’язки називають піридинолін. Кісткова тканина є основним джерелом піридиноліну в біологічних рідинах організму [10]. При руйнуванні кісткової тканини остеокластами піридинолін вивільняється і потрапляє в кров [19], що дає підстави використовувати його рівень у біологічних рідинах для оцінки резорбції кісткової тканини [14]. Встановлено, що сироватковий рівень піридиноліну корелює з найбільш об’єктивними гістоморфометричними показниками кісткової резорбції та кісткоутворення (кількість і площа поверхні остеокластів та остеобластів) і сироватковими рівнями кісткової лужної фосфатази та остеокальцину [33]. У 1989 р. обґрунтовано використання піридиноліну як маркера кісткової резорбції у хворих на остеоартроз (ОА) та РА [30].
Вплив ЛФ на сполучнотканинну деструкцію зумовлений здатністю інгібувати ядерний фактор κB (NF-κB), який активує продукцію прозапальних цитокінів [20]. У хворих на РА ЛФ (на відміну від метотрексату (МТ)) гальмує трансендотеліальну міграцію мононуклеарів із периферичної крові в ділянку запалення [13], де ці клітини здатні продукувати переважну більшість прозапальних цитокінів та бути попередниками остеокластів. Саме прозапальні цитокіни та остеокласти є відповідальними за розвиток синовіту і деструкцію суглоба [8]. Відома також здатність ЛФ інгібувати продукцію ММП-3 у культурі клітин синовіальної оболонки хворих на РА [6]. У хворих на ПсА вплив ЛФ на рівень ММП-3 залишається невивченим.
Мета нашого дослідження — оцінити вплив ЛФ на деструкцію сполучної тканини у хворих на ПсА шляхом вивчення динаміки сироваткових рівнів ММП-3 та піридиноліну і вивчити можливість використання маркерів сполучнотканинної деструкції для оцінки ефективності лікування ПсА.
Об’єкт і методи дослідження
У дослідження було включено 63 хворих на ПсА з ураженням периферичних суглобів та 30 — на ОА. Діагноз ПсА встановлювали відповідно до критеріїв CASPAR 2006 [32], ОА — на підставі критеріїв Американської колегії ревматологів (ACR) залежно від групи уражених суглобів [1–3].
Хворих на ПсА розподілили у групу монотерапії ЛФ (31 пацієнт, який не отримував базисного препарату (БП) не менше 3 міс) або в групу комбінованої базисної терапії (КБТ), де ЛФ додавався до іншого БП (32 пацієнти, які до початку дослідження отримували сульфасалазин (СС) або МТ у стабільній дозі). ЛФ призначали на додаток до іншого БП у зв’язку з недостатнім ефектом лікування СС або МТ (збереження чи рецидив клінічно очевидних синовіту, дактиліту, ентезопатії, залучення у процес нових суглобів). Тривалість безперервного прийому СС становила від 9 міс до 5 років (в середньому — 28,8±18,4 міс), МТ — від 6 міс до 7 років (в середньому — 34,8±20,5 міс). Перед початком і протягом дослідження СС отримували 13 осіб в дозі 2000 мг/добу, МТ — 19 осіб в дозі від 7,5 до 20 мг/тиж, в середньому — 12,7±3,0 мг/тиж. У групі монотерапії ЛФ інші БП раніше приймали 17 (53,1%) із 32 хворих, з них 11 (64,7%) припинили прийом БП у зв’язку з несприятливими явищами, і по 3 (по 17,6%) пацієнти — через неефективність або інші причини (самостійне рішення хворого).
Протягом перших 3 днів учасники обох груп отримували ЛФ по 100 мг/добу, надалі — по 20 мг/добу за умови прийнятної переносимості. Тривалість курсу лікування в обох групах становила 12 тиж.
При обстеженні хворих оцінювали тривалість ранкової скутості, кількість болючих і набряклих суглобів, реєстрували оцінку пацієнтом і лікарем болю і стану здоров’я за 100-мм візуальною аналоговою шкалою (ВАШ) та шкалою Likert, визначали ШОЕ і рівень СРБ у сироватці крові. Ефективність ЛФ стосовно ураження суглобів оцінювали за кількістю хворих, які відповіли на лікування за критерієм ACR 20, модифікованим для ПсА — PsARC [23], величинами індексів DAS (ШОЕ) та DAS (СРБ) [18, 34], змінами якості життя, яку визначали за Стенфордським опитувальником оцінки стану здоров’я HAQ [23]. Для визначення ефективності ЛФ щодо ураження шкіри оцінювали відповідь на лікування за індексом PASI 50, який базується на оцінці інтенсивності еритеми, інфільтрації та десквамації за 5-бальною шкалою з урахуванням площі ураженої шкіри [17].
Оцінку ефективності та переносимості лікування проводили на 4-му та 12-му тижні лікування. Рівні ММП-3 та піридиноліну в сироватці крові визначали імуноферментним методом (ELISA) з використанням тест-систем фірми «Biosource» (США) та «Quidel» (США) відповідно перед початком та через 12 тиж лікування ЛФ.
Троє пацієнтів із ПсА вибули з дослідження на ранніх етапах (до 2 тиж) у зв’язку з припиненням прийому ЛФ, спричиненим побічними ефектами, тому в аналіз динаміки маркерів сполучнотканинної деструкції включено 60 хворих, які повністю завершили лікування.
Демографічну, анамнестичну та клініко-лабораторну характеристику хворих, у яких аналізували вплив ЛФ на сполучнотканинну деструкцію, наведено в табл. 1. Дані свідчать, що серед загальної когорти обстежених хворих на ПсА було дещо більше жінок, тривалість захворювання становила в середньому 8,5 року, більше половини хворих застосовували нестероїдні протизапальні препарати (НПЗП), 16,7% — глюкокортикоїди (ГК). Активність артриту була досить високою, про що, зокрема, свідчать середні величини тривалості ранкової скутості — >2 год та індексів DAS (ШОЕ) і DAS (СРБ) — >4 (відповідає високій активності захворювання). Водночас підвищення ШОЕ та рівня СРБ було незначним. Така невідповідність клінічної активності артриту рівню лабораторних маркерів запалення вважається однією з характерних рис ПсА [23]. Групи хворих, які отримували монотерапію ЛФ та КБТ, за демографічними показниками, тривалістю хвороби були зіставними. Єдиним анамнестичним показником, за яким відрізнялися групи монотерапії та КБТ, була частота прийому ГК: вона була вірогідно вищою у групі КБТ — 26,7% хворих порівняно з 6,6% у групі монотерапії. Це може бути пояснено тенденцією до більш тяжкого перебігу артриту в цій групі, про що також свідчать довша тривалість ранкової скутості, кількість болючих і набряклих суглобів і низька ефективність попередньої БТ.
| Показник | Монотерапія | КБТ | Загалом | |
|---|---|---|---|---|
| Стать | чол. (%) | 12 (40) | 13 (43,3) | 25 (41,6) |
| жін. (%) | 18 (60) | 17 (56,7) | 35 (58,4) | |
| Вік, років | 49,4±12,3 | 49,9±9,1 | 49,7±10,7 | |
| Тривалість ПсА, міс | 92,5±91,5 | 111,3±80,54 | 101,9±86,0 | |
| Прийом ГК, кількість хворих, n (%) |
2 (6,6) | 8 (26,7)* | 10 (16,7) | |
| Прийом НПЗП, кількість хворих, n (%) |
16 (53,3) | 16 (53,3) | 32 (53,3) | |
| Болючі суглоби, із 76 (балів) | 43,0±31,6 | 54,3±28,4* | 48,6±30,40 | |
| Набряклі суглоби, із 74 (балів) | 11,2±8,38 | 17,8±13,2* | 14,5±11,5 | |
| Ранкова скутість, хв | 81,7±92,6 | 192,0±216,1* | 136,9±173,9 | |
| HAQ | 1,20±0,51 | 1,08±0,48 | 1,14±0,50 | |
| ШОЕ, мм/год | 20,5±9,20 | 22,9±14,0 | 21,7±11,8 | |
| СРБ, мг/л | 9,63±4,39 | 10,0±4,32 | 9,84±4,32 | |
| ММП-3, нг/мл | 14,6±6,28 | 19,8±9,22 | 17,2±8,28 | |
| Піридинолін, нмоль/л | 2,06±0,71 | 2,06±0,57 | 2,06±0,63 | |
| DAS (ШОЕ) | 4,07±0,89 | 4,49±0,97 | 4,28±0,95 | |
| DAS (СРБ) | 3,94±0,85 | 4,36±0,90 | 4,15±0,91 | |
| PASI | 11,1±9,95 | 17,2±15,8 | 14,1±13,4 | |
*р<0,05 порівняно з групою монотерапії.
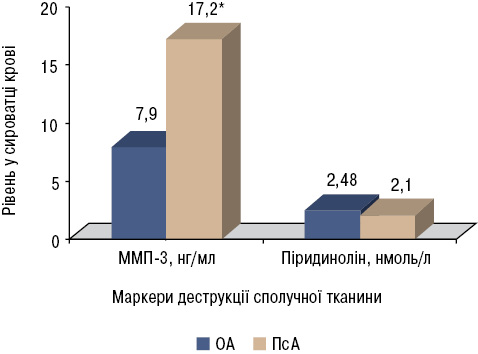
У хворих на ОА, які становили контрольну групу для порівняння рівнів лабароторних маркерів сполучнотканинної деструкції — ММП-3 та піридиноліну, на момент початку дослідження не було ознак активного запального процесу, деструкції кісткової тканини на рентгенограмах суглобів, а величини ШОЕ не перевищувала верхньої межі референтних значень. Серед хворих на ОА було 14 чоловіків і 16 жінок віком від 42 до 89 років (в середньому — 60,6±4,63 року). Середній рівень ММП-3 у сироватці крові становив 7,92±4,63 нг/мл, піридиноліну — 2,48±0,58 нмоль/л. Рівень ММП-3 був у 2 рази вищим у чоловіків — 10,93 нг/мл порівняно з жінками — 5,46 нг/мл (р<0,05), а рівень піридиноліну був вірогідно нижчим у осіб віком ≤55 років — 2,16 нмоль/л порівняно із хворими віком >55 років — 2,70 нмоль/л (р<0,05). Це можна пояснити статевими відмінностями активності ММП-3 [28] та вищою активністю деградації кісткової тканини за рахунок остеопорозу у осіб старших вікових категорій.
Статистичну обробку результатів здійснювали з використанням непараметричних (критерій знаків, Вальда — Вольфовиця, тести Вілкоксона, МакНемара, метод Фішера) і параметричних методів (метод різниць, t-тест) залежно від характеру розподілу варіанта у варіаційному ряду та конкретних завдань аналізу, а також кореляційного аналізу (коефіцієнт Пірсона). Відмінності вважали вірогідними при p<0,05.
Результати та їх обговорення
У загальній когорті хворих на ПсА рівень ММП-3 був більше ніж у 2 рази вищим порівняно із хворими на ОА (рисунок), що може свідчити про важливу роль цього ферменту в розвитку запально-деструктивних змін при ПсА. Отримані результати відповідають висновкам інших дослідників, які встановили, що підвищення рівня ММП корелює з більш деструктивним перебігом ПсА [9], і особливе значення в руйнуванні внутрішньосуглобових тканин відіграє саме ММП-3 [36].
Із 63 хворих на ПсА, включених у дослідження, завершили 3-місячне спостереження 60 (95,2%) осіб — по 30 у групах монотерапії та КБТ. Через 12 тиж лікування ЛФ у загальній когорті хворих на ПсА (табл. 2) відбулося вірогідне зниження рівнів ММП-3 та піридиноліну на 19,6 та 8,61% відповідно, що свідчить про здатність препарату гальмувати сполучнотканинну деструкцію, в тому числі резорбцію кісткової тканини. Здатність ЛФ за рахунок зниження активності та кількості остеобластів уповільнювати деструкцію кісткової тканини та знижувати швидкість рентгенологічного прогресування була доведена раніше для хворих на РА [16, 24, 27]. Позитивна динаміка рівня маркерів сполучнотканинної деструкції супроводжувалася вірогідним зниженням сумарних показників активності ураження суглобів та шкіри (DAS (ШОЕ) і DAS (СРБ) — більше ніж на 30%, кількості набряклих і болючих суглобів — на 64,2 та 51,5% відповідно, індексу PASI — на 42%), покращанням функціональної здатності пацієнтів (зниження величин HAQ на 32,6%) та зниженням лабораторних показників активності запалення (СРБ — на 13,8%, ШОЕ — на 14,4%).
Як видно з табл. 2, зниження рівня ММП-3 після завершення лікування було вірогідно більшим у групі КБТ — 24,4% порівняно з 13,0% у групі монотерапії, де зміни цього показника виявилися статистично незначущими. Суттєво кращою у групі КБТ була й динаміка основних показників ураження суглобів. Так, зниження кількості набряклих суглобів у групі КБТ було більшим порівняно з групою монотерапії ЛФ в 1,9 разу, індексів DAS (ШОЕ) та DAS (СРБ) — в 1,4 разу, зменшення тривалості ранкової скутості — в 2,9 разу. Відмінностей між групами в динаміці інших (крім ММП-3) лабораторних показників не спостерігалося. КБТ із застосуванням ЛФ була вірогідно ефективнішою і стосовно псоріатичного ураження шкіри (PASI).
(М±σ різниць абсолютних значень)
| Показник | Монотерапія | КБТ | Загалом |
|---|---|---|---|
| Болючі суглоби, з 76 (балів) | –21,5±25,5** | –28,7±29,6** | –25,1±27,6** |
| Набряклі суглоби, з 74 (балів) | –6,33±7,67** | –12,3±11,1** | –9,30±9,93** |
| Ранкова скутість, хв | –46,7±79,2** | –133,6±175,3** | –90,1±141,8** |
| HAQ | –0,38±0,45** | –0,26±0,34** | –0,32±0,40** |
| ШОЕ, мм/год | –2,70±7,35 | –3,80±10,2* | –3,25±8,81** |
| СРБ, мг/л | –1,36±3,52* | –1,35±4,17 | –1,35±3,83** |
| ММП-3, нг/мл | –1,89±5,52 | –4,83±7,69** | –3,36±6,80** |
| Піридинолін, нмоль/л** | –0,17±0,35** | –0,18±0,28** | –0,18±0,31** |
| DAS (ШОЕ) | –1,08±0,70** | –1,52±1,08** | –1,30±0,93** |
| DAS (СРБ) | –1,06±0,66** | –1,50±1,06** | –1,28±0,90** |
| PASI | –3,96±6,31** | –8,97±10,0** | –6,47±8,67** |
*р<0,05, **р<0,01 — вірогідність змін порівняно з вихідними значеннями; р<0,05 — порівняно з монотерапією.
При кореляційному аналізі встановлено, що зміни (∆) рівня ММП-3 у загальній когорті хворих на ПсА вірогідно позитивно корелювали з динамікою (∆) показників суглобового статусу — кількістю набряклих суглобів (r=0,29; р<0,03) і тривалістю ранкової скутості (r=0,52; р<0,001). Слід зазначити, що саме ці клінічні показники традиційно вважаються найчутливішими маркерами тяжкості (поширеності й активності) запального ураження суглобів. Динаміка жодного іншого лабораторного показника (ШОЕ, СРБ, піридинолін) не корелювала ані зі змінами рівня ММП-3, ані з динамікою показників ураження суглобів і шкіри. Схожі результати отримано в дослідженні, в якому вивчали значення ММП-3 у розвитку АСА: рівень ММП-3 корелював із показниками запалення синовіальної оболонки (її запальна інфільтрація) та не корелював з лабораторними показниками системного запалення (ШОЕ, СРБ) [35].
Отже, вірогідні позитивні зміни показників суглобового статусу і ураження шкіри під впливом лікування ЛФ супроводжувалися суттєвим зниженням рівнів ШОЕ, СРБ, ММП-3 і піридиноліну, що свідчить про здатність ЛФ справляти протизапальну й антидеструктивну дію у хворих на ПсА. Більш ефективною була комбінація ЛФ із МТ або СС порівняно з монотерапією ЛФ. При цьому серед лабораторних показників вірогідні відмінності між підгрупами КБТ і монотерапії виявлено лише стосовно динаміки рівня ММП-3, що свідчить про найвищу чутливість цього маркера сполучнотканинної деструкції запального генезу в оцінці ефективності базисного лікування ПсА. Цей висновок підтверджується і даними кореляційного аналізу, згідно з якими лише зміни рівня ММП-3 корелювали з динамікою показників активності запального ураження суглобів.
Найважливішим, специфічним для ПсА, критерієм, за яким оцінювали вплив ЛФ на перебіг артриту, була кількість хворих, які відповіли на лікування за критерієм PsARC. Після оцінки відповіді за цим критерієм хворих з ПсА розподілили на дві групи: «відповідачі» за PsARC — 39 осіб, та «не-відповідачі» — 21 особа. За демографічними, анамнестичними характеристиками, супутнім лікуванням (НПЗП, ГК) статистично значущих відмінностей між групами не виявлено.
Величини основних клініко-лабораторних показників до початку лікування у групах хворих, які відповіли та не відповіли за критерієм PsARC, та їх зміни протягом 12 тиж лікування представлено в табл. 3. Як свідчать дані, на початку дослідження основні показники активності захворювання в групі «відповідачів» були вірогідно вищими порівняно з групою «невідповідачів», а саме: кількість болючих суглобів — на 85,3%, набряклих суглобів — більше ніж у 2 рази, індекси DAS (ШОЕ) та DAS (СРБ) — на 22,4 та 22,9% відповідно. У групі «відповідачів» були вищими і рівні лабораторних показників, за винятком ШОЕ: СРБ та піридиноліну — на 7,6%, ММП-3 — на 18,9% порівняно з групою «невідповідачів». Отже, серед лабораторних маркерів запалення/деструкції найбільша різниця між групами хворих, які відповіли чи не відповіли на лікування ЛФ, спостерігалася стосовно вихідних значень ММП-3, серед клінічних показників — стосовно кількості набряклих і болючих суглобів. Це дає підстави вважати, що рівень ММП-3 є найчутливішим лабораторним маркером тяжкості ураження периферичних суглобів при ПсА. Таку закономірність простежено і для хворих на РА: рівні ММП-3 у синовіальній рідині та сироватці крові корелюють із кількістю уражених суглобів [29, 38]. Крім того, можна зробити висновок, що у пацієнтів із ПсА відповідь на лікування ЛФ тим краща, чим вища клініко-лабораторна активність захворювання.
| Показники | «Відповідачі» | «Не-відповідачі» | ||
| До лікування | 12-й тиждень | До лікування | 12-й тиждень | |
| Болючі суглоби, з 76 (бали) | 58,0±32,5# | 21,4±19,3**, §§ | 31,3±15,1 | 27,7±18,0 |
| Набряклі суглоби, з 74 (бали) | 17,6±12,5# | 4,82±5,45**, § | 8,67±5,82 | 5,86±4,88* |
| ШОЕ, мм/год | 21,4±10,3 | 17,0±7,61* | 22,3±14,4 | 21,2±12,3 |
| DAS (ШОЕ) | 4,58±0,94# | 2,83±0,85**, § | 3,74±0,70 | 3,25±0,82* |
| СРБ, мг/л | 10,1±4,14# | 9,00±4,05* | 9,39±4,71 | 7,52±4,04** |
| DAS (CРБ) | 4,44±0,92# | 2,75±0,84**, § | 3,61±0,61 | 3,09±0,80* |
| HAQ | 1,19±0,50 | 0,74±0,51**, §§ | 0,89±0,48 | 0,83±0,52 |
| Ранкова скутість, хв | 179,0±213,6 | 62,4±80,0**, § | 92,7±153,5 | 51,7±62,7** |
| ММП-3, нг/мл | 18,2±8,80# | 13,0±4,59**, §§ | 15,3±6,90 | 15,3±5,74 |
| Піридинолін, нмоль/л | 2,11±0,67# | 1,88±0,65**, § | 1,96±0,56 | 1,89±0,46 |
#р<0,01 — вірогідність відмінностей вихідних значень між групами «відповідачів» і «не-відповідачів»; *р<0,05; **р<0,01 — вірогідність змін порівняно з вихідними значеннями; §р<0,05; §§р<0,01 порівняно з групою «не-відповідачів».
Результати аналізу змін основних клініко-лабораторних показників у групах хворих, які відповіли чи не відповіли на лікування ЛФ за критерієм PsARC (див. табл. 3), свідчать про вірогідне зниження рівнів усіх лабораторних параметрів у групі «відповідачів». Так, ШОЕ знизилася на 20,6%, рівень СРБ — на 11%, ММП-3 — на 28,6%, піридиноліну — на 10,9%. Зниження рівня піридиноліну в групі «відповідачів» свідчить про здатність ЛФ вже протягом перших 3 міс лікування уповільнювати швидкість кісткової деструкції у хворих на ПсА, що відповідає даним інших дослідників, які спостерігали припинення протягом 1 року рентгенологічного прогресування та навіть часткову репарацію кісткової тканини в ділянці ерозій під впливом ЛФ у 1 хворого на ПсА [5]. Позитивна динаміка маркерів запалення та деструкції сполучної тканини супроводжувалася високовірогідними змінами основних клінічних показників у цій групі: зменшилася кількість набряклих і болючих суглобів — відповідно на 72,6 і 63,1%, майже у 3 рази скоротилася тривалість ранкової скутості, значно покращилася функціональна здатність хворих — індекс HAQ знизився на 37,8%; також знизилися величини індексів активності захворювання DAS (ШОЕ) та DAS (СРБ) — на 38,2 і 10,7% відповідно.
У хворих, у яких відповідь на лікування не відповідала критеріям PsARC, серед лабораторних показників суттєво знизився лише рівень СРБ (на 19,9%). Це супроводжувалося зменшенням кількості набряклих суглобів (на 11,3%), тривалості ранкової скутості (на 44,3%), зниженням DAS (ШОЕ) та DAS (СРБ) (на 13,0 та 14,3% відповідно). Вірогідної різниці в динаміці ШОЕ та СРБ між групами «не-відповідачів» і «відповідачів» не зареєстровано. Деяке зниження рівня піридиноліну (на 3,6%; р>0,05) у кількісному відношенні було помітно меншим, ніж у «відповідачів» (10,9%). Для ММП-3 відповідні величини становили 0 і 28,6%.
Отже, серед неклінічних показників найбільша різниця між групами «відповідачів» та «не-відповідачів» на лікування ЛФ за критерієм PsARC спостерігалася стосовно вихідних значень ММП-3, і динаміка ММП-3 у групі «відповідачів» була вірогідно кращою порівняно з групою «невідповідачів», на відміну від ШОЕ та СРБ, і значно суттєвішою порівняно з піридиноліном.
Підсумовуючи отримані результати, можна констатувати, що при різних варіантах аналізу ефективності базисного лікування ПсА (порівнянні ефективності монотерапії ЛФ і КБТ, проведенні кореляційного аналізу між змінами клінічних та лабораторних показників у процесі лікування, оцінці вихідних значень та динаміки показників у «відповідачів» і «не-відповідачів» за критерієм PsARC) найбільш чутливим неклінічним параметром виявився рівень ММП-3, що дає підстави рекомендувати використання цього показника для об’єктивізації активності запально-деструктивного процесу при ПсА, у тому числі при оцінці ефективності лікування.
Висновки
1. У хворих на ПсА рівень маркера сполучнотканинної деструкції ММП-3 більше ніж у 2 рази вищий порівняно із хворими на недеструктивний ОА, що може свідчити про участь цього ферменту в запаленні та деградації сполучної тканини у хворих на ПсА.
2. ЛФ знижує активність запально-деструктивного процесу в сполучній тканині та інтенсивність руйнування кісток при ПсА, на що вказує вірогідне зниження рівнів ММП-3 і піридиноліну в сироватці крові на 19,8 і 8,7% відповідно у загальній когорті хворих на ПсА та на 28,6 і 10,9% відповідно у групі хворих, які відповіли на лікування за критерієм PsARC.
3. Серед лабораторних маркерів запалення і деструкції сполучної тканини лише динаміка рівня ММП-3 корелювала зі змінами показників активності запального ураження суглобів, підтверджувала вищу ефективність КБТ порівняно з монотерапією ЛФ та відмінність групи «відповідачів» на лікування за критерієм PsARC від групи «невідповідачів».
4. З огляду на низьку інформативність при ПсА традиційних лабораторних маркерів активності запального процесу (ШОЕ, СРБ) та необхідність протягом кількох місяців об’єктивно оцінити протизапальну і антидеструктивну дію БТ для контролю ефективності лікування доцільно визначати в динаміці спостереження рівень ММП-3.
Література
1. Altman R., Asch E., Bloch D. et al. (1986) Development of criteria for the classification and reporting of osteoarthritis. Classification of osteoarthritis of the knee. Arthritis Rheum., 29: 1039–1049.
2. Altman R., Alarcon G., Appelrouth D. et al. (1990) The American College of Rheumatology criteria for the classification and reporting of osteoarthritis of the hand. Arthritis Rheum., 33: 1601–1610.
3. Altman R., Alarcon G., Appelrouth D. et al. (1991) The American College of Rheumatology criteria for the classification and reporting of osteoarthritis of the hip. Arthritis Rheum., 34: 505–514.
4. Chin J.R., Murphy G., Werb Z. (1985) Stromelysin, a connective tissue-degrading metalloendopeptidase secreted by stimulated rabbit synovial fibroblasts in parallel with collagenase. Biosynthesis, isolation, characterization, and substrates. J. Biol. Chem., 260: 12367–12376.
5. Cuchacovich M., Soto L. (2002) Leflunomide decreases joint erosions and induces reparative changes in a patient with psoriatic arthritis. Ann. Rheum. Dis., 61: 942–943.
6. Elkayam O., Yaron I., Shirazi I. et al. (2003) Active leflunomide metabolite inhibits interleukin 1β, tumour necrosis factor α, nitric oxide, and metalloproteinase-3 production in activated human synovial tissue cultures. Ann. Rheum. Dis., 62: 440–443.
7. Finzel S., Englbrecht M., Engelke K. et al. (2011) A comparative study of periarticular bone lesions in rheumatoid arthritis and psoriatic arthritis Ann. Rheum. Dis., 70: 122–127.
8. Firestein G.S., Alvaro-Gracia J.M., Maki R. (1990) Quantitative analysis of cytokine gene expression in rheumatoid arthritis. J. Immunol., 144: 3347–3353.
9. Fraser A., Fearon U., Billinghurst R.C. et al. (2003) Turnover of type II collagen and aggrecan in cartilage matrix at the onset of inflammatory arthritis in humans: relationship to mediators of systemic and local inflammation. Arthritis Rheum., 48: 3085–3095.
10. Gallop P.M., Blumenfeld O.O., Seifter S. (1972) «Structure and metabolism of connective tissue proteins». Ann. Rev. Biochem., 41(1): 617–672.
11. Gladman D.D. (1994) The natural history of psoriatic arthritis. In: V. Wright, P.S. Helliwell (Еds) Psoriatic arthritis in Baillière’s Clinical Rheumatology. International Practice and Research. Baillière Tindall., London, p. 379–394.
12. Gladman D.D. (2006) Clinical, radiological, and functional assessment in psoriatic arthritis: is it different from other inflammatory joint diseases? Ann. Rheum. Dis., 65(3): 22–24.
13. Grisar J., Aringer M., Köller M.D. et al. (2004) Leflunomide inhibits transendothelial migration of peripheral blood mononuclear cells. Ann. Rheum. Dis., 63: 1632–1637.
14. Hubert W., Vesper S., Jay Smith et al. (2001) Myers Comparison Study of Urinary Pyridinoline and Deoxypyridinoline Measurements in 13 US Laboratories Clinical Chemistry, 47: 2029–2031.
15. Ishiguro N., Ito T., Obata K.I. et al. (1996) Determination of stromelysin-1, 72 and 92 kDA type IV collagenase, tissue inhibitor of metalloproteinase-1 (TIMP), and TIMP-2 in synovial fluid and serum from patients with rheumatoid arthritis. J. Rheumatol., 23: 1599–1604.
16. Jones G., Halbert J., Crotty M. et al. (2003) The effect of treatment on radiological progression in rheumatoid arthritis: a systematic review of randomized placebo-controlled trials. Rheumatology (Oxford), 42: 6–13.
17. Kaltwasser J.P., Nash P., Gladman D. et al. (2004) Treatment of Psoriatic Arthritis Study Group. Efficacy and safety of leflunomide in the treatment of psoriatic arthritis and psoriasis: a multinational, double-blind, randomized, placebo-controlled clinical trial.Arthritis Rheum., 50(6): 1939–1950.
18. Kavanaugh A.F., Ritchlin C.T. (2006) GRAPPA Treatment Guideline Committee. Systematic review of treatments for psoriatic arthritis: an evidence based approach and basis for treatment guidelines. J. Rheumatol., 33: 1417–1421.
19. Knott L., Bailey A.J. (1998) Collagen cross-links in mineralizing tissues: a review of their chemistry, function, and clinical relevance. Bone, 22: 181–187.
20. Manna S.K., Aggarwal B.B. (1999) Immunosuppressive leflunomide metabolite (A77 1726) blocks TNF-dependent nuclear factor-kappa B activation and gene expression. J. Immunol., 162: 2095–2102.
21. Marsal S., Armadans-Gil L., Martínez M. et al. (1999) Clinical, radiographic and HLA associations as markers for different patterns of psoriatic arthritis. Rheumatology (Oxford), 38: 332–337.
22. McGonagle D., Conaghan P., Emery P. (1999) Psoriatic arthritis—a unified concept 20 years on. Arthritis Rheum., 42: 1080–1086.
23. Mease P.J., Antoni C.E., Gladman D.D. et al. (2005) Psoriatic arthritis assessment tools in clinical trials. Ann. Rheum. Dis., 64: 49–54.
24. Miossec P. (2003) Interleukin-17 in rheumatoid arthritis: if T cells were to contribute to inflammation and destruction through synergy. Arthritis Rheum., 48: 594–601.
25. Murphy G., Cockett M.I., Stephens P.E. et al. (1987) Stromelysin is an activator of procollagenase. Biochem. J., 248: 265–268.
26. Ogata Y., Enghild J.J., Nagase H. (1992) Matrix metalloproteinase 3 (stromelysin) activates the precursor for the human matrix metalloproteinase 9. J. Biol. Chem., 267: 3581–3584.
27. Osiri M., Shea B., Robinson V. et al. (2003) Leflunomide for the treatment of rheumatoid arthritis: a systematic review and metaanalysis. J. Rheumatol., 30: 1182–1190.
28. Ribbens C., Martin y Porras M., Franchimont N. et al. (2002) Increased matrix metalloproteinase-3 serum levels in rheumatic diseases: relationship with synovitis and steroid treatment. Ann. Rheum. Dis., 61: 161–166.
29. Sasaki S., Iwata H., Ishiguro N. et al. (1994) Detection of stromelysin in synovial fluid and serum from patients with rheumatoid arthritis and osteoarthritis. Clin. Rheumatol., 13: 228–233.
30. Seibel M.J., Duncan A., Robins S.P. (1989) Urinary hydroxy-pyridinium crosslinks provide indices of cartilage hone involvcinciit in arthritic diseases. J. Rheuniatol., 16: 964–970.
31. Sellers A., Murphy G. (1981) Collagenolytic enzymes and their naturally occurring inhibitors. Int. Rev. Connect. Tissue Res., 9: 151–190.
32. Taylor W., Gladman D., Helliwell P. et al. (2006) Classification criteria for psoriatic arthritis: development of new criteria from a large international study. Arthritis Rheum., 54: 2665–2673.
33. Ureńa P., Ferreira A., Kung V. (1995) Serum pyridinoline as a specific marker of collagen breakdown and bone metabolism in hemodialysis patients. JBMR, 10(6): 932–939.
34. van der Heijde D.M., van ’t Hof M.A., van Riel P.L. et al. (1990) Judging disease activity in clinical practice in rheumatoid arthritis: first step in the development of a disease activity score. Ann. Rheum. Dis., 49: 916–920.
35. Vandooren B., Kruithof E., Yu D.T. et al. (2004) Involvement of matrix metalloproteinases and their inhibitors in peripheral synovitis and down-regulation by tumor necrosis factor α blockade in spondylarthropathy. Arthritis Rheum., 50: 2942–2953.
36. van Kuijk A.W.R., Reinders-Blankert P., Smeets T.J.M. et al. (2006) Detailed analysis of the cell infiltrate and the expression of mediators of synovial inflammation and joint destruction in the synovium of patients with psoriatic arthritis: implications for treatment. Ann. Rheum. Dis., 65: 1551–1557.
37. Wright V., Moll J.M.H. (1976) Psoriatic arthritis. In: V. Wright, J.M.H. Moll (Еds) Seronegative polyarthritis. North Holland Publishing Co., Amsterdam, р. 169–223.
38. Yoshihara Y., Obata K., Fujimoto N. Y. et al. (1995) Increased levels of stromelysin-1 and tissue inhibitor of metalloproteinases-1 in sera from patients with rheumatoid arthritis. Arthritis Rheum., 38: 969–975.
Возможности объективизации активности воспалительно-деструктивного процесСа при псориатическом артрите
Резюме. Изучен уровень лабораторных маркеров деструкции соединительной ткани у 60 больных с псориатическим артритом (ПcА) и 30 больных недеструктивным остеоартрозом (ОА) и влияние лефлуномида (ЛФ) в качестве монотерапии и в составе комбинированной базисной терапии (КБТ) на деструкцию соединительной ткани у больных с ПcА. У больных с ПcА уровень матриксной металлопротеиназы (ММП)-3 более чем в 2 раза выше по сравнению с пациентами с недеструктивным ОА. Под влиянием лечения ЛФ через 12 нед достоверно снижаются уровни ММП-3 и пиридинолина в сыворотке крови на 19,8 и 8,7% соответственно, что свидетельствует о снижении активности воспалительно-деструктивного процесса в соединительной ткани и интенсивности разрушения костей при ПсА. Достоверные изменения ММП-3 параллельно с изменением суммарных показателей активности поражения суставов и кожи наблюдали лишь в группе «ответчиков» по PsARC и в общей когорте больных с ПсА, а изменения уровня С-реактивного белка были достоверными и в группе «неответчиков». Изменения уровня ММП-3 достоверно коррелировали с динамикой суставного статуса (количество отечных суставов и утренняя скованность), в отличие от других лабораторных показателей. Полученные результаты свидетельствуют о возможности использования ММП-3 для определения эффективности лечения больных с ПсА.
псориатический артрит, лечение, лефлуномид, металлопротеиназа-3, пиридинолин.
Адреса для листування:
Яременко Олег Борисович
01601, Київ, бульв. Тараса Шевченка, 13
Національний медичний університет ім. О.О. Богомольця, кафедра внутрішніх хвороб стоматологічного факультету

Leave a comment