Ефективність фармакотерапії у хворих на остеоартроз колінних суглобів з аберантними рівнями екскреції 6-сульфатоксимелатоніну
Гуменюк О.В., Станіславчук М.А.
Резюме. Досліджено ефективність фармакотерапії у хворих на остеоартроз (ОА) колінних суглобів з аберантною продукцією мелатоніну. У хворих на ОА з нормальним рівнем екскреції 6-сульфатоксимелатоніну (6-SMT) під впливом стандартної фармакотерапії (диклофенак натрію, глюкозаміну гідрохлорид, хондроїтинсульфат) динаміка клінічних показників (індекси Лекена, HAQ, WOMAC, KOOS) була більш вираженою, ніж у хворих на ОА з аберантними рівнями екскреції 6-SMT. Через 12 тиж лікування серед хворих на ОА зі зниженою екскрецією 6-SMT частка нереспондерів WOMAC20 була в 1,7 раза більшою, ніж серед хворих з нормальним рівнем екскреції 6-SMT. Включення мелатоніну (3 мг/добу) до схеми лікування у осіб з ОА з аберантними рівнями екскреції 6-SMT забезпечувало покращення якості сну, зменшення вираженості депресивних розладів, підвищувало динаміку клінічних індексів (Лекена, HAQ, WOMAC, KOOS) і втричі підвищувало шанси досягнення WOMAC20.
Остеоартроз (ОА) належить до найпоширеніших хронічних захворювань суглобів, що асоціюються з больовим синдромом, функціональними обмеженнями, зниженням якості життя та значними економічними витратами на охорону здоров’я [5, 13]. Лише на ОА колінних суглобів хворіють понад 70 млн європейців, а прямі витрати на лікування перевищують 2 млрд євро [15]. Стратегія лікування пацієнтів з ОА, запропонована Європейською антиревматичною лігою (EULAR, 2013), Американською колегією ревматологів (ACR, 2012), Міжнародним товариством дослідження остеоартриту (OARSI, 2014), спрямована на уповільнення прогресування ОА, усунення чи зниження інтенсивності больового синдрому, збереження чи покращення функціональної активності та якості життя пацієнтів [17, 19, 24]. Згідно з рекомендацією Європейської спільноти з клінічних та економічних аспектів остеопорозу, остеоартриту та кістково-м’язових захворювань (ESCEO, 2014; 2016), засоби фармакотерапії ОА повинні відновлювати баланс між катаболічними та анаболічними процесами в суглобових тканинах, зменшувати вираженість болю та запалення [13, 14]. Незважаючи на широкий спектр як нефармакологічних, так і фармакологічних рекомендацій, проблема ефективності лікування пацієнтів з ОА залишається не вирішеною і пошук нових патогенетичних мішеней є актуальним.
У розвитку остеоартрозного ремоделювання суглобових тканин тригерну роль відіграє дисрегуляція експресії clock-генів та порушення хронобіологічних ритмів хондроцитів [7, 26]. Однак значення мелатоніну, ключового гормонального регулятора циркадіанних ритмів, у патогенезі та лікуванні ОА залишається дискутабельним. У дослідах in vivo та in vitro показано, що в артрозному хрящі мелатонін коригує експресію clok-генів та зміну фенотипу хондроцитів, пригнічує експресію катаболічних медіаторів, медіаторів апоптозу, запобігає пошкодженню навколосуглобових м’язів [18, 20], пригнічує активацію прозапальних факторів транскрипції (NF-κB, NFATc1) [22], хоча при тривалому застосуванні промотує ерозування субхондральної кістки [20]. Клінічний досвід застосування екзогенного мелатоніну у хворих на ОА обмежений. У роботі О.В. Пішак та співавторів (2010) підтверджена здатність мелатоніну коригувати циркадіанні ритми вільнорадикальних процесів у хворих на ОА [4]. Застосування мелатоніну зменшувало вираженість психоемоційних розладів та больового синдрому у хворих на ОА, асоційований з депресією [6]. Доцільність поєднання протиартрозної фармакотерапії з препаратами мелатоніну у хворих з різними клінічними формами ОА потребує більш детального вивчення.
Мета роботи — оцінити ефективність препарату мелатоніну в комплексному лікуванні хворих на ОА колінних суглобів з аберантною продукцією мелатоніну.
Об’єкт і методи дослідження
Відкрите проспективне рандомізоване дослідження проведено на базі ревматологічного відділення Науково-дослідного інституту реабілітації інвалідів Вінницького національного медичного університету ім. М.І. Пирогова відповідно до основних біоетичних норм Гельсінкської декларації (1989), Конвенції Ради Європи про права людини та біомедицину (1977), інших міжнародних угод та національного законодавства в цій галузі. Дослідженням охоплено 89 пацієнтів (77,5% жінки) з гонартрозом ІІ–ІІІ стадії за Kellgren — Lawrence віком 58,7±6,35 року, тривалістю захворювання 10,1±6,48 року, які не мали попереднього досвіду застосування та не отримували на момент дослідження препаратів мелатоніну. Критеріями виключення з дослідження були небажання хворого брати в ньому участь; прийом пероральних глюкокортикоїдів; будь-які інтраартикулярні маніпуляції за останніх 4 тиж; ендопротезування суглобів; тяжкі та некомпенсовані стани. Діагноз ОА встановлювали на основі класифікаційних критеріїв ACR 1991 р. [8] та рекомендацій EULAR [27], наказу МОЗ України від 12.10.2006 р. № 676 «Про затвердження протоколів надання медичної допомоги за спеціальністю «Ревматологія».
На підставі персентильного аналізу середньодобової екскреції 6-SMT у 36 практично здорових осіб (середній вік — 57,1±9,95 року, 72,2% — жінки), хворі на ОА були ранжовані на осіб зі збереженою (нормальною) екскрецією 6-SMT (>25-го процентиля групи контролю або >19,4 нг/мг креатиніну) та осіб зі зниженою екскрецією 6-SMT (≤19,4 нг/мг креатиніну). Для оцінки ефективності включення препарату мелатоніну до комплексу лікування хворих на ОА пацієнтів розподілено на три групи (табл. 1), репрезентативні за віком, статтю, тривалістю захворювання, рентгенологічною стадією, порушенням функції суглобів. Стандартну терапію отримували хворі 1-ї групи (n=31) зі збереженим рівнем екскреції 6-SMT та хворі 2-ї групи (n=26) зі зниженим рівнем екскреції 6-SMT. Модифіковану терапію (стандартна терапія + мелатонін) отримували хворі 3-ї групи (n=32) зі зниженим рівнем екскреції 6-SMT. Стандартну терапію проводили відповідно до наказу МОЗ України від 12.10.2006 р. № 676, вона включала нестероїдний протизапальний препарат у стабільній дозі упродовж щонайменше 2 тиж, хондропротектор (500 мг хондроїтинсульфату натрію + 500 мг глюкозаміну гідрохлориду 2 рази на добу) упродовж усього періоду спостереження. Модифікована терапія додатково включала препарат мелатоніну (3 мг/добу за 1 год до нічного сну). Період контрольованого лікування становив 12 тиж. У дослідженні було застосовано Віта-мелатонін (ЗАТ «Київський вітамінний завод», Україна, № UA/7898/01/01).
Ефективність лікування оцінювали за динамікою клінічних індексів Лекена [23], WOMAC [11], KOOS [25], HAQ [12]. Респондерів та нереспондерів лікування у групах визначали за індексом WOMAC20 [10]. Наявність інсомнії визначали за допомогою анкети оцінки нічного сну [1] та шкали денної сонливості Epworth [21]. Наявність депресивних розладів визначали за допомогою шкали депресії Бека [9]. Рівень 6-SMT в cечі визначали імуноферментним методом за набором «6-Sulfatoxymelatonin ELISA» («Buhlmann», Швеція). Рівень 6-SMT оцінювали у двох порціях сечі, зібраних з 18:00 до 22:00 (відображає секрецію мелатоніну вдень) та з 22:00 до 06:00(відображає секрецію мелатоніну вночі) і розраховували середньодобовий показник екскреції 6-SMT (нг/мг креатиніну).
| Характеристика | Група хворих на ОА (n=89) | |||
|---|---|---|---|---|
| 1-ша (n=31) |
2-га (n=26) |
3-тя (n=32) |
||
| Чоловіки | n (%) | 8 (25,8) | 4 (15,4) | 8 (25,0) |
| Жінки | n (%) | 23 (74,2) | 22 (84,6) | 24 (75,0) |
| Вік, років | M±σ | 57,3±5,42 | 59,7±6,02 | 59,3±7,33 |
| Гонартроз | n (%) | 28 (90,3) | 23 (88,5) | 27 (84,4) |
| Гонартроз + коксартроз | n (%) | 3 (9,7) | 3 (11,5) | 5 (15,6) |
| Синовіт | n (%) | 7 (22,6) | 7 (26,9) | 10 (31,3) |
| Тривалість ОА, років | M±σ | 9,23±6,41 | 10,5±5,14 | 10,7±7,54 |
| Рентгенологічна стадія ІІ | n (%) | 23 (74,2) | 14 (53,8) | 20 (62,5) |
| Рентгенологічна стадія ІІІ | n (%) | 8 (25,8) | 12 (46,2) | 12 (37,5) |
| 6-SMT, нг/мг креатиніну | M±σ | 22,0±2,76 | 14,2±2,37 | 14,3±2,53 |
| Фармакотерапія | Стандартна | Стандартна | Стандартна + мелатонін | |
*p≤0,001 відносно 1-ї групи.
Статистичну обробку результатів проводили за допомогою комп’ютерних програм MS Excel, IBM Statistics SPSS 22, STATISTICA 6,0. Достовірність результатів визначали за t-критерієм Стьюдента (при параметричному розподілі даних) та Краскела-Уолліса (при непараметричному розподілі даних). Нормальність розподілу визначали за критерієм Шапіро — Уїлка. Результати наведено як М±σ. Відмінності вважали статистично значущими при р<0,05.
Результати та їх обговорення
Встановлено (табл. 2), що за станом «до лікування» у хворих на ОА з нормальним рівнем 6-SMT (1-ша група) якість сну була достовірно кращою, ніж у хворих зі зниженою екскрецією 6-SMT (3-тя група), про що свідчать більш високі (на 19,1%) показники шкали якості нічного сну та нижчі (на 27,2%) показники шкали денної сонливості Epworth. Застосування стандартної схеми лікування через 12 тиж не викликало суттєвих змін показників якості нічного сну та денної сонливості за шкалою Epworth у хворих на ОА зі збереженою та зниженою екскрецією 6-SMT. Модифікована терапія (із включенням мелатоніну) забезпечувала статистично значуще зменшення вираженості ознак інсомнії за шкалою якості нічного сну та шкалою Epworth (в середньому в 1,3 раза відносно стану «до лікування»). Серед пацієнтів 2-ї та 3-ї групи за станом «до лікування» виявлялося вдвічі більше осіб зі значною інсомнією (<19 балів за шкалою якості нічного сну), ніж серед пацієнтів 1-ї групи 1 (65,4 та 78,1% відповідно проти 38,7%; p<0,05). Через 12 тиж у 3-й групі частка осіб з вираженою інсомнією >19 балів зменшилася до 28,1% (p<0,05), а у 2-й групі — навіть невірогідно зросла до 76,9% (p>0,05).
| Показник, балів | Група хворих на ОА (n=89) | |||
|---|---|---|---|---|
| 1-ша (n=31) |
2-га (n=26) |
3-тя (n=32) |
||
| Якість нічного сну | до лікування | 18,7±4,53 | 17,1±4,04 | 15,7±3,20 |
| через 12 тиж | 20,5±4,22 | 16,4±2,70 | 19,8±2,83 | |
| динаміка, % | 11,5±15,8 | –1,82±13,5 | 30,8±29,3 | |
| Шкала Epworth | до лікування | 8,23±4,39 | 9,62±4,92 | 11,3±4,08 |
| через 12 тиж | 7,16±3,19 | 8,77±3,13 | 6,97±2,92 | |
| динаміка, % | –9,66±25,0 | 3,14±31,5 | –33,9±36,1 | |
| Шкала депресії Бека | до лікування | 15,4±5,17 | 16,9±5,64 | 16,9±6,62 |
| через 12 тиж | 14,3±5,29 | 16,3±5,99 | 13,9±5,07 | |
| динаміка, % | –6,5±14,8 | 3,0±38,1 | –13,7±20,9 | |
У табл. 2–4: *p<0,05 та **p<0,01 відносно стану «до лікування»; p<0,05 відносно показника у 1-й групі; p<0,05 відносно показника у 2-й групі.
За показниками шкали депресії Бека станом «до лікування» групи хворих на ОА суттєво не відрізнялись. Зауважимо, що частота виявлення легких та помірних депресивних розладів за шкалою Бека у 2-й та 3-й групі була вищою, ніж серед хворих 1-ї групи (80,8 та 65,7% проти 58,1%; p<0,05). У хворих на ОА зі зниженою екскрецією 6-SMT модифікована терапія сприяла достовірному зменшенню (в 1,2 раза) вираженості депресивних розладів, на відміну від стандартної терапії.
Аналіз динаміки клінічних індексів ОА виявив відмінності в ефективності стандартної та модифікованої терапії у хворих з аберантною продукцією мелатоніну (табл. 3). Стандартна терапія забезпечила достовірне зниження індексів Лекена та HAQ у хворих 1-ї групи (в середньому в 1,32 та 1,48 раза), в той час як у хворих 2-ї групи ці показники суттєво не змінилися. Водночас модифікована терапія забезпечила достовірне зниження (в 1,28 та 1,55 раза) індексів Лекена та HAQ у хворих 3-ї групи.
| Показник, балів | Група хворих на ОА (n=89) | |||
|---|---|---|---|---|
|
1-ша (n=31) |
2-га (n=26) |
3-тя (n=32) |
||
| Індекс Лекена | до лікування | 15,0±3,77 | 16,4±4,30 | 15,6±4,50 |
| через 12 тиж | 11,4±5,23 | 14,5±4,37 | 12,2±4,75 | |
| динаміка, % | –25,8±24,8 | –12,6±9,25 | –23,0±16,7 | |
| Індекс HAQ | до лікування | 1,20±0,39 | 1,40±0,33 | 1,18±0,36 |
| через 12 тиж | 0,81±0,32 | 1,24±0,25 | 0,76±0,35 | |
| динаміка, % | –33,7±11,3 | –10,0±14,6 | –37,8±15,7 | |
За станом «до лікування» групи хворих на ОА суттєво не відрізнялися за показниками індексу KOOS (табл. 4). Через 12 тиж стандартної терапії у хворих 1-ї групи відзначали статистично значуще підвищення показників за шкалою болю, симптомів, функції (повсякденне життя) та якості життя за індексом KOOS в середньому в 1,22; 1,18 та 1,25 раза, в той час як шкала функції спорт (активний відпочинок) практично не змінилась. У хворих 2-ї групи стандартна терапія упродовж 12 тиж не забезпечувала значущого підвищення показників шкали індексу KOOS, в той час як модифікована терапія викликала підвищення всіх показників індексу KOOS у хворих 3-ї групи (в середньому в 1,25–1,31 раза). У хворих 3-ї групи динаміка шкали болю, симптомів, функції, спорту, якості життя індексу KOOS достовірно перевищувала (в 1,73; 1,60; 1,28; 1,89 та 1,63 раза відповідно) динаміку у хворих 2-ї групи.
| Показник, балів | Група хворих на ОА (n=89) | |||
|---|---|---|---|---|
|
1-ша (n=31) |
2-га (n=26) |
3-тя (n=32) |
||
| Показники індексу KOOS | ||||
| Біль | до лікування | 48,0±10,9 | 47,3±11,7 | 46,9±13,1 |
| через 12 тиж | 58,7±13,4** | 54,2±14,5 | 58,5±16,7** | |
| динаміка, % | 23,3±17,4 | 14,6±11,6 | 25,3±12,4 | |
| Симптоми + скутість | до лікування | 55,0±14,6 | 51,5±17,4 | 50,6±12,4 |
| через 12 тиж | 65,0±16,4* | 60,4±20,6 | 65,0±18,0** | |
| динаміка, % | 19,6±14,5 | 17,9±15,4 | 28,7±20,7 | |
| Функція (повсякден-не життя) | до лікування | 51,7±11,6 | 52,9±15,0 | 52,7±13,0 |
| через 12 тиж | 60,8±12,4* | 62,2±18,7 | 64,5±16,9** | |
| динаміка, % | 18,8±14,4 | 17,8±13,4 | 22,9±17,1 | |
| Функція (спорт) | до лікування | 31,0±13,0 | 31,2±11,9 | 28,9±12,7 |
| через 12 тиж | 37,9±16,8 | 35,8±16,2 | 36,1±16,5* | |
| динаміка, % | 23,6±20,4 | 13,5±19,5 | 25,6±19,6 | |
| Якість життя | до лікування | 42,5±11,0 | 44,5±12,6 | 43,6±14,9 |
| через 12 тиж | 53,2±14,4** | 52,9±14,8* | 57,0±17,5** | |
| динаміка, % | 25,7±15,2 | 20,2±17,9 | 32,8±16,6 | |
| Показники індексу WOMAC | ||||
| Біль | до лікування | 44,5±14,8 | 49,9±15,7 | 47,8±14,6 |
| через 12 тиж | 32,7±14,3** | 42,1±18,4 | 33,2±14,5** | |
| динаміка, % | –26,9±18,5 | –17,7±15,9 | –32,1±16,2 | |
| Симптоми + скутість | до лікування | 50,0±18,6 | 53,4±23,1 | 54,5±16,8 |
| через 12 тиж | 36,8±18,0* | 45,7±22,2 | 38,7±17,2** | |
| динаміка, % | –27,5±20,5 | –16,5±11,4 | –30,5±16,8 | |
| Фізична активність | до лікування | 46,2±15,3 | 48,4±21,6 | 49,1±14,1 |
| через 12 тиж | 36,4±15,8* | 41,4±21,1 | 37,2±14,2* | |
| динаміка, % | –22,0±18,4 | –16,7±12,1 | –25,1±15,7 | |
| Сумарний WOMAC | до лікування | 46,9±13,9 | 50,6±18,8 | 50,4±13,2 |
| через 12 тиж | 35,3±14,4** | 43,1±19,5 | 36,4±14,1** | |
| динаміка, % | –25,8±17,7 | –17,3±12,1 | –29,5±14,8 | |
Аналогічні закономірності спостерігали і при аналізі показників індексу WOMAC. Через 12 тиж стандартної терапії у хворих 1-ї групи відзначали статистично значуще зниження показників шкали болю, симптомів, фізичної активності та сумарного індексу WOMAC (в 1,36; 1,35; 1,27 та 1,33 раза), на відміну від хворих 2-ї групи. Однак під впливом модифікованої терапії у хворих на ОА зі зниженим рівнем екскреції 6-SMТ динаміка шкали болю, симптомів та сумарний WOMAC підвищувались у 1,81; 1,85 та 1,71 раза (p<0,05).
Отже, за індексами KOOS та WOMAC ефективність стандартної терапії у хворих на ОА з нормальним рівнем екскреції 6-SMT була вищою, ніж у хворих зі зниженим рівнем екскреції 6-SMT. Включення мелатоніну до схеми лікування хворих на ОА зі зниженою екскрецією 6-SMT забезпечувало ефективніше зниження показників зазначених індексів, ніж стандартна терапія.
Серед хворих на ОА зі зниженою екскрецією 6-SMT достовірно частіше виявлялись нереспондери стандартної фармакотерапії за індексом WOMAC20, ніж серед хворих зі збереженою екскрецією 6-SMT (рисунок). У 1-й групі за шкалами болю, симптомів та фізичної активності виявляли 54,8; 61,3 та 51,6% респондерів WOMAC20, що було достовірно вищим, ніж у 2-й групі. Серед хворих 3-ї групи частки респондерів WOMAC20 за шкалою болю, симптомів та фізичної активності були вищими майже вдвічі порівняно з 2-ю групою (р<0,05). Cтандартна терапія забезпечила досягнення сумарного WOMAC20 у 58,1% хворих 1-ї групи та 30,8% хворих 2-ї групи, в той час як за модифікованої терапії 59,4% хворих 3-ї групи досягли рівня сумарного WOMAC20 (p<0,05).
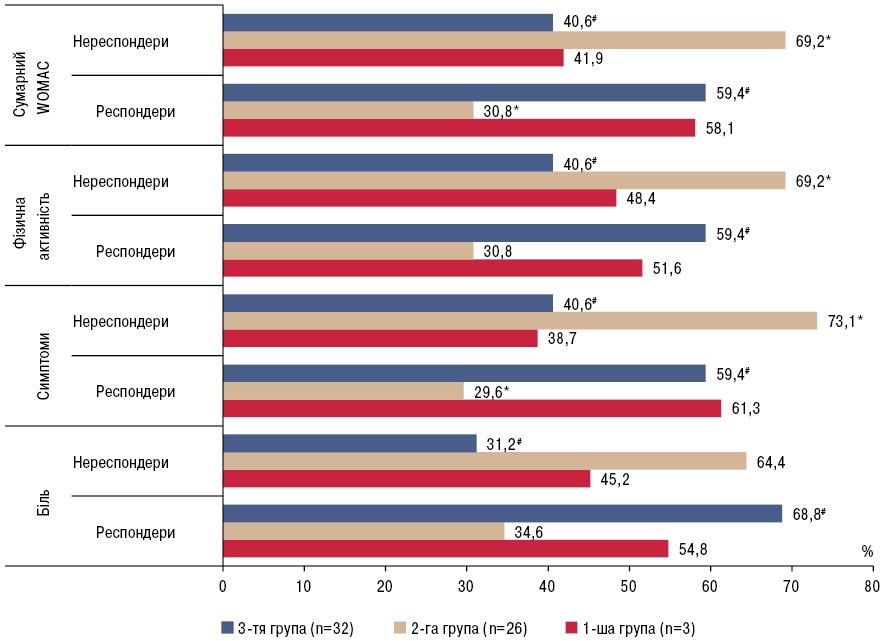
Таким чином, у хворих з нормальними рівнями 6-SMT шанси досягнення WOMAC20 були вищими (відносний шанс (ВШ) 3,12; 95% довірчий інтервал (ДІ) 1,04–9,33), ніж у хворих з аберантними рівнями 6-SMT. Включення до схеми лікування мелатоніну втричі підвищувало шанси досягнення WOMAC20 (ВШ 3,29; 95% ДІ 1,10–9,80) у пацієнтів зі зниженою екскрецією 6-SMT через 12 тиж лікування. В середньому у нереспондерів за WOMAC20 вихідні рівні екскреції 6-SMT були нижчими (в 1,21 раза), ніж у респондерів (16,9±4,53 нг/мг проти 20,4±4,20 нг/мг креатиніну). За результатами ROC-аналізу рівень 6-SMT із точкою відсікання >17,6 нг/мг креатиніну можна розглядати як досить чутливий, але неспецифічний предиктор стану «респондер» у хворих на ОА колінних суглобів (чутливість — 0,875, специфічність — 0,600; площа під кривою — 0,740; 95% ДІ 0,605 — 0,876, р=0,003).
Механізми, через які екзогенний мелатонін може підвищувати ефективність фармакотерапії у хворих на ОА, потребують більш детального вивчення. Можна припустити, що цей ефект пов’язаний із власною антиоксидантною, імуномодулюючою та антиноцицептивною дією мелатоніну. Зокрема, екзогенний мелатонін підвищував анальгезивний ефект диклофенаку у пацієнтів із хронічним болем у спині [3], сприяв нормалізації біохімічних розладів (зменшував активність вільнорадикальних процесів, коригував колагенолітичну активність плазми) у пацієнтів з ОА [4]. У осіб із фіброміалгією застосування мелатоніну поряд із покращенням якості сну, зниженням рівня тривожності та депресії викликало зменшення вираженості больового синдрому та ранкової скутості [2, 16].
Висновки
1. Серед хворих на ОА з аберантними рівнями екскреції 6-SMT через 12 тиж стандартної протиартрозної фармакотерапії (диклофенак натрію, глюкозаміну гідрохлорид, хондроїтинсульфат) виявилась вища (в 1,7 раза) частка нереспондерів за критерієм WOMAC20, ніж серед хворих із нормальним рівнем екскреції 6-SMT.
2. Модифікація стандартної фармакотерапії включенням мелатоніну (в дозі 3 мг/добу) у хворих на ОА з аберантними рівнями екскреції 6-SMT забезпечувала покращення якості сну, зменшення депресивних розладів, прискорювала позитивну динаміку клінічних індексів Лекена, HAQ, WOMAC та KOOS і суттєво підвищувала шанси досягнення клінічної відповіді на лікування на рівні WOMAC20 (ВШ 3,29; 95% ДІ 1,10–9,80).
Список використаної літератури
- 1. Вейн А.М., Левин Я.И. (1998) Принципы современной фармакотерапии инсомний. Журн. неврол. психиатр., 5: 39–43.
- 2. Коляденко С.В., Станіславчук М.А. (2006) Вплив додаткового призначення мелатоніну та його поєднання з флуоксетином на основні клінічні прояви фіброміалгії. Вісн. Вінниц. нац. мед. ун-ту, 10(2): 263–268.
- 3. Курганова Ю.М., Данилов А.Б. (2015) Мелатонин при хронической боли в спине: миф или реальность. Manage pain, 1: 30–34.
- 4. Пішак О.В., Волошин О.І., Микитюк О.П. та ін. (2010) Медикаментозна корекція циркадіанних ритмів метаболічних процесів у пацієнтів з остеоартрозом та подагрою. Буковин. мед. вісн., 4(56): 85–92.
- 5. Стасенко Т. (2017) Остеоартроз: оптимальний вибір для успішного лікування. Укр. мед. часопис, 2(118): 9–11 (http://www.umj.com.ua).
- 6. Фаршатова Е.Р., Камилов Ф.Х., Еникеев Д.А., Халиков А.А. (2009) Клинико-биохимическая оценка применения мелатонина в терапии первичного деформирующего остеоартроза у женщин на фоне депрессии. Мед. вест. Башкортостана, 4(2): 58–61.
- 7. Akagi R., Akatsu Y., Fisch K.M. et al. (2017) Dysregulated circadian rhythm pathway in human osteoarthritis: NR1D1 and BMAL1 suppression alters TGF-β signaling in chondrocytes. Osteoarthritis Cartilage, 25(6): 943–951.
- 8. Altman R.D. (1991) Criteria for the classification of clinical osteoarthritis J. Rheumatol., 18(Suppl. 27): 10–12.
- 9. Beck A.T., Ward C.H., Mendelson M. et al. (1961) An Inventory for Measuring Depression. Archiv. Gen. Psychiatry, 4(6): 561–571.
- 10. Bellamy N., Bell M., Goldsmith C.et al. (2005) Evaluation of WOMAC 20, 50, 70 response criteria in patients treated with hylan G-F 20 for knee osteoarthritis. Ann. Rheum. Dis., 64(6): 881–885.
- 11. Bellamy N., Buchanan W., Goldsmith C. et al. (1988) Validation study of WOMAC: A Health Status instrument for measuring clinically importent patient relevant outcomes to antirheumatic drug therapy in patients with osteoarhritis of the hip or knee. J. Rheumatol., 15(12): 1833–1840.
- 12. Bruce B., Fries J.F. (2003) The Stanford Health Assessment Questionnaire: Dimensions and Practical Applications. Health and Quality of Life Outcomes, 1: 20.
- 13. Bruyère O., Cooper C., Pelletier J.P. et al. (2014) An algorithm recommendation for the management of knee osteoarthritis in Europe and internationally: a report from a task force of the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO). Semin. Arthritis Rheum., 44(3): 253–263.
- 14. Bruyère O., Cooper C., Pelletier J.P. et al. (2016) A consensus statement on the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO) algorithm for the management of knee osteoarthritis-From evidence-based medicine to the real-life setting. Sem. Arth. Rheum., 45(Suppl. 4): 3–11.
- 15. Cucchiarini M., de Girolamo L., Filardo G. et al. (2016) Basic science of osteoarthritis. J. Exp. Orthop., 3(1): 22.
- 16. de Zanette S.A., Vercelino R., Laste G. et al. (2014) Melatonin analgesia is associated with improvement of the descending endogenous pain-modulating system in fibromyalgia: a phase II, randomized, double-dummy, controlled trial. BMC Pharmacol. Toxicol., 15: 40.
- 17. Fernandes L., Hagen K.B., Bijlsma J.W. et al. (2013) EULAR recommendations for the non-pharmacological core management of hip and knee osteoarthritis. Ann. Rheum. Dis., 72(7): 1125–1135.
- 18. Guo J.Y., Li F., Wen Y.B. et al. (2017) Melatonin inhibits Sirt1-dependent NAMPT and NFAT5 signaling in chondrocytes to attenuate osteoarthritis. Oncotarget, 8(34): 55967–55983.
- 19. Hochberg M.C., Altman R.D., April K.T. et al. (2012) American College of Rheumatology 2012 recommendations for the use of nonpharmacologic and pharmacologic therapies in osteoarthritis of the hand, hip, and knee. Arth. Care Res. (Hoboken), 64(4): 465–474.
- 20. Hong Y., Kim H., Lee S. et al. (2017) Role of melatonin combined with exercise as a switch-like regulator for circadian behavior in advanced osteoarthritic knee. Oncotarget, 8(57): 97633–97647.
- 21. Johns M.W. (1991) A new method for measuring daytime sleepiness: the Epworth sleepiness scale. Sleep,14(6): 540–545.
- 22. Kim H.J., Kim H.J., Bae M.K., Kim Y.D. (2017) Suppression of osteoclastogenesis by melatonin: a melatonin receptor-independent action. Int. J. Mol. Sci., 18(6): E1142.
- 23. Lequesne M.G. (1997) The algofunctional indices for hip and knee osteoarthritis. J. Rheumatol., 24(4): 779–781.
- 24. McAlindon T.E., Bannuru R.R., Sullivan M.C. et al. (2014) OARSI guidelines for the non-surgical management of knee osteoarthritis. Osteoarthritis Cartilage, 22(3): 363–388.
- 25. Roos E.M., Roos H.P., Lohmander L.S. et al. (1998) Knee Injury and Osteoarthritis Outcome Score (KOOS) — development of a self-administered outcome measure. J. Orthop. Sports. Phys. Ther., 28(2): 88–96.
- 26. Snelling S.J., Forster A., Mukherjee S. et al. (2016) The chondrocyte-intrinsic circadian clock is disrupted in human osteoarthritis. Chronobiol Int., 33(5): 574–579.
- 27. Zhang W., Doherty M., Peat G. et al. (2010) EULAR evidence-based recommendations for the diagnosis of knee osteoarthritis. Ann. Rheum. Dis., 69(3): 483–489.
ЭФФЕКТИВНОСТЬ ФАРМАКОТЕРАПИИ У БОЛЬНЫХ ОСТЕОАРТРОЗОМ КОЛЕННЫХ СУСТАВОВ С АБЕРРАНТНЫМИ УРОВНЯМИ ЭКСКРЕЦИИ 6-СУЛЬФАТОКСИМЕЛАТОНИНА
Резюме. Исследована эффективность фармакотерапии у больных остеоартрозом (ОА) коленных суставов с аберрантной продукцией мелатонина. У больных ОА с нормальным уровнем экскреции 6-сульфатоксимелатонина (6-SMT) под воздействием стандартной фармакотерапии (диклофенак натрия, глюкозамина гидрохлорид, хондроитинсульфат) динамика клинических показателей (индексы Лекена, HAQ, WOMAC, KOOS) была более выражена, чем у больных ОА с аберрантными уровнями экскреции 6-SMT. Через 12 нед лечения среди больных ОА со сниженной экскрецией 6-SMT часть нереспондеров WOMAC20 была в 1,7 раза выше, чем среди больных с нормальным уровнем экскреции 6-SMT. Включение мелатонина (3 мг/сут) в схему лечения у лиц с ОА с аберрантными уровнями экскреции 6-SMT обеспечивало улучшение качества сна, уменьшение выраженности депрессивных расстройств, повышало динамику клинических индексов (Лекена, HAQ, WOMAC, KOOS) и втрое повышало шансы достижения WOMAC20.
остеоартроз, мелатонин, 6-сульфатоксимелатонин, фармакотерапия.
Адреса для листування:
Станіславчук Микола Адамович
21018, Вінниця, вул. Пирогова, 46
Вінницький національний медичний
університет ім. М.І. Пирогова,
кафедра внутрішньої медицини № 1
E-mail: mstanislav53@yahoo.com

Leave a comment