До 70-річчя створення Європейської антиревматичної ліги: досягнення ревматології
Коваленко В.М.1, Головач І.Ю.2, Яременко О.Б.3, Рекалов Д.Г.4, Шуба Н.М.5, Гарміш О.О.1, Гнилорибов А.М.6, Тер-Вартаньян С.Х.7
- 1ДУ «Національний науковий центр «Інститут кардіології ім. М.Д. Стражеска» НАМН України», Київ
- 2Клінічна лікарня «Феофанія» Державного управління справами, Київ
- 3Національний медичний університет ім. О.О. Богомольця, Київ
- 4Запорізький державний медичний університет
- 5Національна медична академія післядипломної освіти ім. П.Л. Шупика, Київ
- 6ГУ «Институт неотложной и восстановительной хирургии им. В.К. Гусака НАМН Украины»
- 7Міський ревматологічний центр, Київ, Центральна міська клінічна лікарня м. Києва
Резюме. У 1947 р. створена Європейська антиревматична ліга (EULAR) для боротьби з ревматичними і м’язово-скелетними захворюваннями. Мета EULAR — зменшення тягаря ревматичних захворювань та поліпшення лікування, профілактики й реабілітації патології опорно-рухового апарату. В оглядовій статті представлено досягнення світової ревматологічної науки за останні 70 років, проаналізовано етапи розвитку ревматології та вплив цих відкриттів на якість життя пацієнтів із ревматичними захворюваннями. Прогрес у ревматології зумовлений в основному розробленням протизапальних та імуномодулювальних препаратів і лікарських засобів, що модифікують перебіг хвороби.
У цьому році Європейська антиревматична ліга (EULAR) святкує ювілей — 70-річчя створення. І хоча ревматичні захворювання відомі давно і займають вагоме місце у структурі захворюваності й інвалідності, саме у 1947 р. європейські ревматологи об’єдналися для боротьби з ревматичними і м’язово-скелетними захворюваннями. Мета EULAR — зменшення тягаря ревматичних захворювань та покращення лікування, профілактики й реабілітації патології опорно-рухового апарату.
EULAR — головна організація, що представляє наукові медичні товариства, медичні асоціації та громадські організації для пацієнтів із ревматичними і м’язово-скелетними захворюваннями. Вітаючи всю європейську ревматологічну громаду з ювілеєм, президент EULAR Герд Р. Бурместер сказав, що прогрес у ревматології був надзвичайним впродовж останніх 70 років, і це сприятливо вплинуло на якість життя пацієнтів із ревматичними захворюваннями. З 1947 р. EULAR постійно вдосконалювала передові технології в галузях освіти і досліджень у ревматології. Робота EULAR проводилася паралельно дивовижному прогресу в ревматології: численні смертельні ревматичні недуги стали керованими, і це дозволяє пацієнтам вести нормальний спосіб життя. Поступ у ревматології зумовлений в основному розвитком протизапальних, імуномодулювальних та модифікуючих хворобу лікарських засобів. Прогрес у ревматології, насамперед, пов’язаний із впровадженням глюкокортикоїдів (ГК) у клінічну практику (1948); наступним проривом стало застосування метотрексату — препарату, що модифікує перебіг ревматоїдного артриту (РА) (наприкінці 1960-х років). І на сьогодні ГК і метотрексат залишаються опорними стовпами в лікуванні хронічних запальних захворювань. Винахід моноклональних антитіл у 1975 р. став ще однією надважливою віхою в історії ревматології, що привело до створення специфічних таргетних ліків, які стали доступними для пацієнтів наприкінці 1990-х — на початку 2000-х років. Іншим важливим проривом у ревматології слід вважати визнання того факту, що рання діагностика та ранній початок лікування, спрямовані на досягнення ремісії (стратегія treat-to-target), зумовлюють суттєво кращі результати. Водночас наступним проривом слід вважати покращення методів візуалізації та створення конкретних біомаркерів для ранньої діагностики, що уможливило якраз ранню верифікацію клінічного діагнозу.
На офіційному сайті EULAR представлено відеопрезентацію, що демонструє історію асоціації від її заснування (у 1947 р.) і донині.
Перший Європейський конгрес ревматологів відбувся у вересні 1947 р. в Копенгагені та Орхусі. Саме тоді були обрані перші керівники EULAR: президент Метью-П’єр Вейль (Matthieu-Pierre Weil, Франція) та два віце-президенти — Ейнар Ярлов (Einar Jarlov) і президент ILAR (International League of Associations for Rheumatology) Фортескейк Фокс (Fortescue Fox, Велика Британія). До EULAR тоді увійшли національні ревматологічні товариства Бельгії, Чехословаччини, Данії, Великої Британії, Фінляндії, Франції, Голландії, Угорщини, Ісландії, Італії, Норвегії, Польщі, Румунії, Швейцарії, Іспанії, Швеції, Туреччини та Югославії. Головний офіс організації тоді розміщувався у Копенгагені.
У 1948 р. відбулася знакова подія для всієї ревматології: 21 вересня 1948 р. 29-літній жінці з РА була зроблена перша ін’єкція кортизону в достатньо високій дозі (100 мг) із разючим клінічним ефектом. Ревматологи Філіп Хенч та його колеги Чарлз Слокум і Ховард Полей розпочали еру сучасної ГК-терапії (рис. 1).

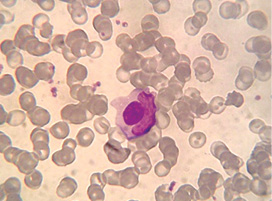
У 1948 р. M.M. Hargraves та співавтори описали незвичні клітини, що в подальшому були названі LE-клітинами, оскільки їх виявили саме у пацієнтів із системним червоним вовчаком (СЧВ), які спостерігалися в клініці Мейо (США). LE-клітини — це нейтрофільні лейкоцити, що фагоцитували денатуровані ядра інших лейкоцитів з утворенням великих гомогенних включень, що відтісняють ядро фагоцитуючого нейтрофіла до периферії (рис. 2). Пізніше було встановлено, що утворення LE-клітин індукується сироватковим фактором, що виявився імуноглобуліном і був названий «вовчаковим фактором». Відкриття LE-клітин і запровадження LE-тесту сприяло формуванню теорії аутоімунітету, що визначила розвиток вчення про системні захворювання сполучної тканини у другій половині ХХ ст.
У 1940-х роках відбулася ще одна важлива подія для ревматологів: у 1949 р. був описаний і застосований тест Ваалер — Роузе для визначення ревматоїдного фактора. Суть цієї реакції полягає у склеюванні сенсибілізованих баранячих еритроцитів при додаванні до них сироватки крові хворого на РА. Упровадження цієї методики дозволило вперше визнати гетерогенність РА та поділити його на сероваріанти.
Наступне десятиріччя ознаменувалося такими видатними подіями та відкриттями в ревматології. По-перше, у 1950 р. за відкриття ГК-гормонів та створення на цій основі ГК-препаратів Філіп Шоуолтер Хенч, Тадеуш Рейхтейн і Едвард Келвін Кендалл були відзначені Нобелівською премією в галузі медицини і фізіології [5].
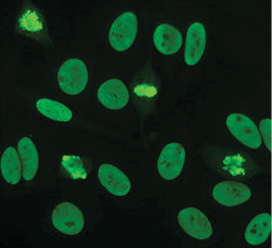
27 вересня 1957 р. група вчених (E.J. Holborow, D.M. Weir, G.D. Johnson) вперше продемонстрували ANA (antinuclear antibody — антинуклеарні антитіла) за допомогою непрямої імунофлюоресценції (рис. 3). Це стало першим свідченням того, що процеси, які впливають на ядро клітини, були відповідальними за СЧВ. У 1959 р. виявлено, що сироватка крові від осіб із СЧВ містить антитіла, які осаджуються сольовими екстрактами ядер, відомими як ядерні антитіла, що екстрагуються (ENA). Це привело до характеристики антигенів ENA та їх відповідних антитіл. Так, анти-Sm і анти-RNP-антитіла були відкриті у 1966 та 1971 р. відповідно. У 1970-ті роки також виявлено антитіла проти Ro/anti-SS-A та анти-La/анти-SS-B. У 1979 р. було з’ясовано, що антитіло Scl-70 є специфічним антитілом до склеродермії, проте антиген (топоізомераза-1) був охарактеризований лише у 1986 р. Антиген і антитіла до Jо-1 були описані у 1980 р.
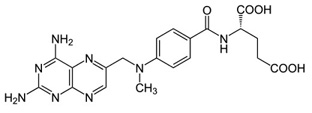
У 1950 р. уперше був синтезований метотрексат (аметоптерин). Це здійснено індійським ученим Єллапрагада Суббарао, який працював у американській компанії «Lederle» та займався синтезом антифолатних з’єднань з 1947 р. (рис. 4). У групу дослідників входив також американський онколог та педіатр Сідні Фарбер, який вперше застосував метотрексат у дітей із гострим лімфобластним лейкозом, що сприяло розвитку ремісії захворювання. Сьогодні метотрексат розглядають як один із найпотужніших і дієвих протизапальних препаратів для лікування не лише ревматологічних, але й інших імунозапальних захворювань у людини.
За період 1950–1959 рр. відбулося три Європейські конгреси ревматологів: у 1951 р. в Барселоні (Іспанія), у 1955 р. — у Схевенінгені (Нідерланди) та у 1959 р. — у Стамбулі (Туреччина). Водночас у 1955 р. секретаріат EULAR переїжджає до Брюсселю (Бельгія). У період 1960–1969 рр. відбулося два Європейські конгреси: у Стокгольмі (Швеція) в 1963 р. та у Лісабоні (Португалія) у 1967 р. У 1965 р. секретаріат EULAR розмістився у Базелі (Швейцарія) , а у 1987 р. переїхав до Цюриха (Швейцарія).
Саме у 1960-ті роки в рутинній ревматологічній практиці почали активно застосовувати кортизон для лікування пацієнтів із РА та СЧВ, також були вперше описані численні побічні ефекти. У той час кортизон сприймався як панацея в лікуванні РА, що стримувало певним чином застосування хворобо-модифікуючих антиревматичних препаратів (ХМАРП, DMARDs). Загальновідомо, як критично переглядалися погляди на ГК-терапію при РА в подальшому, перш за все з урахуванням їх симптоматично-базисного співвідношення та побічних ефектів.
У цей же період метотрексат отримав схвалення для застосування в лікуванні при РА.
Як відомо, при дослідженні метотрексату (та першого метаболіту — аметоптерину) було виявлено антипроліферативний ефект, що спонукало групу дослідників під керівництвом R. Gubner вперше випробувати його в 1951 р. у пацієнтів з РА [4]. Вони вводили препарат декільком пацієнтам із РА і псоріатичним артритом (ПсА) з добрим клінічним ефектом, який швидко завершувався при відміні препарату. У 1962 р. R.L. Black та співавтори повідомили про позитивні результати застосування метотрексату як при лікуванні РА, так і ПсА [1]. Фактично це вважається першим клінічним застосуванням метотрексату при РА.
Однак відкриття ГК та отримання Нобелівської премії Ф. Хенчем зіграло «злий жарт»: спільнота ревматологів не була заінтересована в тому, щоб розглядати метотрексат як дієвий препарат у лікуванні пацієнтів із РА частково внаслідок значного ентузіазму щодо ГК і стурбованості відносно використання протиракової терапії (у той час метотрексат активно застосовували для лікування при різних формах раку) для «доброякісних захворювань», яким на той час був РА [12].
У 1972 р. Рекс Хофмайстер, практикуючий ревматолог зі Спокана (Вашингтон, США), повідомив про позитивні ефекти при внутрішньом’язовому введенні метотрексату у дозах від 10 до 15 мг/тиж у 29 пацієнтів з РА. У наступні 5 років ще декілька груп дослідників повідомили про позитивні ефекти метотрексату в лікуванні при РА. А в 1983 р. було проведено перше рандомізоване плацебо-контрольоване 24-тижневе дослідження ефективності метотрексату за участю 35 пацієнтів із рефрактерним РА.
Однак саме в 60-ті роки ХХ ст. був подоланий негативізм щодо метотрексату, і він почав активно використовуватися у клінічній практиці. Історія застосування метотрексату в педіатричній практиці веде свій відлік з 1986 р., коли вчені з Німеччини H. Truckenbredt і R. Hafner опублікували результати спостережень 19 пацієнтів з ювенільним ідіопатичним артритом (ЮІА). У 12 (63%) пацієнтів було констатовано значне покращання стану.
У 1964 р. R.L. Nienhuis та E. Mandema [7] описали APNF (anti-peri-nuclear factor). Цей антиген представлений у кератогіалінових гранулах, що оточують ядро клітин слизової оболонки порожнини рота людини. Згодом було відкрито, що він відноситься до цитрулінових білків. Антитіла до циклічного цитрулінованого пептиду (ACPA, АЦЦП) з 2010 р. входять до класифікаційних критеріїв РА. Відкриття аутоантигенів, що містять цитрулін, властивих РА, стало однією з найважливіших подій у ревматології останнього часу в галузі серологічної діагностики.
У 1970-ті роки відбулося три Європейських конгреси EULAR: у 1971 р. у Брайтоні (Велика Британія), у 1975 р. — у Гельсінкі (Фінляндія), у 1979 р. — у Вісбадені (Німеччина). Саме на цьому конгресі вперше президентом EULAR було обрано жінку — професора Насонову Валентину Олександрівну (1979–1981).
Період 1970–1979 рр. ознаменувався відомими відкриттями, що мали значення не лише для ревматології, але й для медицини загалом. Насамперед, це відкриття механізму дії ацетилсаліцилової кислоти та гальмування синтезу простагландинів, створення моноклональних антитіл, перше використання технології магнітно-резонансної томографії у діагностиці та отримання Нобелівської премії у 1979 р. в галузі медицини і фізіології за розробку технології комп’ютерної томографії.
23 червня 1971 р. британський фармаколог Джон Вейн (J. Vane) (рис. 5) опублікував свої дослідження про механізм дії ацетилсаліцилової кислоти у статті «Гальмування синтезу простагландинів як механізм дії аспіринподібних ліків», ацетилсаліцилову кислоту у всьому світі почали застосовувати для профілактики серцево-судинних захворювань. Д. Вейн виявив, що ацетилсаліцилова кислота сповільнює виробництво у тромбоцитах простагландинів і тромбоксану A2, що й зумовлює його антитромботичну і кардіопротекторну дії, що переконливо доведено надалі в багатьох великих дослідженнях і метааналізах [11]. Д. Вейн припустив, що саме антипростагландинова активність нестероїдних протизапальних препаратів (НПЗП) лежить в основі їх протизапального, жарознижувального й анальгезивного ефектів.

Разом із Суне Бергстремом і Бенгтом Самуельсоном Д. Вейн був удостоєний Нобелівської премії з фізіології та медицини у 1982 р. Нобелівський комітет відзначив його за «відкриття простагландинів і аналогічних біологічно активних речовин». У 1984 р. він був посвячений у лицарі за заслуги перед фармацевтичною наукою. Д. Вейн говорив про себе: «Моє життя та існування пов’язане з ферментами і медіаторами — це захоплюючий детектив; знайти раніше невідомі шляхи і взаємодії, щоб прийти до нових важливих концепцій і препаратів».
Потрібно додати, що Нemler та співавтори у 1976 р. ідентифікували і виділили фармакологічну ціль дії ацетилсаліцилової кислоти — фермент циклооксигеназу (ЦОГ). ЦОГ-2 відкрив у 1991 р. Даніель Л. Сіммонс з Університету Brigham Young.
У 1975 р. відбулося революційне відкриття для ревматології, гематології, онкології та загалом для клінічної і експериментальної медицини — був запропонований шлях створення моноклональних антитіл. У 1975 р. Георг Келер (George Kohler) та Цезар Мільштейн (Cesar Milstein) розробили методику отримання клітинних гібридів — гібридом [6].
У 1970-х роках молодий німецький імунолог Георг Келер вивчав генетичну мінливість антитіл. Для дослідження потрібно було ізолювати клон антитілоутворювальних клітин (АУК) — плазматичних клітин (похідних від В-лімфоцитів). Необхідно зазначити, що В-лімфоцити можуть жити лише в організмі господаря, у штучному живильному середовищі вони швидко гинуть. Їх тривале культивування поза організмом неможливе. Навпаки, клітини пухлини з плазматичних клітин (плазмоцитома чи мієлома), добре культивуються і розмножуються in vitro, їх називають «безсмертними». Для реалізації проекту Г. Келер поїхав до Англії, в лабораторію Цезаря Мільштейна, який вивчав клони плазмоцитом, і вони разом розробили оригінальний підхід до цієї проблеми: вирішили отримати гібрид нормальної АУК і пухлинної клітини. У разі успіху такий гібрид успадкував би від нормальної клітини здатність до синтезу антитіл, а від пухлинної — безсмертя і здатність до необмеженого і безконтрольного зростання. Це їм вдалося здійснити, створивши гібридомну технологію. Метод гібридизації соматичних клітин in vitro здійснюється шляхом злиття різнорідних клітин. Різнорідні клітини, в яких злилися оболонки, утворювали гібриди, які зберігали здатність до клітинних поділів. Таким чином, виникав істинний гібрид, нащадок двох соматичних клітин, або гібридома. Келер і Мільштейн отримали гібрид між нормальною АУК і пухлинною (мієломною) клітиною.
Гібридоми революціонізували імунологію і створили в ній абсолютно нові галузі. Завдяки гібридомам виникли нові методи діагностики багатьох захворювань і відкрилися нові шляхи для вивчення злоякісних пухлин та багатьох інших захворювань. У зв’язку з цим вчені, які відкрили технологію отримання моноклональних антитіл — Георг Келер та Цезар Мільштейн, відзначені у 1984 р. Нобелівською премією (рис. 6).

Паралельно клінічним і лабораторним дослідженням і відкриттям інтенсивно розвивалася й інструментальна діагностика. У 1979 р. також була присуджена Нобелівська премія Годфрі Хаунсфільду та Аллану Кормаку за розвиток комп’ютерної томографії. Іменем Хаунсфільда також названа шкала вимірювання густини середовища для рентгенівських променів, що використовується в томографії — шкала Хаунсфільда. Спочатку час, необхідний для сканування об’єкта, становив 9 днів, що було пов’язано з низькоінтенсивним джерелом гамма-променів, що вимагало тривалих експозицій. Потужна рентгенівська трубка зменшувала час дослідження до 9 год. Вдалі зображення були отримані при обстеженні головного мозку людини, головного мозку живого теляти і ділянки нирок свині. Контрастність отриманих знімків була вельми чіткою і дозволяла оцінити тканини головного мозку та інших органів, але не було впевненості, що цей метод дасть можливість відрізнити уражені тканини від нормальних, наприклад, виявити пухлину. Для досягнення цієї мети у 1971 р. в госпіталі Аткінсона Морлі в Уїмблдоні був сконструйований і змонтований швидкий і складний апарат, перший клінічний КАТ-сканер. У 1972 р. була зроблена перша сканограма головного мозку жінки з підозрою на його ураження, і отримані зображення чітко показали наявність темної округлої кісти. Поступово були змонтовані більші та швидші сканери, які зменшили час сканування спочатку до 18 с, а потім до 3 с або менше, даючи зображення різних органів з високою роздільною здатністю.
Початком використання методу ультразвукової діагностики в ревматології вважається 1972 р., коли D.G. McDonald і G.R. Leopold вперше продемонстрували кісту Бейкера за допомогою ультразвуку. Застосування ультразвукового методу для обстеження суглобів дозволило оцінити не лише кісткові структури, але й м’які тканини: синовіальну оболонку, м’язи, хрящі. Це уможливило разом із рентгенологічним дослідженням отримувати точнішу інформацію про стан суглоба.
У 1975 р. відбулися зміни і в самій структурі секретаріату EULAR. Вперше було створено 8 постійних комітетів — навчання, епідеміологія, педіатрична ревматологія, соціальне та громадське агентство, міжнародне і національне агентство, агентство клінічних досліджень, агентство публікацій, тренінгів та акредитацій та комітет хірургії ревматичних захворювань.
У 1973 р. Національна соціальна ліга презентувала на EULAR свою програму, а в 1975 р. був створений постійнодіючий комітет — PARE — People with Arthritis/Rheumatism in Europe (Люди з артритом/ревматизмом у Європі). Основні завдання PARE:
- Розвивати потужну мережу ефективних користувачів із ревматичними захворюваннями.
- Забезпечити право бути почутими людям з ревматичними захворюваннями та вплив на тих, хто приймає рішення в Європі.
- Створити потужні альянси, які змінять життя людей із ревматичними захворюваннями.
З того часу кожна країна-член представлена одним делегатом у комітеті. Постійний комітет щорічно збирається з нагоди з’їзду EULAR, щоб ознайомитися з прогресом у ревматологічній науці та планувати подальшу діяльність.
За період 1980–1989 рр. проведено два конгреси EULAR — у Москві (на той час СРСР) у 1983 р. та в Афінах (Греція) у 1987 р.
У 80-ті роки ХХ ст. відбувся прорив у застосуванні метотрексату в лікуванні пацієнтів із РА та ПсА, цей препарат визнаний ефективним, він увійшов до рекомендацій та до списку базисних ХМАРП.
У 1982 р. D.J. Davies та співавтори [2] вперше описали ANCA (anti-neutrophil cytoplasmic antibodies) при сегментарному некротизуючому гломерулонефриті. У 1985 р. F.J. van der Woude та співавтори [10] також описали ці антитіла при гранулематозі Вегенера (гранулематоз із поліангіїтом за сучасною класифікацією). Другий Міжнародний практичний семінар з ANCA, який відбувся у травні 1989 р. в Нідерландах, запропонував номенклатуру щодо перинуклеарних та цитоплазматичних моделей, а антигени MPO (мієлопероксидази) та PR3 (протеїнази-3) були виявлені відповідно у 1988 та 1989 р. Ці відкриття проклали новий шлях до лабораторної діагностики системних васкулітів, виділення нових патогенетичних груп — ANCA-асоційованих васкулітів.
У 1984 р. створене перше анти-CD4-моноклональне антитіло для лікування пацієнтів із РА. У молекулярній біології CD4 (кластер диференціювання 4) — це глікопротеїн, що знаходиться на поверхні імунних клітин, таких як Т-хелперні клітини, моноцити, макрофаги та дендритні клітини. Він виявлений наприкінці 1970-х років і спочатку був відомий як leu-3 та T4, перш ніж його у 1984 р. назвали CD4.
У 80-ті роки ХХ ст. також було присуджено дві Нобелівські премії в галузі медицини, що напряму стосуються ревматології — відкриття механізмів дії ацетилсаліцилової кислоти (1982) та створення моноклональних антитіл (1984).
У 1990-х роках було проведено три Європейські конгреси EULAR: у 1991 р. у Будапешті (Угорщина), в 1995 р. — у Амстердамі (Нідерланди) та у 1999 р. — у Глазго (Шотландія). З 1993 р. почав діяти післядипломний курс навчання ревматологів, організований EULAR. Спочатку він носив очний характер (перший курс відбувся у 1993 р. у Левені (Бельгія)), а згодом став заочним. За ініціативою EULAR з 1996 р. щорічно відзначається Всесвітній день артриту.
У 90-х роках ХХ ст. відбулася ще одна найвидатніша подія — препарати моноклональних антитіл стали доступними для пацієнтів із ревматичними захворюваннями. Моноклональні антитіла, на відміну від традиційних препаратів, є високоспецифічними до певних мішеней-антигенів. Тому застосування моноклональних антитіл як терапевтичних агентів стало для медицини стратегічним етапом у зміні концепції лікування — від неспецифічної до специфічної (таргетної) терапії.
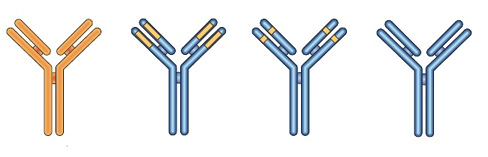
Терапевтичне застосування моноклональних антитіл, які були мишачими антитілами, було обмеженим. Їх введення людині супроводжувалося імунною відповіддю на чужий (гетерогенний) мишачий білок. Це призводило до швидкого усунення бажаного терапевтичного ефекту, а також ураження нирок і гіперчутливості до чужорідного мишачого білка. Однак незабаром був розроблений ще один підхід, що значно розширив терапевтичні можливості моноклональних антитіл. Користуючись технікою рекомбінантних ДНК, вчені зуміли примусити клітини гризунів до вироблення антитіл із людськими Fc-фрагментами (рис. 7). Виробництво моноклональних антитіл є сегментом фармацевтичної індустрії, що швидко розвивається. За підсумками 2010 р. два моноклональних антитіла — Rituxan/MabThera і Remicade — увійшли в тoп-5 блокбастерів серед біотехнологічних препаратів.
Цьому прориву в терапевтичних можливостях сприяли новаторські дослідження професора сера Равіндера Маїні та професора сера Марка Фельдмана, які працювали в Інституті Кеннеді в Лондоні та представили перші химерні моноклональні антитіла до фактора некрозу пухлини (ФНП)-α для лікування пацієнтів з РА [3]. У 2003 р. вони отримали премію Альберта Ласкера за клінічні медичні дослідження, які виявили терапію анти-ФНП як ефективне лікування при РА та інших аутоімунних захворюваннях. Незважаючи на початковий скепсис із дослідного співтовариства про свою ідею, Марк Фельдман і сер Равіндер Маїні перетворили свої знахідки в лабораторії на потужне лікування (рис. 8).

Інгібітори ФНП-α докорінно змінили весь терапевтичний підхід не тільки для РА, а й для анкілозивного спондиліту (АС) і ПсА. Насамперед, вони започаткували таргетну терапію, спрямовану на контроль прогресування захворювання, і переконливо довели можливість досягнення ремісії чи низької активності у пацієнтів з РА. Ці препарати подарували надію сотням тисяч пацієнтам на одужання або ж на жорсткий контроль хвороби, а також надихнули дослідників йти далі по шляху створення нових лікарських препаратів. Саме впровадження інгібіторів ФНП-α у клінічну практику привело згодом до перегляду стратегії та менеджменту хворих на РА.
Нобелівську премію у 1996 р. отримали австралієць Пітер Доєрті (Peter C. Doherty) і швейцарець Рольф Цинкернагель (Rolf M. Zinkernagel) за відкриття способу розпізнавання імунною системою чужорідних мікроорганізмів і власних молекул. Це відкриття дозволило медицині активно розвиватися в напрямку зміцнення імунітету проти широкого спектра захворювань, в тому числі раку. А також у напрямку зниження ефекту аутоімунних реакцій організму.
У 1996 р. також вперше було запропоновано дві шкали для оцінки активності та прогресування РА: шкала DAS та радіологічна шкала — модифікована шкала Sharp — van der Heijde. Цими шкалами успішно користуються ревматологи всього світу.
У 1999 р. на фармакологічному ринку з’явився перший представник коксибів — целекоксиб, випущений на ринок компанією «Pfizer-Pharmacia» як специфічний інгібітор ЦОГ-2. У цей же час на ринку з’являються й інші представники коксибів — рофекоксиб, вальдекоксиб, еторикоксиб, луміракоксиб. Поява препаратів цієї групи супроводжувалася свого роду ейфорією, оскільки до 1999 р. було зареєстровано значну кількість ускладнень з боку шлунково-кишкового тракту, нирок, спричинених неселективними препаратами, що блокують фізіологічні ефекти ЦОГ-1. До 1999 р. у США було зареєстровано близько 100 тис. госпіталізацій і 16 500 смертей, спричинених шлунково-кишковими ускладненнями на тлі прийому неселективних НПЗП. Широке впровадження коксибів зумовило зменшення ускладнень стосовно шлунково-кишкового тракту, однак анонсувало нову проблему — підвищення кардіоваскулярного ризику і серцево-судинних подій.
У 1996 р. був вперше сформований перелік «базисних засобів» для лікування при РА. До цього списку увійшли гідроксихлорохін, сульфасалазин, метотрексат, солі золота та D-пеніциламін. Водночас вперше прозвучала концепція раннього початку терапії при РА: застосування базисних препаратів при ранньому РА дозволяє модифікувати перебіг хвороби; лікування РА (як і багатьох інших хронічних захворювань людини, таких як цукровий діабет, артеріальна гіпертензія, ішемічна хвороба серця та ін.) необхідно починати якомога раніше, бажано протягом перших 3 міс після встановлення достовірного діагнозу РА.
Початок нового століття започаткував щорічне проведення конгресів EULAR. У 2000 р. Конгрес відбувся у Ніцці (Франція) та з того часу проводиться щорічно. Останній Конгрес відбувся у Мадриді (Іспанія) 13–17 червня 2017 р.
У 2000 р. започатковано видання офіційного журналу Європейської протиревматичної ліги — «Annals of Rheumatic Diseases» (ARD). Першим головним редактором став Leo van de Putte. У 2008 р. журнал стане № 1 серед ревматологічних журналів світу з найвищим коефіцієнтом впливу (Impact Factor=12,4).
Також у 2000 р. EULAR розпочало створення рекомендацій з лікування ревматичних захворювань. Так, першими рекомендаціями EULAR стали рекомендації з лікування остеоартриту колінного суглоба — найпоширенішої патології суглобів у пацієнтів різних вікових груп [8]. Найбільш плідним щодо рекомендацій виявився 2016 р., коли на конгресі EULAR у Лондоні було представлено 13 новітніх та оновлених рекомендацій з діагностики та лікування ревматичних захворювань.
У 2002 р. був проведений перший спільний конгрес EULAR і PReS — Paediatric Rheumatology European Society. Відтоді це стало традиційним явищем. У 2004 р. в рамках конгресу EULAR був проведений перший Європейський конгрес з капіляроскопії. У 2008 р. вийшли перші спільні рекомендації EULAR та Американського коледжу ревматологів (ACR), що анонсувало створення єдиних міжнародних рекомендацій та уніфікований погляд на діагностику й лікування ревматичних захворювань у всьому світі.
У 2006 р. відбувся черговий конгрес EULAR в Амстердамі (Нідерланди), що вперше зібрав понад 10 000 учасників — ревматологів з усього світу. Рекорд учасників у подальшому поставить конгрес EULAR у Лондоні у 2011 р., на який з’їхалося 16 102 учасники.
Із 2006 р. почав діяти оновлений сайт EULAR.
Святкування 60-річчя EULAR відбулося під час чергового конгресу в 2007 р. в парку Гуєль у Барселоні (Іспанія). На цьому ж конгресі був представлений стратегічний план запобігання та лікування ревматичних захворювань у світі, що отримав влучну назву «Мобілізація планети». З цього часу почав активно діяти on-line-курс з вивчення ревматичних захворювань.
Надзвичайно багато подій і відкриттів відбулося у 2000–2010 рр. Численні події відбувалися вперше в історії ревматології. Так, вперше анти-ФНП-препарати отримали нову специфікацію — застосування не лише при РА, але й при АС та ПсА. Вперше були схвалені для лікування РА препарати з іншим механізмом дії — ритуксимаб та абатацепт. Абатацепт був затверджений у США та Європі у 2005 р. для лікування РА у дорослих пацієнтів з неадекватною відповіддю на ХМАРП (DMARDs) або інгібітори ФНП-α. У січні 2010 р. він був затверджений в Європі для ювенільного артриту середнього і тяжкого ступеня у хворих віком ≥6 років. Саме в це десятиріччя з’явився новий термін як стратегія лікування ревматичних захворювань — treat-to-target — лікування до досягнення мети, якою стала ремісія чи низька активність хвороби. Повністю людські моноклональні антитіла були вперше з успіхом апробовані в лікуванні ревматичних захворювань. Біологічні препарати вперше увійшли до рекомендацій з лікування РА, АС, ПсА.
З 2010 по 2017 р. в арсеналі лікарів з’явилися препарати класу JAK-інгібіторів. У травні 2012 р. FDA дозволило до клінічного застосування новий препарат тофацитиніб (Tofacitinib; CP-690,550; «Pfizer»), який пригнічує JAK3. Після цього була запропонована нова класифікація базисних ХМАРП (таблиця). Як відзначають автори цієї нової класифікації, передумовою до переосмислення існуючої номенклатури став еволюційний розвиток антиревматичної терапії, значне збільшення кількості нових ХМАРП, а також зміна способів їх створення, поява не тільки біологічних агентів, а й біосимілярів. Другою підставою для перегляду класифікації DMARDs стала розробка і впровадження в клінічну практику нових синтетичних DMARDs з цільовим механізмом дії — інгібіторів малих молекул або кіназного шляхів, перш за все інгібітора янус-кінази тофацитинібу [9].
| ХМАРП | |||
|---|---|---|---|
| Синтетичні ХМАРП (сХМАРП) | Біологічні ХМАРП (бХМАРП) | ||
| Традиційні синтетичні ХМАРП (тсХМАРП) | Цільові (таргетні) синтетичні ХМАРП (цсХМАРП) | Біологічні оригінальні ХМАРП(боХМАРП) | Біосиміляри ХМАРП (бсХМАРП) |
| Метотрексат Лефлуномід Сульфасалазин Гідроксихлорохін Солі золота |
Тофацитиніб | Інфліксимаб Адалімумаб Етанерцепт Голімумаб Цертулізумаб пегол Абатацепт Ритуксимаб Тоцилізумаб Анакінра |
Бс-іфліксимаб |
У 2013 р. Європейським медичним агентством (ЕМА) був офіційно схвалений біосиміляр інфліксимабу для лікування при РА.
У цей період також було затверджено перший біологічний препарат, створений спеціально для лікування пацієнтів із СЧВ, що по праву розглядається як одна з найвидатніших подій ревматології за останні 50 років — блокатор В-клітинного активуючого фактора (B cell-activating factor — BAFF) — белімумаб. Белімумаб — це повністю людські рекомбінантні моноклональні антитіла (IgG1), механізм дії яких пов’язаний із запобіганням взаємодії розчинних BAFF із клітинними рецепторами аутореактивних перехідних і наївних В-клітин, що, у свою чергу, призводить до пригнічення властивої СЧВ В-клітинної гіперреактивності, зокрема синтезу аутоантитіл. Офіційними показаннями до застосування белімумабу при СЧВ є помірна/висока активність, наявність виражених серологічних порушень (позитивні результати визначення антинуклеарного фактора і/або ANA до дволанцюгової ДНК) і недостатня ефективність попередньої стандартної терапії.
Ще однією видатною подією останніх років і новим проривом у лікуванні пацієнтів зі спондилоартритом стало застосування інгібіторів інтерлейкіну (ІЛ)-17. Відомо, що ентезит як запальна реакція реалізується в основному за рахунок ІЛ-17, що виділяється унікальною популяцією Т-клітин, що розташовуються в синовіально-ентезіальному комплексі. На сьогодні доведено, що імунологічний Th17-опосередкований механізм, в якому беруть участь цитокіни ІЛ-23 і -17, є найважливішою ланкою патогенезу псоріазу, ПсА, інших спондилоартритів, включаючи АС. Рекомендаціями EULAR (2015) запропоновано включити цей клас препаратів до алгоритму лікування хворих на ПсА.
2017 р. ознаменувався певним проривом у лікуванні при РА: три нові препарати з різними механізмами дії були затверджені ЕМА для лікування пацієнтів із РА після тривалої перерви (з 2009 р. не було зареєстровано в Європі нових молекул для лікування при РА). Першим із них є сарилумаб — повністю людське моноклональне антитіло, специфічне до рецептора ІЛ-6. Клінічні дослідження сарилумабу продемонстрували статистично і клінічно значуще поліпшення стану у пацієнтів із РА. Наступними препаратами є представники групи малих молекул — барицитиніб — пероральний селективний інгібітор янус-кіназ JAK1 і JAK2 і тофацитиніб — пероральний селективний інгібітор JAK1. Завершують клінічні випробування ще два моноклональних антитіла до ІЛ-6 — сирукумаб та олокізумаб, а також два інгібітори янус-кіназ — філдотиніб та упдацитиніб. Водночас ЕМА затвердила біосиміляри відомих препаратів для лікування пацієнтів із РА. Так, станом на 2017 р. затверджено два біоаналоги інфліксимабу та по одному біосиміляру етанерцепту, адалімумабу та ритуксимабу.
EULAR святкує 70 річчя! За цей період хочеться згадати усіх президентів EULAR — відомих ревматологів, які визначали політику та спрямованість ревматології Європи і світу в останні 70 років.
| 1947–1949 | Mathieu-Pierre Weil (France) |
| 1949–1951 | Wiiliam S.C. Copeman (United Kingdom) |
| 1951–1951 | Marcel Ferond (Belgium) |
| 1951–1955 | Pedro Barcelo (Spain) |
| 1955–1957 | Johan H. Göslings (The Netherlands) |
| 1957–1959 | Jacques Forestier (France) |
| 1959–1961 | Alessandro Rabecchi (Italy) |
| 1961–1963 | Gunnar Edstrom (Sweden) |
| 1963–1965 | Frantisek Lenoch (Czechoslovakia) |
| 1965–1967 | Georg Kersley (United Kingdom) |
| 1967–1969 | Karl Cotsch (Austria) |
| 1969–1971 | Stanislas de Seze (France) |
| 1971–1973 | Veikko A.I. Laine (Finnland) |
| 1973–1975 | Vassil T. Tzonchev (Bulgaria) |
| 1975–1977 | Albert Boni (Switzerland) |
| 1977–1979 | Eric G.L. Bywaters (United Kingdom) |
| 1979–1981 | Valentina Nassonova (USSR) |
| 1981–1983 | Eimar Munthe (Norway) |
| 1983–1985 | Hartwieg Mathies (Germany) |
| 1985–1987 | Vincenzo Pipitone (Italy) |
| 1987–1989 | Michel G. Lequesne (France) |
| 1989–1991 | Colin G. Barnes (United Kingdom) |
| 1991–1993 | Bela Gömör (Hungary) |
| 1993–1995 | Juan G. Banos (Spain) |
| 1995–1997 | Leo van de Putte (The Netherlands) |
| 1997–1999 | Hubert Roux (France) |
| 1999–2001 | Thomas L. Vischer (Switzerland) |
| 2001–2003 | Joachim R. Kalden (Germany) |
| 2003–2005 | Josef S. Smolen (Austria) |
| 2005–2007 | Tore K. Kvien (Norway) |
| 2007–2009 | Ferdinand C. Breedveld (The Netherlands) |
| 2009–2011 | Paul Emery (United Kigdom) |
| 2011–2013 | Maxime Dougados (France) |
| 2013–2015 | Maurizio Cutolo (Italy) |
| 2015–2017 | Gerd R. Burmester (Germany) |
| 2017–2019 | Johannes Bijlsma (The Netherlands) |
Отже, EULAR була заснована в 1947 р. та провела свій перший Європейський ревматологічний конгрес у вересні 1947 р. у Копенгагені (Данія) із 200 делегатами з 16 країн. Останній Конгрес EULAR у Мадриді (Іспанія) зібрав більше ніж 14 тис. делегатів із понад 120 країн. На сьогодні EULAR є потужною організацією, що об’єднує 45 членів — наукових товариств, 36 національних організацій PARE та 23 асоціації всіх європейських держав. EULAR всією своєю діяльністю підкреслює важливість боротьби з ревматичними захворюваннями. Ревматологія продовжує залишатися однією з медичних дисциплін, що бурхливо розвивається та ефективно адаптує міжнародні досягнення і робить істотний внесок у прогрес світової фундаментальної та клінічної медицини. Найбільший прогрес ревматології стосується поліпшення лікування пацієнтів із ревматичними захворюваннями, зниження інвалідності та смертності, що відзначив у своїй доповіді обраний президент EULAR Йоханес Бійлсма (Johannes Bijlsma): «Тридцять років тому я побачив інвалідні візки скрізь у відділенні, в якому я працював, сьогодні я нічого такого не бачу».
Список використаної Літератури
- 1. Black R.L., O’Brien W.M., van Scott E.J. et al. (1964) Methotrexate therapy in psoriatic arthritis. Double-blind study on 21 patients. JAMA, 189: 743–747.
- 2. Davies D.J., Moran J.E., Niall J.F., Ryan G.B. (1982) Segmental necrotising glomerulonephritis with antineutrophil antibody: possible arbovirus aetiology? Br. Med. J., 285(6342): 606.
- 3. Feldmann M., Maini R.N. (2002) Discovery of TNF-α as a therapeutic target in rheumatoid arthritis: preclinical and clinical studies. Joint Bone Spine, 69: 12–18.
- 4. Gubner R., August S., Ginsberg V. (1951) Therapeutic suppression of tissue reactivity.II. Effect of aminopterin in rheumatoid arthritis and psoriasis. Am. J. Med. Sci., 22: 176–182.
- 5. Hench Ph.S., Kendall E.C., Slocumb C.H. et al. (1949) The effect of hormone of the adrenal cortex, cortisone (17-hydroxy-II-dehydrocorticosterone: compound E) and of pituitary adrenocorticotropic hormone on rheumatoid arthritis and acute rheumatic fever. Trans. Assoc. Am. Physicias., 62: 64–80.
- 6. Kohler G., Milstein C. (1975) Continuous cultures of fused cells secreting antibody of predefined specificity. Nature, 256: 495–497.
- 7. Nienhuis R.L., Mandema E. (1964) A new serum factor in patients with rheumatoid arthritis, the antiperinuclear factor. Ann. Rheum. Dis., 23: 302–305.
- 8. Pendleton A., Arden N., Dougados M. et al. (2000) EULAR recommendations for the management of knee osteoarthritis: report of a task force of the Standing Committee for International Clinical Studies Including Therapeutic Trials (ESCISIT). Ann. Rheum. Dis., 59(12): 936–944.
- 9. Smolen J.S., van der Heijde D., Machold K.P., Aletaha D., Landewé R. (2014) Proposal for a new nomenclature of disease-modifying antirheumatic drugs. Ann. Rheum. Dis., 73: 3–5.
- 10. van der Woude F.J., Rasmussen N., Lobatto S. et al. (1985) Autoantibodies against neutrophils and monocytes: tool for diagnosis and marker of disease activity in Wegener’s granulomatosis. Lancet, 1(8426): 425–429.
- 11. Vane J.R.(1971) Inhibition of prostaglandin synthesis as a mechanism of action for aspirin-like drugs. Nat. New. Biol., 231(25): 232–235.
- 12. Weinblatt M.E.(2013) Methotrexate in Rheumatoid Arthritis: A Quarter Century of Development. Trans. Am. Clin. Assos., 124: 16–25.
К 70-ЛЕТИЮ СОЗДАНИЯ ЕВРОПЕЙСКОЙ анТИРЕВМАТИЧЕСКОЙ ЛИГИ: ДОСТИЖЕНИЯ РЕВМАТОЛОГИИ
Резюме. В 1947 г. создана Европейская антиревматическая лига (EULAR) для борьбы с ревматическими и мышечно-скелетными заболеваниями. Цель EULAR — уменьшение бремени ревматических заболеваний и улучшение лечения, профилактики и реабилитации патологии опорно-двигательного аппарата. В обзорной статье представлены достижения мировой ревматологической науки за последние 70 лет, проанализированы этапы развития ревматологии и влияние этих открытий на качество жизни пациентов с ревматическими заболеваниями. Прогресс в ревматологии обусловлен в основном разработкой противовоспалительных и иммуномодулирующих и модифицирующих болезнь лекарств.
ревматология, ревматические заболевания, Европейская антиревматическая лига, EULAR, достижения, прогресс ревматологии, юбилей.

Leave a comment